噻唑类化合物的噻唑环构建方法综述
2017-06-15冯莹超施湘君
冯莹超,施湘君
(浙江工业大学长三角绿色制药协同创新中心,浙江杭州310014)
噻唑类化合物的噻唑环构建方法综述
冯莹超,施湘君*
(浙江工业大学长三角绿色制药协同创新中心,浙江杭州310014)
噻唑类化合物的N-杂环结构,具有独特的生物活性,该类化合物广泛应用于医药、农药等领域。综述了近年来噻唑类化合物噻唑环构建方法,并初步分析了各类方法的优缺点。
噻唑类化合物;噻唑环;构建
噻唑类化合物是一类重要的杂环化合物,其所含的氮原子和硫原子,含丰富电子,易形成氢键、与金属离子配位以及π-π堆积、静电和疏水作用等多种非共价键相互作用。该类化合物具有良好的生物活性,是重要的药物或生理活性物质,在医药、农药、材料、生物染色剂和人工离子受体领域的应用前景很广阔。目前为止,国内外对噻唑环构建方法的研究中,主要以经典Hantzsch法为基础,在改变底物类型、催化方式、溶剂体系等方面进行了一系列探索。本文对不同底物的噻唑环构建方法进行了阐述,以便学者对该领域进行研究。
1 噻唑环构建方法
1.1传统Hantzsch法
Hantzsch法是1887年由Hantzsch率先提出,以α-卤代酮与硫脲为底物反应合成噻唑[1]。传统的Hantzsch法构建噻唑环主要在酸性环境中,以极性有机溶剂为反应体系在回流温度下反应,产率相对不是很高[2]。但鉴于该方法简单、能引入众多基团,目前应用最广泛(Scheme 1)。
1.2以α-卤代酮为底物
在传统的Hantzsch法的基础上,研究人员针对酸性体系在后处理过程中对环境的污染大,对反应的溶剂体系进行改进探索。

Scheme 1
1.2.1 非酸性溶剂体系
研究人员尝试了在中性溶剂体系[3]下合成噻唑类化合物,Jawale等[4]以苯乙酮衍生物,硫代酰胺,NBS在聚乙二醇(PEG-400)溶剂体系中经过7 h得到产率为85%~91%的产物(Scheme 2)。

Scheme 2
王书香[5]等人开发了无溶剂体系,以α-卤代苯乙酮、硫代酰胺为底物,在100℃的熔融状态下经过5~10 min反应,得到产率为87%~96%的噻唑化合物(Scheme 3)。
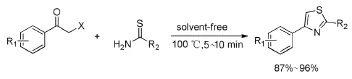
Scheme 3
1.2.2 离子液体溶剂体系
离子液体因其结构中某些取代基的不对称性使离子不能规则地堆积成晶体,在室温或接近室温下呈现液态的、完全由阴阳离子所组成的离子化合物。具有溶剂和催化剂的双重作用,Potewar等[6]经试验后用催化效果较好的pKa为0.5的离子液体[bbim]BF4为溶剂体系,以溴代芳香酮与硫代酰胺为底物在室温下反应15 min得到收率达87%~96%的芳基噻唑(Scheme 4)。

Scheme 4
经分析,其可能的机理(Scheme 5)是离子液体[bbim]BF4的咪唑阳离子起到了Lewis酸或Bronsted酸的性质,通过增加碳氧键的极性,促进亲核试剂进攻羰基C,从而大大缩短了缩合环化的时间。

Scheme 5
1.2.3 固相树脂法
固相树脂只需在反应结束后经过滤和溶剂冲洗即可分离并纯化,Sreejalekshmi等[7]用胺的树脂先固定硫代酰胺,然后与α-溴代酮反应得到产率为88%~92%的噻唑化合物(Scheme 6)。

Scheme 6
1.2.4 固载试剂法
固载酸是具有给出质子或接受电子对能力的固体。属非均相体系,与产物极易分离、也易被回收利用、可降低对设备腐蚀性。
Das等[8]以α-溴代芳基酮和硫代酰胺为底物,杂多酸12-磷钼酸铵为固载酸,以甲醇为溶剂在室温下反应20 min即可得到92%~98%产率的噻唑衍生物(Scheme 7)。
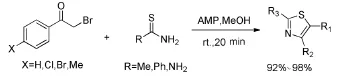
Scheme 7
以氧化物作为固载试剂[9],Karade等以SiO2-Cl[10]反应得到产率为71%~88%的噻唑类化合物(Scheme 8)。
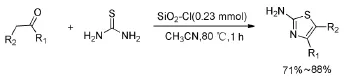
Scheme 8
Narender等[11]以高分子固载试剂β-环糊精为介质,利用其腔内疏水、腔外亲水的性质,提高疏水性底物分子α-溴代苯乙酮衍生物在水中的溶解度,使其可以水中反应。实验进一步表明:在反应时,β-环糊精与溴代酮之间有氢键形成,起到活化溴代酮作用,缩短了反应时间。(Scheme 9)。

Scheme 9
1.2.5 微波法
Kabalka等[12]利用微波辐射高效性的优点,将噻唑合成反应时间缩短至几分钟,且能得到产率为87%~99%的产物(Scheme 10)。

Scheme 10
1.3以二羰基化合物为底物
1.3.1 劳森试剂法
Sanz-Cervera等[13]用劳森试剂与二羰基化合物进行反应,得到噻唑化合物的产率为96%~99%(Scheme 11)。
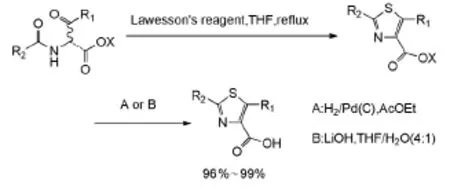
Scheme 11
1.3.2 P2S5法
Sheldrake等[14]用P2S5为硫试剂在碱性条件下与二羰基化合物反应,得到产率为47%~83%的噻唑化合物(Scheme 12)。

Scheme 12
1.4以炔或炔的衍生物为底物
1.4.1 酶法
梅怡嘉[15]用不同蛋白酶催化三组分反应,发现在使用胰蛋白酶时取得了较好的效果,产率可达90%(Scheme 13)。

Scheme 13
1.4.2 微波法
Castagnolo等[16]以溴代炔衍生物为底物,与硫代酰胺在130℃的碱性环境微波反应10 min,得到产率为61%~90%的噻唑化合物(Scheme 14)。

Scheme 14
1.4.3 高碘试剂法
Yoshihide等[17]先用高碘试剂与炔反应固定,再在室温下碱性环境中与过量的硫代酰胺进行反应,产率为46%~82%(Scheme 15)。

Scheme 15
1.4.4 金属催化法
Miura等[18]用金属Cu催化炔烃与MsN3反应生成五元环,然后在金属Rh的催化下与硫酯反应生成噻唑(Scheme 16)。
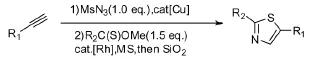
Scheme 16
1.5以醛为底物的缩合氧化法
Fernandez等[19]与Credico等[20]以醛为底物,与带巯基的胺的盐酸盐进行反应,然后在二氧化锰的作用下氧化形成噻唑(Scheme 17)。

Scheme 17
1.6以异硫氰酸酯为底物

Scheme 18
异硫氰酸酯位于-N=C=S的C有高度亲电性,能与某些亲核试剂发生亲核加成反应生成相应的产物[21]。Al-Hourani等[22]以异硫氰酸酯为底物,与亲核试剂反应得到噻唑与其异构体,而其异构体在氘代氯仿中可完全转化成噻唑,产率在19%~95%之间(Scheme 18)。
1.7其他
1.7.1 金属催化重氮酮
Yadav等[23]用重氮酮与硫脲在80℃的三氟甲磺酸铜的二氯乙烷溶液中反应生成芳基噻唑。(Scheme 19)。

Scheme 19
1.7.2 微波催化芳酯法
Qiao等[24]以芳酯,P2S5为底物,在150℃下微波反应1 h生成巯基酯,再与甘氨酸衍生物、乙酸酐反应形成噻唑(Scheme 20)。

Scheme 20
1.7.3 钠氢法
Lingaraju等[25]以异氰与二硫代酸酯为底物,在DMF环境下用钠氢催化,形成噻唑(Scheme 21)。

Scheme 21
1.7.4 噻唑啉合成法
硫基乙醛二聚体在氨和醛的作用下生成2-烷基噻唑啉,脱氢转化成2-取代噻唑[26](Scheme 22)。

Scheme 22
1.7.8 α-巯基代酮合成法
α-巯基代酮在酸性条件下,与嘧啶衍生物环合形成噻唑环[27](Scheme 23)。
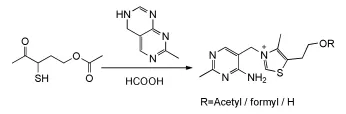
Scheme 23
2 总结与展望
自1887年Hantzsch提出Hantzsch法以来,研究人员针对其酸性溶剂体系的局限性进行了多样化的反应溶剂体系的探索,拓宽了溶剂体系,发现在离子液体、中性甚至碱性环境中也能合成噻唑的制备;又对其催化体系进行开发,在微波、固载试剂、固相树脂等催化条件下不仅缩短了反应时间,还能得到较高产率的噻唑衍生物。各种方法的探索成果为不同底物的适用性拓宽了选择,为噻唑衍生物的合成提供了实验基础。
若能在以后的研究中,综合不同方法的优点,开发多种方法的联合应用,则使噻唑化合物的合成更具发展前景,通过进一步的研究和开发有望应用于工业化生产。
[1]Hantzsch A,Weber J H.Ueber verbindungen des thiazols(pyridins der thiophenreihe)[J].Chem.Ber.,1887,20:3118-3132.
[2]UdapudiV T,MahajanshettiC S.Condensed tetrahydrobenzothiazoles part IV.synthesis of some 2-substituted 4,5,6,7-tetrahydrobenzothiazoles and their 5,5-dimethyl-7-oxo derivatives[J].Indian J.Chem.Sect.,B: Org.Chem.Incl.Med.Chem.,1986,25B(12):1269-1272.
[3]Potewar T M,Ingale S A,Srinivasan K V.Catalyst-free efficientsynthesis of 2-aminothiazoles in wateratambient temperature[J].Tetrahedron,2008,64:5019-5022.
[4]Jawale D V,Lingampalle D L,Pratap U R,et al.One-potsynthesis of 2-aminothiazoles in PEG-400[J].Chinese Chem.Lett.,2010,21:412-416.
[5]王书香,武倩倩,段杰,等.无溶剂合成2-氨基噻唑和2-甲基噻唑衍生物[J].河北大学学报:自然科学版.2010,309(1):53-57.
[6]Potewar T M,Ingale S A,Srinivasan K V.Efficient synthesis of 2,4-disubstituted thiazoles using ionicliquid under ambient conditions:a practical approachtowards the synthesis of Fanetizole[J].Tetrahedron,2007,63:11066-11069.
[7]Sreejalekshmi K G,Devi S K C,Rajasekharan K N.An efficient protocol for solid phase aminothiazole synthesis[J]. Tetrahedron Lett.,2006,47:6179-6182.
[8]Das B,Reddy V S,Ramu R.A rapid and high-yielding synthesis of thiazoles and aminothiazolesusing ammonium-12-molybdophosphate[J].Jour.Mol.Cat.A:Chem.,2006,252(1-2):235-237.
[9]Aoyama T,Murata S,Arai I,et al.One pot synthesis using supported reagents system KSCN/SiO2-RNH3OAc/Al2O3: synthesis of 2-aminothiazolesand N-allylthioureas[J].Tetrahedron,2006,62:3201-3213.
[10]Karade H,Sathe M,Kaushik M P.An efficient method for the synthesis of 2-aminothiazoles usingsilica chloride as a heterogeneous catalyst[J].Cat.Comm.,2007,8(4):741-746.
[11]Narender M,Reddy M S,Sridhar R,et al.Aqueous phase synthesis of thiazoles and aminothiazoles inthe presence of β-cyclodextrin[J].Tetrahedron Lett.,2005,46:5953-5955.
[12]Kabalka G W,Mereddy A R.Microwave promoted synthesis of functionalized 2-aminothiazoles[J].Tetrahedron Lett.,2006,47:5171-5172.
[13]Sanz-Cervera J F,Blasco R,Piera J,et al.Solution versus fluorous versus solid-phase synthesis of 2,5-disubstituted 1,3-azoles.preliminary antibacterial activity studies[J].J. Org.Chem.,2009,74(23):8988-8996.
[14]Sheldrake P W,Matteucci M,McDonald E.Facilegeneration of a library of 5-aryl-2-arylsulfonyl-1,3-thiazoles[J]. Synlett,2006,3:460-462.
[15]梅怡嘉.酶催化多组分合成噻唑杂环的研究[D].杭州:杭州师范大学,2013.
[16]Castagnolo D,Pagano M,Bernardini M,et al.Domino alkylation-cyclization reaction of propargyl bromides withthioureas/thiopyrimidinones:a new facile synthesis of 2-aminothiazolesand 5H-thiazolo[3,2-a]pyrimidin-5-ones[J]. Synlett,2009,13:2093-2096.
[17]Yoshihide I,Hideo T.Facile preparation of thiazoles from 1H-1-(1'-alkynyl)-5-methyl-1,2,3-benziodoxathiole 3,3-dioxide with thioamides[J].Synlett,2008,17:2637-2641.
[18]Miura T,Funakoshi Y,Fujimoto Y,et al.Facile synthesis of2,5-disubstituted thiazoles from terminalalkynes,sulfonyl azides,and thionoesters[J].Org.Lett.,2015,17:2454-2457. [19]Fernandez X,Fellous R,Lizzani-Cuvelier L,etal.Chemoand regioselective synthesis of alkyl-3-thiazolinecarboxylates[J].Tetrahedron Lett.,2001,42:1519-1521.
[20]Credico B D,Reginato G,Gonsalvi L,et al.Selective synthesis of 2-substituted 4-carboxy oxazoles,thiazoles andthiazolidines from serine or cysteine amino acids[J]. Tetrahedron,2011,67:267-274.
[21]Nedolya N A,Brandsma L,Trofimov B A.Directed synthesis of isomeric thiazole and imidazole derivatives from methyl isothiocyanate[J].Tetrahedron Lett.,1997,38:6279-6280.
[22]Al-Hourani B J,Banert K,Gomaa N,et al.Synthesis of functionalized thiazoles via attack of heterocyclicnucleophiles on allenylisothiocyanates[J].Tetrahedron,2008,64:5590-5597.
[23]Yadav J S,Reddy B V S,Rao Y G,et al.First example of the coupling ofα-diazoketones with thiourea:a novel route for the synthesis of 2-aminothiazoles[J].Tetrahedron Lett.,2008,49:2381-2383.
[24]Qiao Q,Dominique R,Goodnow J R.2,4-Disubstituted-5-acetoxythiazoles:useful intermediates forthe synthesis of thiazolones and 2,4,5-trisubstituted thiazoles[J].TetrhedronLett.,2008,49:3682-3686.
[25]Lingaraju G S,Swaroop T R,Vinayaka A C,et al.An easy access to 4,5-disubstituted thiazoles via base-induced clickreaction of active methylene isocyanides with methyl dithiocarboxylates[J].Synthesis,2012,44:1373-1379.
[26]李海峰.几类噻唑类衍生物的合成研究[D].南昌:南昌大学,2011.
[27]Contant P,Forzy L,Hengartner U,et al.A new convergent synthesis of thiamine hydrochloride[J].Helv.Chim.Acta.,1990,73:1300-1305.
A Review of Construction for Thiazole Ring in Thiazole Compounds
FENG Ying-chao,SHIXiang-jun*
(Zhejiang University of Technology,Hangzhou,Zhejiang 310014,China)
Thiazole has an N-heterocycle ring,and its derivatives are widely used in pharmaceutical,medicinal and pesticidal fields for unique biological activity.This article outlined several constructions of thiazole compounds and reviewed the advantages and disadvantages of these methods.
thiazole compounds;thiazolering ring;construction
1006-4184(2017)5-0023-05
2017-01-21
冯莹超(1991-),女,硕士研究生,主要从事药物及中间体的合成。E-mail:1439585670@qq.com。
*通讯作者:施湘君,E-mail:shixj@zjut.edu.cn。
