放疗联合培美曲塞、卡铂同期及巩固化疗治疗中晚期食管癌的疗效评价
2017-06-15李丽王谨郑远达喻冰淇陈建祥
李丽 王谨 郑远达 喻冰淇 陈建祥
放疗联合培美曲塞、卡铂同期及巩固化疗治疗中晚期食管癌的疗效评价
李丽 王谨 郑远达 喻冰淇 陈建祥
目的 评价放疗联合培美曲塞、卡铂同期及巩固化疗治疗中晚期食管癌的有效性及安全性。方法 16例中晚期食管癌患者接受胸部X线调强放疗50~60Gy/5~6周,同期予培美曲塞(500mg/m2)、卡铂(AUC=5)化疗,21d为1个周期;放化疗结束后继续原方案巩固化疗2个周期。治疗结束后随访16(13,40)个月,采用实体瘤的疗效评价标准(RECIST1.1)评价疗效,采用常见不良事件评价标准3.0(CTCAE3.0)评价不良反应。结果 16例患者均完成治疗。完全缓解(CR)1例,部分缓解(PR)15例;无进展生存(PFS)4例,病死12例(远处转移8例、局部进展3例、心力衰竭1例)。全组患者1、2年PFS率分别为44.0%、31.0%,PFS时间为9(6,40)个月;1、2年总生存(OS)率分别为69.0%、38.0%,OS时间为16(10,40)个月。不良反应以3、4级中性粒细胞减少为主,在粒细胞-集落刺激因子的支持下均可完成治疗;其次为2、3级食管炎。结论 放疗联合培美曲塞、卡铂同期及巩固化疗治疗中晚期食管癌疗效可靠,患者耐受性良好。
食管癌 放疗 培美曲塞 卡铂 生存曲线 不良反应
我国是食管癌的高发地区,不少食管癌患者在确诊时已属中晚期,常常不能手术根治。对于不能手术或拒绝手术的食管癌患者,同步放化疗是标准的治疗方法[1],其中顺铂联合5-氟尿嘧啶(PF方案)是最常用的同期化疗方案,但其毒性较大,部分患者不能耐受。目前有研究证实培美曲塞作为一种新型的抗代谢类药物,适用于非小细胞肺癌、恶性间皮瘤的临床治疗,对食管癌也有一定的疗效[2-3]。此外,体外实验证实培美曲塞可增强肿瘤细胞对放疗的敏感性[4];近期临床研究亦表明放疗联合培美曲塞、卡铂同期化疗治疗食管癌具有有效、安全、低毒的优点[5-6]。因此,我们作了进一步研究,以评价食管癌放疗联合培美曲塞、卡铂同期及巩固化疗治疗中晚期食管癌的有效性及安全性。
1 对象和方法
1.1 对象 选择2009年4月至2011年10月本院收治的16例食管癌患者,其中男12例、女4例;年龄42~77 [66.5(57,71)]岁;病灶长度1.5~12(5.3±3.1)cm;所有患者均无半年内体重下降超过10%。组织学分类(2002年WHO分类标准):鳞癌15例,小细胞癌1例;肿瘤分期(2002年国际抗癌联盟分期标准):Ⅱb期8例,Ⅲ期6例,Ⅳa期2例;病变位置:颈段2例,胸上段3例,胸中段8例,胸下段3例;入院时美国东部肿瘤协作组(ECOG)体力状态评分:0分4例,1分8例,2分4例。入组标准:病理学证实为不可切除的局部晚期食管癌(鳞状细胞癌、腺癌等);ECOG体力状态评分为0~2分;第1秒用力呼气量>60.8L;Hb≥100g/L,PLT≥10×109/ml,中性粒细胞绝对计数≥1.5×109/ml;血清肌酐≤1.25倍的正常值上限值(UNL)或肌酐清除率≥60ml/min;血清胆红素≤1.5倍的UNL;AST≤2.5倍的UNL,ALT≤2.5倍的UNL,ALP≤5倍的UNL。排除标准:器官远处转移者;既往患过恶性肿瘤者;有放化疗禁忌证者;既往接受过免疫抑制治疗者;妊娠或哺乳妇女。本研究获得医院伦理委员会批准,所有患者签署知情同意书。
1.2 方法
1.2.1 治疗方法 (1)化疗方法:培美曲塞(500mg/m2,21d为1个周期)联合卡铂(AUC=5,21d为1个周期),化疗前1d及化疗当天予以水化(培美曲塞用0.9%氯化钠溶液溶解,卡铂用5%葡萄糖水溶解)。给药前7d肌肉注射维生素B121 000μg(每3个周期1次)、每天服用叶酸400μg,直至化疗结束后21d。化疗期间预防性应用地塞米松等治疗。同期放化疗结束后休息1个月,再应用原方案巩固化疗2个周期。(2)放疗:在化疗同一天开始。真空垫或体罩体位固定,增强CT模拟定位。制定调强放射治疗计划(IMRT):(a)大体肿瘤体积(GTV):包括原发灶、阳性淋巴结,根据钡餐、CT、内镜、正电子发射型计算机断层显像等检查综合确定;(b)临床靶体积(CTV):在原发灶基础上,上下外扩3~4cm,包括高危淋巴引流区;(c)计划靶体积(PTV):CTV外扩0.8~1cm。采用95%等剂量曲线包绕PTV,用6MV-X线直线加速器照射,2Gy/次,1次/d,每周5d。PTV剂量60Gy,分30次给予。对于体质差、预计不能耐受者,PTV剂量50.4Gy,分28次给予。在满足肺接受≥20Gy照射剂量的肺体积占双肺总体积的百分比≤30%,平均肺受量≤15Gy,脊髓受照射剂量≤45Gy。
1.2.2 评价标准 治疗结束后随访16(13,40)个月,采用实体瘤的疗效评价标准(RECIST1.1)评价疗效,评价结果包括完全缓解(CR)、部分缓解(PR)、恶化(PD)和稳定(SD)。采用美国卫生及公共服务部、国立卫生研究院颁布的常见不良反应事件评价标准3.0(CTCAE3.0)评价不良反应。
1.3 统计学处理 应用SPSS 16.0统计软件,计量资料呈偏态分布,用M(P25,P75)表示。采用Kaplan-Meier法计算无进展生存(PFS)和总生存(OS),以PFS为主要观察终点,不良反应、即时疗效、OS为次要观察终点。
2 结果
2.1 治疗情况 16例患者均完成治疗,其中全部患者完成培美曲塞、卡铂同期化疗,13例患者完成同期放化疗加2周期的巩固化疗。PTV剂量50.4Gy/28F 1例、60Gy/30F 15例。治疗结束时疗效评价结果为CR 1例,PR 15例。
2.2 生存分析 随访期间共有12例(75.0%)患者复发,其中局部复发3例,远处转移9例。生存结局:PFS 4例,病死12例(远处转移8例、局部进展3例、心力衰竭1例)。全组患者1、2年PFS率分别为44.0%、31.0%,PFS时间为9(6,40)个月,见图1a;1、2年OS率分别为69.0%、38.0%,OS时间为16(10,40)个月,见图1b。
2.3 不良反应 不良反应以3、4级中性粒细胞减少为主,在粒细胞-集落刺激因子的支持下均可完成治疗;其次为2、3级食管炎,见表1。
3 讨论
基于美国肿瘤放射治疗协作组织(RTOG)8501、法国消化肿瘤联盟(FFCD)9102等研究结果[7-8],对不可手术或拒绝手术的局部晚期食管癌患者,同期放化疗是标准治疗方法。以上研究采用放疗联合PF方案同期化疗,虽然患者的生存期明显延长,但不良反应较为严重。在RTOG8501研究中,同期放化疗组中有64%的患者出现3级以上的不良反应,8%出现4级以上的不良反应[8]。此外,有报道放疗联合PF方案同期化疗导致超过90%的患者出现≥3级的不良反应,其中约7%的患者因不良反应病死[9-10]。我国食管癌以鳞癌为主,初诊时大部分患者明显消瘦、一般情况差[11]。对这部分患者,采用放疗联合同期PF方案化疗可能会导致较多不良反应,影响患者对治疗的依从性。但亦有研究表明,这部分患者若能耐受同期放化疗,生存获益可能与其他患者群体相似[12]。紫杉醇联合卡铂是一种目前广泛应用的同期化疗方案。相关研究比较新辅助同期放化疗+手术与单纯手术的疗效及不良反应,同期化疗采用紫杉醇联合卡铂,放疗剂量41.4Gy/23次,其中29%的患者达到CR;仅10例患者出现WBC减少,1例出现4级骨髓抑制[13]。但是,新辅助放化疗的标准方案不一定是根治性放化疗的最优方案,尤其对于拟接受巩固化疗的患者。因为胸部放疗患者心脏已接受高剂量照射,同期及巩固应用紫杉醇可能进一步增加心脏毒性[14]。亦有研究探索了以依立替康、多西紫杉醇、卡培他滨等为基础的同期化疗方案,但疗效与安全性并无突破,迄今仍无一种“最优”的同期化疗方案[10]。
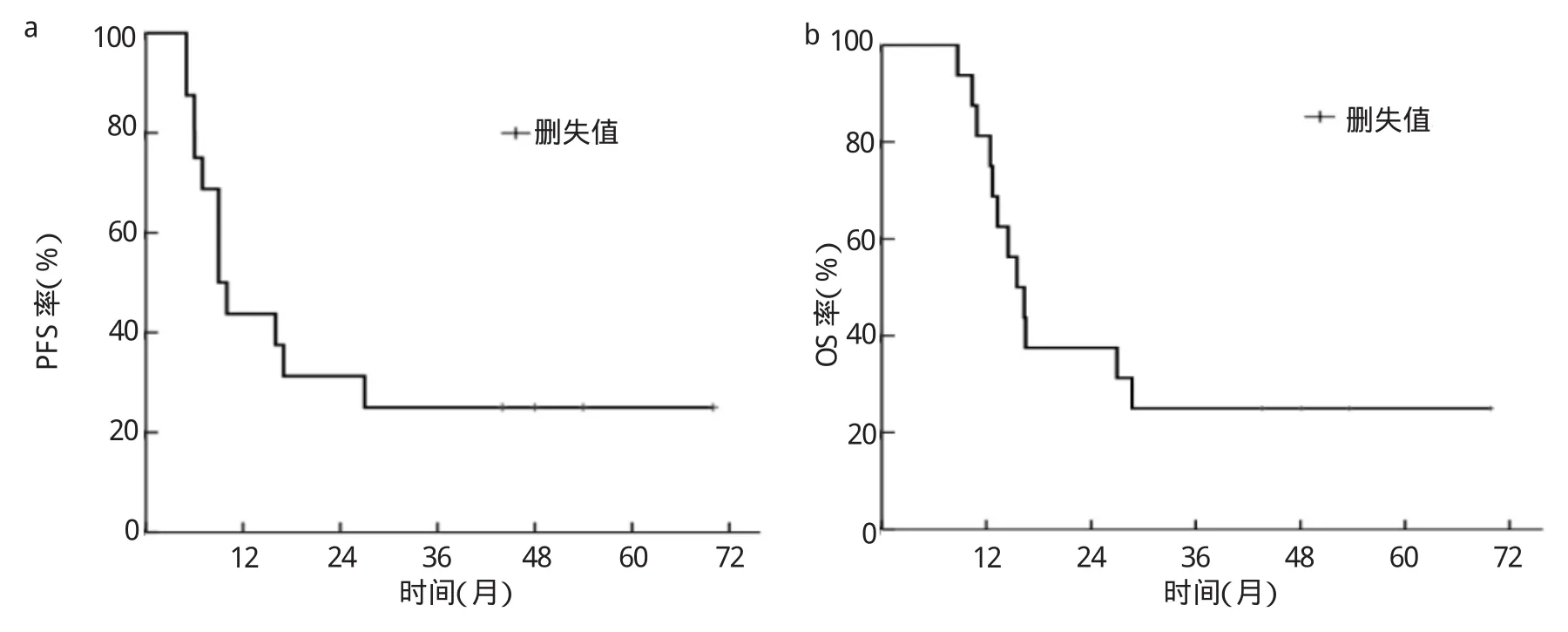
图1 16例食管癌患者的生存曲线(a:PFS曲线;b:OS曲线)

表1 16例食管癌患者放疗联合培美曲塞、卡铂同期化疗的不良反应(例)
因此,本研究对不可手术或拒绝手术的食管癌患者,采用放疗联合培美曲塞+卡铂方案同期化疗;接着行2个周期的培美曲塞+卡铂巩固化疗。结果发现1、2年OS率分别为69.0%、38.0%,OS时间为16(10,40)个月;生存数据与RTOG8501、FECD9102的结果接近。此外,本研究中全部患者完成同期放化疗,79.0%的患者完成同期放化疗+巩固化疗,耐受性较好;不良反应以3、4级中性粒细胞减少为主,在粒细胞-集落刺激因子的支持下均可完成治疗;其次为2、3级食管炎。Li等[5]采用后程加速超分割放疗联合培美曲塞+顺铂同期化疗治疗26例局部晚期胸段食管鳞癌,,临床分期T3~4N0~1M0~1a,放疗剂量40Gy/20次/4周,后程加速19.6Gy/14次/1.4周;同期化疗采用培美曲塞+顺铂方案;中位生存期21个月,中位PFS时间19个月;62.0%的患者发生了超过3级的不良反应。Jatoi等[15]进行了新辅助放化疗加手术治疗局部晚期食管癌与胃食管交界部肿瘤的Ⅱ期研究,同期化疗采用培美曲塞+卡铂方案,新辅助放疗剂量50.4Gy/28次;放疗结束后,27例患者中有22例肿瘤可完全切除,CR率为23%(未达预期值30%,故提前终止);81%出现超过3级不良反应,术后30d病死3例。以上提示培美曲塞+卡铂可能不作为新辅助放化疗“优选”的同期化疗方案,但在根治性放化疗中,其疗效不良反应可被接受。
综上所述,放疗联合培美曲塞卡铂同期及巩固化疗治疗中晚期食管癌疗效可靠,患者耐受性良好。
[1]王军,于金明,景绍武,等.食管鳞癌同期放化疗荟萃分析[J].中华放射肿瘤学杂志,2013,22(6):446-49.
[2]Seiwert T Y,Connell P P,Mauer A M,et al.A phase I study of pemetrexed,carbop latin,and concurrent rad iotherapy in patients with locally advanced or m etastatic non-sm all cell lung or esophagealcancer[J].Clin CancerRes,2007,13(2Pt1):515-522.
[3]陈建祥,毛伟敏.培美曲塞治疗消化道肿瘤研究进展[J].浙江医学,2014,36(3):245-248.
[4]Bischof M,Weber K J,Blatter J,et al.Interac tion of pem etrexed d isod ium(ALIMTA,m ultitargeted antifolate)and irrad iation in vitro [J].Int JRad iatOncolBio lPhys,2002,52(5):1381-1388.
[5]Li B S,Gong H Y,Huang W,et al.Phase Istudy of concurrent se lective lymph node late course accelerated hyper-fractionated rad iotherapy and pem etrexed,cisp latin for locally advanced esophagealsquam ous cell carcinoma[J].Dis Esophagus,2011, 24(4):251-257.
[6]Fu C,Li B,Guo L,et al.PhaseⅡstudy of concurrent selective lym ph node late course acce lerated hyper-frac tionated rad iotherapy and pemetrexed and c isp latin for loca lly advanced oesophagealsquamous cell carcinom a[J].Br J Rad iol,2014,87 (1037):20130656.
[7]Bedenne L,M ichel P,Bouche O,et al.Chemorad iation fo llowed by surgery compared w ith chemorad iation alone in squam ous cancer of the esophagus:FFCD 9102[J].J Clin Oncol,2007,25 (10):1160-1168.
[8]Cooper J S,Guo M D,Herskovic A,et al.Chemorad iotherapy of locally advanced esophageal cancer:long-term follow-up o f a p rospective random ized trial(RTOG 85-01).Rad iation Therapy Oncology Group[J].JAMA,1999,281(17):1623-1627.
[9]Kleinberg L,Forastiere A A.Chem orad iation in the m anagem ent ofesophagealcancer[J].JClin Oncol,2007,25(26):4110-4117.
[10]Lloyd S,Chang B W.Current strategies in chemorad iation for esophagealcancer[J].JGastrointestOncol,2014,5(3):156-165.
[11]张晓东.审慎斟酌食管癌二线治疗——值得探讨的问题[C].全国临床肿瘤学大会暨csco学术年会,2012.
[12]Sm ith G L,Sm ith B D,Buchho lz T A,et al.Patterns of care and locoreg ional treatm ent outcomes in older esophagea l cancer patients:the SEER-Med icare Cohort[J].Int J Rad iat Onco lBiol Phys,2009,74(2):482-489.
[13]van Hagen P,HulshofM C,van Lanschot J J,etal.Preoperative chem orad iotherapy for esophageal or junctional cancer[J].N Eng l JMed,2012,366(22):2074-2084.
[14]Faivre-Finn C.Dose escalation in lung cancer:have we gone fu llcirc le?[J].LancetOncol,2015,16(2):125-127.
[15]JatoiA,SooriG,Foster N R,etal.Phase IIstudy of p reoperative pem etrexed,carbop latin,and rad iation followed by surgery for locally advanced esophageal cancer and gastroesophageal junction tumors[J].JThorac Oncol,2010,5(12):1994-1998.
Radiotherapy combined w ith pemetrexed, carboplatin concurrent and consolidation chemotherapy in patients w ith unresectable esophageal cancer:a prospective phaseⅡ study
LI Li,WANG Jin,ZHENG Yuanda,et al.Department of Ultrasonography,Zhejiang Cancer Hospital,Hangzhou 310022,China
Objective To evaluate the efficacy and safety of rad iotherapy combined w ith pemetrexed,carbop latin concurrent and consolidation chemotherapy in patients w ith unresec tab le esophageal cancer. Methods Sixteen patients w ith local advanced esophagus carcinoma
6MV X ray intensity-modulated rad iation therapy w ith a total dose of 60Gy(30 frac tions for 6 weeks)from 2009 to 2011.Chemotherapy consisted of pemetrexed 500mg/m2and carbop latin(AUC=5) adm inistered concurrently w ith rad iotherapy and after radiotherapy.Tumor response was evaluated w ith thoracic CT scans performed 4 weeks after comp letion of treatment in accordance w ith RECIST 1.1 criteria.Adverse reaction were evaluated in accordance w ith CTCAE 3.0.Results All16 patients comp leted treatment,w ith 1 case of comp lete rem ission(CR)and 15 cases ofpartialrem ission(PR).One-and 2-year survival rate was 69%and 38%,and 1-and 2-yearp rog ression-free survival(PFS)rate was 44%and 31%,respectively.Twelve patients d ied,11 d ied of cancer,1 d ied of other disease,and none died of treatment related toxicities.Seven patients developed grade 3/4 neutrocytopenia,and 7 developed grade 3/4 thrombocytopenia.Grade 3 acute esophagitis and pneumonitis were observed in 4 patients. Conclusion For unresectab le esophageal cancer,radiotherapy combined w ith pemetrexed,carbop latin concurrent and consolidation chemotherapy is safe and the short-term outcomes are p rom ising.Further investigations are warranted.
Esophageal cancer Concurrent chemo-radiotherapy Pemetrexed Carbop latin Survival curve Adverse reaction
2015-11-24)
(本文编辑:陈丹)
10.12056/j.issn.1006-2785.2017.39.6.2015-1394
310022杭州,浙江省肿瘤医院超声科(李丽,本研究在放疗科轮转期间完成),放疗科(王谨、郑远达、喻冰淇、陈建祥)
陈建祥,E-mail:chenjx@zjcc.org.cn
