原始红松林退化演替后土壤微生物功能多样性的变化
2017-06-13韩冬雪冯富娟
孙 雪, 隋 心, 韩冬雪, 刘 岩, 冯富娟*
1.东北林业大学生命学院, 黑龙江 哈尔滨 150040 2.黑龙江省科学院自然与生态研究所, 湿地与生态保育国家地方联合工程实验室, 黑龙江 哈尔滨 150040
原始红松林退化演替后土壤微生物功能多样性的变化
孙 雪1, 隋 心2, 韩冬雪1, 刘 岩1, 冯富娟1*
1.东北林业大学生命学院, 黑龙江 哈尔滨 150040 2.黑龙江省科学院自然与生态研究所, 湿地与生态保育国家地方联合工程实验室, 黑龙江 哈尔滨 150040
为了全面了解原始红松林退化演替为次生林后土壤生境及土壤微生物功能多样性的变化规律,以小兴安岭典型的原始阔叶红松林、退化演替后先锋阶段的白桦林及亚顶级阶段的硬阔叶林为研究对象,采用Biolog-ECO微平板检测法,分析三者0~<10 cm和10~20 cm表层土的土壤微生物功能多样性变化规律. 结果表明:各林型土壤微生物的AWCD值(平均颜色变化率)随培养时间的延长而增加,培养初期表现为原始阔叶红松林>硬阔叶林>白桦林;培养末期表现为原始阔叶红松林>白桦林>硬阔叶林,三者的AWCD值在0~<10 cm土层分别为1.06、0.86、0.81,10~20 cm土层分别为0.68、0.47、0.45,原始林显著高于次生林(P<0.05),说明原始林土壤微生物对单一碳源的代谢活性显著高于次生林;同一林型下土壤微生物的AWCD值均表现为0~<10 cm土层显著高于10~20 cm土层(P<0.05). Shannon-Wiener多样性指数、Simpson指数、McIntosh指数和Richness丰富度指数也均表现为原始林显著高于次生林(P<0.05). 原始林土壤微生物对各类碳源的综合利用强度均大于次生林,不同林型下土壤微生物群落的优势碳源类型存在一定的差异,碳水类、氨基酸类、羧酸类和多聚物类碳源是原始林退化演替后土壤微生物群落在碳源利用上发生变化的敏感碳源.
Biolog-ECO; 土壤微生物; 功能多样性; 退化演替
森林生态系统是陆地生态系统的主体,是陆地上最大的碳储库和碳汇[1]. 土壤有机碳库是森林生态系统最大的碳库,土壤碳循环过程的微小变化都将对CO2等温室气体的释放产生显著影响[2]. 土壤微生物是构成土壤及整个陆地生态系统的重要活性组成部分[3],能敏感地预警土壤生态系统发生的微小变化,在维系和推动土壤物质循环与能量流动中起着重要作用[4]. 研究土壤微生物对了解土壤物质转化过程、土壤形成、肥力演变、植物养分有效化等方面具有重要的意义[5-6]. 土壤微生物群落及其多样性是土壤健康和质量的重要生物指标[7],特别是功能多样性,能够表达土壤微生物群落所能执行的功能范围以及这些功能的执行过程,是土壤微生物群落与生态功能的重要指标之一,可以用来评价土壤中微生物的生态特征,对于明确不同环境中微生物群落的作用具有重要意义[8]. 土壤微生物功能多样性与土壤功能密切相关,是土壤功能的基础,可以反映一个地区土壤的肥力特征,为生态恢复评价指标体系的建立以及土壤资源可持续利用提供理论指导[9].
以红松(Pinuskoraiensis)为建群种的红松阔叶混交林是我国东北地区最具有代性表的地带性顶级植被,也是我国温带针阔混交林带内最典型、最多样、最重要的森林生态系统[8,10],对于区域生态平衡具有重要的意义. 红松阔叶林也是环球北方森林的组成部分,该区气候寒冷、土壤潮湿、有岛状永久性冻土存在,属于全球气候变化敏感区域[11]. 原始红松林CO2的净吸收(NEE)可达1.7~2.9 t(hm2·a),说明红松林具有很强的土壤碳截获能力[12]. 从19世纪开始,由于俄罗斯和日本在东北地区的殖民统治,大片的原始红松林被砍伐,建国后,由于发展需要,又进行了多年的超强度采伐,使原始阔叶红松林遭到严重的破坏. 目前,除了少数保护区外,原始红松阔叶林已基本消失,取而代之的是大面积的温带阔叶次生林,顶极群落向低价阔叶次生林群落的演变意味着人为干扰下的退化演替[13]. 退化演替的先期阶段主要为白桦林、山杨林和杨桦林等. 随着时间的推移,有了中性阔叶树种的发生,但是由于红松种源的奇缺,演替到由水曲柳(Fraxinusmandshurica)、胡桃楸(Juglansmandshurica)等树种组成的硬质阔叶林或者柞木林后出现中断,形成了亚顶级群落[14]. 顶极群落中占优势的晚期演替树种对土壤往往有着深刻的改造与适应,缺少了建群种,土壤生境必然会发生较大的变迁[10]. 目前已经证实退化演替后土壤的矿质氮营养组分、土壤理化性质及活性有机碳含量存在较大的差别[15-16],但对土壤中微生物群落结构及功能变化的研究鲜有涉及,尽管这些因素对于区域气候变化的影响十分巨大.
小兴安岭是天然红松分布的中心区之一,该研究以小兴安岭典型的原始阔叶红松林、退化演替后先锋阶段的白桦林及亚顶级阶段的硬阔叶林为研究对象,采用Biolog-ECO微平板检测法,对三者0~<10 cm和10~20 cm表层土的土壤微生物功能多样性展开研究,旨在揭示退化演替后,缺少了建群种红松,土壤微生物群落在碳源利用上的变化规律,以期为评价原始红松林退化演替后土壤微生物生境的变化及生态功能的差异提供理论基础,并为红松林的保护及管理政策的制订提供科学参考.
1 材料与方法
1.1 样地概况
试验样地设置在隶属于东北林业大学的黑龙江省伊春市带岭区内凉水国家级自然保护区内,保护区地处小兴安岭山脉的东南部——达里带岭支脉的东坡,地理位置为47°07′39″N~47°14′22″N、128°48′30″E~128°55′50″E,凉水国家级自然保护区属温带大陆性季风气候,气候特点是春季大风天多,降水较少;因该区纬度较高,年均气温只有-0.3 ℃,年均最低气温-6.6 ℃,年均最高气温7.5 ℃,年均降水日数120~150 d,年均降水量676 mm,年均蒸发量805 mm,积雪期130~180 d,年均相对湿度78%. 该区是保存着最为典型和完整的原生阔叶红松混交林分布区之一,既有从未采伐过的原始林相,也有经皆伐和火烧后发生的次生林相,代表了森林发生、演替的各阶段. 该研究选取的原始阔叶红松林、硬阔叶林和白桦林大样地相毗邻,海拔、坡向、土壤母质等生态因子一致,并且次生林为一次性皆伐的次生裸地演替而来,演替历史清楚,样地概况见表1.

表1 研究样地概况
1.2 样地设置及样品采集
该研究于2015年9月16日采集土壤样品. 每个林型内设置一块1 hm2的大样地,每个大样地内设3个重复样方,在每个样方内按“S”型布点,做10个1 m2小样方,每个小样方内按对角线法取5个点,去除地表凋落物层,采用自然土壤剖面取样法,自下而上采集0~<10 cm和10~20 cm的表层土样,去掉土壤中可见植物根系和动植物残体[11]. 用无菌袋将土壤进行封袋保存,放入有冰袋的泡沫箱中带回实验室,过2 mm筛后,将各重复样方内每个土层的共50个重复样品充分混合成一个混合土样,再将3个重复样方样品混合成一个土样,一部分用于土壤微生物群落功能多样性的测定;另一部分土样风干用于pH等土壤理化性质的测定(见表2).

表2 土壤理化性质
注:同列中大写字母表示不同林型之间的差异显著性,同列中不同小写字母表示不同土层的之间的差异显著性(P<0.05).
1.3 试验方法
1.3.1 土壤理化性质测定
土壤理化性质采用常规方法[17]测定,w(速效磷)采用碳酸氢钠浸提-钼锑抗比色法测定;w(速效钾)采用乙酸铵-火焰光度法测定;w(总有机碳)、w(TN)采用Multi N/C 2100s分析仪(德国耶拿公司)测定;土壤含水量采用烘干恒重法测定;w(碱解氮)采用碱解扩散法测定;土壤pH采用1∶2.5水土比电位法测定.
1.3.2 Biolog-ECO微平板检测法
采用31种碳源的生态板(Biolog-ECO)分析微生物群落的代谢特征,Biolog-ECO板有96个孔、3个重复,每个重复有32个孔(包括31个单一碳源孔和1个无菌水对照孔). Biolog-ECO接种液的制备采用Classen等[18]的方法,首先取适量新鲜土壤样品放在25 ℃恒温箱中活化24 h;然后称取3 g土壤样品放入装有27 mL灭菌的0.85% NaCl溶液的三角瓶中,旋涡振荡器上振荡1 min,冰水浴1 min,反复3次,在超净工作台上静置2 min后,吸取1 mL上清液,注入盛有9 mL NaCl溶液的三角瓶中,混匀后吸取2 mL上清液注入盛有18 mL NaCl溶液的三角瓶中. 最终稀释比例为1∶1 000,将Biolog-ECO平板室温条件下预热,吸取150 μL溶液接种至Biolog-ECO板孔中,在25 ℃恒温箱中培养12 d,每24 h用酶标仪(Sunrise Remote, TECAN,瑞士帝肯公司)测定590 nm处的吸光值并记录.
1.4 土壤微生物功能多样性指数计算及数据分析方法
AWCD(average well color development,平均颜色变化率)反映微生物群落整体代谢活性[19]:
AWCD=∑(Ci-R)/31
(1)
Shannon-Wiener多样性指数[20-21]:
H=-∑Pi×lnPi
(2)
Simpson优势度指数[22-23]:
D=1-∑(Pi)2
(3)
McIntosh均匀度指数[19-20]:
(4)
Richness丰富度指数[24]通过被利用碳源的总数目(判断标准为Ci-R>0.25)来表征.
式中:Ci为第i个碳源孔的OD(吸光度)值;R为对照孔的OD值,若Ci-R≤0,记为0;ni为第i个碳源孔的相对OD值,该试验中为31;Pi为ni与整个平板相对吸光值总和的比率.
应用SPSS 19.0软件进行单因素方差分析(one-way ANOVA)、主成分分析(PCA)、差异显著性检验,显著性水平设为α=0.05[16];应用Excel 2003软件进行制图;应用Canoco for Windows 4.5软件进行冗余分析.
2 结果与分析
2.1 不同林型下土壤微生物对碳源利用的动力学特征
Biolog-ECO微平板板孔的AWCD可作为评价微生物整体活性、利用碳源的整体能力和群落功能多样性的有效指标[25]. 根据计算3种林型下土壤微生物连续12 d利用31种碳源的AWCD值绘出随时间的变化曲线. 由图1中可见,AWCD值随着培养时间的延长呈逐渐增加的趋势,0~24 h内AWCD值几乎不变;24~168 h内AWCD值增加显著,微生物在经过短暂的环境适应之后处于快速生长期,代谢活性达到巅峰,碳源被大量利用;培养168 h以后,AWCD值增幅逐渐减弱,微生物生长减缓步入稳定期,土壤中几乎所有微生物都已经参与到了碳源代谢过程中,可以比较全面地反映土壤微生物群落的碳代谢特征.
培养初期(0~48 h),不同林型下土壤微生物AWCD值的大小顺序为原始阔叶红松林>硬阔叶林>白桦林,并且0~<10 cm土层高于10~20 cm土层;培养末期(168 h以后)AWCD值稳定后,不同林型下土壤微生物AWCD值的大小顺序为原始阔叶红松林>白桦林>硬阔叶林,并且原始林与次生林之间差异显著(P<0.05). 三者的AWCD值均表现为0~<10 cm土层高于10~20 cm土层,不同土层间差异极显著(P<0.01).
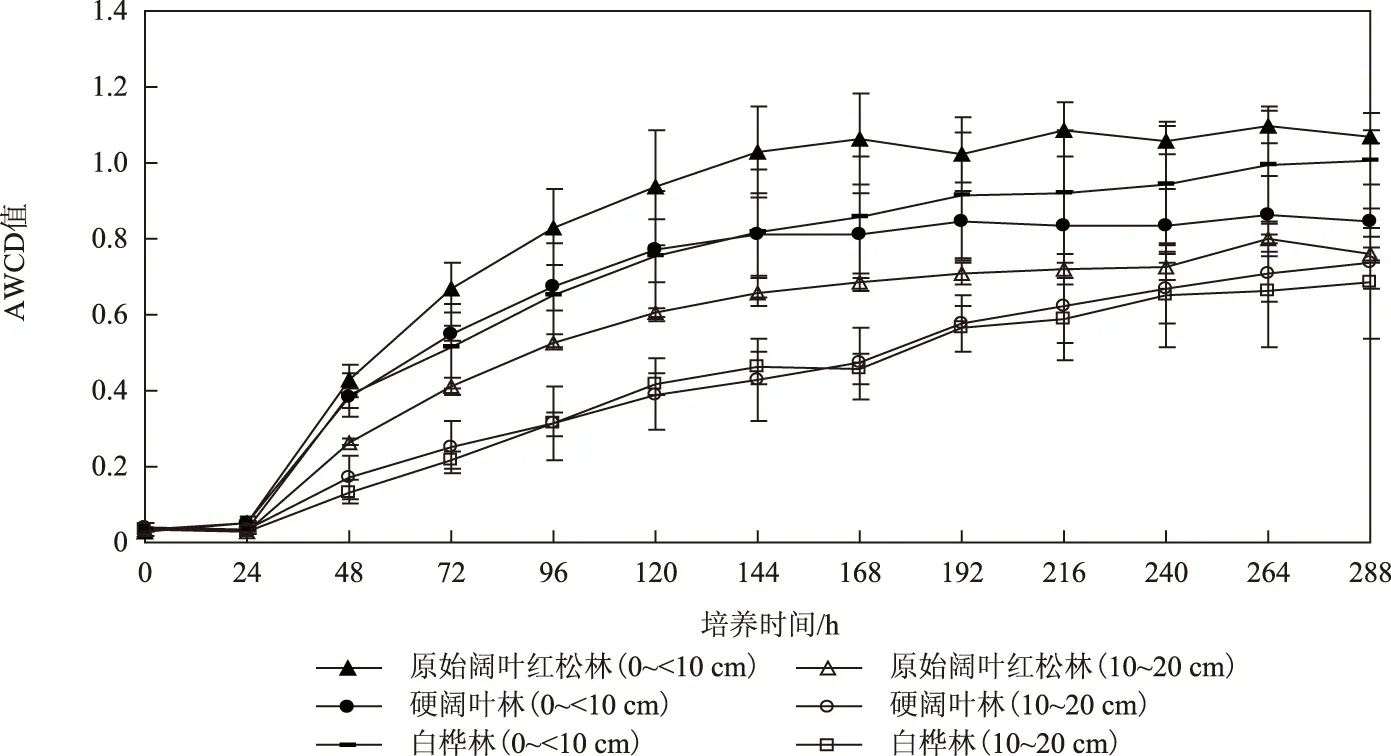
图1 AWCD值随培养时间的变化Fig.1 Changes of incubation time-dependent AWCD value
2.2 不同林型下土壤微生物多样性指数分析
Shannon-Wiener多样性指数、Simpson优势度指数、McIntosh均匀度指数和Richness丰富度指数分别反映了土壤微生物物种的多样性、优势度、均匀度及丰富度[25]. 利用培养168 h的土壤微生物群落的AWCD值计算多样性指数并进行分析,由表3可见,Shannon-Wiener多样性指数、Simpson优势度指数和Richness丰富度指数的变化规律为原始阔叶红松林>硬阔叶林>白桦林,在0~<10 cm土层差异均不显著,在10~20 cm土层原始林与次生林之间差异均显著(P<0.05);McIntosh均匀度指数表现为原始阔叶红松林>白桦林>硬阔叶林,在0~<10 cm土层原始林与硬阔叶林之间差异显著,在10~20 cm土层原始林与次生林之间差异均显著(P<0.05). 总体来看,原始林的4个多样性指数均高于次生林,说明原始林下土壤微生物群落表现出了更高的多样性. 4个多样性指数均表现为0~<10 cm土层高于10~20 cm土层,并且土层间差异极显著(P<0.01).

表3 不同林型下土壤微生物群落多样性指数
注:同列中大写字母表示不同林型同一土层之间的差异显著性,同列中不同小写字母表示不同土层的之间的差异显著性(P<0.05).
2.3 不同林型下土壤微生物对不同碳源的利用强度
Biolog-ECO微平板孔中含有31种碳源,其中包括碳水类10种、羧酸类7种、氨基酸类6种、多聚物类4种、芳香类2种和胺类2种[23]. 由图2可见,原始林土壤微生物对各类碳源的综合利用强度均大于次生林;其中对碳水类、多聚物类碳源的利用强度差异显著. 不同林型下土壤微生物群落的优势碳源类型存在一定差异,原始阔叶红松林中,多聚物类和氨基酸类利用较多,其次是碳水类、胺类,对羧酸类碳源利用最少;硬阔叶林中,多聚物类和氨基酸类利用较多,其次是碳水类、胺类,对酚类碳源利用最少;白桦林中,氨基酸类和多聚物类利用较多,其次是碳水类、胺类,对酚类碳源利用最少. 虽然原始林和次生林对6类碳源的优先利用顺序虽存在差异,但多聚物类、氨基酸类和碳水类是各林型下土壤微生物群落的主要优势碳源类型. 土壤微生物对碳源的利用强度均表现为0~<10 cm土层高于10~20 cm土层,各土层间差异显著(P<0.05).
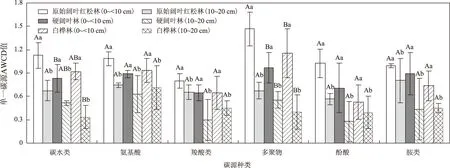
图2 不同林型下土壤微生物群落对不同碳源的利用强度Fig.2 Utilization level of carbon sources by soil microbial communities indifferent types of forest
2.4 不同林型下土壤微生物群落功能主成分分析
对不同林型下土壤微生物对31种碳源的利用率进行主成分分析(PCA),2个主成分累计贡献率为76.46%,可以解释变量的大部分信息,因此,这2个主成分可以较为全面地表征3种林型下土壤中微生物群落代谢能力的基本轮廓,载荷值见表4. 载荷值越高,表示该种碳源对主成分的影响越大. 与PC1(主成分1)相关性较高的碳源主要有19种,其中包括碳水类8种、氨基酸类1种、羧酸类3种、多聚物类4种、酚酸类2种、胺类1种;与PC2(主成分2)相关性较高的碳源主要有5种,包括氨基酸类2种、羧酸类2种和胺类1种. 综合分析与PC1和PC2具有较高相关性的碳源类型发现,碳水类、氨基酸类、羧酸类和多聚物类碳源是原始林退化演替后土壤微生物群落在碳源利用上发生变化的敏感碳源.
2.5 土壤微生物群落功能多样性与土壤理化性质的相关性
土壤微生物群落功能多样性指数与土壤各理化指标进行的冗余分析结果(见图3)显示,AWCD值、Shannon-Wiener多样性指数、Simpson指数、McIntosh指数和Richness指数分别与w(速效磷)、w(速效钾)、w(总有机碳)、土壤含水量、w(碱解氮)、C/N呈正相关,并且分别与pH呈负相关.

表4 31种碳源与PC1、PC2的相关系数

注:速效磷—w(速效磷);速效钾—w(速效钾);总有机碳—w(总有机碳);碱解氮—w(碱解氮).H—Shannon-Wiener多样性指数;D—Simpson优势度指数;U—McIntosh均匀度指数;S—Richness丰富度指数.YT—原始阔叶红松林(0~<10 cm);YD—原始阔叶红松林(10~20 cm);KT—硬阔叶林(0~<10 cm);KD—硬阔叶林(10~20 cm);HT—白桦林(0~<10 cm);HD—白桦林(10~20 cm).图3 土壤微生物功能多样性与土壤理化性质的冗余分析结果Fig.3 Redundancy analysis (RDA) of microbial functional diversity with soil physicochemical parameters
3 讨论
3.1 退化演替后AWCD值和微生物多样性的变化
在长期稳定的复杂森林生态系统或顶极群落中,占优势的晚期演替树种对土壤往往有着深刻的改造与适应[10],缺少了建群种的退化演替过程则必然会引起土壤的物理、化学、生物学性状发生变化,这是本研究的核心设想. 该研究表明,AWCD值、多样性指数的变化规律基本一致,均表现为原始林显著高于次生林,说明在立地条件一致的情况下,退化演替后缺少了建群种红松,土壤微生物群落代谢活性和功能多样性均有一定的降低. Jangid等[26]在不同森林演替阶段土壤微生物群落组成变化的研究中也得到了相近的结论,他们也发现演替后期顶级群落土壤微生物的多样性指数高于早期演替阶段. 梁健[27]在对森林演替过程中优势树种凋落叶对土壤微生物多样性影响的研究中也发现,顶级群落较先锋群落和亚顶级群落具有更高的功能多样性. 而娄鑫等[28]在对温带森林次生演替过程中土壤微生物多样性的研究中所获得的结论与上述结果并不一致,分析其原因可能与取样季节的差异、所设置研究样地立地条件是否一致及次生演替的历史原因等有关. 已经得到共识的是,微生物群落的多样性指数及代谢活性的变化与演替过程中土壤理化性质的变化密切相关[29]. 土壤理化性质的改变,影响了微生物所生存的微环境,而土壤微环境是影响土壤微生物群落的种类、活性和分布的关键因素[30]. 由图3可见,土壤微生物群落的AWCD值、多样性指数与C/N和w(速效钾)之间存在显著相关性,二者可能是微生物功能多样性发生变化的重要因子. 从表2可以看出,原始林的C/N低于次生林,C/N越低,凋落物分解的速度就越快,供给土壤微生物的养分就越多,所能支持的微生物类群及数量就会更多[31]. 而速效钾则作为微生物较易利用的能源,对微生物的生物活性和多样性指数影响最为深刻[32]. 除C/N和w(速效钾)外,原始林较次生林具有更高的pH,高pH(酸性范围内)土壤养分有效性最高,能促进土壤代谢强度的显著增加,影响土壤微生物的生理状态,提高土壤微生物碳源代谢的活性[33].
不同林型下土壤微生物活性均为0~<10 cm表层土微生物活性高,随着土壤深度的增加微生物的活性呈现出下降的趋势. 已有研究[34-35]也普遍认为,林下土壤表层由于具有较多的凋落物而含有更多的有机和无机物质,土壤养分含量高,为各种微生物提供了丰富的营养和能量,有利于微生物的生长活动.
3.2 退化演替后微生物对碳源利用的差异
3个林型土壤微生物对31种碳源利用的因子载荷值分析表明,原始林和次生林的土壤微生物在碳水类、氨基酸类、羧酸类和多聚物类碳源的利用上存在差异. 已有研究表明,碳源利用能力的增强或消弱能够反映出利用此类碳源的土壤微生物种群数量的增加或减少[36],因而此结果从另一个角度体现了土壤微生物群落组成结构的变化. 群落结构的变化特别是功能种群的差异引起了微生物的代谢功能的改变[37],Caracciolo等[38]指出,土壤微生物群落组成结构的变化,决定了微生物的功能多样性,最终对生态系统进程产生不同的影响. 另外,优势碳源类型的变化还反映了不同林型下土壤微生物呼吸代谢底物的差异,而这一点与地上植被类型的更替有关[39]. 森林演替过程中地上植被的更替直接影响了凋落物的变化,凋落物作为土壤有机质输入的主要来源,其质和量的变化必然会对土壤微生物群落组成产生影响[40-41],从而引起土壤微生物功能代谢的变化,Ushio等[42]早已证实土壤微生物群落结构会受到土壤碳源输入种类的影响.
综上所述,在同一立地条件下原始红松林退化演替后由于缺少了建群种红松,土壤微生物功能多样性发生了显著的变化,其AWCD值、多样性指数及对六大类碳源的综合利用强度均表现为原始林高于次生林.
4 结论
a) 不同林型下土壤微生物的AWCD值在培养168 h后均趋于稳定,表现为原始阔叶红松林>白桦林>硬阔叶林,三者的AWCD值在0~<10 cm土层分别为1.06、0.86、0.81,10~20 cm土层分别为0.68、0.47、0.45,原始林显著高于次生林(P<0.05);多样性指数呈现出与AWCD值基本相同的变化规律.
b) 不同林型下土壤微生物群落对六大类碳源的利用强度存在显著差异,其中多聚物类、氨基酸类和碳水类是各林型下土壤微生物群落的主要优势碳源类型;原始林土壤微生物对各类碳源的综合利用强度均大于次生林;通过主成分分析,PC1和PC2的贡献率分别为59.59%、16.87%,综合分析与PC1和PC2具有较高相关性的碳源类型发现碳水类、氨基酸类、羧酸类和多聚物类碳源是原始林退化演替后土壤微生物群落在碳源利用上发生变化的敏感碳源.
c) 对土壤理化性质与微生物群落多样性及其代谢活性的冗余分析结果显示,w(速效钾)、C/N均与微生物群落多样性及其代谢活性存在显著相关性,二者是微生物功能多样性发生变化的重要因子.
[1] 刘世荣,王晖,栾军伟.中国森林土壤碳储量与土壤碳过程研究进展[J].生态学报,2011,31(19):5437- 5448. LIU Shirong,WANG Hui,LUAN Junwei.A review of research progress and future prospective of forest soil carbon stock and soil carbon process in China[J].Acta Ecologica Sinica,2011,31(19):5437- 5448.
[2] 王清奎.碳输入方式对森林土壤碳库和碳循环的影响研究进展[J].应用生态学报,2011,22(4):1075- 1081. WANG Qingkui.Responses of forest soil carbon pool and carbon cycle to the changes of carbon input[J].Chinese Journal of Applied Ecology,2011,22(4):1075- 1081.
[3] LI Fangliang,LIU Ming,LI Zhongpei,etal.Changes in soil microbial biomass and functional diversity with a nitrogen gradient in soil columns[J].Applied Soil Ecology,2013,64(1):1- 6.
[4] LAWRENCE J R,ZHU B,SWETHONE G D W,etal.Comparative microscale analysis of the effects of triclosan and triclocarban on the structure and function of river biofilm communities[J].Science of the Total Environment,2009,407(10):3307- 3316.
[5] CHODAK M,GOLEBIEWSKI M,MORAWSKA-PLOSKONKA J,etal.Diversity of microorganisms from forest soils differently polluted with heavy metals[J].Applies Soil Ecology,2013,64(3):7- 14.
[6] MA Jun,BU Rengcang,LIU Miao,etal.Ecosystem carbon storage distribution between plant and soil in different forest types in Northeastern China[J].Ecological Engineering,2015,81:353- 362.
[7] YANG Dongwei,ZHANG Mingkui.Effects of land-use conversion from paddy field to orchard farm on soil microbial genetic diversity and community structure[J].European Journal of Soil Biology,2014,64:30- 39.
[8] 韩冬雪,王宁,王楠楠,等.不同海拔红松林土壤微生物功能多样性[J].应用生态学报,2015,26(12):3649- 3656. HAN Dongxue,WANG Ning,WANG Nannan,etal.Soil microbial functional diversity of different altitudePinuskoraiensisforests.Chinese Journal of Applied Ecology,2015,26(12):3649- 3656.
[9] 曹成有,姚金冬,韩晓姝,等.科尔沁沙地小叶锦鸡儿固沙群落土壤微生物功能多样性[J].应用生态学报,2011,22(9):2309- 2315. CAO Youcheng,YAO Jindong,HAN Xiaoshu,etal.Soil microbes functional diversity in sand-fixingCaraganamicrophyllacommunities in Horqin Sandy Land[J].Chinese Journal of Applied Ecology,2011,22(9):2309- 2315.
[10] 丘阳,高露双,张雪,等.气候变化对阔叶红松林不同演替阶段红松种群生产力的影响[J].应用生态学报,2014,25(7):1870- 1878. QIU Yang,GAO Lushuang,ZhANG Xue,etal.Effect of climate change on net primary pro-ductivity ofKoreanpineat different successional stages of broad-leavedKoreanpineforest[J].Chinese Journal of Applied Ecology,2014,25(7):1870- 1878.
[11] 王宁,杨雪,李世兰,等.不同海拔红松混交林土壤微生物量碳、氮的生长季动态[J].林业科学,2016,52(1):150- 158. WANG Ning,YANG Xue,LI Shilan,etal.Seasonal dynamics of soil microbial biomass carbon-nitrogen in theKoreanPinemixed forests along elevation gradient[J].Scientla Silvae Sinicae,2016,52(1):150- 158.
[12] 吴家兵,关德新,张弥,等.长白山阔叶红松林碳收支特征[J].北京林业大学学报,2007,29(1):1- 6. WU Jiabing,GANG Dexin,ZHANG Mi,etal.Carbon budget characteristics of the broadleavedKoreanpineforests in Changbaishan Mountains.Journal of Beijing Forestry University,2007,29(1):1- 6.
[13] 周晓峰.东北次生林经营[M].哈尔滨:东北林业大学出版社,2000.
[14] 赵惠勋.东北东部山区次生林经营理论初探[J].东北林业大学学报,1986(3):74- 81. ZHAO Huixun.In the eastern mountainous secondary forest management theory[J].Journal of Northeast Forestry University,1986(3):74- 81.
[15] 郝敬梅,张韫,崔晓阳,等.原始阔叶红松林、次生林土壤矿质氮特征及树种吸收反应[J].北京林业大学学报,2014,36(1):21- 25. HAO Jingmei,ZANG Yun,CUI Xiaoyang,etal.Soil mineral N characteristics in original broadleavedPinuskoraiensisforest and secondary forest and N absorption of some tree species[J].Journal of Beijing Forestry University,2014,36(1):21- 25.
[16] 胡嵩,张颖,史荣久,等.长白山原始红松林次生演替过程中土壤微生物生物量和酶活性变化[J].应用生态学报,2013,24(2):366- 372. HU Song,ZHANG Ying,SHI Rongjiu,etal.Temporal variations of soil microbial biomass and enzyme activities during the secondary succession of primary broadleaved-Pinuskoraiensisforests in Changbai Mountains of Northeast China[J].Chinese Journal of Applied Ecology,2013,24(2):366- 372.
[17] 鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000.
[18] CLASSEN A T,BOYLE S I,HASKINS K E,etal.Community-level physiological profiles of bacteria and fungi:plate type and incubation temperature influences on contrasting soils[J].FEMS Microbiology Ecology,2003,44(3):319- 328.
[19] QIAN Xun,GU Jie,PAN Hongjia,etal.Effects of living mulches on the soil nutrient contents,enzyme activities,and bacterial community diversities of apple orchard soils[J].European Journal of Soil Biology,2015,70:23- 30.
[20] LIU Bei,LI Yanxia,ZHANG Xuelian,etal.Effects of chlortetracycline on soil microbial communities:comparisons of enzyme activities to the functional diversity via Biolog EcoPlatesTM[J].European Journal of Soil Biology,2015,68:69- 76.
[21] FLORES-RENTERA D,RINCN A,VALLADARES F,etal.Agricultural matrix affects differently the alpha and beta structural and functional diversity of soil microbial communities in a fragmented Mediterranean holm oak forest[J].Soil Biology & Biochemistry,2016,92:79- 90.
[22] ZHANG Xiaobing,WANG Xujing,TANG Qiaoling,etal.Effects of cultivation of Osr HSA transgenic rice on functional diversity of microbial communities in the soil rhizosphere[J].The Crop Journal,2015,3(2):163- 167.
[23] ZHANG Haifang,LI Gang,SONG Xiaolong,etal.Changes in soil microbial functional diversity under different vegetation restoration patterns for Hulunbeier Sandy Land[J].Acta Ecologica Sinica,2013,33(1):38- 44.
[24] 郑学博,樊剑波,崔键,等.沼液还田对旱地红壤微生物群落代谢与多样性的影响[J].生态学报,2016,36(18):5865- 5875. ZHENG Xuebo,FAN Jianbo,CUI Jian,etal.Analysis on metabolic characteristics and functional diversity of soil edaphon communities in upland red soil under biogas slurry applacition[J].Acta Ecologica Sinica,2016,26(18):5865- 5875.
[25] 王静娅,王明亮,张凤华.干旱区典型盐生植物群落下土壤微生物群落特征[J].生态学报,2016,36(8):2363- 2372. WANG Jingya,WANG Mingliang,ZHANG Fenghua.Soil microbial properites under typical halophytic vegetation communities in arid regions[J].Acta Ecologica Sinica,2016,36(8):2363- 2372.
[26] JANGID K,WILLIAMS M A,Franzluebbers A J,etal.Land-use history has a stronger impact on soil microbial community composition than aboveground vegetation and soil properties[J].Soil Biology & Biochemistry,2011,43(10):2184- 2193.
[27] 梁健.子午岭植物群落演替与土壤养分及微生物群落的关系[D].西安:陕西师范大学,2011.
[28] 娄鑫,崔晓阳.温带森林次生演替过程中土壤微生物多样性研究[J].土壤通报,2011,42(3):557- 561. LOU Xin,CUI Xiaoyang.The study of soil microbial diversity in temperate forest secondary succession process[J].Chinese Journal of Soil Science,2011,42(3):557- 561.
[29] 王晓峰,汪思龙,张伟东.杉木凋落物对土壤有机碳分解及微生物生物量碳的影响[J].应用生态学报,2013,24(9):2393- 2398. WANG Xiaofeng,WANG Silong,ZHANG Weidong.Effects of litter on soil organic carbon and microbial biomass carbon in Chinese fir[J].Journal of Applied Ecology,2013,24(9):2393- 2398.
[30] HOOGMOED M,CUNNINGHAM S C,BAKER P,etal.N-fixing trees in restoration plantings:effects on nitrogen supply and soil microbial communities[J].Soil Biology & Biochemistry,2014,77(7):203- 212.
[31] LI Su,LIU Wenyao,LI Dawen,etal.Slower rates of litter decomposition of dominant epiphytes in the canopy than on the forest floor in a subtropical montane forest,southwest China[J].Soil Biology & Biochemistry,2014,70(2):211- 220.
[32] 范瑞英,杨小燕,王恩姮,等.黑土区不同林龄落叶松人工林土壤微生物群落功能多样性的对比研究[J].北京林业大学学报,2013,35(2):63- 68. FAN Ruiying,YANG Xiaoyan,WANG Enheng,etal.Effects of different soil and water conservation forests on topsoil metabolic functional diversity of soil microbial community in black soil region,northeastern China[J].Journal of Beijing Forestry University,2013,35(2):63- 68.
[33] MUHAMMAD N,DAI Zhongmin,XIAO Kongcao,etal.Changes in microbial community structure due to biochars generated from different feedstocks and their relationships with soil chemical properties[J].Geoderma,2014,226227:270- 278.
[34] 王风芹,田丽青,宋安东,等.华北刺槐林与自然恢复植被土壤微生物量碳、氮含量四季动态[J].林业科学,2015,51(3):16- 24. WANG Fengqin,TIAN Liqing,SONG Andong,etal.Seasonal dynamics of microbial biomass carbon and nitrogen in soil ofRobiniapseudoacaciaforests and near-naturally restored vegetation in northern China[J].Scientla Silvae Sinicae,2015,51(3):16- 24.
[35] MURPHY D V,COOKSON W R,BRAIMBRIDGE M,etal.Relationships between soil organic matter and the soil microbial biomass(size,functional diversity,and community structure)in crop and pasture systems in a semi-arid environment[J].Soil Research,2011,49(7):582- 594.
[36] 马玲,马琨,汤梦洁,等.间作与接种AMF对连作土壤微生物群落结构与功能的影响[J].生态环境学报,2013,22(8):1341- 1347. MA Ling,MA Kun,TANG Mengjie,etal.Effects of intecropping and inoculation of AMF on the microbial community structure and function of continuous cropping soil[J].Ecology and Environmental Sciences,2013,22(8):1341- 1347.
[37] 陈法霖,郑华,阳柏苏,等.外来种湿地松凋落物对土壤微生物群落结构和功能的影响[J].生态学报,2011,31(12):3543- 3550. CHENG Falin,ZENG Hua,YANG Bosu,etal.Effects of exotic species slash pine(Pinuselliottii)litter on the structure and function of the soil microbial community[J].Chinese Journal of Applied Ecology,2011,31(12):3543- 3550.
[38] CARACCIOLO A B,BUSTAMANTE M A,NOGUES I,etal.Changes in microbial community structure and functioning of a semiarid soil due to the use of anaerobic digestate derived composts and rosemary plants[J].Geoderma,2015,245246:89- 97.
[39] 吴则焰,林文雄,陈志芳,等.武夷山国家自然保护区不同植被类型土壤微生物群落特征[J].应用生态学报,2013,24(8):2301- 2309. WU Zeyan,LIN Wenxiong,CHEN Zhifang,etal.Characteristics of soil microbial community under different vegetation typer in wuyushan national nature reserve′east China[J].Chinese Journal of Applied Ecology,2013,37(5):2301-2309.
[41] INNANGI M,SCHENK M K,D′ALESSANDRO F,etal.Field and microcosms decomposition dynamics of European beech leaf litter:influence of climate,plant material and soil with focus on N and Mn[J].Applied Soil Ecology,2015,93:88- 97.
[42] USHIO M,KITAYAMA K,BALSER T C.Tree species effects on soil enzyme activities through effects on soil physicochemical and microbial properties in a tropical montane forest on Mt.Kinabalu Borneo[J].Pedobiologia,2010,53(4):227- 233.
Changes of Soil Microbial Functional Diversity in the Degraded and Successional Primitive Korean Pine Forest in Lesser Khingan Mountain, Northern China
SUN Xue1, SUI Xin2, HAN Dongxue1, LIU Yan1, FENG Fujuan1*
1.School of Forestry, Northeast Forestry University, Harbin 150040, China 2.National and Provincial Joint Engineering Laboratory of Wetlands and Ecological Conservation, Institute of Nature & Ecology, Heilongjiang Academy of Sciences, Harbin 150040, China
This study aimed to understand the changes of soil biotope and soil microbial functional diversity in the Lesser Khingan Mountain primitive Korean pine forest and subsequent succession by secondary forest. We selected soils of a typical primitive broad-leaved Korean pine forest and two main secondary forests (Betulaplatyphyllaforest at the pioneer stage and a hardwood forest at the subclimax stage during degradation and succession of the forest vegetation) in Lesser Khingan Mountain as materials. We analyzed changing patterns of microbial functional diversity of the soils in the depths of 0-<10 cm and 10-20 cm by using the Biolog-ECO microplate method. The results showed that the Average Well Color Development (AWCD) values increased with increasing incubation time; the values in the initial stage of incubation followed a decreasing order: broadleaved Korean pine > hardwood forest >B.platyphylla. In the terminal stage of incubation, the AWCD values of broadleaved Korean pine,B.platyphylla, and hardwood forest were 1.06, 0.86 and 0.81, respectively, on 0-<10 cm soil layers, and 0.68, 0.47 and 0.45 on 10-20 cm soil layers. The higher AWCD value of the soil layers in the primitive forest indicated that the single carbon source metabolic activity of the soil microorganism in the primitive forest was significantly higher than that of the secondary forests. The AWCD values of 0-<10 cm soil were significantly higher than that in 10-20 cm in the same kind of forest (P<0.05). Microbial diversity indices (Shannon-Wiener index, Simpson index, McIntosh index and Richness index) of the primitive forest were significantly higher than those of the secondary forests (P<0.05). The results indicate that soil microbes in the primitive forest microbial had a higher utilization intensity to various carbon sources as compared with those in the secondary forests; the types of dominant carbon source utilized by soil microbial communities varied in different forest types. After degradation and subsequent succession of the primitive forest, soil microbial community during utilization of carbon sources was sensitive to the four carbon sources (e.g., carbohydrates, amino acids, carboxylic acids and Polymer).
Biolog-ECO; soil microorganism; functional diversity; degradation and succession
2016-10-10 修改日期:2016-12-23
国家自然科学基金项目(31670496);中央高校基本科研业务费专项(2572015EA02)
孙雪(1991-),女,吉林省德惠人,1005612348@qq.com.
*责任作者,冯富娟(1972-),女,黑龙江哈尔滨人,教授,博士,博导,主要从事土壤微生物生态学研究,ffj9018@sina.com
X171.1
1001- 6929(2017)06- 0911- 08
A
10.13198/j.issn.1001- 6929.2017.01.90
孙雪,隋心,韩冬雪,等.原始红松林退化演替后土壤微生物功能多样性的变化[J].环境科学研究,2017,30(6):911- 919.
SUN Xue,SUI Xin,HAN Dongxue,etal.Changes of soil microbial functional diversity in the degraded and successional primitive korean pine forest in Lesser Khingan Mountain,northern China[J].Research of Environmental Sciences,2017,30(6):911- 919.
