右肺门硬化性血管瘤一例
2017-06-13罗经文成俊玲古琳陈开林范文斌刘志新张飞
罗经文 成俊玲 古琳 陈开林 范文斌 刘志新 张飞
· 病例报告 ·
右肺门硬化性血管瘤一例
罗经文 成俊玲 古琳 陈开林 范文斌 刘志新 张飞
血管瘤; 硬化性肺泡细胞瘤; CT扫描
肺硬化性血管瘤并非血管源性肿瘤,而是一种肺泡来源的肿瘤。2015年世界卫生组织肺肿瘤分类中将“硬化性血管瘤”改为“硬化性肺泡细胞瘤”,归为腺瘤[1]。为避免与本例的临床检查报告混淆,本文仍使用原有“硬化性血管瘤”术语。肺硬化性血管瘤在冰冻切片、小活检和细胞学上都容易被误诊为腺癌或类癌,故难以确诊,手术完整切除病理检查是最好的方法。本病临床上少见,生长于肺门处罕见,既要切除肿瘤又要保护肺功能,行肿瘤剔除还是联合肺叶切除,手术处理方法值得探讨。因此,对此类肿瘤的准确认识,将有利于临床治疗方法的选择,现报告1例硬化性血管瘤的诊疗过程。
患者 女性,51岁。因“咳嗽、咳痰”1周,于2015年11月28日收入广东医科大学附属深圳南山医院呼吸科。患者咳嗽以刺激性干咳为主,少量黏白痰。无咳血,无发热、盗汗,无体重减轻。门诊治疗无好转,行胸部X线片提示右肺门区占位性病变,遂行胸部CT平扫及增强表现:右肺中叶、下叶支气管间可见一类圆形肿块,直径约4.2 cm,密度较均匀,CT值约为36 Hu,动脉期CT值约80 Hu,实质期约90 Hu,考虑偏良性病变(硬化性血管瘤、孤立性纤维瘤),不完全排除类癌(图1)。既往有子宫肌瘤和胆囊结石病史。体格检查:神清,无贫血貌,全身皮肤、巩膜无黄染,浅表淋巴
结未触及肿大,口唇无发绀,颈软,胸廓无畸形,双肺语颤增强及减弱,双肺叩诊清音,双肺呼吸音清,未闻及干湿性啰音。心前区无隆起,无震颤,心界无扩大,心率93次/min,律齐,未闻及杂音。腹平软,全腹无压痛,无反跳痛,肝脾肋下未触及,莫菲氏征阴性,肝肾区叩痛阴性。双下肢无水肿。入院后积极完善各项检查:血、尿、粪常规正常。红细胞沉降率为56 mm/h,C反应蛋白(C reactive protein,CRP)12.7 mg/L,糖类抗原CA153为41.76 IU/ml ,痰找抗酸杆菌、结核感染T细胞、γ-干扰素(interferon-γ,IFN-γ)三项检测均阴性。支气管镜检查提示右中叶、右下叶基底段外压性狭窄。考虑位于肺门,位置深,穿刺活检困难,遂经本科会诊后转入手术治疗,12月3日全麻双腔气管插管胸腔镜下行右肺门肿物切除,术中见水平裂与斜裂交界处约5 cm×4 cm大小圆形肿块,予以吸引器、超声刀钝锐性分离,肿瘤内侧与肺动、静脉关系密切,血供丰富,有滋养血管,紧贴右中、下叶支气管分叉处完整切除,术中冰冻病理考虑良性肿瘤,未做纵隔淋巴结清扫,术后常规病理见肿瘤为实性、乳头状、硬化性和出血性组织结构混合,增生的Ⅱ型肺泡细胞被覆在乳头状结构表面,并可见慢性炎症和泡沫细胞等变化(图2)。免疫组织化学检查明确为硬化性血管瘤(图3),术后恢复顺利,第8天痊愈出院。随访11个月,患者无不适,复查胸部CT未见异常。
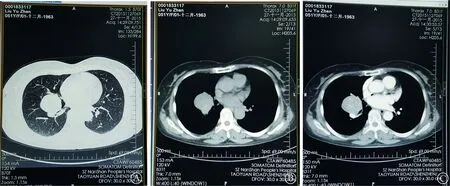
图1 右肺门硬化性血管瘤胸部CT扫描显示:右肺中叶、下叶支气管间可见一类圆形肿块,直径约4.2 cm,形态较为规整,未见明显分叶及毛刺征象,肿块与中叶、下叶支气管分界不清。A:肺窗;B:平扫纵隔窗;C:增强后纵隔窗,见肿块下方紧贴肺动脉
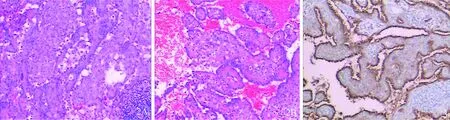
图2 病理学检查显示肿瘤中见实性、乳头状、硬化性和出血性组织结构(A:HE染色×100;B:HE染色×400)图3 检测结果支持硬化性血管瘤(免疫组织化学染色×100)
讨论 肺硬化性血管瘤(pulmonary sclerosing hemangioma,PSH)系肺部少见的良性肿瘤,由Leibow和Hubbell[2]于1956年首先报道,其病理组织形态类似于皮肤组织中的硬化性血管瘤而得名,主要表现有实性细胞、血管瘤样改变或出血、乳头状突起、硬化,按不同的比例混合存在[3]。其组织起源和性质尚未达成共识,有研究[4]通过免疫组织化学等技术表明实际上是来源于肺泡上皮( Ⅱ型肺泡细胞) 或细支气管上皮细胞的良性肿瘤 ,因局部的慢性炎症表现也有学者认为是非特异炎症所致的肺内瘤样增生病变,又称为硬化性血管瘤型肺炎性假瘤。也有数例报道[5,6]骨转移、淋巴结转移的,但预后良好,故可认为是低度恶性肿瘤。发病中年女性多见,临床表现多数患者无症状,少数表现为咳嗽、咳痰或胸痛,亦有发热表现[7]。本例患者出现刺激性干咳与瘤体较大压迫、刺激局部的支气管有关。影像学常为主要的诊断方式,胸部 CT 多表现为单发类圆形肿物,边缘光滑,少有毛刺、分叶,增强 CT 延迟强化,一般无肿大的肺门及纵隔淋巴。因肿块多位于肺周边部,经皮肺穿刺活检亦为可行,但本例位于肺门深处,靠近血管,术中发现肿瘤血供丰富,术前未做穿刺活检避免了大出血的风险。或者CT表现有明显强化,有血管瘤成分的病变亦不适合穿刺。临床注意与结核球、错构瘤、炎性假瘤、周围型肺癌鉴别。治疗以手术完整切除瘤体为主,尽量保留肺功能,本例患者完整剔除肿瘤,避免了肺叶切除。尽管肿瘤界限清楚,但与周围肺间质和支气管关系密切甚至有浸润现象,尤其是瘤体较大且位于肺门处,术中需注意暴露,防止出血及损伤支气管壁,有滋养血管的需仔细分离,可靠结扎或者超声刀凝断,本例采用胸腔镜手术,术野有放大作用,解剖结构和层次更为清晰,有一定的优势,比小切口更为微创[8]。虽预后良好,但术后需随访有无复发。
1 董有文.硬化性肺泡细胞瘤的影像及临床特征研究进展.天津医科大学学报,2016, 22(5):463-465.
2 Liebow AA, Hubbell DS. Sclerosing hemangioma (histiocytoma zanthoma) of the lung [J]. Cancer, 1956, 9(1):53-75.
3 Xu HM, Li WH, Hou N, et al. Neuroendocrine differentiation in 32 cases of so called selerosing hemangioma of the lung:Identifled by immumuohistochemical and ultrastructural and study[J]. Am J Surg Pathol, 1997, 21(9): 1013-1034.
4 Wang E, Lin D, Wang Y, et al. Immunohistochemical and ultra-structural markers suggest different origins for cuboidal and polygonal cells in pulmonary sclerosing hemangioma [J]. Hum Pathol, 2004, 35(4): 503-508.
5 Kim MK, Jang SJ, Kim YH, et al.Bone metastasis in pulmonary sclerosing hemangioma[J].Int J Clin Exp Pathol, 2015, 8(7):8619-23.
6 Miyagawa-Hayashino A, Tazelaar HD, Langel DJ, et al. Pulmonary sclerosing hemangioma with lymph node metastases: report of 4 cases[J]. Arch Pathol Lab Med, 2003,(127):321-325.
7 Zhou L1, Sun C2, Huang Y1, et al. Pulmonary sclerosing hemangioma with a rare symptom: A case report and review of the literature. [J]. Mol Clin Oncol. 2017,6(2):221-224.
8 张军,邱雪杉.不断肌肉、不断肋骨、微创小切口开胸手术切除多发性硬化性肺细胞瘤1例[J].中国微创外科杂志,2017,17(3): 285.
(本文编辑:周珠凤)
罗经文,成俊玲,古琳,等. 右肺门硬化性血管瘤1例[J/CD].中华胸部外科电子杂志,2017,4(2):133-134.
10.3877/cma.j.issn.2095-8773.2017.02.13
518052 广东医科大学附属深圳南山医院心胸外科
成俊玲,电子邮箱:luo21@21cn.com
2016-11-19)
