RvD1对大鼠2型糖尿病神经病理性痛的作用及机制研究*
2017-06-12马益梅李传达朱雅冰
马益梅, 李传达, 朱雅冰, 徐 霞, 李 军, 曹 红
(温州医科大学附属第二医院麻醉科, 浙江温州 325027)
RvD1对大鼠2型糖尿病神经病理性痛的作用及机制研究*
马益梅, 李传达, 朱雅冰, 徐 霞, 李 军, 曹 红△
(温州医科大学附属第二医院麻醉科, 浙江温州 325027)
目的:采用2型糖尿病神经病理性痛大鼠,探讨其脊髓背角小胶质细胞极化情况以及消退素D1(RvD1)缓解大鼠2型糖尿病神经病理性痛的机制。方法:雄性SD大鼠高糖高脂饲养,腹腔注射链脲佐菌素(STZ),制备大鼠2型糖尿病神经病理性痛模型。将2型糖尿病神经病理性痛大鼠随机分为3组(n=36):2型糖尿病神经病理性痛组(D组)、2型糖尿病神经病理性痛注射RvD1组(R组)和溶剂对照组(S组)。R、S组分别于注射STZ 14 d后蛛网膜下腔置管,3 d后R、S组分别给予RvD1 10 μl(10 ng/μl)和100%乙醇10 μl,每天1次,连续14 d,D组不做任何处理。另取36只正常大鼠为正常对照组(N组),普通饲料喂养。鞘内给药后第1、3、7、14 天时测定机械缩足阈值(MWT)和热缩足潜伏期(TWL),各组随机取9只大鼠处死,取L4-6脊髓膨大,采用Western blot法检测小胶质细胞M1、M2型极化标记物,即诱导型一氧化氮合酶(iNOS)、精氨酸酶1(Arg1)的表达。结果:与N组比较,D、S组第1、3、7、14 天时MWT降低、TWL缩短,脊髓背角Arg1表达减少,iNOS表达增多(P<0.05);与D组比较,R组第7、14 天时MWT升高、TWL延长,脊髓背角Arg1表达增多,iNOS表达减少(P<0.05);D组与S组各指标比较差异无统计学意义。结论:RvD1促进小胶质细胞M2型极化并缓解大鼠2型糖尿病神经病理性痛。
大鼠;2型糖尿病;脊髓;小胶质细胞极化;RvD1;Arg1;iNOS;
随着生活水平不断的提高,糖尿病患者也逐渐增多,2011年全世界2型糖尿病患者约为3.66亿,预计2030年将达到5.53亿[1,2]。糖尿病神经病理性疼痛(diabetic neuropathic pain,DNP)是2型糖尿病患者周围神经病变引起的神经病理性疼痛,发病率高达50%[4],其临床特征为自发痛、诱发痛、痛觉过敏、痛觉超敏以及异常疼痛。目前对DNP的治疗药物主要是抗惊厥药、抗抑郁药、非甾体类抗炎药、阿片类镇痛药。然而,只有少数患者的疼痛能得到有效缓解,且耐受性较差,严重影响糖尿病患者的生活水平。因此,探讨DNP的发病机制,对于寻找新的治疗方法具有重要意义。消退素 (Resolvin D1,RvD1)是一种内源性促炎症消退介质,有研究证明其对多种疼痛模型具有镇痛作用[4, 5],并参与影响小胶质细胞极化状态,促进其M2型极化,而小胶质细胞作为中枢神经系统(central nervous system, CNS)的免疫活性细胞,其极化状态对CNS的免疫环境有重要影响,与慢性神经炎性疾病密切相关[6]。然而对于RvD1是否可通过影响小胶质细胞极化缓解2型糖尿病大鼠DNP的研究仍较缺乏。因此本实验在2型糖尿病大鼠模型在给予RvD1治疗后,检测2型糖尿病大鼠机械和热痛阈的变化,以及小胶质细胞极化的表达情况,探讨RvD1是否可通过影响脊髓背角小胶质细胞极化来缓解2型糖尿病大鼠DNP,为DNP的发病机制及治疗方法提供新的思路。
1 材料与方法
1.1 主要试剂及仪器
链脲佐菌素(streptozotocin, STZ)、无水乙醇均购自Sigma公司;RvD1、Iba1、精氨酸酶1(arginine1,Arg1)抗体和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗体分别购自Cayman、Wako、Santa cruz和Abcam公司。STZ用pH 4.3的柠檬酸液配成1%贮存液,于4℃冰箱保存;2390型Electronic von Fery 触觉测痛仪、336型甩尾足底测试仪购自美国2TC公司;Bio-Rad电泳转膜仪购自美国Bio-Rad公司,PE-10导管(OD:0.5mm,ID:0.25 mm)购自宁波市科技园区安来软件科技有限司。
1.2 动物模型制备及分组
清洁级SD大鼠,雄性,体重120~160 g,由温州医科大学实验动物中心提供,许可证号:SCXK(浙)2005-0019。大鼠饲养于20℃~25℃环境中,摄食摄水,适应环境72 h。给予高糖高脂饲料(67%普通饲料+10%猪油+20%蔗糖+2%胆固醇+1%胆酸钠)并饮水,于实验开始及饲养第8 周(8w)测体重,并于第8周测空腹血糖、取尾静脉血测血清胰岛素以评估胰岛素敏感性。饲养8周大鼠空腹胰岛素浓度升高,胰岛素敏感性指数明显下降,即出现胰岛素抵抗后,禁食不禁饮12 h,以35 mg/kg腹腔注射1% STZ溶液。3 d后测定大鼠尾静脉血糖,血糖稳定且≥16.7 mmol/L入选2型糖尿病大鼠组,14 d后测大鼠机械缩足阈值(mechanical withdrawal threshold, MWT),降低至基础值80%以下为2型糖尿病神经病理性痛大鼠[7]。采用随机数字表法,将其分为3组(n=36):2型糖尿病神经病理性痛组(D组)、2型糖尿病神经病理性痛复合RvD1组(R组)和溶剂对照组(S组)。R、S组经L4-5椎间隙,于蛛网膜下腔向头端置入PE10导管1 cm,置管3 d后恢复正常。R、S组分别给予RvD1 10 μl(10 ng/μl)、100%乙醇 10 μl, 1次/天,连续14 d,D组不做任何处理。另取36只正常大鼠为正常对照组(N组),给予普通饲料喂养。
1.3 胰岛素测定
大鼠禁食不禁水12 h后,尾静脉采血约1 ml,室温静止约30 min,4℃恒温离心后取上清液,采用双抗体夹心ELISA法测定胰岛素浓度,作标准曲线,计算待测标本血清胰岛素浓度。
1.4 行为学测试
所有测定均在上午(8: 00~11: 00)、安静的环境下进行,室温维持在(25.0±0.5)℃。(1) MWT测定:将大鼠置于底为金属筛网的透明玻璃箱中,玻璃箱放置于实验台面上方50 cm左右。待大鼠在箱中适应环境、安静后,用2TC-2390 型Electronic Von Fery触觉测痛仪垂直刺激大鼠足底中部皮肤,均匀缓慢加大刺激力度,直至大鼠出现快速缩足、舔足、抬腿等阳性反应,取此时的刺激强度值,单次刺激时间≤1 s,刺激间隔>10 s。左右后爪各测5次,取其平均值即为其MWT。(2) 热缩足潜伏期(thermal withdrawal latency,TWL)测定:将大鼠置于底为3 mm厚玻璃板的透明玻璃箱中,待大鼠适应环境、安静后,使用2TC336甩尾足底测试仪的热辐射光源照射大鼠后趾,记录大鼠从照射到缩爪回避的时间,每只大鼠双足各测5次,每次间隔5 min,取后3次的平均值即为其TWL。
1.5 计算胰岛素敏感性指数及2型糖尿病神经病理性痛的判断
胰岛素敏感性指数=1/(空腹血糖×空腹胰岛素浓度),此值为非正态分布,计算时取其自然对数[8]。空腹血糖≥16.7 mmol/L,胰岛素敏感性下调、痛阈降低至基础值80%以下为2型糖尿病神经病理性痛大鼠。
1.6 蛛网膜下腔置管
2型糖尿病神经病理性痛大鼠在5%水合氯醛手术麻醉状态下,经L4-5腰椎间隙,于蛛网膜下腔轻柔向头端置入PE-10导管1 cm,置管过程中见大鼠甩尾、清亮脑脊液流入导管,固定导管;3 d后,经留置导管给予2%利多卡因10 μl,大鼠后肢瘫痪,蛛网膜下腔置管成功[9]。
1.7 脊髓背角Arg1、iNOS检测
于蛛网膜下腔给药后第1、3、7、14天,测定MWT和TWL,各组随机取9只大鼠腹腔注射5%水合氯醛,手术麻醉状态下取L4-6节段脊髓,液氮速冻,-80℃低温保存,取出新鲜组织标本,按重量体积比1∶10加入裂解液,充分研磨,超声5 min×3次后静置30 min,4℃恒温离心后取上清液。BCA方法测定蛋白浓度,按照50 μg、10 μl加样变性蛋白,经SDS-聚丙烯酰胺凝胶电泳分离,转移到孔径0.45 μm PVDF膜上,用含5% BSA的TBST溶液常温封闭2 h或4℃摇床封闭过夜,加入Arg1、iNOS单克隆抗体,4℃过夜,室温TBST洗10 min×3次,加入碱性磷酸酶标记的IgG抗体,室温孵育2 h,TBST洗10 min×3次。加ECL发光液后用DNRMIROCHEMI化学发光成像系统曝光、拍照,AlphaEaseFC软件分析条带光密度值,内参β-actin,以光密度比值反映Arg1、iNOS的表达水平。
1.8 统计学处理
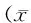
2 结果
2.1 血糖、胰岛素敏感指数情况
与N组比较,D组大鼠饲养8周后血糖升高,但没有达到糖尿病诊断标准(≥16.7mmlo/L),而空腹胰岛素浓度升高,胰岛素敏感性指数下降。在注射STZ 3 d后,血糖明显升高(表1)。
2.2 痛阈变化
腹腔注射STZ前,各组大鼠MWT、TWL差异无统计学意义。造模成功后,与N组比较,D组和S组第1、3、7、14天时MWT降低、TWL缩短,与D组比较,R组第1、3天时MWT、TWL没有明显变化,第7、14 天时MWT升高、TWL延长(表2、表3)。
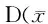
Tab. 1 Comparison of blood glucose, insulin, and insulin sensitivity index between group N and group ±s, n=9)
N: Normal group; D: Type 2 DNP group; STZ: Streptozotocin
*P<0.05vsN group
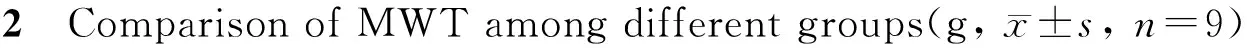
Tab.
MWT: Mechanical withdrawal threshold; N: Normal group; D: Type 2 DNP group; S: Solvent control group; R: Type 2 DNP and RvD1 group
*P<0.05vsN group;#P<0.05vsD group
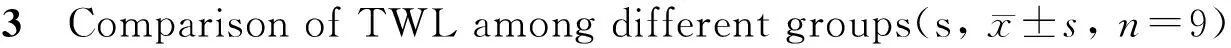
Tab.
TWL: Thermal withdrawal latency; N: Normal group; D: Type 2 DNP group; S: Solvent control group; R: Type 2 DNP and RvD1 group
*P<0.05vsN group;#P<0.05vsD group
2.3 脊髓背角Arg1、iNOS表达
与N组比较,D组和S组第1、3、7、14天时脊髓背角Arg1表达相对值减少,iNOS表达相对值增加;与D组比较,R组第7、14天时脊髓背角Arg1表达相对值增加,iNOS表达相对值减少(P<0.05)。D组与S组各指标比较差异无统计学意义(图1、图2,表4、表5)。
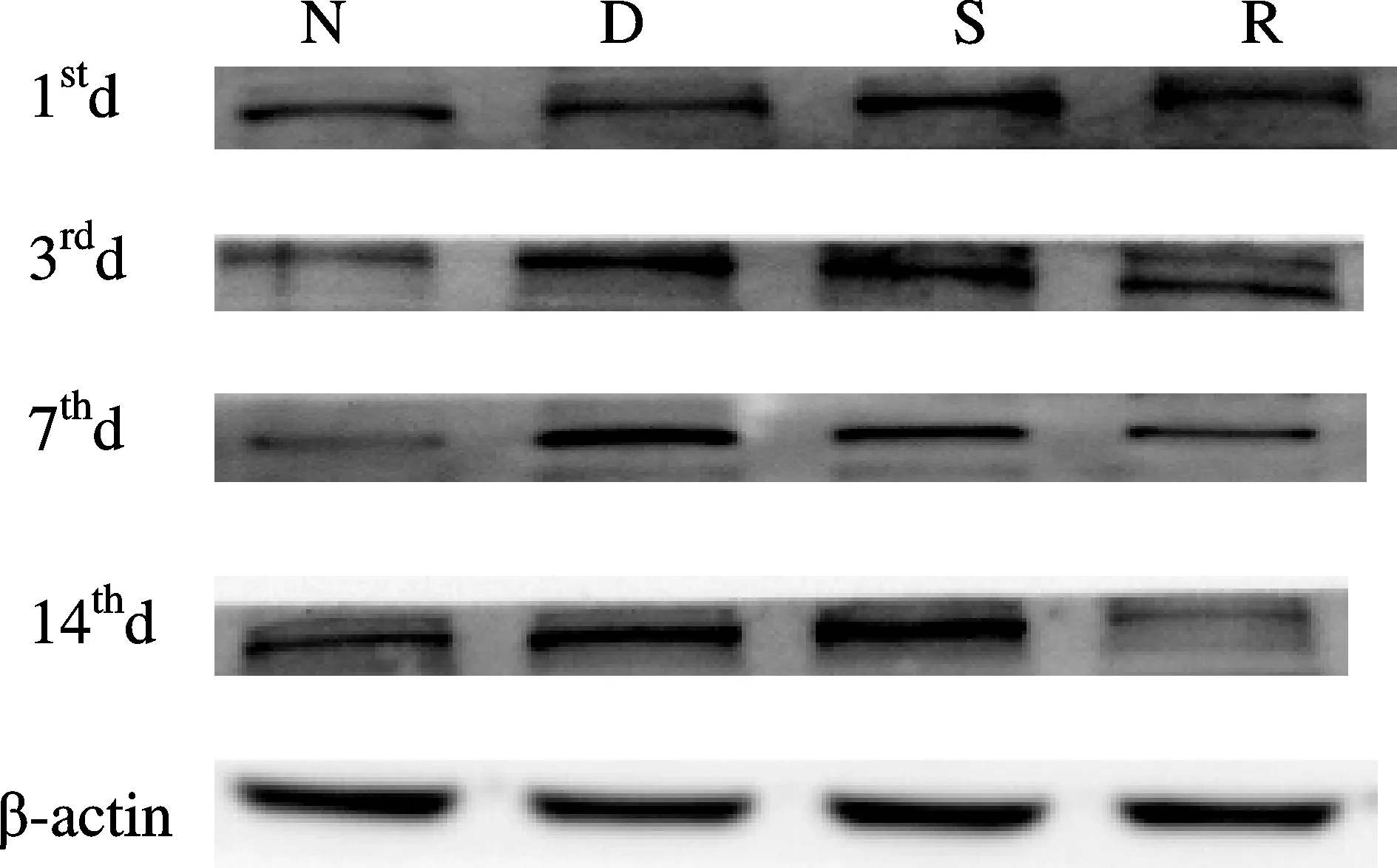
Fig. 1 Detecction the expression of iNOS by Western blot N: Normal group; D: Type 2 DNP group; S: Solvent control group; R: Type 2 DNP and RvD1 group
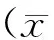

Group1std3rdd7thd14thdN1.0±0.11.0±0.20.9±0.10.9±0.1D1.1±0.2*1.2±0.3*1.1±0.2*1.1±0.2*S1.1±0.1*1.2±0.2*1.1±0.2*1.1±0.2*R1.0±0.21.0±0.21.0±0.2#1.0±0.2#
N: Normal group; D: Type2 DNP group; S: Solvent control group; R: Type 2 DNP and RvD1 group; iNOS: Inducible nitric oxide synthase
*P<0.05vsN group;#P<0.05vsD group
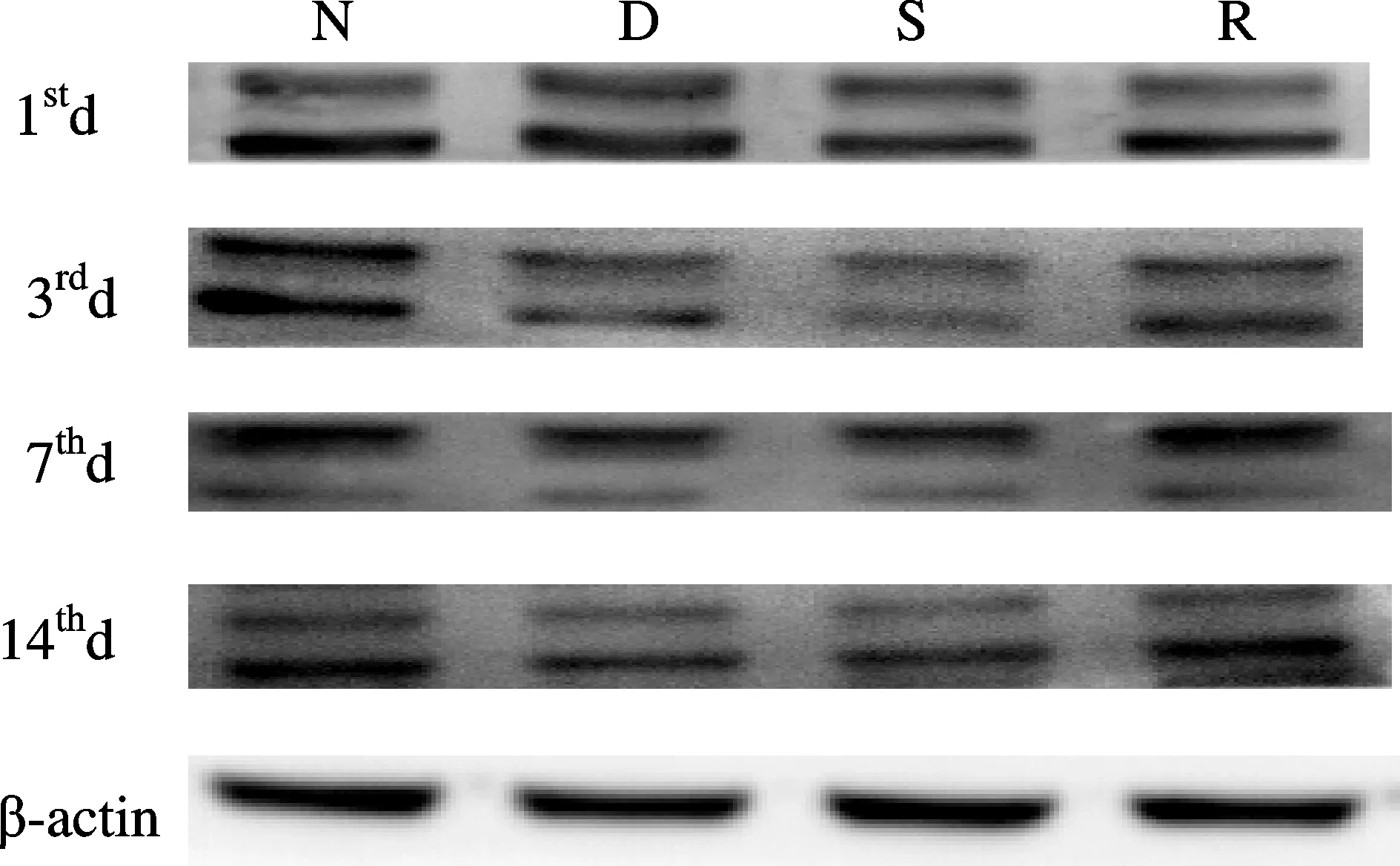
Fig. 2 Detecction the expression of Arg1 by Western blot N: Normal group; D: Type 2 DNP group; S: Solvent control group; R: Type 2 DNP and RvD1 group; Arg1: Arginine 1
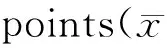

Group1std3rdd7thd14thdN1.2±0.31.1±0.11.2±0.31.1±0.2D1.0±0.1*1.0±0.1*0.9±0.1*1.0±0.1*S0.9±0.1*1.0±0.1*0.9±0.1*0.9±0.1*R1.0±0.21.1±0.21.1±0.2#1.1±0.1#
N: Normal group; D: Type 2 DNP group; S: Solvent control group; R: Type 2 DNP and RvD1 group
*P<0.05vsN group;#P<0.05vsD group
3 讨论
本研究采用高糖高脂饲养复合单次小剂量注射STZ的方法制备大鼠2型糖尿病神经病理性痛模型[7],结果表明,D组较N组不同时间点MWT降低、TWL缩短,表明神经病理性疼痛模型制备成功。
本实验参照文献[7]的方法制备大鼠2型糖尿病神经病理性痛模型,之后给予相应药物进行处理,本研究中神经病理性疼痛组与溶剂对照组各指标比较无统计学差异,排除了溶剂及手术操作对实验结果的影响。与D组比较,R组第7、14 天时MWT升高、TWL延长,髓背角Arg1表达增加,iNOS表达减少,说明鞘内给予RvD1可缓解神经病理性疼痛, 促进小胶质细胞M2型极化。
Kristina等在脊髓损伤(SCI)模型中发现,小胶质细胞在不同的微环境中,可激活细胞内不同的信号通路,引起相应的激活状态,产生M1和M2型极化,表现出截然不同的神经毒性作用或保护修复作用。SCI早期阶段释放大量的促炎因子,如TNF-α、IFN-γ和IL-1β等[10],使大部分小胶质细胞呈M1型极化,少量的小胶质细胞呈现为M2型极化。M1型小胶质细胞产生更多的TNF-α、IFN-γ等炎症因子以及氧化应激产物,其造成的炎症环境在维持自身M1型极化的同时,对神经元产生神经毒性作用。SCI中晚期阶段,由于损伤本身以及M1型小胶质细胞产生炎症因子的积累,使更多的小胶质细胞呈M1型极化[11],而抑制M2极化的产生,形成恶性循环。而SCI后期,随着炎症消退,有利于小胶质细胞向M2极化,小胶质细胞M2型极化增多,M1型极化减少,其可以释放大量具有神经保护及促进轴突再生作用的营养因子BDNF、NGF及抗炎因子IL-4、IL-10和TGF-β[12],使神经损伤逐渐修复。
本实验采用的2型糖尿病神经病理性疼痛模型作为一种慢性炎症模型,免疫印迹实验结果表明,糖尿病神经病理性疼痛大鼠较正常大鼠脊髓背角iNOS表达上调,Arg1表达下调,即小胶质细胞M1型极化增多,M2型极化减少,糖尿病大鼠MWT、TWL明显下降。蛛网膜下腔注射RvD1后第1、3天,大鼠的痛阈并没有明显改善,小胶质细胞M1、M2型极化也没有明显变化。RvD1是Serhan等发现的一种内源性的促炎症消退介质[13],它具有强效的抗炎促消退作用。近来有研究发现,RvD1可明显促进IL-4诱导的小胶质细胞M2型极化[14], 并且能抑制角叉莱胶诱发的热痛觉过敏和机械痛觉过敏[15]。蛛网膜下腔注射RvD1后第7、14天,给予RvD1大鼠的痛阈明显提高,iNOS表达下调,Arg1表达上调,即小胶质细胞M1型极化减少,M2型极化增多。这就表明,在2型糖尿病神经病理性疼痛中由于慢性炎症的存在,导致脊髓背角小胶质细胞更趋向于M1型极化,而M2型极化受到抑制,M1型小胶质细胞又会产生更多的炎症因子,炎症因子的积累,使更多的小胶质细胞呈M1型极化[11]。而RvD1的应用,可促进小胶质细胞M2型极化,使M1型极化减少,改善大鼠脊髓背角的微环境,从而提高糖尿病神经病理性疼痛大鼠的痛阈。
综上所述,RvD1可以通过促进脊髓背角小胶质细胞M2型极化缓解2型糖尿病大鼠神经病理性疼痛。
[1] Lam DW, LeRoith D. The worldwide diabetes epidemic[J].CurrOpinEndocrinolDiabetesObes, 2012, 19(2): 93-96.
[2] Chen L, Magliano DJ, Zimmet PZ. The worldwide epidemiology of type 2 diabetes mellitus--present and future perspectives[J].NatRevEndocrinol, 2011, 8(4): 228-236.
[3] Guan Y, Ding X, Cheng Y,etal. Efficacy of pregabalin for peripheral neuropathic pain: results of an 8-week, flexible-dose, double-blind, placebo-controlled study conducted in China[J].ClinTher, 2011, 33(2): 159-66.
[4] Xu ZZ, Zhang L, Liu T,etal. Resolvins RvE1 and RvD1 attenuate inflammatory pain via central and peripheral actions[J].NatMed, 2010, 16(5): 592-597.
[5] Quan-Xin F, Fan F, Xiang-Ying F,etal. Resolvin D1 reverses chronic pancreatitis-induced mechanical allodynia, phosphorylation of NMDA receptors, and cytokines expression in the thoracic spinal dorsal horn[J].BMCGastroenterol, 2012, 12(1): 1-10.
[6] Ji RR, Berta T, Nedergaard M. Glia and pain: Is chronic pain a gliopathy[J].Pain, 2013, 154(Suppl 1): S10-28.
[7] Dang JK, Wu Y, Cao H,etal. Establishment of a Rat Model of Type II Diabetic Neuropathic Pain[J].PainMed, 2014, 15(4): 637-646.
[8] Muniyappa R, Lee S, Chen H,etal. Current approaches for assessing insulin sensitivity and resistance in vivo: advantages, limitations, and appropriate usage[J].AmJPhysiolEndocrinolMetab, 2008, 294(1): 15-26.
[9] Yaksh TL, Grafe MR, Malkmus S,etal. Studies on the safety of chronically admisnistered intrathecal neostigmine methylsulfate in rats and dogs[J].Anesthesiol, 995, 82(2): 412-427.
[10]Chan CC. Inflammation: beneficial or detrimental after spinal cord injury[J].RecentPatCNSDrugDiscov, 2008, 3(3): 189-199.
[11]Kigerl KA, Gensel JC, Ankeny DP,etal. Identification of two distinct macrophage subsets with divergent effects causing either neurotoxicity or regeneration in the injured mouse spinal cord[J].JNeurosci, 2009, 29(43): 13435-13444.
[12]Shechter R, Schwartz M. Harnessing monocyte derived macrophages to control central nervous system pathologies: no longer ‘if’but ‘how’[J].JPathol, 2013, 229(2): 332-346.
[13]Serhan CN, Hong S, Gronert K,etal. Resolvins a family of bioactive products of omega-3 fatty acid transformation circuits initiated by aspirin treatment that counter proinflammation signals[J].JExpMed, 2002, 196(8): 1025-1037.
[14]Li L, Yan W, Wang Y,etal. Resolvin D1 promotes the interleukin-4-induced alternative activation in BV-2 microglial cells[J].JNeuroInflammation, 2014, 11(1): 72.
[15]Bang S, Yoo S, Yang TJ,etal. 17(R)-resolvin D1 specifically inhibits transient receptor potential ion channel vanilloid 3 leading to peripheral antinociception[J].BrJPharmacol, 2012, 165(3): 683-692.
关于图、表的要求
图应具有自明性,其内容不可与文字、表格重复。图中的量、单位、符号、缩写词和文字等须与正文一致。图片应图像清晰,反差明显,精度600 dpi。显微照片图应附比例标尺(如Scale bar=50 μm)。染色后拍摄的显微照片还应注明染色法。表一般采用三线式,须置于文中相应处,图可附另页。图表的题目、内容和注释须用英文。
本刊编辑部
The mechanism of RvD1 alleviates type 2 diabetic neuropathic pain by influencing microglia polarization in rats
MA Yi-mei, LI Chuan-da, ZHU Ya-bing, XU Xia, LI Jun, CAO Hong△
(Department of Anesthesiology, the Second Affiliated Hospital of Wenzhou Medical University, Wenzhou 325027, China)
Objective: To study the relationship between microglia polarization in the spinal dorsal horn and type 2 diabetic neuropathic pain (DNP). And explore the mechanism of RvD1 alleviating type 2 diabetic neuropathic pain. Methods: Type 2 diabetes mellitus (T2DM) rats came from the male SD rats which were fed by high-fat and high-sucrose diet and given intraperitoneal streptozotocin(STZ), then detected fasting blood glucose level, the mechanical withdrawal threshold (MWT) and thermal withdrawal latency ( TWL), which was to prepare the type 2 DNP model rats . And they were randomly divided into 3 groups : type 2 DNP group (group D), type 2 DNP and RvD1 group (group R), type 2 DNP and solvent control group (group S), 36 rats in each group. After being given STZ 14 days, the rats of group D, R, S were placed a catheter in subarachnoid cavity. Three days later, the RvD1 10 μl (10 ng/μl) and 100% ethanol 10 μl were injected into subarachnoid cavity through the catheter once a day for 14 consecutive days. Another 36 normal rats were served as normal control group (group N) and were fed with common forage. MWT and TWL were measured at 1, 3, 7, 14 days after Subarachnoid injection, then the nine rats’ spinal cord of the lumbar segment 4~6 were removed to detect the expression of inducible nitric oxide synthase(iNOS) and arginase 1(Arg1) by Western blot, the marker of microglia M1 and M2 polarization. Results: Compared with group N, MWT was decreased significantly and TWL was shortened, the expression of Arg1 was down-regulated and the expression of iNOS was up-regulated in spinal dorsal horn at the 1, 3, 7, 14 days in groups D and S (P<0.05). Compared with group D, MWT was significantly increased and TWL was prolonged, the expression of Arg1 was up-regulated and the expression of iNOS was down-regulated in spinal dorsal horn at the 7, 14 days in group R (P<0.05). There was no significant difference in the MWT, TWL and expression of Arg1 and iNOS between D and S groups. Conclusion: RvD1 promotes microglia toward M2 polarization and alleviates type 2 diabetic neuropathic pain in rats.
rats; T2DM; the spinal dorsal horn; microglia polarization; RvD1; Arg1; iNOS
国家自然科学基金(81073125)
2016-11-14
2017-02-20
R614
A
1000-6834(2017)03-277-05
10.12047/j.cjap.5521.2017.067
△【通讯作者】Tel: 13758497562; E-mail: caohongwz@163.com
