酒精依赖大鼠不同脑区肌动蛋白结合蛋白的表达变化*
2017-06-12张瑞岭万为滔胡一文
余 意, 黄 楠, 张瑞岭, 万为滔, 胡一文△
(1. 武汉科技大学附属天佑医院精神科, 湖北 武汉 430064; 2. 中国人民解放军武汉总医院, 湖北 武汉 430070;3. 新乡医学院第二附属医院, 河南 新乡 453003)
酒精依赖大鼠不同脑区肌动蛋白结合蛋白的表达变化*
余 意1, 黄 楠2, 张瑞岭3, 万为滔1, 胡一文1△
(1. 武汉科技大学附属天佑医院精神科, 湖北 武汉 430064; 2. 中国人民解放军武汉总医院, 湖北 武汉 430070;3. 新乡医学院第二附属医院, 河南 新乡 453003)
目的:研究长期酒精暴露对大鼠不同脑区肌动蛋白结合蛋白cofilin表达的影响。方法:雄性SD大鼠24只,随机等分为慢性酒精暴露1月组(E1组)和2月组(E2组),各饮酒组均设对照组(C1组、C2组),每组大鼠6只。参照文献制作实验动物模型,给慢性酒精暴露组大鼠自由饮含低浓度乙醇(体积分数为6%)的水溶液,对照组大鼠正常饮自来水。撤除酒精后6 h进行戒断症状评分,并分别处死各组大鼠取脑组织。采用免疫组织化学方法检测各组大鼠前额叶皮质和海马CA1区cofilin蛋白的表达水平。结果:饮酒组大鼠撤除酒精后出现明显的戒断症状。在前额皮质区,E1组大鼠cofilin表达水平较C1组显著升高(P<0.05),E2组大鼠cofilin表达水平较C2组显著升高(P<0.01);在大鼠海马CA1区,E1组cofilin表达水平较C1组显著升高(P<0.05),E2组cofilin表达水平较C2组相比无显著差异(P>0.05)。结论:长期酒精暴露可导致大鼠前额皮质及海马CA1区肌动蛋白结合蛋白的表达变化。
酒精依赖;突触可塑性;肌动蛋白结合蛋白
ethanol dependence; synaptic plasticity; cofilin
长期大量饮酒可使部分个体产生酒精依赖,表现为对酒精的耐受,强烈的渴求,以及中断饮酒后出现戒断症状,并伴有明显的社会和职业功能损害。目前研究表明,突触可塑性在酒精成瘾中扮演了重要角色[1-3]。中枢神经系统大多数突
触位于神经元的树突和树突棘部位,这些结构被认为是大脑突触可塑性的主要位点[4]。目前已证实树突棘形态动力学是由肌动蛋白动态调节的,肌动蛋白在棘突形态形成中发挥重要作用[5,6]。Cofilin是中枢神经系统重要的肌动蛋白结合蛋白,可调节肌动蛋白动力学[7]。
研究发现肌动蛋白细胞骨架的适当调节是酒精细胞和行为反应的关键因素[8]。Shibasaki等也证实酒精诱导的小鼠行为敏化至少部分地通过肌动蛋白的动态变化所调节[9]。细胞骨架肌动蛋白可能是神经元重要的酒精作用靶点,酒精诱导的树突棘形态和数量改变的机制是细胞骨架完整性的改变,这些变化背后的机制仍未阐明[10,11]。
本研究拟从影响神经元形态和功能的细胞骨架肌动蛋白入手,采用动物行为学、免疫组织化学等方法,研究大鼠酒精作用不同时程及不同脑区肌动蛋白结合蛋白cofilin的表达变化,探讨肌动蛋白结合蛋白在酒精诱导的神经元突触可塑中的作用,进一步深化酒精成瘾的分子生物学机制。
1 材料与方法
1.1 实验动物
雄性SD大鼠24只,体质量120~160 g,购自郑州大学实验动物中心,SPF级(许可证号:scxk(豫)2010-0002)。
1.2 药品与试剂
兔抗鼠cofilin多克隆抗体购自北京博奥森生物技术有限公司;免疫组化试剂盒、DAB显色试剂盒购自北京中衫金桥生物技术有限公司;其他试剂均为分析纯试剂。
1.3 大鼠酒精依赖模型的建立及实验分组
将大鼠饲养在一间安静房间的笼子里,自然光照,室温控制在18℃~24℃。参照文献[12]将实验组大鼠的饮水换成含6% (v/v)乙醇的水溶液,作为饮水的唯一来源, 24 h自由饮水,自由进食,每天9: 00配制酒精水溶液,置换。对照组大鼠正常饮自来水,自由进食,每天9: 00更换饮水。实验分为4组:(1)慢性酒精暴露1月组(E1组);(2)对照1月组(C1组);(3)慢性酒精暴露2月组(E2组);(4)对照2月组(C2组),每组大鼠6只。分别取材制备相应的组织样品。
1.4 酒精戒断症状的观察
参照Erden等[13]方法,观察大鼠撤除酒精后的戒断症状。大鼠饮酒1月和2月,在停饮后6 h对大鼠进行行为体征和听源性癫痫发作评分。
1.5 免疫组织化学
在选定的时间用10%水合氯醛麻醉处死大鼠,经生理盐水和4%多聚甲醛心脏灌注,取脑,修块,于固定液后固定6 h。经脱水、透明、浸蜡步骤制备石蜡块,参照脑立体定位图谱选取前额皮质和海马CA1部位切片,片厚5 μm。采用ABC法进行免疫组化染色,cofilin抗体滴度均为1∶100,用PBS 代替一抗作阴性对照。阴性对照组均未染色,说明本实验所检测的cofilin免疫反应阳性颗粒为特异性染色。采用Image-Pro Plus 6.0 图像分析软件测量图片的平均光密度值,每只大鼠取相关部位5张切片的平均值为这只大鼠的数值。
1.6 统计学处理
2 结果
2.1 行为学观察
大鼠在饮酒期间较为温顺,不易激惹,攻击性行为较少;酒精撤除后6 h,大鼠出现理毛、打喷嚏、易激惹、尾巴强直、低头拱背、听源性癫痫发作强度增加。其戒断症状评分在酒精暴露1月组和酒精暴露2月组均显著高于对照组大鼠,差异有统计学意义(P<0.01, 表1)。说明长期酒精处理后,大鼠对酒精产生了躯体依赖。
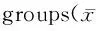
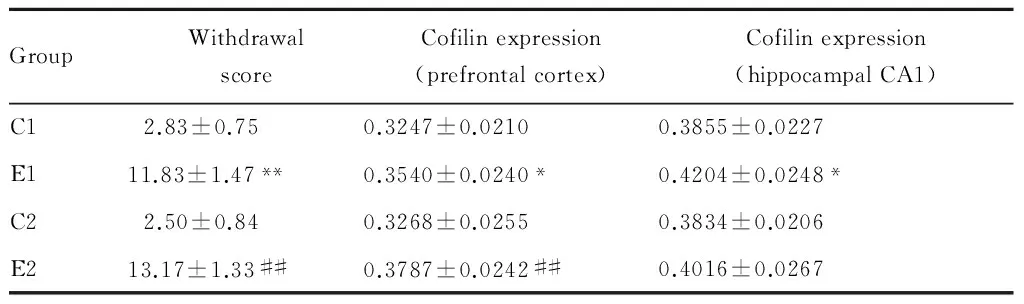
GroupWithdrawalscoreCofilinexpression(prefrontalcortex)Cofilinexpression(hippocampalCA1)C12.83±0.750.3247±0.02100.3855±0.0227E111.83±1.47**0.3540±0.0240*0.4204±0.0248*C22.50±0.840.3268±0.02550.3834±0.0206E213.17±1.33##0.3787±0.0242##0.4016±0.0267
C1: Control group one months; C2: Control group two months; E1: Ethanol exposure one-month group; E2: Ethanol exposure two-month group
*P<0.05,**P<0.01vsC1;#P<0.05,##P<0.01vsC2
2.2 各组大鼠前额叶皮质cofilin蛋白表达的变化
各组大鼠前额叶皮质cofilin蛋白表达的平均光密度值见表1,平均光密度值的大小正比于cofilin表达水平。结果显示,与对照1月组相比,酒精暴露1月组cofilin蛋白表达水平显著升高,差异有统计学意义(P<0.05)。酒精暴露2月组较对照2月组相比,cofilin蛋白表达水平显著升高,差异有统计学意义(P<0.01, 表1,图1,见彩图页Ⅱ)。
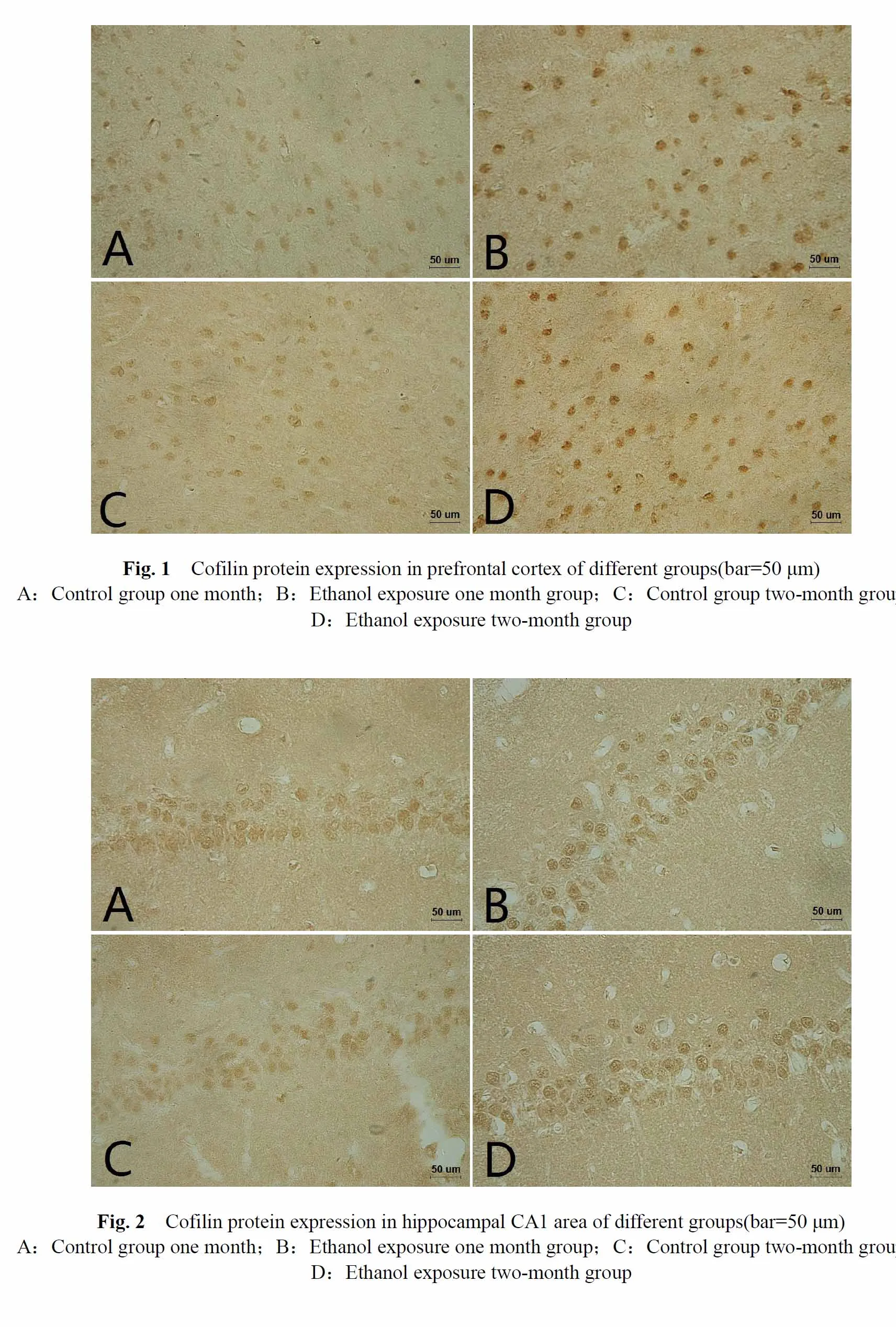
2.3 各组大鼠海马CA1区cofilin蛋白表达的变化
各组大鼠海马CA1区cofilin蛋白表达的平均光密度值见表1,平均光密度值的大小正比于cofilin表达水平。结果显示,与对照1月组相比,酒精暴露1月组cofilin蛋白表达水平显著升高,差异有统计学意义(P<0.05)。酒精暴露2月组较对照2月组相比,cofilin蛋白表达水平无显著变化,差异无统计学意义(表1,图2,见彩图页Ⅱ)。
3 讨论
长期酒精使用可造成中枢神经系统突触的可塑性改变,突触可塑性包括很多环节,其中树突棘的形态学改变被认为是促成各种刺激事件诱导的行为适应性改变的重要基础。目前已证实长期酒精暴露对树突棘数量以及形态变化的影响,但具体的作用机制仍未阐明[14-16]。树突棘形态动力学是由肌动蛋白动态调节的,肌动蛋白在棘突形态形成中发挥重要作用。Cofilin是中枢神经系统重要的肌动蛋白结合蛋白,可调节肌动蛋白动力学。Cofilin的活性依赖于它的磷酸化状态,其受各种激酶的调节。Ser3位点的磷酸化使cofilin蛋白失活,使其不能与肌动蛋白丝结合,从而提高肌动蛋白的稳定性。因此,cofilin的磷酸化与否是肌动蛋白动态变化的开关。除了受磷酸化的调节之外,cofilin还与其它肌动蛋白结合蛋白发生相互作用,共同调节棘突的稳定性[17]。因此,cofilin在树突棘可塑性中可能发挥关键作用,然而该蛋白在酒精依赖形成过程中的表达变化,国内外尚无报道。
本研究通过建立大鼠慢性酒精使用模型,选择与酒精依赖以及学习记忆关系密切的脑区:前额叶皮质与海马,测定了酒精依赖形成过程中cofilin蛋白在上述脑区的表达变化。行为学结果显示,大鼠长期饮酒撤除酒精后,出现严重的躯体戒断症状,这与文献报道的一致[12-13],说明酒精依赖大鼠模型建立成功。本研究显示长期酒精处理改变大鼠大脑神经元cofilin蛋白的表达水平,但在酒精作用的不同时程以及不同脑区均有所不同。其中慢性酒精处理1月和2月大鼠的前额叶皮质cofilin表达水平较对照组均显著升高,大鼠慢性酒精处理1月海马CA1区cofilin表达水平较对照组显著升高,而在慢性酒精处理2月组则无显著变化。提示慢性酒精处理改变大鼠一些脑区cofilin蛋白表达的水平,其变化与酒精作用时间的长短有一定的关系,同时在不同脑区也略有不同。本课题前期在成瘾相关其他脑区的研究与此亦有所差异[18]。目前研究普遍认为长期酒精使用对不同脑区突触可塑性变化的影响具有明显特异性,其中具体的机制仍需进一步实验研究阐明。
研究证实cofilin与认知功能以及学习记忆有着密切联系[11,19]。也有研究发现调节cofilin磷酸化的重要蛋白激酶cdk5在慢性酒精中毒大鼠海马区表达增加并导致其学习记忆功能的下降[20,21]。前额叶皮质是中脑边缘多巴胺系统的重要组成部分,海马与学习记忆关系密切,同时它又是大脑内对酒精敏感性较高的结构之一,可以推测cofilin在前额皮质及海马区表达的异常可能与长期酒精暴露导致的学习记忆功能障碍有关。
总之,我们的研究证明长期酒精作用导致大鼠一些脑区肌动蛋白结合蛋白cofilin的表达变化,这种关键分子在调节树突棘形态变化和突触可塑性中具有重要作用,并可能参与对酒精依赖导致的学习记忆功能障碍。我们的结果对进一步阐明酒精依赖的分子生物学机制提供实验依据。
[1] Bramham CR, Alme MN, Bittins M,etal. The Arc of synaptic memory [J].ExpBrainRes, 2010, 200(2): 125-140.
[2] Hyman SE, Malenka RC, Nestler EJ. Neural mechanisms of addiction: the role of reward-related learning and memory[J].AnnuRevNeurosci, 2006, 29: 565-598.
[3] Kalivas PW, O’Brien C. Drug addiction as a pathology of staged neuroplasticity[J].Neuropsychopharmacology, 2008, 33(1): 166-180.
[4] Gass JT, Olive MF. Neurochemical and neurostructural plasticity in alcoholism[J].ACSChemNeurosci, 2012, 3(7): 494-504.
[5] Ethell IM, Pasquale EB. Molecular mechanisms of dendritic spine development and remodeling[J].ProgNeurobiol, 2005, 75(3): 161-205.
[6] Robinson TE, Kolb B. Structural plasticity associated with exposure to drugs of abuse[J].Neuropharmacology, 2004, 47(suppl 1): 33-46.
[7] Des Marais V, Ghosh M, Eddy R,etal. Confilin takes the lead[J].JCellSci, 2005, 118(1): 19-26.
[8] Offenha user N, Castelletti D, Mapelli L,etal. Increased ethanol resistance and consumption in Eps8 knockout mice correlates with altered actin dynamics[J].Cell, 2006, 127(1): 213-226.
[9] Shibasaki M, Kurokawa K, Mizuno K. Actin dynamics in development of behavioral sensitization after withdrawal from long-term ethanol administration to mice[J].AlcoholClinExpRes, 2012, 36(8): 1385-1396.
[10]Pospelova TV, Pospelov VA. Latest progress in tyrosine kinase inhibitors [J].Oncotarget, 2014, 5(5): 1157-1161.
[11]Romero AM, Renau-Piqueras J, Pilar Marin M,etal. Chronic alcohol alters dendritic spine development in neurons in primary culture [J].NeurotoxRes, 2013, 24(4): 532-548.
[12]李 菁, 袁孝如, 李跃华, 等. 酒精依赖大鼠模型建立[J]. 中国药物依赖性杂志, 2006, 15(6): 433-436.
[13]Erden BF, Ozdemirci S, Yildiran G,etal. Dextromethorphan attenuates ethanol withdrawal syndrome in rats[J].PharmacolBiochemBehav, 1999, 62(3): 537-541.
[14]Carpenter-Hyland EP, Chandler LJ. Homeostatic plasticity during alcohol exposure promotes enlargement of dendritic spines[J].EurJNeurosci, 2006, 24(12): 3496-3506.
[15]Carpenter-Hyland EP, Chandler LJ. Adaptive plasticity of NMDA receptors and dendritic spines: implications for enhanced vulnerability of the adolescent brain to alcohol addiction[J].PharmacolBiochemBehav, 2007, 86(2): 200-208.
[16]Zhou FC, Anthony B, Dunn KW,etal. Chronic alcohol drinking alters neuronal dendritic spines in the brain reward center nucleus accumbens[J].BrainRes, 2007, 1134(1): 148-161.
[17]Kojima N, Shirao T. Synaptic dysfunction and disruption of postsynaptic drebrin-actin complex: a study of neurological disorders accompanied by cognitive deficits[J].NeurosciRes, 2007, 58(1): 1-5.
[18]余 意, 韩金珠, 连阳阳, 等. 长期酒精暴露和戒断后大鼠不同脑区肌动蛋白结合蛋白、细胞周期素依赖性蛋白激酶5的表达[J]. 中华行为医学与脑科学杂志, 2014, 23(7): 587-590.
[19]Rust MB, Gurniak CB, Renner M,etal. Learning, AMPA receptor mobility and synaptic plasticity depend on confllin-mediated actin dynamics [J].EMBOJ, 2010, 29(11): 1889-1900.
[20]李新娟, 张 艳, 徐春阳, 等. 白藜芦醇甙对慢性酒精中毒大鼠学习记忆及海马Cdk5激酶活性的影响[J]. 中国应用生理学杂志, 2015, 31(2): 117-120.
[21]李 爽, 徐春阳, 姜洪波, 等. 孕期引用酒精对子代大鼠学习记忆及海马Cdk5表达的影响[J]. 中国应用生理学杂志, 2012, 28(1): 13-14.
武汉科技大学青年科技骨干培育计划项目(2015X2024)
2016-01-13
2016-11-21
R749
A
1000-6834(2017)03-197-03
10.12047/j.cjap.5414.2017.050
△【通讯作者】Tel: 027-51228590; E-mail: hyw79818@163.com
