有氧运动联合褪黑素对Ⅱ型糖尿病大鼠骨质疏松的影响*
2017-06-12景会锋王小梅
景会锋, 王小梅
(延安大学体育学院, 陕西 延安 716000)
有氧运动联合褪黑素对Ⅱ型糖尿病大鼠骨质疏松的影响*
景会锋1△, 王小梅2
(延安大学体育学院, 陕西 延安 716000)
目的:观察有氧运动和褪黑素对Ⅱ型糖尿病大鼠骨质疏松的影响。方法:6周龄的成年雌性SD大鼠60只,随机分为安静对照组(N组)10只和Ⅱ型糖尿病模型组50只,N组大鼠不加任何干预,Ⅱ型糖尿病模型组大鼠一次性腹腔注射35 mg/kg链脲佐菌素(STZ),1周后检测大鼠血糖大于16.7 mmol/L为Ⅱ型糖尿病造模成功,将40只成模大鼠随机分为糖尿病对照组(D)、糖尿病+有氧运动组(DE)、糖尿病+褪黑素组(DM)、糖尿病+有氧运动+褪黑素组(DEM),每组10只;DE组和DEM组大鼠采用20 min的递增负荷的方式进行跑台有氧运动,训练持续6周,DM组和DEM组大鼠每天灌胃40 mg/kg褪黑素,观察各组大鼠体重、脊椎骨以及左右股骨骨密度(BMD)、观察大鼠血糖、血清丙二醛(MDA) 、超氧化物歧化酶(SOD) 、谷胱甘肽过氧化物酶(GSH-Px)、血清总钙(Ca)、无机磷(P)和甲状旁腺素(PTH)的变化。结果:与N组相比,D组大鼠体重、血清SOD、GSH-Px 水平、血Ca、腰椎和左右股骨BMD显著降低(P<0.05,P<0.01),血糖、血清MDA和血PTH水平显著升高(P<0.01),血P无明显变化(P>0.05);与D组比较,DE组、DM组大鼠大鼠体重、血清SOD、GSH-Px 水平、血Ca、腰椎和左右股骨BMD显著升高(P<0.05,P<0.01),血糖、血清MDA和血PTH水平显著降低(P<0.05,P<0.01),血P无明显变化(P>0.05),有氧运动和褪黑素同时干预效果更好。结论:有氧运动和褪黑素均能改善糖尿病骨质疏松,且两者联合干预的效果更加显著,其可能与通过提高糖尿病大鼠的抗氧化应激能力,调节糖的代谢从而有效地降低血钙和PTH,改善BMD来缓解骨质疏松有关。
有氧运动;褪黑素;二型糖尿病;骨质疏松
骨质疏松(osteoporosis,OP)症是常见的代谢性骨病,近年来我国OP的患病率呈现出逐年增加的趋势,研究表明,糖尿病(diabetes mellitus,DM)患者半数以上合并OP[1],其发病机制尚不明确。运动和褪黑素对于2型糖尿病(type 2 diabetes,T2DM)的益处十分明显,能有效改善糖尿病人的血脂代谢紊乱,降低氧化应激损伤,有效缓解症状[2];运动训练作为调控骨代谢的重要因素之一,其对骨产生的力学刺激可显著提高骨中细胞因子转录、蛋白表达和骨量等,从而防治OP[3]。最近研究表明,褪黑素除了参与机体生物节律、生殖、体温、免疫功能、心血管发育等方面的调节以外,还可以通过提高抗氧化、影响降钙素和甲状旁腺素的分泌,参与钙的新陈代谢,对骨的形成、骨量的增加等发面有积极作用[4]。随着人年龄增长(尤其是女性),血清中的褪黑素水平下降,OP的发生几率增加[5],且与此相关。对T2DM与OP的相关性国内外学者有所探讨[6-7],但鲜有从运动疗法方面结合褪黑素对糖尿病骨质疏松症(diabetic osteoporosis,DOP) 的关系做进一步的研究。本实验用DM大鼠模型,综合评价运动结合外源性褪黑素的补充对T2DM患者预防OP的作用,对改善糖尿病患者的症状,预防并发症的发生有实际意义。
1 材料与方法
1 材料
雌性SD大鼠50只(购于西安交通大学实验动物管理中心),6周龄,体重200~220 g,动物室内温度(22±2)℃,相对湿度45%~55%,每天按自然昼夜照明,光照时间12 h,分笼饲养,自由饮水,国家标准饲啮齿类普通饲料喂养。
1.2 大鼠分组及DOP模型的建立
适应性喂养1周后,随机分组:安静对照组(N)10只和Ⅱ型糖尿病模型组50只,N组大鼠不加任何干预,Ⅱ型糖尿病模型组大鼠一次性腹腔注射35 mg/kg链脲佐菌素(STZ),STZ购买于Sigma公司,现配现用,注射7 d后尾静脉采血测试血糖浓度,血糖浓度大于16.7 mmol/L为暂时成模大鼠。1周后复测大鼠随机血糖,以随机血糖浓度仍大于16.7 mmol/L为Ⅱ型糖尿病成模标准[8]。随后成模大鼠共40只,随机分为4 组,每组各10只,糖尿病对照组(D)、糖尿病+有氧运动组(DE)、糖尿病+褪黑素组(DM)、糖尿病+有氧运动+褪黑素组(DEM)。
1.3 褪黑素干预
褪黑素购买于Sigma公司,使用前溶于2%的乙醇溶液中,DM组和DEM组大鼠每天灌胃40 mg/kg褪黑素,N组、D 组和D+E组每天灌胃等体积的2%乙醇溶液。
1.4 运动训练方案
DE组和DEM组大鼠采用递增负荷的方式进行跑台有氧运动,起始速度为10 m/min,时间为20 min,适应性训练一周后开始正式训练。运动负荷参考Bedford的研究加以调整,每周训练5 d,速度逐渐递增由10 m/min增至20 m/min,训练时间递增值为5 min/d[9]。整个训练过程共持续6周,DEM组大鼠灌胃给药30 min后开始训练。
1.5 仪器设备与观察指标的测定
于末次训练结束后,按50 mg/kg的剂量腹腔注射2%的戊巴比妥钠溶液麻醉后,仰卧位置于DEXA探头之下,固定四肢,使椎体保持竖直,双侧股骨保持水平状态,应用双能X线BMD测定仪测定腰椎(L3-L6)和左右股骨BMD。BMD测试结束后,迅速分离颈总动脉,采血4 ml,注入含乙二胺四乙酸钠30 μl和10%抑肽酶40 μl的试管中,混匀,离心半径12 cm,离心(3 000 r/min,10 min,4℃),分离血浆,-20℃保存,备用待测血糖、SOD、MDA、GSH-Px、血Ca、P、PTH,血糖和血Ca、P测定应用东芝全自动生化分析仪,SOD、MDA、GSH-Px 的测试严格按照试剂盒说明,试剂盒购于南京建成生物科技有限公司,应用放射免疫法测定PTH,PTH放免试剂盒购自中国人民解放军总医院长城免疫研究所。
1.6 统计学处理
2 结果
2.1 各组大鼠体重的变化
由表1可知:与N组比较,D组大鼠体重显著性下降(P<0.01);与D组比较,有氧运动和褪黑素干预后大鼠体重显著性升高(P<0.01),与DE和DM组比较,运动和褪黑素联合干预后大鼠体重进一步升高(P<0.01)。
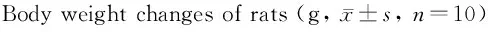
GroupWeight(beforeexperiment)Weight(afterexperiment)N218.1±26.6230.4±19.4D215.6±23.2180.3±13.8**DE220.1±21.7209.6±15.8##DM216.6±20.6198.2±17.4#DEM218.3±19.5220.1±16.9△△▲▲
N: Normal group; D: Diabetes group; DE: Diabetes and exercise group; DM: Diabetes and melatonine group; DEM:Diabetes, exercise and melatonine group
**P<0.01vsN;#P<0.05,##P<0.01vsD;△△P<0.01vsDE;▲▲P<0.01vsDM
2.2 各组大鼠椎骨和左右股骨BMD的变化
由表2可知:与N组比较,D组大鼠椎骨和左右股骨BMD显著性下降(P<0.01);与D组比较,有氧运动干预后大鼠椎骨和左右股骨BMD显著性升高(P<0.01),褪黑素干预后大鼠椎骨和左右股骨BMD升高,但不具有显著性差异(P>0.05),与DME和DMM组比较,运动和褪黑素联合干预后大鼠椎骨和左右股骨BMD显著性升高(P<0.01)。
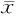
GroupVertebralBMDLeftfemurBMDRightfemurBMDN0.231±0.0150.229±0.0150.229±0.019D0.159±0.021**0.137±0.009**0.136±0.002**DE0.211±0.016##0.217±0.011##0.215±0.011##DM0.215±0.0190.205±0.0080.207±0.015DEM0.223±0.024△△▲▲0.221±0.013△△▲▲0.222±0.003△△▲▲
**P<0.01vsN;##P<0.01vsD;△△P<0.01vsDE;▲▲P<0.01vsDM
2.3 各组大鼠血糖与血清总Ca、P和PTH的变化
由表3可知:与N组比较,D组大鼠血糖和血PTH显著性升高(P<0.01),血Ca显著降低(P<0.05),血P无明显变化;与D组比较,有氧运动和褪黑素干预后大鼠血糖和血PTH显著性降低(P<0.01),血Ca显著升高(P<0.05),血P无明显变化(P>0.05),与DE和DM组比较,运动和褪黑素联合干预后大鼠血糖和血PTH显著性降低(P<0.01),血Ca显著升高(P<0.05),血P无明显变化(P<0.01)。
2.4 各组大鼠血清中的SOD、GSH-Px 活性和MDA含量的变化
由表4可知:与N组比较,D组大鼠血清中的SOD、GSH-Px 活性显著降低(P<0.01),MDA含量显著升高(P<0.01);与D组比较,有氧运动和褪黑素干预后大鼠血清中的SOD、GSH-Px 活性显著升高(P<0.01),MDA含量显著降低(P<0.01),与DE和DM组比较,运动和褪黑素联合干预后SOD、GSH-Px 活性显著升高(P<0.01),MDA含量显著降低(P<0.01)。
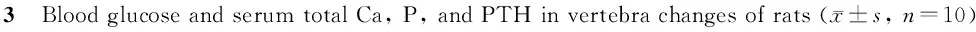
Tab.
N: Normal group; D: Diabetes group; DE: Diabetes and exercise group; DM: Diabetes and melatonine group; DEM: Diabetes, exercise and melatonine group; PTH: Parathyroid hormone
*P<0.05,**P<0.01vsN;#P<0.05,##P<0.01vsD;△P<0.05,△△P<0.01vsDE;▲P<0.05,▲▲P<0.01vsDM
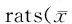

GroupSOD(NU/mgprot)MDA(nmol/mgprot)GSH-Px(U/min·mg)N129.34±4.730.41±0.02119.53±6.43D60.46±1.19**1.26±0.05**75.38±7.41**DE111.45±6.32##0.67±0.08##101.43±5.79##DM114.37±8.73##0.70±0.04##103.67±6.35##DEM123.45±6.21△△▲▲0.54±0.03△△▲▲110.37±5.16△△▲▲
**P<0.01vsN;##P<0.01vsD;△△P<0.01vsDE;▲▲P<0.01vsDM
3 讨论
以往对D2M的研究表明,病程持续时间越长,体重降低程度则越明显,Tong等人研究发现模拟失重可明显降低大鼠的股骨生物力学指标值[10],由此表明,体重下降是发生骨质疏松的危险因素之一;另有部分研究则显示BMD与体脂百分比呈正相关,单就BMD与脂肪的关系而言,目前研究尚未取得一致结果,徐君翔[11]认为脂肪含量对BMD有显著的影响,局部脂肪比例增加BMD下降显著。本研究则证实,随着D2M大鼠体重下降, BMD下降,有氧运动和褪黑素干预后可明显抑制大鼠体重下降,同时BMD下降的趋势也得到缓解。
运动是影响BMD的一个重要因素。运动方式不同对骨骼的负荷作用不同,对BMD产生的不同影响。适度的运动在增加肌肉重量、增强肌力的同时,BMD也可获得不同程度的提高,有研究显示,肌力与BMD呈正相关,肌力的增加有助于骨量的维持[12,13]。大量研究证明,体育锻炼可增加峰值的骨量,而峰值骨量是决定是否出现骨质疏松症状的关键性因素。研究发现中等强度跑台运动通过抑制骨吸收对去卵巢大鼠股骨下端松质骨的骨量和骨结构产生了良好的影响[14]。另有研究表明高强度运动,更有利于骨的矿化[15];同时随着运动强度的增加,BMD值逐步增加。本研究也证实运动能改善BMD,运动时骨骼受到挤压力和剪切力的直接刺激作用外,还有来自肌肉收缩对骨骼的牵拉刺激,有助于骨形成和重建,从而增加BMD;另外,运动还能增加胃肠道对营养物质和钙的吸收,体内维生素D浓度增高等作用来提高BMD。综上所述,运动对大鼠骨产生的直接力学刺激有可能通过提高骨形成并抑制骨吸收,从而使得大鼠BMD显著增加。
血清Ca、P测定是可间接反应骨代谢情况[16]。已有研究表明,糖尿病大鼠长期的高血糖会引起Ca、P摄入减少而丢失增加,血Ca降低,PTH分泌增加,动员大量骨钙入血,致使骨质疏松[17],也有临床证据表明长期高血糖环境不利于骨胶原交联[18]。另外,Balint等指出高血糖毒性作用可以抑制成骨细胞对Ca的摄取,可能与糖尿病发生时骨结构改变有关。在 T1DM患者中BMD值是降低的,T2DM患者中大量的研究表明,BMD值可以正常,降低或升高。本研究则证实,D2M大鼠血糖和PTH水平显著升高的同时,伴随血Ca显著降低,椎骨和左右股骨BMD均显著性下降,这或许是由于D2M大鼠长期的高血糖能够降低血Ca水平,而低血Ca进而影响骨矿化,使得血PTH反馈升高,并且与血糖升高水平成正相关,从而降低BMD。糖尿病大鼠血P降低,但是变化不明显,运动后有升高的趋势,这可能与运动引起的PTH分泌以及骨骼肌三磷酸腺苷代谢活跃后的脱磷作用有一定的关系。因此,可以认为糖尿病通过高血糖引起的低血Ca、高PTH降低BMD,形成骨质疏松。
褪黑素主要由松果体合成与分泌,近年来众多实验证明,褪黑素对于骨的重建过程具有重要作用,一方面能促进骨的发生,另一方面能防止骨的退化。外源性褪黑素促进了多种前成骨细胞系以及人骨髓间充质干细胞的进一步分化,在骨的发生中有至关重要的调节作用,能促进成骨过程。褪黑素在钙新陈代谢方面的作用最初由Csaba等人研究,发现这个作用褪黑素是通过影响降钙素与甲状旁腺激素的分泌介导的。本研究也证实褪黑素干预后,血糖和血清PTH降低,血Ca升高,同时伴随BMD的增加。
大量研究表明,当DM患者血糖水平升高时,会使氧化应激水平增高,从而促进DOP的发生与发展,这点提示控制血糖可能是防治DOP的一个非常重要途径[19]。氧化应激主要通过耗竭抗氧化物质、激活破骨细胞、抑制成骨细胞及骨形成来影响骨代谢。血清中的SOD、GSH-Px活性和MDA含量一直被认为是反映氧化应激的敏感指标[20]。本研究表明,D2M大鼠血清中的SOD、GSH-Px活性降低和MDA含量升高,抗氧化应激能力减弱,骨代谢过程紊乱。以往研究表明,运动特别是有氧运动可以提高机体的抗氧化应激的能力[21],褪黑素是一种非酶类抗氧化物质,具有较强的抗氧化应激作用[22]。本研究结果显示,经过6周的有氧运动和褪黑素治疗后,血清中SOD和GSH-Px活性明显升高,MDA含量明显下降,从而减少氧化应激损伤。规律运动能够稳定控制血糖水平已被诸多研究所证实。但是不同方式运动对血糖影响的报道不多,且尚有争议。大量资料表明, 对于改善糖和胰岛素抵抗代谢, 有氧运动能够加快骨骼肌对糖的摄取,从而有效降低血糖。本研究表明,有氧运动和褪黑素干预后大鼠血糖显著性降低,血Ca显著性升高,同时血PTH水平降低,且联合干预后大鼠效果更好。近年研究证实[23],高糖抑制成骨细胞的增殖、分化,导致成骨细胞功能下降,orifuji等发现3周的有氧运动可降低Ⅱ型糖尿病大鼠血糖的水平,与本研究的结果相一致。
综上所述,糖尿病持续高血糖使血Ca下降,PTH反馈性升高和清除自由基能力减弱,引起BMD下降,导致骨质疏松的发生;有氧运动联合褪黑素共同干预可以明显在改善糖的代谢的同时还可以提高抗氧化应激能力,降低高糖氧化应激对骨骼代谢的影响,有效控制体重和BMD下降,缓解骨质疏松,可以为临床上糖尿病引发的骨质疏松症的非药物治疗新方法提供实验依据。
[1] Kemink SA, Hermus AR, Swinkels LM,etal. Osteopenia in insulin-dependent diabetes mellitus; prevalence and aspects of pathophysiology [J].JEndocrinolInvest, 2000, 23(5): 295-303.
[2] 申潇竹, 张 玲, 田昌荣, 等. 阻抗训练对老年缺血性卒中患者预防骨质疏松的作用[J]. 实用医学杂志, 2012, 28(21): 3592-3593.
[3] 赵向东, 卢海龙. 老年2型糖尿病患者骨质疏松症相关危险因素分析[J]. 中华实用诊断与治疗杂志, 2011, 25(11): 1143-1144.
[4] Chan ME, Adler BJ, Green DE,etal. Bone structure and B-cell populations, crippled by obesity,are partially rescued by brief daily exposure to low-magnitude mechanical signals[J].FASEBJ, 2012, 26(12): 4855-4863.
[5] Shibata K, Yoshimura Y, Kikuiri T,etal. Effect of the release from mechanical stress on osteoclastogenesis in RAW264.7 cells[J].IntJMolMed, 2011, 28(1): 73-79.
[6] Stein GS, Lian JB, van Wijnen AJ,etal. Runx2 control of organization, assembly and activity of the regulatory machinery for skeletal gene expression[J].Oncogene, 2004, 23(24): 4315-4329.
[7] Gilbert LC, Chen H, Lu X,etal. Chronic low dose tumor necrosis factor-α (TNF) suppresses early bone accrual in young mice by inhibiting osteoblasts without affecting osteoclasts[J].Bone, 2013, 56(1): 174-183.
[8] 曹 姣, 肖国强. 有氧运动和白藜芦醇对II型糖尿病大鼠肝脏氧化应激及NF-κBp65的影[J]. 体育学刊, 2013, 27(6): 138-144.
[9] 景会锋. 有氧运动和褪黑素对2型糖尿病大鼠抗氧化运动功能的影响[J]. 中国应用生理学杂志, 2014, 30(5): 426-428.
[10]张 恒, 刘 宁, 任宁涛, 等. 模拟失重状态下雌、雄大鼠骨质疏松模型骨结构及生物力学对比研究[J]. 中国骨质疏松杂志, 2015, 21(9) : 1076-1082.
[11]Xu JX, Qian ZY, Li GF,etal. Correlational study between regional fat content and the bone mineral density in 12285 healthy subjects[J].Osteoporos, 2014, 20(8): 863-868.
[12]Wang ZQ, Wang LH, Wang M. The correlation between muscle strength and bone mineral density and other indicators in senile patients with osteoporosis and the efficacy evaluation of different interventions[J].ChinJOsteoporos, 2014, 20(7): 815-819.
[13]Zheng L, Chen XH, Zhou ZX. Relationship between characteristics of physical activity and bone mass in postmenopausal women[J].SportsMed, 2013, 32(3): 197-203,210.
[14]Wu Q, Chen JT. The effects of oxidative stress on the development of osteoporosis[J].Osteoporps, 2010, 16(3): 222-224.
[15]Wang W, Zhang X, Zheng J,etal. High glucose stimulates adipogenic and inhibits osteogenic differentiation in MG-63 cells through cAMP/protein kinase A/extracellular signal-regulated kinase pathway[J].MolCellBiochem, 2010, 338(1-2): 115-122.
[16]Botolin S, Faugere MC, Malluche H,etal. Increased bone adiposity and peroxisomal proliferator-activated receptor-γ2 expression in type 1 diabetic mice[J].Endocrinology, 2005, 146(8): 3622-3631.
[17]王振富, 钟 灵. 姜黄素对大鼠糖尿病防治作用的实验研究[J]. 中国应用生理学杂志, 2014, 30(1): 68-69.
[18]李世昌, 季 浏, 刘体伟, 等. 不同方式运动对去卵巢大鼠骨密度、骨生物力学及代谢指标的影响[J]. 体育学刊, 2012, 19(2): 132-137.
[19]房冬梅. 不同方式的运动对生长期大鼠骨代谢及其相关激素的影响[J]. 天津体育学院学报, 2009, 24(4): 337-340.
[20]林梅芳, 冯 星. 褪黑素抗氧化应激作用与器官保护[J]. 中华实用儿科临床杂志, 2007, 22(20): 1583-1585.
[21]Pacheco-Costa R, Hassan I, Reginato RD,etal. High bone mass in mice lacking Cx37 because of defective osteoclast differentiation[J].JBiolChem, 2014, 289(12): 8508-8520.
[22]Zawawi MS, Dharmapatni AA, Cantley MD,etal. Regulation of ITAM adaptor molecules and their receptors by inhibition of calcineurin-NFAT signalling during late stage osteoclast differentiation[J].BiochemBiophysResCommun, 2012, 427(2): 404-409.
[23]陈祥和, 李世昌, 孙 朋, 等. 下坡跑对生长期去卵巢小鼠骨BMP-2、Smad1/5和Runx2表达的影响[J]. 中国运动医学杂志, 2013, 32(7): 609-614.
Effects of aerobic exercise combined with melatonin on osteoporosis of type II diabetic rats
JING Hui-feng1△, WANG Xiao-mei2
(Department of Physical Education, Yanan University, Yanan 716000, China)
Objective: To investigate the effects of aerobic exercise and melatonin on osteoporosis in type 2 diabetic rats. Methods: Sixty female SD rats were randomly divided into the control group (n=10) and the diabetic model group (n=50). The rats in the control group(N group) did not receive any intervention, and the rats in the type Ⅱ diabetic group (D) was injected with streptozocin(STZ) at the dose of 35 mg/kg by intraperitoneally. One week later, rats with blood glucose greater than 16.7 mmol/L were successfully modeled for type Ⅱ diabetes. Forty diabetic rats were randomly divided into diabetic control group (D), diabetes+aerobic exercise group(CDE),diabetes+melatonin group(DM), diabetes mellitus + aerobic exercise + melatonin group (DEM), 10 rats in each group. The rats in DE and DEM groups were treated with 20 min aerobic exercise for 6 weeks. The rats in DM group and DEM group were given 40 mg/kg of melatonin per day. The body weight, vertebrae and left and right femur bone mineral density (BMD) of the rats in each group were observed. Malondialdehyde(MDA), superoxide dismutase (SOD), glutathione peroxidase (GSH-Px), serum total calcium (Ca), inorganic phosphate (P) and parathyroid hormone (PTH) were detected. Results: Compared with N group, body weight, serum SOD, GSH-Px levels, blood Ca, lumbar and femoral BMD of rats in group D were decreased significantly (P<0.05 orP<0.01). The levels of blood glucose, serum MDA and serum PTH were increased significantly (P<0.01), the level of blood P had no changes (P>0.05); compared with group D, DE group, DM group rats body weight, serum SOD, GSH-Px levels, blood Ca, lumbar spine and femur about BMD were increased significantly (P<0.05 orP<0.01). The levels of blood glucose, serum MDA and serum PTH were decreased significantly (P<0.05 orP<0.01), the level of blood P had no changes (P>0.05). The effects in diabetic rats treated with aerobic exercise and melatonin at the same time were much better. Conclusion: Both aerobic exercise and melatonin can improve diabetic osteoporosis, and the effect of both joint intervention is more significant, it may be associated with oxidative stress by increasing the ability of diabetic rats, regulate glucose metabolism in order to effectively reduce the calcium and PTH, improve BMD to alleviate osteoporosis.
aerobic exercise; melatonin; Type II diabetes; osteoporosis
2015年陕西省体育局常规课题项目(15035)
2015-12-08
2016-12-07
G804.7
A
1000-6834(2017)03-252-05
10.12047/j.cjap.5395.2017.062
△【通讯作者】Tel: 18329906898; E-mail: jinghuifeng112@126.com
