胸腔积液肿瘤标记物检测的临床价值探讨
2017-06-12陈晓菊谢明智裴思雅赖乐锦广西医科大学附属肿瘤医院综合内科消化肿瘤内科广西南宁5300
陈晓菊,谢明智,裴思雅,赖乐锦(广西医科大学附属肿瘤医院:综合内科,消化肿瘤内科,广西南宁5300)
胸腔积液肿瘤标记物检测的临床价值探讨
陈晓菊1,谢明智2,裴思雅1,赖乐锦1(广西医科大学附属肿瘤医院:1综合内科,2消化肿瘤内科,广西南宁530021)
目的:探讨癌胚抗原(CEA)、癌抗原125(CA-125)、神经元特异性烯醇化酶(NSE)、细胞角蛋白19片段(CYFRA21-1)联合血管内皮生长因子(VEGF)对鉴别良恶性胸腔积液的作用.方法:选取2015-01/2016-06广西医科大学附属肿瘤医院70例初诊CT发现恶性胸腔积液的患者,治疗前抽取一次胸腔积液留取标本,采用酶联免疫吸附试验(ELISA)测定CEA、CA-125、NSE、CYFRA21-1、VEGF水平.最终选取62份标本进行分析,通过ROC曲线计算出各指标诊断恶性胸腔积液的cut-off(临界值),计算各指标单独及联合对于恶性胸腔积液诊断的敏感性、特异性及准确性.结果:70例患者经活检(胸水细胞学、纤维支气管镜或经皮穿刺活检+随访)确诊,其中原发肺癌胸膜转移38例(其中腺癌25例,鳞癌11例,小细胞癌2例),良性胸腔积液 24例,最后共62例胸腔积液标本纳入研究.其中恶性胸腔积液中CEA、CA-125、CYFRA21-1、VEGF标记物明显高于良性组,差异有统计学意义(P<0.05),单独检测 CEA、CA-125、CYFRA21-1、NSE、VEGF对恶性胸水的敏感性分别为 78.9%,71.1%,71.1%,52.6%,78.9%,特异性为83.3%,58.0%,87.5%,66.6%,79.2%.联合各个指标对恶性胸腔积液的敏感性及特异性进行统计,可观察到最佳组合为CEA+CYFRA21-1+VEGF,敏感性及特异性为100%和84.2%,曲线下面积(AUC)为0.962,具有非常好的诊断效能.结论:测定胸腔积液中CEA+CYFRA21-1+VEGF浓度对鉴别良、恶性胸腔积液有一定价值,可以作为有用的肿瘤标记物测定组合,具有较高的敏感性、准确性及诊断效能,值得在临床推广应用.
肿瘤标记物;血管内皮生长因子;胸腔积液;诊断价值
0 引言
胸腔积液是全身或局部病变使胸膜毛细血管、淋巴系统的滤过与吸收动态平衡受到破坏而产生的,在临床上较为常见,其病因可以是本身胸膜疾病或者全身性疾病在胸部的一种表现.恶性胸腔积液可能由多种晚期恶性肿瘤引起,如肺癌、恶性间皮瘤等,恶性胸腔积液的出现对患者生活质量有较大的影响[1-2].由于病因不同,治疗方法及预后也有所不同,故对其进行鉴别具有重要的意义.而以往胸腔积液中寻找胸腔冲洗细胞学检查是目前检测游离癌细胞的最佳方法,但其检出率较低,仅有50%左右[3].尽管现在诊断胸腔积液的手段日益先进,如胸腔镜的开展,细胞学跟病原学检测的提高,影像学的发展,但即使完善了各种相关检查,仍有20%左右的胸腔积液未能明确病因[4].
肿瘤标志物是细胞在癌变的发生、发展、浸润及转移过程中所分泌产生的一些活性物质,它们存在于癌组织及宿主的体液中,肿瘤标志物的检测成为近年研究早期发现肿瘤的一个重要手段,但传统的肿瘤标记物如CEA,CA-125等单一检测敏感性及特异性均不高,现多主张联合检测[5].越来越多新发现的肿瘤标记物被用于临床检测,以期对早期发现恶性肿瘤达到更好的敏感性及特异性[6].
血管内皮生长因子(vascular endothelial growth factor,VEGF)是作用于血管内皮细胞的特异性有丝分裂原,通过旁分泌的方式与受体结合,促进内皮细胞的增殖和血管形成,且VEGF能提高微血管通透性,增加胸腔积液的形成[7-8].已经有研究表明,一些肺癌的组织学类型能够表达VEGF[9],说明VEGF在恶性胸腔积液中可能扮演重要作用.本研究通过检测胸腔积液中 CEA、CA-125、NSE、CYFRA21-1及VEGF水平,探讨其在良恶性胸腔积液中的鉴别价值,以期为临床合理诊治提供依据.
1 资料和方法
1.1 一般资料本组均为广西壮族自治区肿瘤医院2014-06/2015-06收治的胸腔积液患者共70例,所有患者最少行一次胸腔穿刺术区胸腔积液标本留存,且在胸腔积液留取前,均未行任何治疗.研究过程符合医学伦理学原则,并取得患者知情同意.
1.2 方法所有患者在治疗前采集胸水标本1份及晨起抽取5 mL空腹血,胸水经离心后取胸水上清液,置于-20℃冰箱保存,测定前置室温自然融化.空腹血离心后取血清备用.CEA、CA-125、NSE、CYFRA21-1及VEGF均用酶联免疫吸附实验(enzyme linked immuno sorbent assay,ELISA)测定,操作步骤严格按说明书进行.
1.3 临界值根据ROC曲线选择CEA、CA-125、CYFRA21-1、NSE及VEGF 5种肿瘤标志物在恶性胸腔积液诊断中的最佳分界值(cut-off值),分别是6.10 ng/mL、42.70 U/mL、14.35 ng/mL、4.45 ng/mL、342.8 pg/mL.
1.4 诊断标准符合以下条件可诊断为恶性胸腔积液:①腔积液中找到恶性细胞;②胸腔镜胸膜活检找到恶性肿瘤证据;③全身有恶性肿瘤证据,经抗肿瘤治疗后胸腔积液减少;④定期随访后疾病进展,并找到恶性肿瘤证据.明确良性原发病诊断或者随访1年后疾病较前无进展可诊断为良性胸腔积液.
1.5 统计学处理采用SPSS17.0统计学软件进行数据分析,所有数据用±s表示.两组之间均数比较采用t检验.另外,利用受试者工作曲线(receiver operating characteristic curve,ROC曲线)和曲线下面积(area under the curve,AUC)来比较5种肿瘤标志物单独检测在肺癌中的诊断价值,确定每种标志物的cut-off值利用Logistics回归及ROC曲线确定联合多个指标检测恶性胸腔积液的AUC、敏感性及特异性,P<0.05表示差异有统计学意义.
2 结果
所有患者经后续检查,肺癌38例(腺癌25例,鳞癌11例,小细胞癌2例),乳腺癌胸膜转移3例,恶性胸膜间皮瘤2例,卵巢癌胸膜转移3例,良性疾病24例.因肺癌胸膜转移样本量大,故选取肺癌恶性胸腔积液与良性胸腔积液进行比较,共有62例患者(男35例,女27例,平均年龄49.05±10.93岁)胸腔积液标本纳入研究,其中38例(男21例,女17例,平均年龄52.38±6.57岁)肺癌恶性胸腔积液及24例(男10例,女14例,平均年龄38.45±8.72岁)良性胸腔积液标本行统计学分析患者.
2.1 ROC曲线分析由ROC曲线分别可以确定CEA、CA-125、CYFRA21-1、NSE及VEGF 5种肿瘤标志物在恶性胸腔积液诊断中的最佳分界值(cut-off值),分别是6.10 ng/mL、42.70 U/mL、14.35 ng/mL、4.45 ng/mL、342.8 pg/mL.ROC曲线下面积分别为0.869,0.832,0.846,0.550,0.834.
2.2 恶、良性胸水及血清中5种标记物水平比较肺癌恶性组胸腔积液中CEA、CA-125、CYFRA21-1及VEGF的浓度明显高于良性组(P<0.05,表1).恶性胸腔积液患者CEA、CA-125、CYFRA21-1的胸水浓度高于血清,差异有统计学意义(P<0.05),恶性胸水和血清中的NSE、VEGF水平比较,差异无统计学意义(P>0.05,表1).
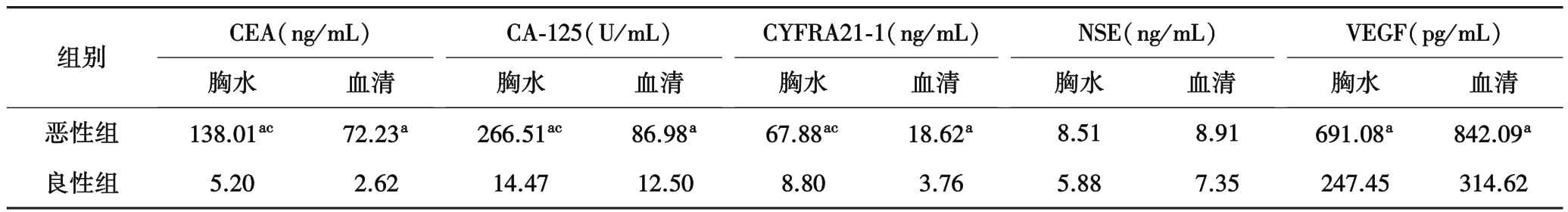
表1 良、恶性胸水及血清中5种标记物水平
2.3 胸腔积液肿瘤标记物单独或联合检测对恶性胸腔积液的诊断效能比较单个肿瘤标记物检测诊断恶性胸腔积液为 CEA及 VEGF敏感性最高,CYFRA21-1特异性最高(表3);CEA+CYFRA21-1+ VEGF诊断效能最高,可达到0.962,敏感性为100%,特异性为84.2%(表4).

表3 5种标记物的ROC曲线下面积,Cut-off值,敏感性和特异性
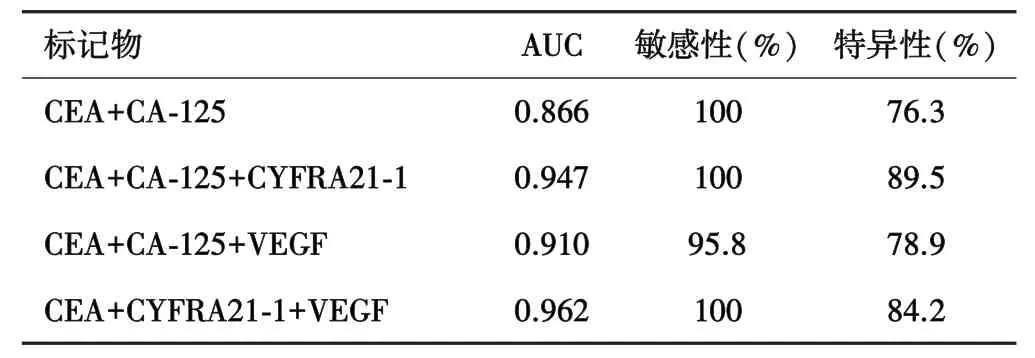
表4 联合检测5种标记物的AUC,敏感性和特异性
3 讨论
数十年来,胸腔积液的诊断有了长足的进步,特别是胸腔镜及细针穿刺技术的出现使得大多数胸腔积液患者得到明确的诊断,从而使患者可以得到相应的治疗[4,10],但尽管如此,仍有20%左右的胸腔积液患者最终无法得到确诊,并且很多患者无法耐受胸腔镜等侵入性检查[11].所以,寻找一些非侵入性的、诊断效能高的方法尽可能地鉴别良恶性胸腔积液可以帮助制定下一步诊断及治疗计划.本研究通过多个肿瘤标记物单独或联合检测来探讨具有更好诊断效能的指标以应用于临床实践.
目前已知VEGF家族有6大成员:VEGF-A、B、C、D、E和胎盘生长因子(placental growth factor,PIGF),VEGF-A是肿瘤血管生成最重要的调控因子[12].VEGF受体主要表达在内皮细胞,是迄今发现作用最强的血管通透性促进剂,能增强胸膜间皮细胞层的通透性,促进胸腔积液的形成.同时VEGF能促进内皮细胞的增殖和血管形成.VEGF这两个特点表明其可能在恶性胸腔积液形成中起重要作用.Ma等[13]在小鼠恶性胸腔积液模型中注射高剂量重组人血管内皮抑制素后小鼠胸腔积液量、VEGF较对照组减少,Psatha等[14]报道VEGF在恶性胸腔积液的敏感性和特异性分别为87.9%和80.0%.本研究中VEGF的敏感性为78.9%,特异性为79.2%,AUC为0.848,具有较好的诊断效能.
CEA是由Gold等[15]在1965年发现的一种大分子糖蛋白,恶性胸腔积液中CEA的含量较高,出现也较早,所以CEA是诊断恶性胸腔积液较好的指标[16].文献报道CEA对恶性胸水诊断的敏感性为27.0%~87.2%,特异性为77.0%~98.6%[17].本研究中单独检测CEA显示胸水含量明显高于良性组,对恶性胸腔积液诊断的敏感性及特异性分别为78.9%和83.3%,AUC为0.840,具有较好的诊断效能.CYFRA21-1主要存在于肺癌或食管癌等上皮起源的肿瘤细胞的细胞质中,在肺鳞癌中表达较高,但是肺癌的所有组织类型都可以表达[18].Kulpa等[19]报道血清CYFRA21-1在鳞癌中的诊断敏感性及特异性可达到80.5%和95.0%.本研究发现,恶性积液组CYFRA21-1水平明显高于良性积液组及血清水平,差异有统计学意义.CYFRA21-1对恶性胸腔积液的敏感性和特异性分别为71.1%和87.5%,AUC为0.846,且对肺癌恶性积液的敏感性及特异性较文献报道的低[19],可能跟本研究中肺腺癌比例较高有关.
CA-125为大分子糖蛋白,是另一种临床常用的肿瘤标记物,对肺癌也有较高的阳性率,Antonangelo等[3]研究表明 CA-125对恶性胸水诊断敏感性为68.14%,特异性为 83.33%,本研究恶性胸水中CA-125的含量高于血清中CA-125的含量,且明显高于良性组CA-125的含量,对恶性胸腔积液的敏感性为71.1%,特异性为58.%,AUC为0.789,诊断效能一般.NSE是神经元和神经内分泌细胞所特有的一种酸性蛋白酶,主要分布于神经元和神经内分泌细胞,是神经内分泌肿瘤的特异性标志.Korczynski等[20]报道恶性胸腔积液患者中NSE敏感性为94%,特异性为36%,本研究2例小细胞癌中胸水中NSE均明显升高,但总体在良恶性胸腔积液中和血清中比较,差异无统计学意义,可能和本组恶性胸腔积液中小细胞肺癌病例较少有关.
本研究发现,单一肿瘤标记物在临床应用中的敏感性和特异性均不高,所以使用多种指标联合检测,结果显示多种肿瘤标记物联合检测的敏感性及特异性均较前明显提高,其中CEA+VEGF+CYFRA21-1组合的诊断敏感性为100%,特异性为84.2%,AUC面积为0.962,具有最高的诊断效能.表明联合检测肿瘤标记物有助于良恶性胸腔积液的鉴别,有较好的临床应用价值.
鉴于CEA、CYFRA21-1、VEGF等肿瘤标记物为恶性胸腔诊断较好的临床指标,可行进一步试验发掘其更多临床价值:①加大样本数量,了解其在不同类型肿瘤中表达如何,为进一步寻找原发灶提供依据;②加长随访时间,了解初诊时标记物的水平和预后有无相关性;③全身化疗或胸腔灌注前后比较有无变化来评价疗效.
综上所述,检测胸腔积液中CEA、CYFRA21-1、VEGF、NSE等肿瘤标记物的表达操作简单、价格低廉、创伤小、患者容易接受,且具有较好的诊断效能,值得临床推广.
[1]Lumachi F,Mazza F,Ermani M,et al.Talc pleurodesis as surgical palliation of patients with malignant pleural effusion.Analysis of factors affecting survival[J].Anticancer Res,2012,32(11):5071-5014.
[2]Basso SM,Mazza F,Marzano B,et al.Improved quality of life in patients with malignant pleural effusion following videoassisted thoracoscopic talc pleurodesis.Preliminary results[J].Anticancer Res,2012,32(11):5131-5134.
[3]Antonangelo L,Sales RK,Cora AP,et al.Pleural fluid tumour markers in malignant pleural effusion with inconclusive cytologic results[J].Curr Oncol,2015,22(5):e336-e341.
[4]McGrath EE,Anderson PB.Diagnosis of pleural effusion:a systematic approach[J].Am J Crit Care,2011,20(2):119-127.
[5]AlataF,AlataO,MetintaM,et al.Diagnostic value of CEA,CA 15-3,CA 19-9,CYFRA 21-1,NSE and TSA assay in pleural effusions[J].Lung Cancer,2001,31(1):9-16.
[6] Lombardi G,Zustovich F,Nicoletto MO,et al.Diagnosis and treatment of malignant pleural effusion:a systematic literature review and new approaches[J].Am J Clin Oncol,2010,33(4):420-423.
[7]Dvorak HF.Vascular permeability factor/vascular endothelial growth factor:a critical cytokine in tumor angiogenesis and a potential target for diagnosis and therapy[J].J Clin Oncol,2002,20(21):4368-4380.
[8]Grove CS,Lee YC.Vascular endothelial growth factor:the key mediator in pleural effusion formation[J].Curr Opin Pulm Med,2002,8(4):294-301.
[9] Ishimoto O,Saijo Y,Narumi K,et al.High level of vascular endothelial growth factor in hemorrhagic pleural effusion of cancer[J].Oncology,2002,63(1):70-75.
[10]Metintas M,Yildirim H,Kaya T,et al.CT scan-guided abrams’needle pleural biopsy versus ultrasound-assisted cutting needle pleural biopsy for diagnosis in patients with pleural effusion:a randomized,controlled trial[J].Respiration,2016,91(2):156-163.
[11]Lee P,Colt HG.Pleuroscopy in 2013[J].Clin Chest Med,2013,34(1):81-91.
[12]刘洪建,王玉波,解 桢,等.VEGF水平与恶性胸腔积液的相关性研究[J].中国生化药物杂志,2015,35(3):141-143.
[13]Ma X,Yao Y,Yuan D,et al.Recombinant human endostatin endostar suppresses angiogenesis and lymphangiogenesis of malignant pleural effusion in mice[J].Plos One,2012,7(12):483-496.
[14]Psatha A,Makris D,Kerenidi T,et al.A potential role for VEGF in the diagnostic approach of pleural effusions[J].J Thorac Dis,2016,8(7):1681-1687.
[15]Gold P,Freedman SO.Specific carcinoembryonic antigens of the human digestive system[J].J Exp Med,1965,122(3):467-481.
[16]Lee JH,Chang JH.Diagnostic utility of serum and pleural fluid carcinoembryonic antigen,neuron-specific enolase,and cytokeratin 19 fragments in patients with effusions from primary lung cancer[J].Chest,2005,128(4):2298-2303.
[17]Tozzoli R,Basso SM,D’Aurizio F,et al.Evaluation of predictive value of pleural CEA in patients with pleural effusions and histological findings:A prospective study and literature review[J].Clin Biochem,2016,49(16-17):1227-1231.
[18]Azimi Q,Rezadoost B,Jalali Nadoushan M,et al.Evaluation of serum cyfra21 in patients with pleural effusion[J].Iran Red Crescent Med J,2012,14(10):613-616.
[19]Kulpa J,Wójcik E,Reinfuss M,et al.Carcinoembryonic antigen,squamous cell carcinoma antigen,CYFRA 21-1,and neuron-specific enolase in squamous cell lung cancer patients[J].Clin Chem,2002,48(11):1931-1937.
[20]Korczynski P,Krenke R,Safianowska A,et al.Diagnostic utility of pleural fluid and serum markers in differentiation between malignant and non-malignant pleural effusions[J].Eur J Med Res,2009,14 Suppl 4:128-133.
Clinical value of tumor markers detection in pleural effusion
CHEN Xiao-Ju1,XIE Ming-Zhi2,PEI Si-Ya1,LAI Le-Jin11General Medicine,2Chemotherapy Medicine,Cancer Hospital Affiliated to Guangxi Medical University,Nanning 530021,China
AIM:To evaluate the individual and combined diagnostic value of carcinoembryonic antigen(CEA),cancer antigen 125(CA-125),neuron specific enolase(NSE)and cytokeratin 19 fragment(CYFRA21-1)combine with vascular endothelial growth factor(VEGF)in the blood and pleural fluid of patients with benign and malignant pleural effusion.METHODS:A total of 70 patients with pleural effusion diagnosed by CT in Affiliated Tumor Hospital of Guangxi Medical University from January to June 2016 were enrolled in this study.Before the treatment,the samples were collected from pleural effusion,and the levels of CEA,CA-125,NSE,CYFRA21-1 and VEGF were measured by enzyme linked immunosorbent assay(ELISA).Finally,62 samples were selected for analysis.The cut-off values(critical value) of malignant pleural effusion were calculated by ROC curve.The sensitivity,specificity and accuracy of the indexes were calculated separately and in combination for the diagnosis of malignant pleural effusion.RESULTS:A total of 70 patients were diagnosed with biopsy(pleural effusion cytology,fiberoptic bronchoscopy and percutaneous biopsy and follow-up),Among them,38 cases of primary lung cancer pleural metastasis(25 cases of adenocarcinoma,11 cases of squamous cell carcinoma,2 cases of small cell carcinoma),24 cases of benign pleural effusion.Finally,62 cases of pleural effusion specimens were included in the study.The CEA,CA-125,CYFRA21-1,VEGF of the malignant pleural effusion were significantly higher than those of benign group,with statistically significant differences(P<0.05).The sensitivity of CEA,CA-125,CYFRA21-1,NSE and VEGF was 78.9%,71.1%,71.1%,52.6%,78.9%,and the specificity was 83.3%,58.0%,87.5%,66.6%,79.2%respectively.The combined diagnosis of CEA,CA-125,CYFRA21-1,NSE and VEGF showed that CEA+CYFRA21-1+VEGF had an highest diagnositic efficiency.The sensitivity was 100%,and specificity was 84.2%.Area under the curve was 0.962,and it had a good effect of diagnosis.CONCLUSION:The results suggest that the assay of CEA+CYFRA21-1+VEGF might be useful in the differentiation between benign and malignant pleural effusion,which can be used as a useful tumor marker combination,with high sensitivity,accuracy and diagnostic efficacy,and it is worthy of clinical application.
tumor marker;vascular endothelial growth factor;
R734.2
A
2095-6894(2017)05-40-04
2016-12-16;接受日期:2016-12-31
2016年度广西壮族自治区中青年教师基础能力提升项目(KY2016YB075);广西医科大学教育教学改革2015年一般B类项目(2015XJGB20)
陈晓菊.博士.E-mail:chenxiaoju984@163.com
谢明智.硕士,住院医师.E-mail:78108760@qq.com
pleural effusion;diagnostic value
