细胞自噬与肿瘤治疗研究进展
2017-06-12王程远第四军医大学唐都医院泌尿外科陕西西安710038
王程远,焦 勇,张 波 (第四军医大学唐都医院泌尿外科,陕西西安710038)
细胞自噬与肿瘤治疗研究进展
王程远,焦 勇,张 波 (第四军医大学唐都医院泌尿外科,陕西西安710038)
自噬是应激状态下细胞内的一种物质分解、回收循环系统,以维持细胞的基本稳态.自噬广泛参与多种生理和病理过程.自噬与肿瘤关系复杂,对肿瘤治疗具有双重作用.本文对细胞自噬及其与肿瘤治疗关系研究进展进行综述.
自噬;作用机制;肿瘤;治疗;综述文献
0 引言
细胞死亡是细胞生命活动不可逆的终止,关于细胞死亡的研究贯穿于生命科学的各个领域.细胞死亡形式主要有三种类型:细胞坏死(necrosis)、细胞凋亡(apoptosis)、细胞自噬 (autophagy)[1].细胞自噬现象发现于20世纪90年代,是一种分解代谢过程,通过消化自身内部物质的方式,对细胞代谢中物质、能量进行质量控制、改造和监督,以维持细胞稳态、保持多细胞生物生存[2-3].自噬水平异常与人类多种疾病关系密切,自噬和肿瘤关系复杂,对肿瘤治疗具有双重作用.自噬水平异常影响肿瘤发生、发展,并在肿瘤治疗及治疗抵抗中起重要作用[4-6].
1 自噬的发生过程
自噬是细胞应激状态下的一种分解代谢过程,通过消化自身内部物质的方式,维持自身内环境稳定,清除异常蛋白质结构和细胞器,实现物质循环利用,获取营养,保持细胞活力,以自噬体的形成为特点[7].细胞自噬在真核细胞生物中普遍存在,但在人类成体机体水平,多出现在病理状态下,如营养不足、氧化应激、缺氧、生长因子缺乏、感染、高温、电离辐射、DNA损伤等,细胞会启动自噬程序[8].依据底物进入溶酶体的途径不同,可分为三种类型:微自噬(microautophagy)、分子伴侣介导的自噬(chaperone-mediated autophagy,CMA)、巨自噬(macroautophagy)[4].微自噬指溶酶体直接内陷,包裹受损伤的细胞器并降解,没有自噬泡的形成过程.巨自噬是细胞内老化或受损的细胞器或蛋白质由起源于内质网和高尔基体的双层膜性小泡包裹,然后送入溶酶体降解消化的过程.分子伴侣介导的自噬指胞浆内靶蛋白质分子先结合到分子伴侣上,通过分子伴侣的中间作用转运到溶酶体中降解.胞浆中大分子物质通过巨自噬过程被双膜结构的自噬体包裹,与溶酶体融合后分解,分解产生的小分子物质(如氨基酸、核苷酸、游离脂肪酸等)进入有氧循环合成蛋白质或产生能量.
自噬过程分为以下几个阶段:自噬的启动、降解物的选择、自噬体的形成、自噬体的降解,其中自噬体的形成是最主要的环节.由短暂饥饿诱发的经典巨自噬生物过程包括以下几个序贯的基本生物学步骤:诱导、成核、扩张、完成、融合、降解、再循环.自噬是高度保守的、受到复杂调控的过程.巨自噬整个过程迅速,常常在数分钟内完成,对底物批量降解,没有底物选择性,是类似于泛素化-蛋白酶体的降解过程[9](图1).短暂的饥饿诱发巨自噬,如果饥饿或营养不良持续存在,CMA将取代巨自噬.三种形式的细胞自噬在不同应激强度、不同应激持续时间、底物选择方面各有特点,以适应自身环境变化,达到能量消耗、营养摄取、物质循环利用的最佳平衡.依据上游调控信号途径不同,主要有依赖mTOR(mammalian target of rapamycin,mTOR)的信号途径和非依赖mTOR的信号途径[10].mTOR是丝/苏氨酸蛋白激酶,也是激素、ATP的感受器,能够感受营养和能量的变化,对细胞生长起调节作用.
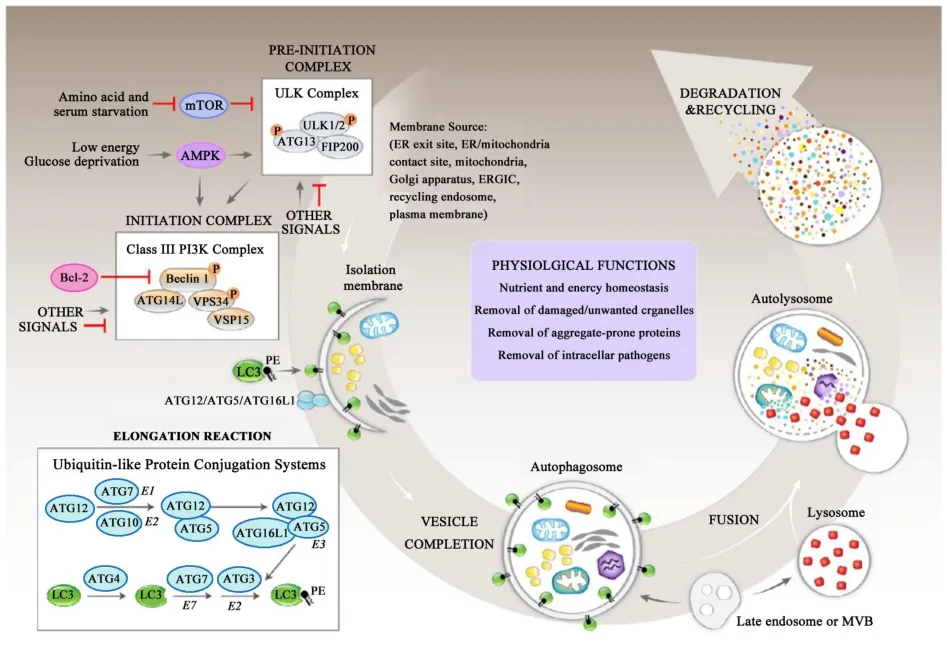
图1 自噬主要途径的概况(引自参考文献[9])
2 自噬的生物学功能
自噬在细胞生命活动中发挥着重要作用.在真核细胞生物中普遍存在,在机体营养充足时,自噬通常维持在较低水平.当细胞受到某些不利刺激时,自噬水平迅速上调.正常情况下,自噬参与细胞发育、分化,促进胚胎正常发育,清除错误折叠蛋白质及多余蛋白质、细胞器,维持内环境稳定[11-13],维持干细胞处于静止状态,抵抗衰老[14].在应激状态下,可以调整细胞新陈代谢和耗氧量,清除受损蛋白质及细胞器,保护细胞基因免受损伤,其产物(如氨基酸、核苷酸、游离脂肪酸等)可作为细胞及时更新的原料,达到物质及能量的优化处理,以应对不利刺激,为细胞存活创造条件[2,13].自噬参与先天性免疫及获得性免疫机制形成,抵御感染因子,调节免疫及炎症[6,15].可见,自噬是细胞和组织再造的一个动态循环系统,对细胞代谢中物质、能量进行质量控制和改造[15-17].自噬水平异常与人类一系列疾病关系密切,如恶性肿瘤、帕金森病等神经退行性病变、克罗恩病等炎症性疾病,以及白内障、肾小球硬化症,与恶性肿瘤的关系尤其密切[10,18-20].
3 自噬的调控
细胞自噬的调控过程十分复杂,涉及许多调节因子参与,现已发现有20余种自噬相关蛋白及多种调控基因.细胞自噬的调控机制目前尚未完全明确.Mizushima等[8]通过实验证实,在众多调节因子中,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一个关键的抑制性调节因子.正常生长条件下,细胞的mTOR为活化状态,细胞内的自噬被抑制.PI3K-Akt-mTOR,LKB1-AMPK-mTOR和p53等信号通路是细胞自噬发生的主要上游调控分子.此外,免疫系统也参与自噬的调节.参与调节自噬的免疫细胞因子主要由CD4阳性T细胞分泌,分为Th1细胞型和Th2细胞型.其中Th1型细胞因子INF-γ能够促进自噬,而Th2型细胞因子IL4和IL5却可以抑制自噬[21].自噬体形成后与溶酶体的融合还受胞质内pH值的影响,胞质内的酸性环境能促进它们的融合,而pH值的升高则抑制这个过程.
参与细胞自噬的调控信号通路现已明确的主要有以下几条:①RAS和PI3K-Akt-mTOR通路,该通路整合细胞营养、生长因子、能量状态,调控细胞生长与增殖,作为最主要的调控因子参与细胞自噬调控.mTOR是多条信号通路的重要交汇点,mTOR主要以两种不同复合物形式存在,即mTORC1和mTORC2.RAS是一种小G蛋白,可激活下游效应物Raf,使EMK1/2丝氨酸残基磷酸化,进而激活 MAPK.②LKB1-AMPK-mTOR通路,腺苷酸活化蛋白激(AMP-activated protein kinase,AMPK)是能量变化的感受器,在饥饿或营养缺乏时,可激活 AMPK[18].③p53通路,p53是一种重要的抑癌基因,对细胞自噬的调控作用是双重的,具体发挥何种作用取决于p53在细胞的位置,核内的p53作为转录因子促进自噬发生,而胞浆内的p53作为抑制因子抑制自噬发生[18].④其他调控因子:Beclin 1被认为是一种重要的自噬调控蛋白,在肝癌、胃癌中表达下调,能与多蛋白复合体(如PI3KC3、hVps34、Atg14L和p150等)结合,形成自噬非常重要的囊泡成核复合体,促进自噬发生[6].FoxO家族基因作为转录因子,不仅能诱导自噬,还可与其他自噬通路相互作用,调节自噬的发生.PTEN是一种抑癌基因,在多种肿瘤细胞发现PTEN突变,通过PI3K/PKB通路来促进自噬(图2).

图2 哺乳细胞自噬过程中的信号调控通路主要(引自参考文献[22])
4 自噬与肿瘤
自噬作为细胞和组织再造的一个动态循环系统,是维持细胞稳态、保持多细胞生物生存力的一种重要保护机制,自噬水平异常打破了这种动态平衡,自噬异常可能与人类多种疾病有关,恶性肿瘤生物学行为改变过程伴随自噬水平的调节[19].肿瘤与自噬关系复杂,并相互影响,自噬对肿瘤具有双重作用,自噬活动的水平高低在肿瘤发生、恶化、转移的不同阶段对肿瘤有不同的作用,对单个肿瘤细胞和整个肿瘤组织作用表现出差异性,肿瘤相关基因及其产物对自噬过程具有调节作用.
4.1 自噬抑制肿瘤在肿瘤发生的早期阶段,自噬监视并阻止细胞恶变.自噬阻止蛋白质受损,清除受损细胞器及蛋白质,可以防止毒性蛋白质、细胞器积累,减少基因突变机率;线粒体自噬可限制氧化应激,减少活性氧产生,抑制癌变启动[23-24].自噬功能缺陷可导致染色体损伤,毒性产物聚积,诱发癌变[4,24].同时,自噬功能障碍可诱发机体产生相应代偿机制,以适应复杂微环境的改变,在此过程中基因突变增加,基因突变可诱导癌变[25].自噬与凋亡并非两种独立的细胞死亡过程,其调控基因和传导通路存在交叉点[26],而凋亡是肿瘤细胞死亡的重要机制之一[27].Beclin 1不但调节自噬,还能与Bcl-2相互作用,在自噬和凋亡之间形成Beclin 1-Bcl-2分子连接,Beclin 1表达水平升高可以促进Bcl-2与促凋亡蛋白BAK/BAX结合状态的解离.因此,从这个方面看,自噬促进肿瘤细胞凋亡,抑制肿瘤[23,28](图3).
在人类疾病动物模型中,敲除自噬相关基因(autophagy-related genes,ATG)可诱发恶性肿瘤发生,ATG突变基因被确定存在于各种人类疾病如神经退行性疾病、传染病和癌症中[29].自噬相关基因突变常导致自噬调节障碍,并且与肿瘤发生、发展关系密切[30].

图3 细胞损伤参与的细胞死亡途径(引自参考文献[9])
4.2 自噬促进肿瘤在肿瘤组织,自噬通过降解异常肿瘤细胞为正常肿瘤细胞回收营养,在小鼠化疗所致自噬中,可引起释放三磷酸腺苷(ATP),修复受损细胞器,提供能量,并限制免疫系统攻击肿瘤细胞[31].在肿瘤快速增长阶段,由于缺乏足够的营养和氧气,自噬所产生的物质能量代谢产物可为肿瘤细胞提供一定程度的物质和能量供应,增强肿瘤细胞对营养不足、缺氧的耐受性[32].自噬导致细胞死亡,可引起局部范围炎症反应,炎症反应促进新生血管扩张进入肿瘤组织,改善血氧供应,增强肿瘤组织生存力[33].在肿瘤快速生长中诱发的持续自噬状态可能增强肿瘤转移能力:正常细胞如果脱离细胞基质或邻近细胞会诱发失巢凋亡,肿瘤细胞转移需要有抗失巢凋亡能力,长期的营养缺乏、缺氧、持续自噬状态可刺激肿瘤产生抗失巢凋亡能力,在转移过程中脱离基质而免受失巢凋亡[34].对胰腺癌,Alderton[35]研究发现高水平的自噬与胰腺癌不良预后呈正相关,提示自噬可增强肿瘤的某些恶性行为.自噬促进肿瘤生长可通过抑制p53的反应,维持线粒体功能和复杂环境下细胞代谢平衡,提高生存能力[36].当肿瘤细胞处于复杂微环境不利生存时,自噬可诱导肿瘤细胞进入可逆性休眠状态,当环境条件成熟时,肿瘤再次增殖、转移,休眠是恶性肿瘤复发和远处转移的重要原因[37].Lu等[38]研究发现在卵巢癌中存在自噬与肿瘤休眠的证据,抑癌基因ARHI诱导自噬,促进肿瘤在复杂微环境中生存.
4.3 自噬对肿瘤的双重作用不管在正常细胞还是肿瘤细胞,自噬作为一种监督机制,预防应激,维持细胞生存:自噬保护正常细胞防止其发生恶变、损伤;对肿瘤细胞,在肿瘤不同发展阶段、不同类型肿瘤、不同应激强度、不同自噬水平等条件下,可能产生截然相反的作用,并对肿瘤放化疗产生抵抗,造成治疗逃逸.因此,探讨特定环境下自噬的具体作用及分子机制,对指导以自噬为基础的治疗尤为重要[3].在肿瘤早期阶段,自噬抑制肿瘤细胞发生恶变、增殖,在肿瘤快速生长阶段,自噬为肿瘤细胞提供物质、能量支持,增强肿瘤组织对营养缺乏、缺氧的耐受性,诱导肿瘤休眠,增强肿瘤细胞转移的抗失巢凋亡能力.Burada等[5]研究发现,自噬在直肠癌发病机制中发挥双重作用,Chen等[39]在一项关于乳腺癌的研究中,发现自噬水平与应激环境关系密切.自噬诱导单个肿瘤细胞死亡,但其引发的炎症反应促进新生血管扩张进入肿瘤组织,改善血氧供应,增强肿瘤组织整体生存力[40].另外,肿瘤相关基因可能在基因及其表达产物水平对自噬进行调控,目前发现,p53、Bcl-2蛋白家族对自噬具有双向调节作用.
4.4 自噬与肿瘤治疗肿瘤治疗方法日新月异,趋于多样化,但以手术、放疗、化疗为基础的综合治疗仍然是当前治疗的基石.在肿瘤放化疗过程中,凋亡和自噬同时存在,且相互作用,肿瘤抵抗治疗,并恶化、发展,与肿瘤细胞自我销毁失败有关[41].肿瘤对放疗及化疗药物的抵抗备受关注,自噬水平在治疗期间明显增高,自噬是产生治疗抵抗的重要机制,对自噬的合理调控可使治疗获益[42].放射线及化疗药物可使肿瘤细胞DNA受损,诱发细胞凋亡,同时也诱发自噬[43].射线产生线粒体功能破坏和DNA损伤,使线粒体释放大量活性氧(reactive oxygen species,ROS)到胞内,引起氧化应激,进一步损伤细胞,产生间接治疗效应.凋亡所导致的肿瘤细胞大量死亡及细胞氧化应激均对治疗有益,但自噬主要对射线导致的DNA损伤进行修复,抑制细胞进一步凋亡,同时清理受损线粒体,发生线粒体自噬,弱化氧化应激反应,提高了肿瘤细胞对射线的耐受性,产生射线抵抗,不利于治疗[44].放化疗可引起肿瘤细胞内蛋白质合成障碍,造成内质网腔内聚集大量错误折叠的蛋白质,称其为内质网应激[45].如果这种应激状态持续存在,细胞生存难以维继,自噬机制促进错误折叠的蛋白质及时清理,形成新的物质循环,缓解内质网应激状态,对放化疗形成治疗抵抗[4].
肿瘤耐药是一个多基因、多因素、多水平共同参与的复杂问题,涉及药代动力学抗性、肿瘤自身抗性、肿瘤微环境因素[46].理想的化疗效果是达到肿瘤细胞的不可逆死亡,自噬抑制肿瘤细胞凋亡,增强耐药.Mani等[47]在一项膀胱癌化疗耐药的研究中发现,凋亡减少,自噬增加导致肿瘤耐药.同样,关于移行细胞癌反复耐药及复发的研究提示细胞自噬和糖酵解在耐药中发挥核心作用,自噬的高水平作用有利于肿瘤抵抗化疗[48].对于血供较差的实体肿瘤,快速增长导致肿瘤缺血缺氧加重,引发代谢应激,自噬可增强肿瘤细胞对营养不足、缺氧的耐受性,抑制自噬能使肿瘤细胞对应激反应敏感性增加,最终诱导细胞凋亡[49],Sakitani等[50]发现,通过激活p53途径抑制自噬可阻止直肠癌增殖.针对自噬抑制机制开发的自噬抑制剂如洛霉素A1、氯喹、3-甲基腺嘌呤等已被证实与放、化疗具有协同效应,可促进肿瘤细胞凋亡,进一步研究发现这种协同效应在多种肿瘤放化疗中是有效的,如恶性胶质瘤、多发性骨髓瘤、乳腺癌、结直肠癌及前列腺癌等[51].然而,也有研究发现,大约50%的肿瘤本身缺乏凋亡机制,化疗药物诱导的过度自噬可能是肿瘤细胞死亡的主要机制,诱导过度或持续的自噬可能成为肿瘤治疗的新靶点[52].利用全反式维甲酸和三氧化二砷(As2O3)治疗急性早幼粒细胞白血病时,自噬是引起癌基因下降的主要机制[53].mTOR是自噬通路的一个关键的抑制性调节因子,mTOR抑制剂可诱导自噬.Kondo等[54]在恶性神经胶质瘤、乳腺癌中使用mTOR抑制剂雷帕霉素,发现可诱导自噬,抑制肿瘤细胞生长,导致细胞死亡,具有治疗作用.
5 讨论
自噬是细胞和组织再造的一个动态循环系统,对细胞代谢中物质、能量进行质量控制、改造和监督,以维持细胞稳态、保持多细胞生物生存.自噬异常可能与人类多种疾病有关,自噬和肿瘤关系复杂,对肿瘤具有双重作用,对于不同类型肿瘤、肿瘤不同发展阶段、不同应激环境、不同自噬水平、不同治疗因素等条件下的反应各异.自噬受到复杂调控,其具体调控机制尚未完全阐明.自噬在肿瘤治疗中的应用颇受争议,一方面自噬抑制肿瘤细胞恶变、增殖,过度自噬促进肿瘤细胞死亡,对化疗药物起协同效应,有利于治疗;另一方面自噬改善肿瘤细胞物质能量代谢,促进肿瘤生长、增殖,诱导肿瘤休眠,增强肿瘤侵犯、转移能力,并对放化疗产生抵抗、耐药,不利于肿瘤治疗.从目前研究现状看,以自噬为基础的肿瘤治疗,已成为抗肿瘤治疗的全新思路,但以下问题值得进一步探讨:①需结合特定肿瘤,深入研究自噬与肿瘤的调控机制,正确认识肿瘤发展中自噬的双重作用;②自噬与凋亡的关系;③自噬与肿瘤干细胞的关系;④如何准确监测肿瘤即时的自噬水平;⑤从治疗角度出发,如何科学选择治疗时机,是抑制自噬还是诱导自噬?⑥研发有效药物,寻找现有治疗方法与自噬治疗联合的切入点,避免自噬对现有治疗方法的不利影响因素,使治疗效应最大化.
[1]Fuchs Y,Steller H.Live to die another way:modes of programmed cell death and the signals emanating from dying cells[J].Nat Rev Mol Cell Biol,2015,16(6):329-344.
[2]Mizushima N.Autophagy in protein and organelle turnover[J].Cold Spring Harb Symp Quant Biol,2011,76:397-402.
[3]White E.Deconvoluting the context-dependent role for autophagy in cancer[J].Nat Rev Cancer,2012,12(6):401-410.
[4]Mizushima N,Levine B,Cuervo AM,et al.Autophagy fights disease through cellular self-digestion[J].Nature,2008,451(7182):1069-1075.
[5]Burada F,Nicoli ER,Ciurea ME,et al.Autophagy in colorectal cancer:An important switch from physiology to pathology[J].World J Gastrointest Oncol,2015,7(11):271-284.
[6]Ryter SW,Cloonan SM,Choi A M.Autophagy:a critical regulator of cellular metabolism and homeostasis[J].Mol Cells,2013,36(1):7-16.
[7]Hurley JH,Schulman BA.Atomistic autophagy:the structures of cellular self-digestion[J].Cell,2014,157(2):300-311.
[8]Mizushima N,Klionsky DJ.Protein turnover via autophagy:implications for metabolism[J].Annu Rev Nutr,2007,27:19-40.
[9]Green DR,Levine B.To be or not to be?How selective autophagy and cell death govern cell fate[J].Cell,2014,157(1):65-75.
[10]Eskelinen EL,Saftig P.Autophagy:a lysosomal degradation pathway with a central role in health and disease[J].Biochim Biophys Acta,2009,1793(4):664-673.
[11] Lin TC,Chen YR,Kensicki E,et al.Autophagy:resetting glutamine-dependent metabolism and oxygen consumption[J].Autophagy,2012,8(10):1477-1493.
[12]Mizushima N,Tsukamoto S,Kuma A.Autophagy in embryogenesis and cell differentiation[J].Tanpakushitsu Kakusan Koso,2008,53(16 Suppl):2170-2174.
[13]Mizushima N,Levine B.Autophagy in mammalian development and differentiation[J].Nat Cell Biol,2010,12(9):823-830.
[14]García-Prat L,Martínez-Vicente M,Perdiguero E,et al.Autophagy maintains stemness by preventing senescence[J].Nature,2016,529(7584):37-42.
[15]Levine B,Mizushima N,Virgin HW.Autophagy in immunity and inflammation[J].Nature,2011,469(7330):323-335.
[16]Mizushima N,Komatsu M.Autophagy:renovation of cells and tissues[J].Cell,2011,147(4):728-741.
[17]Madrigal-Matute J,Cuervo AM.Regulation of Liver Metabolism by Autophagy[J].Gastroenterology,2016,150(2):328-339.
[18]Watanabe T,Kuma A,Mizushima N.Physiological role of autophagy in metabolism and its regulation mechanism[J].Nihon Rinsho,2011,69(Suppl 1):775-781.
[19]Yang Z,Klionsky DJ.Eaten alive:a history of macroautophagy[J].Nat Cell Biol,2010,12(9):814-822.
[20]Stappenbeck TS,Rioux JD,Mizoguchi A,et al.Crohn disease:a current perspective on genetics,autophagy and immunity[J].Autophagy,2011,7(4):355-374.
[21]石 峰,王明荣.细胞自噬及其与肿瘤关系的研究进展[J].中国细胞生物学学报,2011,33(12):1366-1373.
[22]高 原,王 莹,黄智慧.自噬在癌症的预防、发展和治疗中的作用[J].中国细胞生物学学报,2015,37(11):1581-1592.
[23]Su M,Mei Y,Sinha S.Role of the Crosstalk between Autophagy and Apoptosis in Cancer[J].J Oncol,2013,2013:102735.
[24]White E,Mehnert JM,Chan CS.Autophagy,Metabolism,and Cancer[J].Clin Cancer Res,2015,21(22):5037-5046.
[25]Finkel T,Serrano M,Blasco MA.The common biology of cancer and ageing[J].Nature,2007,448(7155):767-774.
[26]Jakhar R,Paul S,Bhardwaj M,et al.Astemizole-Histamine induces Beclin-1-independent autophagy by targeting p53-dependent crosstalk between autophagy and apoptosis[J].Cancer Lett,2016,372(1):89-100.
[27]Pennarun B,Meijer A,de Vries EG,et al.Playing the DISC:turning on TRAIL death receptor-mediated apoptosis in cancer[J].Biochim Biophys Acta,2010,1805(2):123-140.
[28]Pattingre S,Tassa A,Qu X,et al.Bcl-2 antiapoptotic proteins inhibit Beclin 1-dependent autophagy[J].Cell,2005,122(6):927-939.
[29]Jiang P,Mizushima N.Autophagy and human diseases[J].Cell Res,2014,24(1):69-79.
[30]汤智平,关 中.自噬调节与肿瘤治疗相关的研究进展[J].中华肿瘤防治杂志,2013,20(6):477-480.
[31]Amaravadi RK.Cancer.Autophagy in tumor immunity[J].Science,2011,334(6062):1501-1502.
[32]Chen N,Karantza-Wadsworth V.Role and regulation of autophagy in cancer[J].Biochim Biophys Acta,2009,1793(9):1516-1523.
[33]Degenhardt K,Mathew R,Beaudoin B,et al.Autophagy promotes tumor cell survival and restricts necrosis,inflammation,and tumorigenesis[J].Cancer Cell,2006,10(1):51-64.
[34]Lock R,Debnath J.Extracellular matrix regulation of autophagy[J].Curr Opin Cell Biol,2008,20(5):583-588.
[35]Alderton GK.Autophagy:Surviving stress in pancreatic cancer[J].Nat Rev Cancer,2015,15(9):513.
[36]Guo JY,Xia B,White E.Autophagy-mediated tumor promotion[J].Cell,2013,155(6):1216-1219.
[37]White E,Dipaola RS.The double-edged sword of autophagy modulation in cancer[J].Clin Cancer Res,2009,15(17):5308-5316.
[38]Lu Z,Luo RZ,Lu Y,et al.The tumor suppressor gene ARHI regulates autophagy and tumor dormancy in human ovarian cancer cells[J].J Clin Invest,2008,118(12):3917-3929.
[39]Chen YR,Tsou B,Hu S,et al.Autophagy induction causes a synthetic lethal sensitization to ribonucleotide reductase inhibition in breast cancer cells[J].Oncotarget,2016,7(2):1984-1999.
[40]Shin GC,Kang HS,Lee AR,et al.Hepatitis B virus-triggered autophagy targets TNFRSF10B/death receptor 5 for degradation to limit TNFSF10/TRAIL response[J].Autophagy,2016,14:1-16.
[41]Vijayarathna S,Gothai S,Jothy SL,et al.Can cancer therapy be achieved by bridging apoptosis and autophagy:a method based on microRNA-dependent gene therapy and phytochemical targets[J].Asian Pac J Cancer Prev,2015,16(17):7435-7439.
[42]Lao Y,Xu N.Autophagy in Cancer Chemoprevention:Identification of Novel Autophagy Modulators with Anticancer Potential[J].Methods Mol Biol,2016,1379:151-163.
[43]Polager S,Ofir M,Ginsberg D.E2F1 regulates autophagy and the transcription of autophagy genes[J].Oncogene,2008,27(35):4860-4864.
[44]Mathew R,Karantza-Wadsworth V,White E.Role of autophagy in cancer[J].Nat Rev Cancer,2007,7(12):961-967.
[45]Yu H,Su J,Xu Y,et al.p62/SQSTM1 involved in cisplatin resistance in human ovarian cancer cells by clearing ubiquitinated proteins[J].Eur J Cancer,2011 47(10):1585-1594.
[46]姜 燕,张 洁,张金阳.自噬与肿瘤耐药的研究进展[J].生命科学研究,2015,19(1):62-67.
[47]Mani J,Vallo S,Rakel S,et al.Chemoresistance is associated with increased cytoprotective autophagy and diminished apoptosis in bladder cancer cells treated with the BH3 mimetic(-)-Gossypol(AT-101)[J].BMC Cancer,2015,15:224.
[48]Ojha R,Jha V,Singh SK.Gemcitabine and mitomycin induced autophagy regulates cancer stem cells pool in urothelial carcinoma cells[J].Biochim Biophys Acta,2015,1863(2):347-359.
[49]Zhang R,Zhu F,Ren J,et al.Beclin1/PI3K-mediated autophagy prevents hypoxia-induced apoptosis in EAhy926 cell line[J].Cancer Biother Radiopharm,2011,26(3):335-343.
[50]Sakitani K,Hirata Y,Hikiba Y,et al.Inhibition of autophagy exerts anti-colon cancer effects via apoptosis induced by p53 activation and ER stress[J].BMC Cancer,2015,15:795.
[51]Chen N,Debnath J.Autophagy and tumorigenesis[J].FEBS Lett,2010,584(7):1427-1435.
[52]Scarlatti F,Granata R,Meijer AJ,et al.Does autophagy have a license to kill mammalian cells?[J].Cell Death Differ,2009,16(1):12-20.
[53]Isakson P1,Bjørås M,Bøe SO,et al.Autophagy contributes to therapy-induced degradation of the PML/RARA oncoprotein[J].Blood,2010,116(13):2324-2331.
[54]Kondo Y,Kanzawa T,Sawaya R,et al.The role of autophagy in cancer development and response to therapy[J].Nat Rev Cancer,2005,5(9):726-734.
Research advance on autophagy and its role in cancer therapy
WANG Cheng-Yuan,JIAO Yong,ZHANG Bo
Department of Urology,Tangdu Hospital,Fourth Military Medical University,Xi’an 710038,China
Autophagy is a regulated intracelluar degradation/recycling system under stress that plays a fundamental role in celluar homeostasis.Autophagy exists widely in physiological and pathological processes.There is a complex relationship between autophagy and cancer,and autophagy is a double-edged sword in cancer therapy.In this review,autophagy and its role in cancer therapy are discussed.
autophagy;mechanism;cancer;therapy;review literature
R329.2
A
2095-6894(2017)05-65-05
2016-10-25;接受日期:2016-11-12
国家自然科学基金(31272391)
王程远.主治医师.研究方向:泌尿系肿瘤.Tel:029-84777728 E-mail:chengyuandoctor@163.com
张 波.博士,副教授,硕士生导师.研究方向:泌尿系肿瘤.Tel:029-84777728 E-mail:zhangbo@fmmu.edu.cn
