山西省圣天湖天鹅H5N8禽流感疫情与当前H5亚型病毒谱系分析
2017-06-10蒋文明田文霞侯广宇李金平王素春王仲兵陈继明
蒋文明,田文霞,侯广宇,李金平,程 隆,王素春,彭 程,王仲兵,陈继明
(1. 中国动物卫生与流行病学中心,山东青岛 266032;2. 山西省动物疫病预防控制中心,山西太原 033000)
山西省圣天湖天鹅H5N8禽流感疫情与当前H5亚型病毒谱系分析
蒋文明1,田文霞2,侯广宇1,李金平1,程 隆2,王素春1,彭 程1,王仲兵2,陈继明1
(1. 中国动物卫生与流行病学中心,山东青岛 266032;2. 山西省动物疫病预防控制中心,山西太原 033000)
2016年12月,山西省芮城县圣天湖景区的18只白天鹅陆续出现异常死亡。经病毒分离、基因组测序与分析,确定此次疫情的病原为H5N8亚型高致病性禽流感病毒。该毒株与同期在欧洲流行的H5N8病毒同源性很高,其HA和NA基因同源性分别为99.1%~99.6%和98.7%~99.6%;同期在欧洲流行的H5N8病毒的HA基因主要从2010—2013年在韩国、保加利亚、泰国、越南流行的病毒进化而来。基因组序列分析表明,2016年流行的H5N8病毒是一种新重组病毒。病毒的不断变异进化,造成了全球H5亚型禽流感流行的复杂性,增加了对其防控的难度,疫苗也需要随之更新换代。因此,建议加大疫苗的研发投入力度,改进水禽养殖模式,提高水禽免疫覆盖率和合格率,从而降低其感染和排毒的风险。
禽流感;野鸟;H5;防控
2016年11月以来,H5N8亚型禽流感病毒在欧洲、中东、非洲等地引起了多起疫情,我国的迁徙野鸟也受到影响。本研究对引起2016年12月山西省芮城县圣天湖天鹅疫情的病原进行了分离和分析,并结合当前的H5亚型禽流感形势,提出了相应的防控措施,以期为H5亚型禽流感的防控提供技术支持。
1 圣天湖天鹅疫情基本情况
山西省芮城县圣天湖的规划范围包括圣天湖内湖、外湖、周边部分的河滩地,以及内湖西侧的部分林地。地域范围东至黄河河岸,西边及北边至崖根,南至圣天湖南坝外200 m;地理坐标为东经110°53′27″~110°55′02″,北纬34°42′20″~34°44′04″;总面积为470.8公顷(1公顷= 0.01 km²),其中非水域面积约246.6公顷。2016年在芮城县越冬的天鹅约有1 500余只、野鸭约3 000余只。
2016年12月13日,圣天湖景区有2只白天鹅异常死亡;12月16日,又有8只白天鹅死亡。12月18日、19日、20日,圣天湖景区又分别有3只、2只、3只白天鹅死亡。此次疫情共造成18只白天鹅死亡。
2 病毒分离
将发病天鹅的肺脏、肠道组织剪碎后,加入含抗生素的PBS和钢珠,用MM400组织匀浆机(Retsch)处理后,-20 ℃冻融1次,10 000 r/min 4 ℃离心10 min,上清经0.22 µm滤膜过滤后接种10日龄SPF鸡胚,37 ℃孵化培养,每隔24 h照胚1次;收获死胚尿囊液,用1%鸡红细胞测定其血凝性。
3 基因组测序与分析
用QIAamp Viral RNA Mini Kit(Qiagen)提取血凝阳性尿囊液中的病毒RNA,根据Hoffmann发表的文献[1],用HiScript II One Step RT-PCR Kit(Vazyme)扩增病毒的8个基因片段。反应体系包括:2 × RT-PCR Buffer 25.0 μL,引物各2.0 μL(10 μmol/L),Enzyme Mix 2.5 μL,ddH2O 12.5 μL,RNA模板6.0 μL。RT-PCR反应条件为:50 ℃反转录30 min,94 ℃预变性2 min,然后94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸3 min,进行30个循环,最后72 ℃延伸7 min。用innuPRER Gel Extraction Kit(Analytikjena)回收纯化PCR产物,然后与pClone-TA-AMP载体(Clone Smarter)连接,将阳性重组质粒送青岛志远生物进行测序鉴定。
Blast结果显示,此次疫情的病原为H5N8亚型高致病性禽流感,并命名为A/swan/Shanxi/ST/2016(H5N8)。下载GenBank和GISAID数据库中的禽流感病毒基因组序列,利用MegAlian软件对序列进行分析,发现A/swan/Shanxi/ST/2016与同期在欧洲流行的H5N8病毒同源性很高(表1),而与2014—2015年在全球流行的H5N8病毒同源性较低。HA和NA基因与同期在欧洲流行的H5N8病毒同源性分别为99.1%~99.6%和98.7%~99.6%。其中,HA基因核苷酸序列与A/duck/India/10CA01/2016、A/ turkey/Poland/83/2016、A/turkey/Poland/78/2016、A/bronze_turkey/Czech_Republic/1414-17/2017的同源性最高。NA基因核苷酸序列与A/duck/ India/10CA01/2016、A/Brown-headed_Gull/ Qinghai/ZTO1-LU/2016的同源性最高。除NP基因与A/great_crested_grebe/Uvs-Nuur_Lake/341/2016(H5N8)的同源性最高,亲缘关系最近外,其他内部基因与A/duck/India/10CA01/2016的同源性最高,亲缘关系最近。
表1 A/swan/Shanxi/ST/2016(H5N8)基因组与同期在欧洲流行的H5N8病毒同源性比较
利用Mega 6软件对H5N8亚型禽流感病毒HA基因片段进行遗传进化分析,发现当前的H5N8病毒HA基因主要从2010—2013年在韩国、保加利亚、泰国、越南流行的病毒进化而来(图1)。H5N8病毒HA基因可以分为两个大的分支[2]:一是Gochang1分支,以A/breeder duck/Korea/Gochang1/2014为代表,主要包括2016—2017年在全球流行的H5N8病毒,以及2013—2014年中国和韩国流行的部分毒株。导致此次圣天湖天鹅疫情的病毒属于此分支。二是Buan2分支,以A/broiler duck/Korea/ Buan2/2014为代表,主要包括2014—2015年在全球流行的H5N8病毒,以及2010—2014年中国流行的部分毒株。特别指出的是,2016年在韩国流行的H5N8也属于这个分支。

图1全球H5N8亚型禽流感病毒HA基因遗传进化分析
4 H5N8候鸟疫情
2014年1月16日,韩国首先报道了H5N8亚型高致病性禽流感疫情。此次疫情导致蛋鸭产蛋率下降(60%)和死亡率上升。此后该病毒迅速传播至亚洲(中国、日本)、欧洲(德国、荷兰、英国、意大利)和北美洲(美国),在全球引起了大流行。从2016年11月开始,欧洲多个国家再次暴发H5N8亚型高致病性禽流感疫情,并迅速蔓延至欧洲、亚洲和大洋洲,感染的禽类涉及野生鸟类、鸭子和火鸡等[3]。
现有证据表明,这两波疫情主要是由野生鸟类传播引起的。2014年秋季,H5N8亚型高致病性禽流感病毒随鸟类迁徙传播到了西伯利亚[4-5],之后从西伯利亚传播到亚洲、欧洲和北美洲,导致了第一波疫情的发生。2016年秋季,H5N8亚型高致病性禽流感病毒随候鸟迁徙传播到了南亚、欧洲、中东、非洲,导致了第二波疫情的发生。该病毒能很好地适应某些水禽,并随着这些水禽的长距离迁徙开始跨洲传播。基因组序列分析结果表明,导致第二波疫情的H5N8病毒是一种新的重组病毒[6]。
5 H5亚型禽流感病毒谱系分析
5.1 第2.3.4.4分支H5亚型禽流感病毒谱系分析
该分支于2013年下半年开始出现,包括N1、N2、N6、N8等亚型。利用Mega 6软件,对H5N8亚型禽流感病毒HA基因片段进行遗传进化分析,发现第2.3.4.4分支病毒HA基因可以分为四个大的分支:一是Group A分支(以A/broiler duck/Korea/ Buan2/2014为代表),主要包括2014—2015年导致全球疫情的H5N8病毒,还包括少量国内分离的H5毒株。二是Group B分支,主要包括2014—2015年流行的少量H5亚型病毒。三是Group C分支,主要包括2014—2017年全球流行的H5亚型病毒(包括N1、N2、N6等亚型)。我国2016年开始使用的Re-8疫苗属于此分支。四是Group D分支(以A/ breeder duck/Korea/Gochang1/2014为代表),主要包括2016—2017年导致全球疫情的H5N8病毒,还包括少量2013—2014年从中国和韩国分离的毒株。相对Group A、B、D分支,Group C分支的病毒数量更多,可进一步分为4个小分支(图2)。与Re-8疫苗株相比,各分支中出现了一些变异株,应引起足够重视。
5.2 第2.3.2.1分支H5亚型禽流感病毒谱系分析
该分支于2009年开始流行,病毒主要划分为a、b、c 3个小分支。2012年我国推出Re-6疫苗(b小分支)来防控该分支的病毒。随着病毒的进化,2014年下半年之后,出现了一些变异较大的毒株,其分别位于d和e两个新的小分支(图3)[7]。研究表明,现有Re-6疫苗对d和e分支病毒的保护有限。2017年3月20日,农业部发布第2501号公告,用Re-10疫苗替代Re-6疫苗。
5.3 第7.2分支H5亚型禽流感病毒谱系分析

图2第2.3.4.4分支H5亚型禽流感病毒HA基因遗传进化分析
该分支于2011年开始出现,其前身为2006年在我国北方出现的第7分支。2006年我国使用Re-4疫苗来防控第7分支病毒。随着病毒的进化,Re-4疫苗的保护率出现下降,2014年我国又推出Re-7疫苗替代Re-4疫苗来防控第7.2变异株(图4)。随着疫苗使用,从2015年开始很少监测到该分支病毒。
6 结语
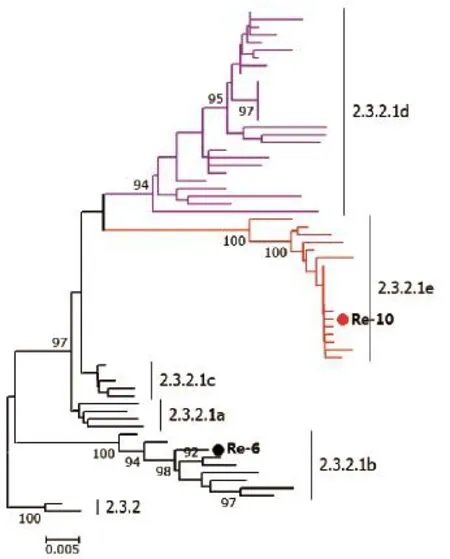
图3第2.3.2.1分支H5亚型禽流感病毒HA基因遗传进化分析

图4我国H5亚型禽流感病毒进化历程
自1 9 9 6年我国首次在广东省的鹅中分离到H5N1高致病性禽流感病毒(A/goose/ Guangdong/1/1996)以来,我国的H5亚型高致病性禽流感病毒的流行呈现出复杂的态势。最重要是病毒在不断变异,由最初的第0分支(GS/GD/1/96)逐步进化为第2和第7分支,前者继续进化为第2.3.4和第2.3.2.1a、b、c分支,后者继续进化为第7.1和7.2分支。第2.3.4分支又进一步进化为第2.3.4.4a、b、c分支,第2.3.2.1分支又进一步进化为d和e分支。病毒的不断变异进化,造成了H5亚型禽流感疫情的复杂性,增加了防控难度。随着病毒的变异,疫苗也随之更新换代,由最初的Re-1到Re-4、Re-5,再到后来的Re-6、Re-7、Re-8和Re-10。但是,疫苗的研发和使用,永远落后于病毒的变异和进化。一些疫情的发生也是由于现有疫苗不能对流行毒提供足够的保护。
要解决这个问题,一是要鼓励有条件的单位加大疫苗的研发投入力度,研发针对性强、更加有效的疫苗,加快符合生产实际疫苗的审批。二是促进养殖产业的专业升级,政府要加大出台相关措施和政策的力度,大力鼓励和扶持养殖企业向标准化、规模化、集约化、现代化方向发展,对登记备案、动物防疫条件合格、养殖档案齐全、生物安全水平和防疫水平合格的养殖企业进行奖励。三是重点解决水禽的免疫问题。监测发现水禽的带毒率和发病率较鸡的要高,而且由于我国的水网密集、水禽养殖量大、养殖方式落后,导致水禽的免疫覆盖率和合格率较低,带毒率和发病率较高。由于水禽对禽流感病毒的天然耐受,很多水禽带毒而不表现任何症状,又可继续排毒继而感染其他家禽。因此,要改进水禽的养殖模式,提高水禽的免疫覆盖率和合格率,从而降低其感染和排毒的风险。
[1] HOFFMANN E,STECH J,GUAN Y,et al. Universal primer set for the full-length amplification of all influenza A viruses[J]. Arch Virol,2001,146(12):2275-2289.
[2] LI M,LIU H,BI Y,et al. Highly pathogenic avian influenza A(H5N8) virus in wild migratory birds,Qinghai Lake,China[J]. Emerg Infect Dis,2017,23(4):637-641.
[3] 蒋文明,宋建德,黄保续. 近期全球H5N8亚型禽流感疫情分析[J]. 中国动物检疫,2017,34(1):1-3.
[4] MARCHENKO V Y,SUSLOPAROV I M,KOLOSOVA N P,et al. Inf l uenza A(H5N8) virus isolation in Russia,2014[J]. Arch Virol,2015,160:2857-2860.
[5] LEE D H,TORCHETTI M K,WINKER K,et al. Intercontinental spread of Asian-origin H5N8 to North America through Beringia by migratory birds[J]. J Virol,2015,89:6521-6524.
[6] POHLMANN A,STARICK E,HARDER T,et al. Outbreaks among wild birds and domestic poultry caused by reassorted inf l uenza A(H5N8)clade 2.3.4.4 viruses,Germany,2016[J]. Emerg Infect Dis,2017,23(4):633-636.
[7] JIANG W,HOU G,LI J,et al. Novel variants of clade 2.3.2.1 H5N1 highly pathogenic avian inf l uenza virus in migratory waterfowl of Hongze Lake[J]. Vet Microbiol,2017,198:99-103.
(责任编辑:朱迪国)
Analysis of Swan H5N8 Avian Inf l uenza in Holy Lake of Shanxi Province and the Current Virus Lingeage of H5 Subtype Avian Inf l uenza
Jiang Wenming1,Tian Wenxia2,Hou Guangyu1,Li Jinping1,Cheng Long2,Wang Suchun1,Peng Cheng1,Wang Zhongbing2,Chen Jiming1
(1. China Animal Health and Epidemiology Center,Qingdao,Shandong 266032;2. Shanxi Animal Disease Prevention and Control Center,Taiyuan,Shanxi 033000)
In December 2016,18 white swans died in the scenic area of Holy Lake in Ruicheng county of Shanxi province. It was conf i rmed that the outbreak was caused by the H5N8 subtype highly pathogenic avian inf l uenza virus through virus isolation,genome sequencing and analysis. The homology between the strain and the prevalent H5N8 viruses was high. The homology between HA and NA genes was 99.1%~99.6% and 98.7%~99.6%,respectively. During the same period,the HA gene,which was prevalent in Europe,evolved mainly from viruses prevalented in South Korea,Bulgaria,Thailand,and Vietnam (H5N8)in 2010—2013. Genome sequence analysis showed that the prevalent H5N8 virus in 2016 was a new recombinant virus. The complexity of the global H5 subtype avian inf l uenza epidemic was created by the continuous evolution of the virus,increasing the diff i culty of its prevention and control,and the vaccine needs to be updated accordingly. Suggestions of increasing investment and efforts in vaccine research and development,improving the waterfowl farming model,and improving the coverage rate and pass rate of waterfowl were put forward,in order to reduce the risk of infection and detoxif i cation.
avian inf l uenza;wild bird;H5;prevention and control
S852.65
:A
:1005-944X(2017)06-0014-05
10.3969/j.issn.1005-944X.2017.06.004
科技部科技基础性工作专项(2012FY111000);国家重点研发计划(2016YFD0501609)
