接种密度对C57BL/6小鼠CIK细胞增殖、分化及杀瘤作用的影响
2017-06-09李光宗曾喜欢刘英富霍景瑞郁硕张益侯世科陈小义陈锋
李光宗,曾喜欢,刘英富,霍景瑞,郁硕,张益,侯世科,陈小义,陈锋
1.武警后勤学院 附属医院救援医学研究所,天津 300162;2.锦州医科大学,辽宁 锦州 121001;
3.武警后勤学院 细胞生物与医学遗传学教研室,天津 300309
接种密度对C57BL/6小鼠CIK细胞增殖、分化及杀瘤作用的影响
李光宗1,曾喜欢2,刘英富3,霍景瑞3,郁硕1,张益2,侯世科1,陈小义3,陈锋1
1.武警后勤学院 附属医院救援医学研究所,天津 300162;2.锦州医科大学,辽宁 锦州 121001;
3.武警后勤学院 细胞生物与医学遗传学教研室,天津 300309
目的:探讨不同接种密度对C57BL/6小鼠细胞因子诱导的杀伤细胞(CIK细胞)增殖分化及杀瘤作用的影响,进一步优化CIK细胞培养方法。方法:按照1×106/mL(A组)、4×106/mL(B组)、8×106/mL(C组)、12×106/mL(D组)4种接种密度培养细胞,加入必要的细胞因子,14 d后收获细胞,通过流式细胞术、CCK-8法对细胞增殖、分化、杀瘤作用进行分析。结果:培养过程中,C组细胞形态及增殖能力优于A、B组,在14 d时收获细胞并对其进行检测时发现,C组CD3+/NK1.1+细胞所占比例明显高于A、B组,杀瘤活性也优于A、B组;D组细胞密度过大,在7 d细胞进入快速增殖期后出现大面积死亡。结论:适当提高C57BL/6小鼠CIK细胞的接种密度利于细胞增殖、分化及杀瘤作用的形成,选择8×106/mL的接种密度是较为合适的。
细胞因子诱导的杀伤细胞;密度;细胞培养;增殖;杀瘤作用
细胞因子诱导的杀伤细胞(cytokine-induced killer cells,CIK细胞)是细胞毒T细胞中表达CD3+和CD56+的独特类型,其不仅有强大的抗肿瘤活性,还具有非MHC限制细胞毒性。它对多种肿瘤细胞具有杀伤作用,且对正常组织的毒性较低,因而广泛应用于临床过继性免疫治疗[1]。目前针对肿瘤的体内实验研究多在小鼠肿瘤模型中开展[2-4],而建立一种实用、高效的小鼠CIK细胞培养方法对于肿瘤细胞免疫治疗研究显得尤为重要。近年来,国内外相关研究已培养出小鼠CIK细胞[5-7],但均未探讨接种密度对CIK细胞生长的影响,而笔者在培养过程中却发现接种密度对于CIK细胞生长起很关键的作用。
1 材料和方法
1.1 材料
SPF级雄性C57BL/6小鼠(6~8周)购自军事医学科学院实验动物中心,生产许可证号:SCXK-(军)-2012-0004。小鼠IL-1、IL-2、γL-22购自Peprotech公司;抗CD3单抗、抗鼠CD3-FITC、抗鼠NK1.1-PE购自Ebioscience公司;X-VIVO15培养基购自Lonza公司;胎牛血清、青霉素、链霉素购自Gibco公司;红细胞裂解液购自Sigma公司;CCK-8试剂盒购自贝博生物公司;流式细胞仪购自Millipore公司;离心机购自Eppendorf公司。
1.2 小鼠CIK细胞的制备
脱颈处死C57BL/6小鼠,在无菌环境中取出脾脏,用400目筛网分离脾细胞,加入红细胞裂解液90 s后加入PBS终止反应,离心收集细胞,用含10%胎牛血清的X-VIVO15完全培养基分别将细胞浓度调整为1×106/mL(A组)、4×106/mL(B组)、8×106/mL(C组)和12×106/mL(D组),接种于24孔板中,加入IFN-F(1000 U/mL),于37℃、5% CO2培养箱中培养,24 h后加入抗CD3单抗(1 μg/mL)、IL-1(100 U/mL)、IL-2(300 U/mL),以后视生长情况传代,使细胞密度始终与接种密度一致,并半量换液含IL-2(300 U/mL)的X-VIVO15完全培养基,14 d后收集细胞。
1.3 流式细胞仪检测
将收集的CIK细胞用含1%牛血清白蛋白(BSA)的FACS缓冲液重悬,调整细胞浓度为1× 105/mL,加入荧光标记抗体(CD3-FITC、NK1.1-PE),混匀,于4℃避光反应30 min,然后用FACS缓冲液洗涤2次,最后用100μL FACS缓冲液重悬,上流式细胞仪分析
1.4 小鼠CIK细胞杀瘤活性检测
应用CCK-8试剂盒检测CIK细胞对小鼠骨髓瘤细胞Sp20的体外毒性试验。细胞接种10 000/孔,效应细胞(CIK细胞)与靶细胞(Sp20细胞)分别按5∶1、10∶1、20∶1的比例加入96孔板,于37℃、5%CO2培养箱中孵育24 h。每孔加入10 μL CCK-8溶液,37℃孵育4 h,测定各孔的D450nm值。杀瘤活性(%)=[1-(混合细胞D450nm-效应细胞D450nm)/效应细胞D450nm]×100
1.5 统计分析
计量资料用x±s表示,多组间比较用单因素方差分析,率的比较用χ2检验。P<0.05时表示有统计学差异。
2 结果
2.1 不同接种密度对CIK细胞形态学的影响
刚从脾脏分离出的细胞呈单个分布,表现为圆形且体积较小,折光性弱,4组细胞形态无差别。当在24 h后加入抗CD3单抗,IL-1、IL-2细胞因子后,细胞开始形成集落,但集落体积小,且散在分布,C、D组较A、B组集落稍大,且折光性更好。3 d后,C、D组集落明显扩大并增多,立体感变强;A、B组集落也有增大,但明显不如前者。7 d后,C组细胞增殖速度明显加快,短期就能布满培养板孔,细胞集落呈片状,单个细胞大而饱满,折光性强;B组细胞增殖速度稍慢,集落小于C组,但细胞形态与C组无明显;A组则生长较为缓慢,集落小而分散,单个细胞体积不如B、C组,折光性较差;D组细胞密度过大,布满整个视野,细胞出现大面积死亡(图1)。14 d后,细胞增殖速度减慢,部分细胞呈不规则形状,细胞碎片增多。
2.2 不同接种密度对CIK细胞增殖的影响

图1 培养至7 d各组CIK细胞的形态特征(×100)
分别于0、3、7、14 d通过台盼蓝染色对细胞进行计数。如图2所示,在3 d内,细胞增殖较为缓慢,细胞数量甚至还有轻度下降,4组增殖速度无差别。3 d后细胞增值速度明显加快,C、D组增殖速度(分别由3 d的5×106/mL扩增为7 d的40×106/mL,3 d的9×106/mL扩增为7 d的74×106/ mL)快于A、B组(分别由0.7×106/mL增长到1.9× 106/mL和由2×106/mL增长到12×106/mL)。7 d后,CIK细胞进入快速增长期,B、C组增殖较快,且C组(由7 d的40×106/mL增长到14 d的387×106/ mL,较0 d扩增48倍)增殖速度快于B组(由7 d的12×106/mL增长到14 d的132×106/mL,较0 d扩增33倍),A组增殖则较为缓慢(由7 d的1×106/ mL增长到14 d的17×106/mL,较0 d扩增17倍),D组则由于细胞增值速度过快、密度过大,导致细胞出现大面积死亡,直至14 d收集细胞时细胞所剩无几。
2.3 不同接种密度对CIK细胞表型的影响
培养2周后,对收集的细胞进行流式分析,显示不同接种密度对细胞免疫表型产生影响,C组中CD3+/NK1.1+细胞占到38.79%,明显高于其他2组(A组为22.84%,B组为32.22%),见图3。
2.4 不同接种密度对CIK细胞杀瘤活性的影响
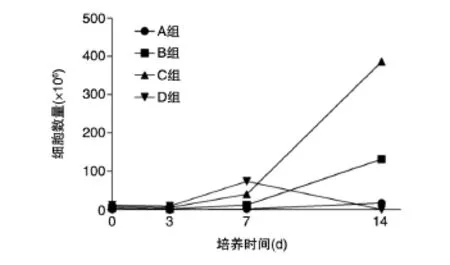
图2 各组CIK细胞增殖情况比较

图3 培养至14 d各组CIK细胞的表型比较
随着效应细胞和靶细胞比例的不断增大,CIK细胞对Sp20细胞的杀瘤活性也越大。对于相同效靶比,不同组之间存在差异。在效靶比为5∶1时,C组的杀瘤活性为74.0%±3.6%,高于A组(49.6%±2.9%,P<0.01)和B组(61.0%±5.1%,P<0.05),B组杀瘤活性高于A组(P<0.05);在效靶比为10∶1时,C组的杀瘤活性为81.0%±2.2%,高于A组(52.1%±3.2%,P<0.01)和B组(63.3%±3.9%,P<0.01);在效靶比为20∶1时,C组的杀瘤活性为82.8%±2.8%,高于A组(70.3%±5.1%,P<0.01)和B组(56.8±%1.7%,P<0.01)。见表1。

表1 各组CIK细胞杀瘤活性比较
3 讨论
CIK细胞是单个核细胞在抗CD3抗体和IL-1、IL-2、IFN等许多细胞因子共诱导下形成的,其增殖速度快、杀瘤范围广且不受免疫抑制药物影响,杀瘤作用依赖于分泌细胞因子、穿孔素及Fas-Fas配体相互作用等途径。在过去20年中,大量临床实验证实其在肿瘤病人中的安全性和有效性,因此被认为是一种理想的杀瘤细胞[8]。近年来,相关学者试图通过优化CIK细胞的培养方法,或将细胞治疗与手术、化疗、放疗协同作用来进一步提高其杀瘤效率,因而迫切需要大量的基础研究为其提供数据支持。目前,虽然相关实验研究已培养出小鼠CIK细胞,但接种密度存在差异,更多采用1×106/mL的接种密度[5,7,9],而笔者在研究过程中发现该密度培养效果并不十分理想,适当提高密度更有利于细胞增殖、分化及杀瘤作用的形成。
本实验结果显示,在接种3 d后,不同密度组细胞无论在细胞形态和增殖速度上均存在明显不同,第7 d时接种密度8×106/mL组细胞大而饱满,折光性强,并且聚集成较大集落,细胞状态良好,增殖能力强,扩增倍数为48倍,而接种密度1×106/mL组细胞体积小且细胞集落分散,扩增能力较差,扩增倍数仅为17倍,两者差异明显,由此可见适当增大细胞接种密度能显著提高细胞的活力状态及增殖能力。但细胞接种密度也不宜过大,接种密度12×106/mL组细胞因其过于拥挤,导致生长空间相对不足,在第7 d出现大量细胞死亡。不同接种密度对CIK细胞的表型及杀瘤活性同样有重要影响,在14 d时收集细胞并对其进行表型及杀瘤活性检测发现,起主要杀瘤作用的CD3+/NK1.1+细胞在接种密度8×106/mL组中所占比例达到38.79%,远高于接种密度1×106/mL组的22.84%。在用CCK-8法对CIK杀瘤活性进行检测时,同样发现接种密度8×106/mL组在各种效靶比中杀瘤活性高于1×106/mL组。有研究证实,CIK细胞能够表达多种细胞因子,包括IFN-F、IL-2、TNF、IL-2R、IL-10R等[10],适当增加接种密度可提高培养基中的细胞因子水平,利于细胞增殖和功能形成。IL-2促进CIK细胞增殖、存活及杀瘤功能的形成,基于它能够上调CIK细胞CD40LG和IFR7的表达[11]。CD40LG是CD40的配体,两者结合后可抑制肿瘤生长并诱导其凋亡[12];IFR7则是调节Ⅰ型IFN表达的转录因子,IFN能够提高单核细胞的自噬和抗原呈递功能[1]。此外,由于CIK细胞结团生长,各细胞之间的相互作用是否影响其增殖还待进一步研究。
综上所述,我们初步探讨了接种密度对小鼠CIK细胞增殖、分化及杀瘤作用的影响,对CIK细胞生长特性的研究有一定的启迪,也为小鼠CIK细胞培养方式的优化和进一步探索免疫细胞治疗提供了新的思路。
[1]Jiang J,Wu C,Lu B.Cytokine-induced killer cells promote antitumor immunity[J].J Transl Med,2013,11: 83.
[2]Liu S,Wang X,Lu Y,et al.The combined use of cytokine-induced killer cells and cyclosporine a for the treatment of aplastic anemia in a mouse model[J].J Interferon Cytokine Res,2015,35(5):401-410.
[3]Kim J S,Chung I S,Lim S H,et al.Preclinical andclinical studies on cytokine-induced killer cells for the treatment of renal cell carcinoma[J].Arch Pharm Res,2014,37(5):559-566.
[4]Zhang L,Zhao G,Hou Y,et al.The experimental study on the treatment of cytokine-induced killer cells combined with EGFR monoclonal antibody against gastric cancer[J].Cancer Biother Radiopharm, 2014,29(3):99-107.
[5]Bach M,Schimmelpfennig C,Stolzing A.Influence of murine mesenchymal stem cells on proliferation,phenotype,vitality,and cytotoxicity of murine cytokine-induced killer cells in coculture[J].PLoS One,2014,9(2): e88115.
[6]Baker J,Verneris M R,Ito M,et al.Expansion of cytolytic CD8+natural killer T cells with limited capacity for graft-versus-host disease induction due to interferon gamma production[J].Blood,2001,97(10):2923-2931.
[7]Zhu X L,Lin Z B.Effects of Ganoderma lucidum polysaccharides on proliferation and cytotoxicity of cytokine-induced killer cells[J].Acta Pharmacol Sin, 2005,26(9):1130-1137.
[8]Guo Y,Han W.Cytokine-induced killer(CIK)cells: from basic research to clinical translation[J].Chin J Cancer,2015,34(3):99-107.
[9]Zou Y,Li F,Hou W,et al.Manipulating the expression of chemokine receptors enhances delivery and activity of cytokine-induced killer cells[J].Br J Cancer, 2014,110(8):1992-1999.
[10]Wang Y,Bo J,Dai H R,et al.CIK cells from recurrent or refractory AML patients can be efficiently expanded in vitro and used for reduction of leukemic blasts in vivo[J].Exp Hematol,2013,41(3):241-252.
[11]Wang W,Meng M,Zhang Y,et al.Global transcriptome-wide analysis of CIK cells identify distinct roles of IL-2 and IL-15 in acquisition of cytotoxic capacity against tumor[J].BMC Med Genomics,2014,7:49.
[12]Eliopoulos A G,Davies C,Knox P G,et al.CD40 induces apoptosis in carcinoma cells through activation of cytotoxic ligands of the tumor necrosis factor superfamily[J].Mol Cell Biol,2000,20(15):5503-5515.
Effects of Different Inoculation Density on the Proliferation,Differentiation and Anti-Tumor Capability of CIK Cells in C57BL/6 M ice
LI Guang-Zong1,ZENG Xi-Huan2,LIU Ying-Fu3,HUO Jing-Rui3, YU Shuo1,ZHANG Yi2,HOU Shi-Ke1,CHEN Xiao-Yi3,CHEN Feng1*
1.Institute of Rrescue Medicine,Affiliated Hospital,Logistics University of Chinese People's Armed Police Forces, Tianjin 300162;2.Jinzhou Medical University,Jinzhou 121001;3.Department of Cell Biology,Logistics University of Chinese People's Armed Police Forces,Tianjin 300309;China
*Corresponding author,E-mail:chenfeng_tj@126.com
Objective:To investigate the effects of different inoculation densities on proliferation,differentiation and anti-tumor capability of cytokine-induced killer(CIK)cells in C57BL/6 mice,and to further optimize CIK cells culture method.Methods:The cells were cultured in the density of 1×106/mL(group A),4×106/mL(group B),8×106/mL(group C)and 12×106/mL(group D),and after 14 days,the cells were harvested and analyzed by microscope,flow cytometry and CCK-8 for cell proliferation,differentiation and anti-tumor capability.Results:The cell morphology and proliferation ability of group C were superior to those of group A and B.Whencells were har-vested and detected on 14 d,the percentage of CD3+/NK1.1+cells in C group was significantly higher than the proportion of group A and B,anti-tumor capability was better than that of group A and B.Cell density of group D cell density was too large,in the 7 d cells into the rapid proliferation phase,the cells appear large area of death.Conclusion:It is appropriate to increase the inoculation density of CIK cells in C57BL/6 mice,which is beneficial to the proliferation,differentiation and anti-tumor capability of C57BL/6 mice,and the inoculation density of 8×106/mL is more appropriate
cytokine-induced killer cells;density;cell culture;proliferation;anti-tumor capability
Q25
A
1009-0002(2017)03-0342-05
10.3969/j.issn.1009-0002.2017.03.020
2016-11-23
天津市科技计划(14ZCDZSY00033);全军重点实验室开放基金(JY1402);武警后勤学院附属医院科研平台开放基金(WYFKFM201602,WYKFZ201603)
李光宗(1990-),男,硕士研究生,(E-mail)384018843@qq.com
陈锋,(E-mail)lchenfeng_tj@126.com
