生物表面活性剂对红球菌SY095降解正十六烷及细胞表面性质的影响
2017-06-09张晓青郝建安任华峰司晓光王静张雨山
张晓青,郝建安,任华峰,司晓光,王静,张雨山
国家海洋局 天津海水淡化与综合利用研究所,天津 300192
生物表面活性剂对红球菌SY095降解正十六烷及细胞表面性质的影响
张晓青,郝建安,任华峰,司晓光,王静,张雨山
国家海洋局 天津海水淡化与综合利用研究所,天津 300192
目的:研究红球菌SY095产生物表面活性剂对正十六烷的溶解性、微生物降解正十六烷的效率、菌体生长及菌体表面疏水性的影响。方法:测定添加不同生物表面活性剂的降解体系中菌体生物量、细胞表面疏水性、正十六烷含量的变化。结果:生物表面活性剂对疏水性底物正十六烷具有很强的增溶作用,可以显著提高正十六烷的表观溶解度;生物表面活性剂对正十六烷的生物降解具有促进作用,添加量为100 mg/L时,96 h正十六烷去除率达93.32%;生物表面活性剂能明显促进红球菌SY095生长,添加量为300 mg/L时,菌株32 h生物量为未添加生物表面活性剂对照组的2.7倍;生物表面活性剂还能引起红球菌SY095菌体表面疏水性明显增大,添加量为25 mg/L时,菌株对数生长期BATH值达66.94%,高于未添加生物表面活性剂对照组的42.99%。结论:生物表面活性剂可以增加菌体的表面疏水性,促进微生物对正十六烷的生物降解。
生物表面活性剂;增溶作用;生物降解;生长促进;细胞表面疏水性
随着海洋经济的快速发展和人们海洋活动的增加,海洋污染正在日益加剧,其中难降解疏水性有机物的污染问题突出。疏水性有机物进入海洋环境后,由于其溶解度低,持续时间长,能通过食物链进入人体,给海洋环境和人类健康带来严重危害。据统计,2015年春、夏、秋、冬季石油类含量超过第一、二类海水水质标准的海域面积分别为9410、19560、15580和14930平方公里。
微生物修复技术具有低成本、高效、环保等优点,已成为去除石油类污染的重要手段,发展潜力巨大[1]。但石油烃类中疏水性较强的长链烷烃和芳香烃等化合物水溶性差限制了其生物修复效率[2]。表面活性剂可以提高疏水性污染物在水相中的表观溶解度,增加这类污染物与微生物的接触面积,加强有机相和水相的传质,从而提高污染物的生物可利用性[3]。生物表面活性剂是微生物生长代谢的活性产物,与化学表面活性剂相比具有更好的环境兼容性,有利于微生物的降解,因此生物表面活性剂作为一种石油助解剂成为研究热点[4]。目前研究最多的生物表面活性剂为鼠李糖脂,据文献报道,鼠李糖脂对疏水性烃类有机物(如菲、芘等)增溶作用显著[5-6],能促进降解菌生长[7-8],改变菌体表面疏水性[9],从而加快石油烃的生物修复进程。
我们通过研究红球菌SY095所产生物表面活性剂对疏水性污染物增溶作用,考察添加生物表面活性剂后其对降解菌生长、细胞表面疏水性及污染物降解效率的影响,探讨生物表面活性剂在强化烃类污染物生物降解过程中与微生物的相互作用,为生物表面活性剂在生物修复中的应用提供理论支持。
1 材料与方法
1.1 材料
红球菌SY095(Rhodococcussp.)由本实验室分离鉴定,GenBank登录号为GU184127[10]。正十六烷(纯度≥95%,天津艾勒科技公司);氯仿、甲醇等无机溶剂(分析纯,天津市江天化工技术有限公司);正十六烷标物(99.9%纯度,山东西亚化学工业有限公司)。
种子培养基:蛋白胨10 g,酵母粉5 g,NaCl 10 g,去离子水1 L,初始pH7.0~7.5。
无机盐培养液(/L):K2HPO41.0 g,KH2PO41.0 g,MgSO4·7H2O 0.5 g,CO(NH2)22.0 g,大豆油2%,初始pH7.5。
正十六烷培养基:将无机盐培养基中的大豆油换成正十六烷,添加量为0.5%。
1.2 种子液的制备
将SY095接种于LB液体培养基中,30℃、160 r/min振荡培养24 h,D600nm达1.80±0.05。
1.3 生物表面活性剂的分离与提纯
按2%接种量将红球菌SY095转接到无机盐培养基中,30℃、160 r/min培养48 h,发酵液用浓盐酸调节pH值为2.0±0.2,4℃静置过夜;将酸沉淀后的发酵液10 000 r/min离心10 min,收集离心管中的悬浮物,用同等体积的氯仿∶甲醇(2∶1)抽提2~3次,合并抽提液,在60℃条件下用旋转蒸发仪减压浓缩,最终体积7~10 mL,于70℃烘箱中将有机溶液完全挥发,得到表面活性剂制品,储于4℃冰箱中[11]。
1.4 生物表面活性剂乳化增溶实验
在100 mL含不同浓度表面活性剂的溶液中加入0.5 mL正十六烷,25℃、160 r/min振荡24 h,静置24 h,吸取下层水溶液5 mL,用等体积正己烷萃取2~3次,合并有机相浓缩至5 mL,利用气相色谱法测定正十六烷含量。
1.5 生物表面活性剂强化红球菌SY095降解正十六烷实验
在100 mL正十六烷培养基(添加量0.5%)中添加生物表面活性剂,其终浓度分别为0、25、50、75、100、50、200、300 mg/L,接种量为4%,30℃、160 r/min摇床培养4 d,定期测定菌体生物量、细胞表面疏水性和正十六烷的降解率。
1.6 正十六烷测定
正十六烷测定采用安捷伦6890N气相色谱仪,用标准物质鉴定并计算正十六烷的降解率。采用毛细管气相色谱柱(Phenyl Methyl Siloxane HP-5),载气为99.99%氮气,进样口温度250℃,分流比30∶1,检测器温度300℃,氢气流量30 mL/ min,空气流量300 mL/min,进样量1μL。初始160℃,保留1 min,以20℃/min升温至260℃,保留6 min[12]。
1.7 细胞表面疏水性的测定
菌体表面疏水性采用BATH(bacterial adhesion to hydrocarbons,细菌对碳氢化合物的黏附)方法测定[13]。取不同培养时间的发酵液,4℃、6000 r/min离心8 min,收集菌体细胞,用无机盐培养基洗涤2次,再重悬于其中,菌悬液D400nm约为1.0;取4 mL菌悬液和1 mL正十六烷加入20 mL离心管中,盖紧盖子后快速振荡60 s,室温放置30 min,吸取底层水相,测其D400nm值;按下式计算表面疏水性A:

其中T0为吸附前菌液的D400nm值,T1为吸附后菌液的D400nm值。每个样品测3次,结果取平均值。
1.8 菌体生物量测定
取不同培养时间的培养液5 m L,8000 r/min离心5 min,收集菌体细胞,用去离子水洗涤2次,再重悬于等体积的无机盐培养基中,测定其D600nm值。
2 结果
2.1 生物表面活性剂对正十六烷的增溶作用
红球菌SY095产生物表面活性剂对长链烷烃正十六烷的增溶作用见图1,可知生物表面活性剂的增溶作用明显,正十六烷在水相中的溶解度随着生物表面活性剂浓度的增加而增大。生物表面活性剂的浓度低于临界胶束浓度值(CMC= 68.3 mg/L)时,正十六烷在水相中的溶解度从0.12增大到59.83 mg/L,这主要由于烷烃与表面活性剂疏水基团相互作用降低油/水界面张力,从而增加烷烃在水相中的溶解度[14];生物表面活性剂浓度从临界胶束浓度值提高到300 mg/L时,正十六烷在水相中的溶解度从59.83增加到125.12 mg/L。
2.2 生物表面活性剂作用下正十六烷的生物降解
添加不同浓度生物表面活性剂后红球菌SY095对正十六烷的降解效果见图2。可以看出,与未添加生物表面活性剂的降解体系相比,加入一定量的生物表面活性剂可以大大提高正十六烷的降解效率。培养96 h时,添加生物表面活性剂浓度为25、50、75、100、150、200、300 mg/L,培养液中正十六烷的去除率比未添加生物表面活性剂体系分别增加了8.3%、12.8、15.2%、18.4%、18.2%、18.8%和19.9%。高浓度生物表面活性剂(100~300 mg/L)体系中,正十六烷的降解率显著提高,24 h正十六烷去除率达30%,72 h降解率都在93%以上。正十六烷降解率的显著提高,一方面因为生物表面活性剂对正十六烷增溶作用,为菌体和正十六烷的接触提供有利条件,从而促进正十六烷的降解;另一方面可能是生物表面活性剂和降解菌株SY095之间相互作用,使得微生物细胞表面性质发生改变,更容易摄取难溶疏水性的物质,从而促进底物的降解[15]。

图1 红球菌SY095产生物表面活性剂对长链烷烃正十六烷的增溶作用

图2 生物表面活性剂对正十六烷的生物降解的影响
2.3 生物表面活性剂对红球菌SY095生长的影响
在红球菌SY095的正十六烷培养基中加入一定量的生物表面活性剂,不同条件下菌株D600nm值的变化见图3。培养24 h时,红球菌SY095生长缓慢,处于生长延滞期,不同条件下菌株生物量D600nm值都在0.3左右;24 h后,菌株适应了培养基环境,进入快速生长期,且添加了生物表面活性剂菌株生物量快速增加,其中添加量为300 mg/L菌株培养32 h时D600nm值达0.824,未添加菌株D600nm值仅为0.305,因此生物表面活性剂可以显著加快菌株的生长,促进菌株快速进入对数生长期;随后56 h菌株进入生长稳定期和衰亡期。从图3还可以看出,菌株最大生物量随培养液中生物表面活性剂浓度的增加而变大,其中添加量为200和300 mg/L最大生物量(D600nm值)分别达到1.988和2.022。
2.4 生物表面活性剂对红球菌细胞疏水性的影响

图3 生物表面活性剂对红球菌SY095生长的影响
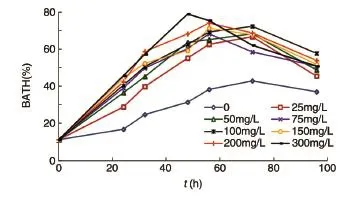
图4 生物表面活性剂对红球菌SY095菌体细胞表面疏水性的影响
添加不同浓度的生物表面活性剂,菌株细胞疏水性随时间的变化见图4。可以看出,在未添加生物表面活性剂培养基中,菌株SY095表面疏水性随培养时间的增加而逐渐增大,从开始的11.2%增加到72 h的42.99%,之后略有下降,这时细胞疏水性增大主要是由于疏水性底物正十六烷的诱导作用,菌体细胞为了适应疏水性环境而改变细胞性质[16]。添加了生物表面活性剂后红球菌SY095在正十六烷培养基中的BATH明显增大,当添加量为300 mg/L时,菌株在对数生长期中BATH值高达79.22%,之后略有下降,96 h时仍为51.03%,均高于未添加生物表面活性剂的BATH。生物表面活性剂可以与菌体细胞相互吸附,改变菌体表面的吸附特性,从而改变菌体与疏水性有机物间的亲和力,使降解菌株更好地摄取疏水性的底物,加速其降解速率。在菌株生长后期,细胞表面疏水性下降,这可能是因为随着微生物进入生长衰退期,菌体细胞表面疏水位点减少,同时分泌一些脂肪酸和脂类物质,改变自身表面疏水性[17]。
3 讨论
生物表面活性剂是由微生物在一定培养条件下代谢分泌的具有表面生物活性的物质,具有低毒、易降解等优点,可以显著提高疏水性污染物在水相中的表观溶解度,增加疏水性有机物与微生物的接触面积,从而提高污染物的生物可利用性。我们选取红球菌SY095产生物表面活性剂,通过增溶实验和降解实验,研究该表面活性剂对正十六烷的增溶作用、降解菌生长、菌体细胞表面疏水性及疏水性底物降解效率的影响。
本实验中红球菌SY095产生物表面活性剂对正十六烷的增溶作用明显,正十六烷在水相中的溶解度随生物表面活性剂浓度的增加而增大。当浓度较低时,生物表面活性剂主要以单体形式存在,烷烃溶解度增加主要是由于烷烃与生物表面活性剂疏水基团间相互作用;当浓度大于临界胶束浓度值时,其亲水基团向外伸向水相,疏水基团向内形成胶束,增溶作用主要是通过胶束将疏水性烷烃包裹在胶束内核区域,使其在水相中的表观溶解度增加[18]。
微生物菌体表面疏水性强有利于微生物与细胞底物的接触,增加微生物细胞与疏水性基质之间的亲和力,提高其降解速率,而在降解体系中加入生物表面活性剂可以使菌体表面疏水性发生变化。马霞[12]等研究表明,在石油烃生物降解过程中,鼠李糖脂能够促进菌株生长,增加菌体的表面疏水性,加快烃类的传质速率,从而加速环境的生物修复速度。姜萍萍[14]等发现鼠李糖脂可显著促进降解菌GP3生长,且在降解初期细胞表面疏水性显著增加,有利于微生物摄取有机底物,加速芘的生物降解。在本研究中,与未添加生物表面活性剂的降解体系相比,加入一定量的生物表面活性剂可以提高正十六烷的降解效率,加快菌株的生长,促进菌株快速进入对数生长期,且菌株最大生物量随培养液中生物表面活性剂浓度的增加而变大。同时,培养基中添加了生物表面活性剂后红球菌SY095在正十六烷培养基中的BATH值明显增大。因此,红球菌SY095产生物表面活性剂可以显著提高正十六烷表观溶解度,促进降解菌生长,改变降解菌细胞表面疏水性,使菌体更好摄取疏水性底物,从而提高正十六烷的生物降解效率。
[1]马超,刘光全,赵林,等.表面活性剂在油污土壤修复中的应用[J].污染防治技术,2013,26(5):55-59.
[2]朱生凤,梁生康,吴亮,等.鼠李糖脂及其产生菌对原油生物降解影响研究[J].环境科学与技术,2010,33(5): 15-20.
[3]Mulligan C N,Yong R N,Gibbs B F.Surfactant-enhanced remediation of contaminated soil:a review[J]. Eng Geol,2001,60(4):371-380.
[4]Bognolo G.Biosurfantants as emulsifying for hydrocarbons[J].Colloids Surfaces A,1999,15(1-2):41-52.
[5]李琦,黄廷林,宋进喜.生物表面活性剂对疏水性有机物的增溶特性[J].化学工程,2011,39(9):1-5.
[6]Doong R A,Lei W G.Solubilization and mineralization of polycyclic aromatic hydrocarbons by pseudomonas putida in the presence of surfactant[J].J Hazardous Materials,2003,96(1):15-27.
[7]Sotirova A,Spasova D,Vasileva-Tonkova E,et al.Effects of rhamnolipid biosurfactant on cell surface of Pseudomonas aeruginosa[J].Microbiol Res,2009,164(3): 297-303.
[8]陈廷君,王红旗,王然,等.鼠李糖脂对微生物降解正十六烷以及细胞表面性质的影响[J].环境科学,2007, 28(9):2117-2122.
[9]姜萍萍,郭楚玲,党志,等.鼠李糖脂与疏水性底物及其降解菌的相互作用[J].环境科学,2011,32(7):2144-2150.
[10]任华锋,张雨山,王静,等.石油烃降解菌的分离鉴定及其产生乳化剂条件[J].化学工业与工程,2010,27(3): 189-194.
[11]张晓青,郝建安,司晓光,等.响应面法优化红球菌产生物表面活性剂的发酵条件[J].生物加工过程,2016,14 (4):10-13.
[12]马霞,聂麦茜,卢健,等.鼠李糖脂对铜绿假单胞菌NY3表面特性及其烃降解效率的影响[J].环境科学学报,2014,34(10):2462-2468.
[13]Zhang Y,Miller R M.Effect of a pseudomonas rhamnolipid biosurfactant on cell hudrophobicity and biodegradation of octadecane[J].Appl Environ Microlobiol,1994,60(6):2201-2106.
[14]姜萍萍,党志,卢桂宁,等.鼠李糖脂对假单胞菌GP3A降解芘的性能及细胞表面性质的影响[J].环境科学学报,2011,31(3):485-491.
[15]Owsianiak M,Szulc A,Chrzanowski L,et al.Biodegradation and surfactant-mediate biodegradation of dieselfuel by 218 microbial consortia are not correlated to cell surface hydrophobicity[J].Appl Microbiol Biotechnol,2009,84:545-553.
[16]Whyte L G,Slagmna S J,Pietrantonio F,et al.Physiological adaptations involved in alkane assimilation at a low temperature by Rhodococcussp.strain Q15[J]. Appl Environ Microbiol,1999,65(7):2961-2968.
[17]赵晴,张甲耀,陈兰洲,等.疏水性石油烃降解菌细胞表面疏水性及降解特性[J].环境科学,2005,25(5):132-136.
[18]郭利坚,苏荣国,梁康生,等.鼠李糖脂生物表面活性剂对多环芳烃的增溶作用[J].环境化学,2009,28(4): 510-514.
Effects of Biosurfactant Produced by Rhodococcus SY 095 on the Biodegradation of n-Hexadecane and the Cell Surface Hydrophobicity
ZHANG Xiao-Qing,HAO Jian-An,REN Hua-Feng, SI Xiao-Guang,WANG Jing*,ZHANG Yu-Shan
Institute of Seawater Desalination and Multi-purpose Utilization,SOA,Tianjin 300192,China
*Corresponding author,E-mail:Wang_nana@163.com
Objective:To study the effects of biosurfactant produced byRhodococcusSY095 on the biodegradation efficiency of n-hexadecane,the solubility of n-hexadecane,the growth of bacteria and the cell surface hydrophobicity.Methods:The cell biomass ofRhodococcusSY095,cell surface hydrophobicity and n-hexadecane content in different biosurfactant degradation systems were determ ined.Results:The results showed that the solubility of n-hexadecane was enhanced significantly by biosurfactant.The degradation of n-hexadecane was accelerated with biosurfactant.With 100 mg/L of biosurfactant,the average degradation rate of n-hexadecane in 96 h could reach 93.32%.The biosurfactant could promote the growth ofRhodococcusSY095.Compared with the control group,the biomass ofRhodococcusSY095 increased 2.7 times in 32 h by adding 300 mg/L biosurfactant.The cell surface hydrophobicity ofRhodococcusSY095 was enhanced significantly also by adding biosurfactant.The cell sur-face hydrophobicity reached 66.94%in logarithmic growth phase by adding 25 mg/L biosurfactant,while that the absence of biosurfactant was only 42.99%.Conclusion:The biosurfactants could enhance the cell surfaces hydrophobicity of SY095 and promoted the biodegradation of the n-hexadecane.
biosurfactant;solubility enhancement;biodegradation;growth promotion;cell surface hydrophobicity
Q939.9
A
1009-0002(2017)03-0328-05
10.3969/j.issn.1009-0002.2017.03.017
2016-12-06
海洋公益性行业科研专项(201305022);中央级公益性科研院所基本科研业务费专项(K-JBYWF-2015-G16,K-JBYWF-2015-T11,K-JBYWF-2016-T9)
张晓青(1983-),女,工程师,(E-mail)radicle@163.com
王静,(E-mail)Wang_nana@163.com
