2-叔丁基-4-溴-1-氟苯的合成
2017-06-09白雪梅
梁 亭,李 军,白雪梅,罗 强
(河北北方学院生命科学研究中心,河北 张家口 075000)
2-叔丁基-4-溴-1-氟苯的合成
梁 亭,李 军,白雪梅,罗 强
(河北北方学院生命科学研究中心,河北 张家口 075000)
以2-叔丁基苯胺为起始原料,经溴代和氟化脱重氮基反应等2步操作,得到2-叔丁基-4-溴-1-氟苯,合成的产物经核磁共振谱检测确定结构。该方法起始原料廉价易得、操作简便成熟,且该化合物是合成Raf抑制剂和治疗神经退行性疾病药物的重要中间体。
2-叔丁基-4-溴-1-氟苯;合成;重氮化
Raf抑制剂在临床治疗神经退行性疾病中表现出了良好的有效性和特异性,与传统细胞毒药物联合使用也取得了良好效果[1-4],2-叔丁基-4-溴-1-氟苯是合成Raf激酶抑制剂[5-6]和治疗神经退行性疾病药物[7]的重要中间体。目前,具有Raf抑制作用的化合物主要有L1[1]、L2[2](见图1)等,化合物
L1、L2一般利用2-叔丁基-4-溴-1-氟苯为原料,通过偶联的方法制得。L3[7](见图1)是治疗神经退行性疾病的化合物,对Alzheimer疾病(老年痴呆症)和Down’s综合征(唐氏综合征)都有一定效疗。我们使用廉价的起始原料,以较高收率制得了2-叔丁基-4-溴-1-氟苯,现报道如下。
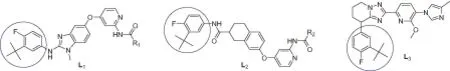
图1 化合物L1,L2,L3的结构
1 实验材料
1.1 仪器
BANTE智能磁力搅拌器(上海良星机电设备有限公司),SHB-ⅢA循环水式多用真空泵(上海豫康科教仪器设备有限公司),数显恒温水浴锅(HH-2江苏省金坛市荣华仪器制造有限公司),旋转蒸发器(RE-52AA上海亚荣生化仪器厂),2K-82B电热真空干燥箱(上海实验仪器厂有限公司),T-500电子天平(常熟双杰测试仪器厂),1H-NMR采用AV400 MHz核磁共振谱仪(德国Bruker公司),KQ-250B超声波清洗器(昆山市超声仪器有限公司)。
1.2 试剂
2-叔丁基苯胺(上海毕得医药科技有限公司),HPF65%水溶液(上海毕得医药科技有限公司),四丁基三溴化铵(TBA-Br3,Alfa Aesar),薄层层析硅胶G、柱层析硅胶(400目,500 g)购自青岛海洋化工有限公司,其它试剂如盐酸(分析纯)、无水乙醇(分析纯)、乙酸乙酯(分析纯)、氢氧化钠、四氢呋喃(THF,色谱纯)、甲苯(色谱纯)、亚硝酸钠(NaNO2)等购自北京化工厂。
2 方法与结果
2-叔丁基-4-溴-1-氟苯的合成主要包括:溴代和胺基重氮化2步反应,合成路线如图2所示。
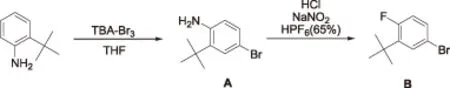
图2 2-叔丁基-4-溴-1-氟苯的合成路线
2.1 2-叔丁基-4-溴苯胺的合成
根据文献报道[8-9],在500 mL三口烧瓶中,将25 g(168 mmol)2-叔丁基苯胺溶解在250 mL四氢呋喃溶液中,此反应液搅拌冷却到0 ℃。81 g(168 mmol)四丁基三溴化铵分批加入到此反应液中,加入过程中反应温度保持在0~5 ℃(大约1 h),随后缓慢升至室温,反应30 min。TLC(石油醚/乙酸乙酯=1/8)跟踪原料消失,加水(250 mL)淬灭,乙酸乙酯萃取(3×250 mL)。有机相用饱和的硫代硫酸钠溶液(35.6%)洗涤(1 L),无水硫酸钠干燥。除去溶剂,粗产品(大约50 g)经柱层析纯化(梯度洗脱程序:石油醚,石油醚/乙酸乙酯=3/7),将洗脱剂放置在常温环境下,蒸发浓缩得到白色固体37.5 g(收率98%)。1H(400 MHz,DMSO-d6)δ:1.31(9 H,s),4.98(2 H,s),6.61(1 H,d,J=8.5),7.03(1 H,dd,J=8.5,2.4),7.10(1 H,d,J=2.4)。核磁谱图见图3-1。
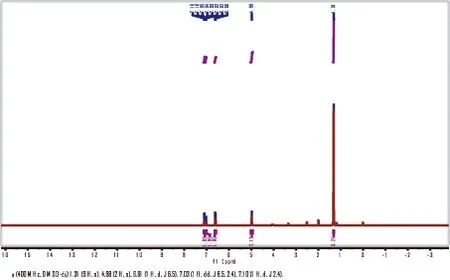
图3-1 2-叔丁基-4-溴苯胺的1H-NMR
2.2 2-叔丁基-4-溴-1-氟苯的合成
根据文献报道[10],向1 L三口烧瓶中依次加入36.6 g(161 mmol)2-叔丁基-4-溴苯胺、350 mL水和52.5 mL浓盐酸,将此混合物剧烈搅拌至固体溶解,使反应温度降至-10 ℃。将15.18 g亚硝酸钠(220 mmol)溶解在40 mL水中,再将该溶液缓慢滴入到上述混合液中,反应温度保持在-5~-10 ℃(大约1 h)。继续向该混合液中缓慢滴加46.5 mL六氟磷酸水溶液(65%),滴加结束后将此悬浊液剧烈搅拌1 h。TLC(石油醚/乙酸乙酯=1/8)检测原料消失,将悬浊物过滤、干燥后得到固体粗产品为重氮盐。将此重氮盐收集加热至120 ℃,在甲苯(300 mL)中剧烈搅拌反应1 h。待反应温度降至50 ℃左右时,将此反应液倒入冰水混合物(1 L)中,用乙酸乙酯(3×250 mL)萃取,有机相用无水硫酸钠干燥,粗产品经柱层析纯化(梯度洗脱程序:石油醚,石油醚/乙酸乙酯=1/5),将洗脱剂放置在常温环境下,蒸发浓缩得到无色油状物22.2 g(收率60%)。1H(400 MHz,DMSO-d6)δ:1.31(9 H,d,J=1.1),7.12(1 H,dd,J=12.4,8.5),7.36~7.48(2 H,m)。核磁谱图见图3-2。
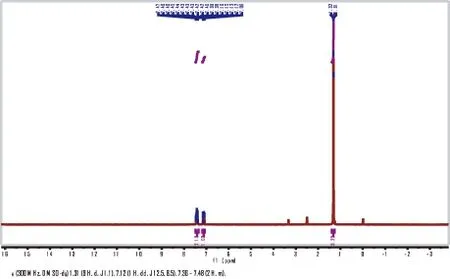
图3-2 2-叔丁基-4-溴-1-氟苯的1H-NMR
2.3 反应条件的优化
本实验对这两步的反应原料和反应时间等进行了系统优化,并最终确定了2-叔丁基-4-溴-1-氟苯各步合成的反应条件。
2.3.1 2-叔丁基-4-溴苯胺反应条件的优化

表1 原料投料比对2-叔丁基-4-溴苯胺收率的影响
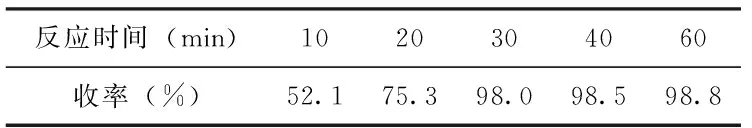
表2 反应时间对2-叔丁基-4-溴苯胺收率的影响
由实验结果可知当四丁基三溴化铵的用量增加到168 mmol时,产物收率达到98%,四丁基三溴化铵的用量继续增加,产物收率逐渐降低,可能因反应过程中生成双溴代物所致(见表1);当反应时间达到30 min时,产物收率达到98%,反应时间继续增加,产物收率趋于稳定(见表2)。因此2-叔丁基-4-溴苯胺合成优化的条件是:四丁基三溴化铵168 mmol,反应时间30 min。
2.3.2 2-叔丁基-4-溴-1-氟苯反应条件的优化
由实验结果可知,在得到粗产品重氮盐后,反应温度增加至120 ℃时,产物收率达到60%,反应温度继续增加,产物收率逐渐降低(见表3);反应时间达到60 min时,产物收率为60%,反应时间继续增加,产物收率趋于稳定(见表4)。因此2-叔丁基-4-溴苯胺合成优化的条件是:反应温度为120 ℃,反应时间为60 min。

表3 反应温度对2-叔丁基-4-溴-1-氟苯收率的影响
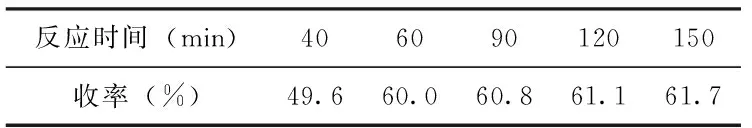
表4 反应时间对2-叔丁基-4-溴-1-氟苯收率的影响
3 结 论
以2-叔丁基苯胺为原料,经溴代后发生重氮化变氟反应得到中间体2-叔丁基-4-溴-1-氟苯,此方法简便易行,收率较高,而且该化合物是合成Raf抑制剂和治疗神经退行性疾病药物的重要中间体。
[1]Schulze A,Lehmann K,Jefferies H B,et al.Analysis of the transcriptional program induced by Raf in epithelial cells[J].Genes Dev,2001,15(8):981-994.
[2]Downward J.Targeting Ras signaling path ways in cancer therapy[J].Nat Rev Cancer,2003,3:11-22.
[3]Kasid U,Suy S,Dent P,Ray S,et al.Activation of Raf by ionizing radiation[J].Nature,1996,382:813-816.
[4]Yoon J H,Werneburg N W,Higuchi H,et al.Bile acids inhibit Mcl-1 protein turnover via an epidermal growth factor receptor Raf-1-dependent mechanism[J].Cancer Res,2002,62:6500-6505.
[5]Savithri R,Joelle S,Daniel P J.Substituted benzazoles and use thereof as inhibitors of Raf kinase:MX2006PA04236[P].2006-06-28.
[6]Emily C F,Matthew D,Alexandra G E,et al.Bicyclic compounds with kinase inhibitory activity:20070149533[P].2007-06-28.
[7]Noritaka K,Daisuke S,Koichi I,et al.Nitrogen-containing fused heterocyclic compounds and their use as beta amyloid production inhibitors:8754100[P].2014-06-17.
[8]Kasai S,McGee Jr K F.et al.Derivatives of N-acyl-N’-phenylpiperazine useful(inter alia)for the prophylaxis or treatment of diabetes:US2012071489[P].2012-03-22.
[9]Gege C,Kinzel O,Steeneck C,et al.Carboxamide or sulfonamide substituted nitrogen-containing 5-membered heterocycles as modulators for the orphan nuclear receptor RORγ:20150344423[P].2016-10-04.
[10]Ren P D,Liu,Y,Li,L S,et al.Heterocyclic compounds and uses thereof:20150158859[P].2015-06-11.
[责任编辑:李蓟龙 英文编辑:刘彦哲]
Synthesis of 2-tert-butyl-4-bromo-1-fluorobenzene
LIANG Ting,LI Jun,BAI Xue-mei,LUO Qiang
(Life Science Research Center,Heibei North University,Zhangjiakou,Heibei 075000,China)
The synthesis route started with 2-tert-butylbenzenamine,by way of two steps of -bromo,fluoro-de-diazotization and eventually obtained 2-tert-butyl-4-bromo-1-fluorobenzene.The structure of synthetic product was determined by nuclear magnetic resonance spectrum.The materials of this synthetic route are cheaper and easier to obtain,and the reaction procedure is also safer.This compound is the key intermediate to synthesize Raf inhibitors and a drug for the treatment of a neurodegenerative diseases.
2-tert-butyl-4-bromo-1-fluorobenzene;synthesis;diazotization
梁亭(1980-),男,硕士,助教。
TQ 243
A
10.3969/j.issn.1673-1492.2017.02.003
来稿日期:2016-09-07
