外源抗氧化剂硫脲基苯甲酰基硫脲衍生物的合成及促植物生长作用
2017-06-07段志芳李新昌
段志芳,邵 玲,李新昌
(肇庆学院生命科学学院,广东 肇庆 526061)
外源抗氧化剂硫脲基苯甲酰基硫脲衍生物的合成及促植物生长作用
段志芳,邵 玲,李新昌
(肇庆学院生命科学学院,广东 肇庆 526061)
以苯甲酸、芳氨基硫脲或单缩二氨基硫脲为原料,合成得到5个取代硫脲基苯甲酰基硫脲衍生物,经红外、质谱、核磁共振氢谱和元素分析确认了化合物的结构。测定其清除超氧自由基(O2-·)、羟自由基(·OH)和2,2- 二苯基-1-苦味酰基自由基(DPPH·)的活性及总还原能力,并与维生素C的活性进行比较。以水稻和黄瓜幼苗为试材,用生长测试法、超氧歧化酶(SOD)活性测定法以及过氧化物酶(POD)活性测定法研究这些化合物作为外源抗氧化剂对植物的生长调节作用。结果表明,在测定浓度下,这些化合物均具有清除自由基活性,并对水稻和黄瓜幼苗的生长发育有促进作用,且能激起SOD和POD的活力。
苯甲酰基硫脲;合成;抗氧化;植物生长调节
植物受到逆境胁迫时,会产生过量自由基,从而引发或加剧膜脂过氧化作用,造成细胞膜系统的损伤,严重时会导致植物细胞死亡[1-2]。应用外源抗氧化剂能减少自由基对有机体的毒害,提高植物的抗氧化能力,增强其抗逆能力,从而保护细胞[3-4],如周万海等[5]发现外源水杨酸(salicylic acid,SA)能调控苜蓿幼苗抗氧化保护系统,缓解盐胁迫对苜蓿植株的伤害。
硫脲类化合物和苯甲酰基硫脲类化合物具有杀菌、杀虫、除草和调节植物生长等生物活性[6-8],在农药学方面具有潜在的应用价值,如肖彩琴等[9]发现含酰基硫脲查尔酮衍生物对双子叶油菜籽的生长具有调节作用。目前尚未见对这两类化合物抗氧化能力的研究。
鉴于不同活性的基团聚集于同一分子中能明显改善化合物的生物活性,本试验采用亚结构连接法,将硫脲和苯甲酰基硫脲两种结构结合在同一分子中,以期实现活性成分的优化叠加,为新农药筛选提供先导化合物。以苯甲酸为起始原料,通过酰氯化、无溶剂条件下与硫氰酸铵反应得到相应的中间体苯甲酰基异硫氰酸酯,不经分离分别与芳氨基硫脲或单缩二氨基硫脲发生加成反应得到目标化合物,产物经EtOH或DMF/EtOH重结晶,采用红外、质谱、核磁共振氢谱和元素分析对其进行结构鉴定,通过测定清除超氧自由基(O2-·)、羟自由基(·OH)和DPPH·及总还原能力研究了它们的抗氧化活性,并以水稻和黄瓜幼苗为试材,测定它们对植物的生长调节作用,初步研究此类化合物抗氧化活性与调节植物生长作用之间的对应关系。合成化合物结构见图1。

图 1 合成化合物的结构
1 材料与方法
1.1 仪器和试剂
X-4显微熔点测定仪(北京,温度计未校正);日本岛津UV-2550型紫外可见分光光度计;德国Bruker AVANCE AV 400 超导脉冲傅里叶变换核磁共振谱仪;德国Elementar varioEL cube型元素分析仪;美国Nicolet FT-IR 6700型红外光谱仪(KBr压片);美国Thermo公司DSQ质谱仪(EI);上海HH·B11·420-BS恒温培养箱。二氯亚砜重蒸后使用,其他试剂均为国产分析纯试剂,直接使用。
1.2 目标化合物的合成
苯氨基硫脲、对甲苯氨基硫脲、对氯苯氨基硫脲参照文献[10]制备;苯乙酮单缩二氨基硫脲、对氯苯甲醛单缩二氨基硫脲参照文献[11]制备;苯甲酰氯参照文献[12]制备。
将5 mmol苯甲酰氯、7.5 mmol硫氰酸铵和1滴PEG400置于玻璃研钵中,混和均匀,室温研磨5 min后,加入4.5 mmol芳氨基硫脲或单缩二氨基硫脲,继续研磨10 min,固体用蒸馏水洗涤多次,再用无水乙醇洗涤,晾干后用EtOH或DMF/ EtOH重结晶,得化合物1。
N-苯硫脲基-N′-苯甲酰基硫脲(1a):白色固体粉末,产率28.71%,m.p.252~254℃;1H NMR(400MHz,DMSO-d6)δ:13.73(s,1H,PhNH),11.77(s,1H,CONHCS),10.76(s,1H,CSNH),10.38(s,1H,NHCS),6.95~8.11(m,10H,Ar-H);IR(KBr)ν:3341、3211、3111(NH),3027,3004,1678(C=O),1604,1510,1447,1322,1223、1170(C=S),1087,746,695;EI-MS m/z (%):330(M+,1.01),296(2.81),135(44.02),105(100),77(67.04),65(3.99),51(10.06);Anal. calcd. for C15H14N4OS2:C 54.54,H 4.24,N 16.97;found C 54.31,H 4.19,N 16.85。
N-对甲苯硫脲基-N′-苯甲酰基硫脲(1b):白色固体粉末,产率33.64%,m.p.247~249℃;1H NMR(400MHz,DMSO-d6)δ:13.71(s,1H,PhNH),11.75(s,1H,CONHCS),10.64(s,1H,CSNH),10.29(s,1H,NHCS),7.17~7.99(m,9H,Ar-H),2.29(s,3H,-CH3);IR(KBr)ν:3209、3152(NH),3014,1671(C=O),1579,1528,1452,1212、1163(C=S),1092,842,717,695,670;EI-MS m/z (%):344(M+,0.07),175(11.69),149(39.01),102(17.11),105(100),77(57.49),51(10.85);Anal. calcd. for C16H16N4OS2:C 55.81,H 4.65,N 16.28;found C 55.67 ,H 4.49,N 16.15。
N-对氯苯硫脲基-N′-苯甲酰基硫脲(1c):淡黄色固体粉末,产率36.10%,m.p.278~280℃;1H NMR(400MHz,DMSO-d6)δ:13.73(s,1H,PhNH),11.78(s,1H,CONHCS),10.86(s,1H,CSNH),10.46(s,1H,NHCS),7.39~7.99(m,9H,Ar-H);IR(KBr)ν:3334、3199、3157、3093(NH),3066,3007,1669(C=O),1603,1526,1450,1210、1161(C=S),1089,838,716,694,667;EI-MS m/z (%):364(M+,0.02),330(3.84),237(2.82),195(9.67),177(3.39),169(34.05),122(14.71),111(17.82),105(100),77(57.49),65(3.94),51(10.85);Anal. calcd. for C15H13ClN4OS2:C 49.38,H 3.57,N 15.36;found C 49.88,H 3.55,N 15.54。
N-对氯苯甲醛缩氨基硫脲基-N′-苯甲酰基硫脲(1d):白色固体粉末,产率68.55%,m.p.210~212℃;1H NMR(400MHz,DMSO-d6)δ:13.50(s,1H,NHC=S),12.35(s,1H,C=SNHC=O),11.95(s,1H, =NNH),11.07(s,1H,C=SNH),8.16(s,1H,CH=N),7.53~8.01(m,9H,Ar-H);IR(KBr) ν:3251、3158(NH),3004,1679(C=O),1594、1518、1459(Ar),1234、1166(C=S),1087,830,711,670;EI-MS m/z (%):391(M+,0.09),228(3.14),196(7.77),138(10.70),122(6.00),111(19.10),105(100),89(5.99),77(50.94),51(10.24);Anal. calcd. for C16H14ClN5OS2:C 49.03,H 3.58,N 17.88;found C 49.29,H 3.43,N 17.96。
N-苯乙酮缩氨基硫脲基-N′-苯甲酰基硫脲(1e):白色固体粉末,产率76.61%,m.p.198~200℃;1H NMR(400MHz,DMSO-d6)δ:13.90(d,J=8.0Hz,1H,NHC=S),11.99(s,1H,C=SNHC=O),11.40(s,1H,=NNH),11.26(d,J=7.8Hz,1H,C=SNH),7.45~8.02(m,10H,Ar-H),2.41(s,3H,CH3);IR(KBr) ν:3433、3210、3084、3054(NH),3022,1668(C=O),1600、1520、1459(Ar),1234、1167(C=S),1087,850,713,691;EI-MS m/z (%):371(M+,0.06),118(12.76),105(100),77(60.97),51(11.43);Anal. calcd. for C17H17N5OS2:C 54.99,H 4.58,N 18.87;found C 55.08,H 4.32,N 18.73。
1.3 抗氧化活性试验
新化合物抗氧化活性试验参照文献[13-14]进行,试样浓度配制为1.0 mg/mL二甲亚砜溶液,其中羟自由基由Fe2+-H2O2-水杨酸体系产生,超氧自由基采用碱性条件下邻苯三酚的自氧化产生,DPPH·自由基用无水乙醇配制使用,还原能力测定采用铁氰化钾还原法,并与常用抗氧化剂维生素C进行比较。
1.4 促植物生长试验
取新化合物分别用少量二甲亚砜溶解,加入一滴乳化剂,用蒸馏水稀释至10 ppm,空白对照用蒸馏水。对水稻和黄瓜幼苗的生长活性测试分别用生长测试法[15]、SOD活性测定法[16-17]以及POD活性测定法[18-19],并与植物生长调节剂吲哚乙酸(IAA)进行比较。
2 结果与分析
2.1 目标化合物的合成
将苯甲酰氯和硫氰酸铵在无溶剂条件下与催化剂PEG-400室温研磨,然后加入芳氨基硫脲或单缩二氨基硫脲反应得到相应产物,反应过程中不使用有机溶剂,避免资源浪费和环境污染,具有操作简单、反应条件温和、环境友好等特点,为目标化合物的合成提供了一条绿色途径。
2.2 目标化合物的谱图分析
2.2.1 目标化合物的红外谱图分析 以化合物1c的红外光谱为例,在3 066~3 334 cm-1处出现中等强度的吸收峰或强的宽峰,为 N-H伸缩振动特征吸收峰。在1 669 cm-1处出现的强吸收峰为C=O 的伸缩振动特征吸收峰。在3007 cm-1左右出现的吸收峰为苯环的 C-H 伸缩振动吸收峰,1 603、1 489、1 450 cm-1左右出现的峰为苯环骨架振动吸收峰。在 1581、1526 cm-1处出现的强、宽吸收峰为C-N 的伸缩振动和-NH-弯曲振动吸收峰,在1210、1161 cm-1处出现的中等强度吸收峰为 C=S 的伸缩振动吸收峰,1265 cm-1处出现的强吸收峰为C-N-C 反对称伸缩振动吸收峰,1090 cm-1处出现的中等强度吸收峰为C-N-C对称伸缩振动吸收峰.
2.2.2 目标化合物的氢核磁共振谱图分析 以化合物1c的核磁氢谱为例,可以看到4个N-H的共振吸收峰(单峰),与其化学环境相符合。O=CNHC=S中N-H中的氢原子处在-C=S-的正屏蔽区,化学位移比NHC=S位于高场。由于-NHCS-中的H原子易与分子中的羰基(C=O)上的氧原子形成六元环的分子内氢键,产生较强的去屏蔽效应,使H原子电子云密度降低,其抗磁性屏蔽效应减小,从而导致核磁共振信号移向低场。
2.2.3 目标化合物的质谱图分析 以化合物1c的质谱图为例,该化合物的分子离子峰很弱,其他离子峰可以得到较好的解释,其中质荷比为330的离子峰形成的可能途径见图2。
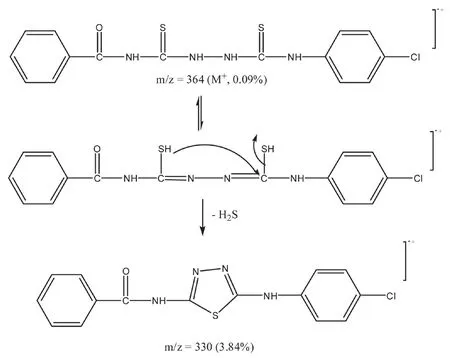
图2 质荷比为330的离子峰形成的可能途径

表1 化合物 1a~1e和维生素C在1.0 mg/mL浓度下抗氧化活性
2.3 目标化合物体外抗氧化活性
测定了新化合物清除超氧自由基(O2-·)、羟自由基(·OH)和2,2-二苯基-1-苦味酰基自由基(DPPH·)的活性及总还原能力,并同维生素C(Vc)抗氧化活性进行了比较。试验过程中选用了多个浓度,结果发现低浓度时,清除自由基效果较弱,高浓度时化合物在测定体系中的溶解度小,清除自由基效果也较弱,为便于比较,选用浓度为1.0 mg/mL时的试验结果。从表1可以看出,这些化合物均具有清除自由基活性,其中N-对氯苯硫脲基-N′-苯甲酰基硫脲(1c)和N-对氯苯甲醛缩氨基硫脲基-N′-苯甲酰基硫脲(1d)清除超氧自由基(O2-·)、羟自由基(·OH)及总还原能力均较强,可以作为抗氧化剂使用,但其抗氧化活性弱于Vc。
2.4 目标化合物促植物生长活性
为测定新化合物对植物的生物活性作用,分别以水稻和黄瓜幼苗为试验材料,用la~le 5个化合物所配制的溶液进行一个星期培养,然后用生长测试法、超氧歧化酶(SOD)活性测定法以及过氧化物酶(POD)活性测定法测定相应指标,结果如图3~6所示。
图3、图4生长测试法结果表明,用5种目标化合物溶液培养的水稻和黄瓜幼苗的重量、株高以及根长明显比蒸馏水培养的有所增加。由此可知,这5种新型的硫脲基苯甲酰基硫脲化合物对水稻和黄瓜幼苗的生长均有促进作用,其中化合物N-对氯苯硫脲基-N′-苯甲酰基硫脲(1c)和化合物N-对氯苯甲醛缩氨基硫脲基-N′-苯甲酰基硫脲(1d)对水稻幼苗的作用较为明显,化合物N-对氯苯硫脲基-N′-苯甲酰基硫脲(1c)和化合物N-苯乙酮缩氨基硫脲基-N′-苯甲酰基硫脲(1e)对黄瓜幼苗的作用是较为明显的。
根据图5、图6结果,用5种目标化合物溶液培养的水稻和黄瓜幼苗SOD、POD总活性均明显提高。其中化合物N-对氯苯硫脲基-N′-苯甲酰基硫脲(1c)和化合物N-对氯苯甲醛缩氨基硫脲基-N′-苯甲酰基硫脲(1d)对水稻幼苗SOD、POD的增强作用较为明显,化合物N-对氯苯硫脲基-N′-苯甲酰基硫脲(1c)和化合物N-苯乙酮缩氨基硫脲基-N′-苯甲酰基硫脲(1e)对黄瓜幼苗SOD、POD的增强作用较为明显,且超过IAA(吲哚乙酸)的效果。

图3 目标化合物对水稻幼苗根长、株高和重量的作用
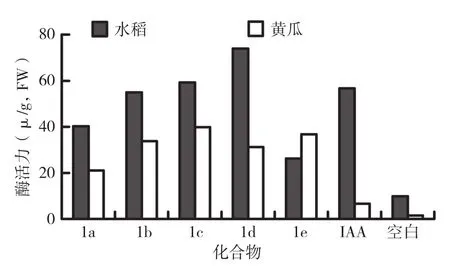
图5 目标化合物对水稻和黄瓜幼苗SOD活性的影响

图6 目标化合物对水稻和黄瓜幼苗POD活性的影响
由以上试验结果可以看出,5个新化合物对水稻和黄瓜幼苗的生长发育均有促进作用,且能增强幼苗体内SOD和POD的活力,其中化合物N-对氯苯硫脲基-N′-苯甲酰基硫脲(1c)对水稻和黄瓜幼苗促生长活性作用均较为明显。
3 结论与讨论
植物生长调节剂是用于调节植物生长发育的一类农药,使用合成的化学调节剂来控制植物生长已成为一种新的农业技术,被广泛应用于大田作物、经济作物、果树、林木、蔬菜、花卉等各个方面,其研究及在生产上的应用是近代植物生理学及农业科学的重大进展之一。此类物质在研发过程中,因涉及到植物的生长过程,所需周期较长,存在不足之处。本论文首次研究苯甲酰基硫脲类外源抗氧化剂对植物生理特性的影响,在无溶剂条件下由苯甲酰基异硫氰酸酯与芳氨基硫脲或单缩二氨基硫脲发生加成反应得到5个相应的硫脲基苯甲酰基硫脲衍生物,具有操作简单、反应条件温和和环境友好等特点,为此类型化合物提供了一条绿色合成途径。经红外、质谱、核磁共振氢谱和元素分析确认了新化合物的结构。体外测定了这些新化合物清除超氧自由基(O2-·)、羟自由基(·OH)和DPPH·自由基的活性及还原能力。并采用生长测试法、SOD活性测定法以及POD活性测定法比较它们对水稻和黄瓜幼苗的促生长作用。结果表明,在测定浓度下,这些化合物均具有体外清除自由基活性,其中N-对氯苯硫脲基-N′-苯甲酰基硫脲(1c)和N-对氯苯甲醛缩氨基硫脲基-N′-苯甲酰基硫脲(1d)清除超氧自由基(O2-·)、羟自由基(·OH)及总还原能力均较强。这些化合物对水稻和黄瓜幼苗的生长均有促进作用,并能提高SOD和POD的活性,其中化合物N-对氯苯硫脲基-N′-苯甲酰基硫脲对二者作用均较为明显(1c)。结果表明,该类化合物体外抗氧化能力与促植物生长作用之间可能有一定相关性。该研究结果既提供了一种绿色合成方法,为设计与合成活性更高的酰基硫脲化合物分子提供理论依据,又可以通过体外抗氧化试验结果筛选出有效化合物,用于植物生长调节剂的开发,可以减轻试验量,缩短农药开发周期。
[1]徐萍,李进,吕海英,等. 干旱胁迫对银沙槐幼苗叶绿体和线粒体超微结构及膜脂过氧化的影响[J]. 干旱区研究,2016,33(1):120-130.
[2]张海平,程小爱. 水涝胁迫下欧李丙二醛和氧自由基的变化[J]. 天津农业科学,2015,21(12):15-20.
[3]郝敬虹,易旸,尚庆茂,等. 干旱胁迫下外源水杨酸对黄瓜幼苗膜脂过氧化和光合特性的影响[J],应用生态学报,2012,23(3):717-723.
[4]江绪文,李贺勤,王建华. 盐胁迫下黄芩种子萌发及幼苗对外源抗坏血酸的生理响应[J]. 植物生理学报,2015,51(2):166-170.
[5]周万海,师尚礼,寇江涛. 外源水杨酸对苜蓿幼苗盐胁迫的缓解效应[J]. 草业学报,2012,21(3):171-176.
[6]Mohamed N A,El-Ghany N A A,Fahmy M M. Novel antimicrobial superporous cross-linked chitosan/pyromellitimide benzoyl thiourea hydrogels[J]. Int J Biol Macromol,2015,82(1):589-598.
[7]Sunduru N,Salin O,Åsa G,et al. Design,synthesis and evaluation of novel polypharmacological antichlamydial agents[J]. Eur J Med Chem,2015,101(8):595-603.
[8]Zhang Q,Zhao B,Song Y,et al. Synthesis and biological activity of N-aroyl (aryloxyacetyl)-N′-ferrocenyl thiourea derivatives[J]. Heteroatom Chem,2015,26(5):348–354.
[9]肖彩琴,傅颖. 新型含酰基硫脲查尔酮衍生物的合成及其植物生长调节活性[J]. 合成化学,2015,23(9):785-790.
[10]钟蒙,刘兆鹏,徐丽君,等. 腺嘌呤衍生物的合成及体外抗疱疹病毒活性[J]. 药学学报,1996,31(11):837-843.
[11]周琳,王麟生,王海霞,等. 单缩和双缩二氨基硫脲类化合物的合成与表征[J]. 化学通报,2006(5):355-358.
[12]左明明,周健民,胡国辉,等. 肉桂酰胺类化合物的合成及其体外抗肿瘤活性[J]. 化学世界,2012(4):239-242.
[13]陈红梅,谢翎. 响应面法优化半枝莲黄酮提取工艺及体外抗氧化性分析[J]. 食品科学,2016,37(2):45-50.
[14]张耀雷,黄立新,张彩虹,等. 壶瓶枣多糖的分离及其抗氧化活性[J]. 中成药,2015,37(6):1267-1271.
[15]李亮,武洪庆,马朝阳,等. 印度梨形孢促进蒺藜苜蓿生长及其提高耐盐性研究[J]. 微生物学通报,2015,42(8):1492-1500.
[16]张蜀秋. 植物生理学实验技术教程[M]. 北京:科学出版社,2011.
[17]孔四新,李海奎,王保民,等. 铅胁迫对冬凌草抗氧化酶系统和生长的影响[J]. 中草药,2015,46(18):2788-2793.
[18]唐探,姜永雷,张瑛,等. 铅、镉胁迫下云南樟幼苗的生理特性变化[J]. 江苏农业科学,2015,43(1):199-201.
[19]廖金花. 小麦种子过氧化物酶活性分析[J]. 中国农学通报,2015,31(21):123-129.
(责任编辑 白雪娜)
Synthesis of thiourea benzoylthiourea derivatives as exogenous antioxidants and their plant growth- promoting effects
DUAN Zhi-fang,SHAO Ling,LI Xin-chang
(College of Life Science,Zhaoqing University,Zhaoqing 526061,China)
Five thiourea benzoylthiourea derivatives were synthesized by using benzoic acid,arylthiosemicarbazide or thiosemicarbazones as raw materials. Their structures were characterized by UV,IR,1H-NMR and MS. Their scavenging effects on the superoxide radical(O2-·),hydroxyl radical(·OH) and DPPH· radical and their total reduction capacity were compared with ascorbic acid(Vc) as the reference material. As exogenous antioxidants,their promoting effects on plant growth of rice and cucumber were tested by the methods of growth test,superoxide dismutase(SOD) and peroxidase(POD) activity determination. The results showed that at the determinated concentration,these compounds all had scavenging effects on these radicals,and also could promote the growth of rice and cucumber,at the same time increase their SOD and POD activity.
benzoylthiourea; synthesis; antioxidant activity; plant growth regulator
S482.8
A
1004-874X(2017)03-0113-07
2016-12-29
广东省科技计划项目(2014A030304070)
段志芳(1973-),女,博士,副教授,E-mail:zhaoqing606@126.com
段志芳,邵玲,李新昌.外源抗氧化剂硫脲基苯甲酰基硫脲衍生物的合成及促植物生长作用[J].广东农业科学,2017,44(3):113-119.
