南美白对虾多酚氧化酶的提取及其性质研究
2017-06-07段秀霞施文正邱伟强汪之和
段秀霞,施文正,邱伟强,方 兵,汪之和,江 敏
(1.上海海洋大学食品学院/上海水产品加工及贮藏工程技术研究中心,上海 201306;2.上海海洋大学水产与生命学院,上海 201306)
南美白对虾多酚氧化酶的提取及其性质研究
段秀霞1,施文正1,邱伟强1,方 兵1,汪之和1,江 敏2
(1.上海海洋大学食品学院/上海水产品加工及贮藏工程技术研究中心,上海 201306;2.上海海洋大学水产与生命学院,上海 201306)
以南美白对虾为对象,研究了多酚氧化酶(PPO)分离提取工艺及其生化特性。在单因素试验基础上,采用响应面试验优化了料液比、提取液pH值和浸提时间等因素提取南美白对虾PPO的工艺,并对PPO的生化性质进行分析。结果表明:液料比为2∶1、提取液体系pH值为8.0、浸提时间为3 h等条件下,提取的PPO具有最大酶活力为94.8 A/min·mL,所得回归模型显著(P<0.0001),方程拟合性好(R2=0.9762),可用于预测南美白对虾中PPO的提取;PPO酶促反应动力学方程符合米氏方程,米氏常数Km为30.322 mmol/L,Vmax为0.281 A/min。PPO性质研究将为南美白对虾黑变抑制提供理论指导。
南美白对虾;多酚氧化酶(PPO);响应面优化;反应动力学
我国是虾类养殖大国,2015年淡水养殖产量为186.74万t,比上年增长5.91%,其中南美白对虾养殖产量为73.15万t[1]。南美白对虾具有肉质鲜美、营养价值高等特点,是我国养殖的重要虾品种[2]。但是,南美白对虾在贮藏中较易发生黑变,目前研究认为这主要是因为在酶作用下,酪氨酸或其衍生物等水溶性色原素物质被氧化形成黑色素[3]。国内外大量研究表明,虾体黑变与微生物作用无关,而与多酚氧化酶(Polyphenol oxidase,PPO)作用有关,PPO是一类含铜的氧化还原酶,广泛存在于自然界中[4-6]。在有氧的条件下,酚酶会催化酚类物质形成黑色醌类化合物[7]。研究发现,PPO是生物体合成黑色素所需的关键酶[8]。
目前,国外研究一般采用磷酸盐缓冲液提取、以L-3,4-二羟基苯丙氨酸(L-3,4-dihydroxy-phenylalanine,L-DOPA)作为酶的底物进行PPO活性测定[9],而国内研究者大多采用Tris-HCl缓冲液提取、以邻苯二酚作为反应底物[10]。20世纪90年代以来,国内外学者对不同原料中酚氧化酶的提取和纯化进行了一系列研究,包括从植物锡兰醋栗[11]和荨麻叶[12]中提取多酚等。目前为止,国内对虾体中PPO的分离提取工艺优化及其酶动力学性质的报道也较少。黄万有等[13]研究发现,凡纳滨对虾壳部与虾肉均表现为头部的PPO活性最大,所以本试验选择虾头作为研究对象,采用磷酸盐缓冲液浸提法对南美白对虾中PPO提取分离,并用十二烷基聚乙二醇醚(Brij-35)作为表面活性剂、L-DOPA作为酶反应底物,确定较优的提取工艺条件,为进一步开展虾体防褐变研究提供理论依据。
1 材料与方法
1.1 试验材料
南美白对虾购于上海市浦东新区古棕路农贸市场,选取鲜活、大小均一、完整、体重在15.5(±1.0)g/尾的个体,流水清洗加冰猝死后用速冻机速冻,置于-80℃冻藏,待用。
主要试剂:磷酸二氢钠(分析纯)、磷酸氢二钠(分析纯)、氯化钠(分析纯)、L-DOPA(分析纯)、Brij-35(分子生物学用)。
仪器设备:H2050R台式高速冷冻离心机(湘仪离心机仪器有限公司)、AUW320电子分析天平(梅特勒-托利多仪器有限公司)、超低温保存箱(青岛海尔股份有限公司)、UV-2450紫外分光光度计(日本津岛公司)、均质机(上海昂尼仪器仪表有限公司)、雷磁PHS-3C-型pH计(上海仪电科学仪器股份有限公司)、DC-1015节能型智能恒温槽(宁波新芝生物科技股份有限公司)。
1.2 试验方法
1.2.1 测定波长优选 以L-DOPA为底物采用分光光度法测定PPO的活性[14]。试验方法经修正为:在试管中加入1 mL 15 mmol/L的L-DOPA(用去离子水配制)、1 mL 0.05 mol/L磷酸盐缓冲液(pH 6.0)、1 mL去离子水,需要提前在25℃恒温水浴10 min。倒入石英比色皿中先调零再加入0.3 mL上述粗酶液混合,用UV-2450紫外-可见分光光度计在260~700 nm波长范围内每隔2 nm进行扫描,确定PPO生成产物的最大吸收波长(λmax)。
1.2.2 PPO的提取与测定 PPO的提取在吴亮亮等[13-16]方法的基础上进行修改,称取半解冻的带壳虾头5 g,与10 mL(液料比为2∶1)0.05 mol/L磷酸盐缓冲液(0.5 mol/L NaCl、0.2% Brij35,pH 7.5)混匀于离心管中,在冰水(4± 1℃)中静置3 h,再于4℃、12 000 r/min下冷冻离心30 min。取其上清液,即得PPO粗酶液。将上述粗酶液置于25℃恒温水浴,于最大吸收波长下检测多巴色素的生成。在UV-2450紫外分光光度计于最大吸收波长下调0,选择紫外-可见分光光度计动力学模块,先调零再直接加入PPO粗酶液0.3 mL于比色皿中,该混合液作为酶反应体系,混匀后立即测其吸光度,每隔10 s记录1次,共测定10 min,选取吸光度A直线上升区间数据进行计算酶活,此阶段属于初速率反应的酶促反应阶段,进而计算酶促反应速率。
1.2.3 单因素试验设计 (1)最适料液比的确定:称取半解冻的带壳虾头5 g与不同体积0.05 mol/L磷酸盐缓冲液(0.5 mol/L NaCl、0.2% Brij35,pH 7.5)混匀,设置液料比为1∶1、2∶1、3∶1、4∶1、5∶1,具体实验操作见1.2.2。(2)最适pH值的确定:称取半解冻的带壳虾头5 g,按上述最适料液比添加0.05 mol/L pH值不同的缓冲液混匀,设置磷酸盐缓冲液pH值为6.0、6.5、7.0、7.5、8.0、8.5、9.0,具体实验操作见1.2.2。(3)最适浸提时间的确定:称取半解冻的带壳虾头5 g,在上述最佳料液比和pH值条件下与0.05 mol/L磷酸盐缓冲液混匀,在4(± 1)℃静置不同时间(设置作用时间为1、2、3、4、5 h),具体实验操作见1.2.2。
1.2.4 响应面法试验设计 根据单因素试验结果,采用Box-Benhenken Design设计试验方案,选择液料比、体系pH值和浸提时间3个对PPO活力影响较大的因素作为响应面设计的变量,以酶活力Y作为响应值,运用Design Expert 8.0软件建立数学回归模型进行优化PPO的提取工艺,试验因素和水平设计如表1所示。

表1 响应面分析实验因素与水平
1.2.5 底物浓度与反应速率的关系及酶促反应动力学研究 在PPO的最适提取工艺条件下,测定不同底物浓度(2、4、6、8、10、12、14、16、18、20 mmol/L L-DOPA溶液)条件下PPO的酶促反应速率,然后采用双倒数作图法作图,并计算出酶促动力学常数Km、Vmax值,具体实验操作见1.2.2。
试验数据采用Office 2013、Originpro 8.5和Design Expert 8.0软件进行分析处理。
2 结果与分析
2.1 PPO测定波长确定
从图1可以看出,以L-DOPA为底物,反应生成产物有两个吸收峰,在477 nm处有一个较宽峰,而在305 nm处有一个细窄峰。477 nm处的吸收峰与José等[14]研究南美白对虾PPO时选择的最适吸收波长相近,这个可能是因为PPO氧化L-DOPA生成产物醌类物质所引起的。305 nm在紫外光区域,这个吸收峰可能是由一些未参与反应的底物产生。由此可见,PPO作用产物的最大吸收波长为477 nm,因此本试验选择477 nm作为反应产物的测定波长。
图1 PPO与底物L-DOPA作用产物的吸收曲线
2.2 南美白对虾PPO活力单因素试验
2.2.1 液料比对PPO活力的影响 从图2可以看出,PPO活力随着液料比的增大先上升后下降。磷酸盐溶液在提取过程中主要作用是溶解细胞膜,使蛋白质溶解,PPO活力下降可能是因为酶有一定的结合位点,与底物接触会达到一定的反应极限,当底物量持续增加就会阻碍反应的继续,或者是因为离子具有水合作用,降低了蛋白质的溶解度。当液料比为2∶1时,PPO活力最大为27.6 A/(min·mL)。因此,后续试验选择液料比2∶1。
图2 液料比对PPO活力的影响
2.2.2 浸提时间对PPO活力的影响 从图3可以看出,随着浸提时间的增加,PPO活力先升高再逐渐降低,当浸提时间为3 h时,PPO活力表现为最大(28.8 A/min·mL)。这可能是因为在提取前期PPO活力与浸提时间是成正比例增加的,但当时间过长时,细胞中的蛋白质被溶解出来,部分蛋白质凝聚沉淀就有可能出现,导致PPO活力降低。结合上述试验结果,后续试验选择浸提时间为3 h。
2.2.3 pH值对PPO活力的影响 从图4可以看出,PPO活力随着pH值的增加呈先逐渐升高再下降的趋势,当pH为8.0时达到最大值46.8 A/(min·mL)。当pH值在6.0~7.0,PPO活力较小且不稳定,这可能是因为在低酸性条件下酶活力不稳定;当pH值在7.0~8.0时,PPO活力随着pH值的增加逐渐升高,可能是因为蛋白质结构发生了改变,蛋白质分子间的部分氢键被破坏,从而促使酶蛋白溶解,使酶活性增强;但当pH值持续升高时,PPO活力慢慢降低,可能是因为碱性条件过强,使酶蛋白变性水解,使酶活力下降。因此,浸提液pH值选择8.0较为合适。
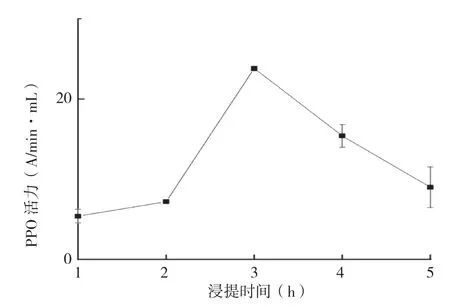
图3 浸提时间对PPO活力的影响

图4 pH值对PPO活力的影响
2.3 南美白对虾PPO活力响应面试验
根据单因素试验确定的液料比为2∶1、pH值为8.0、浸提时间为3 h的结果,确定合适的因素和水平,采用Box-Benhenken Design设计响应面试验方案,17组响应面试验设计方案及结果见表2,采用Design Expert 8.0软件对结果进行方差分析,结果见表3。
根据相应的方案进行实验,将相应方案得到的17组数据进行多元回归拟合,得到以酶活力Y为目标函数的二次回归方程模型:

响应面软件方差分析结果(表3)显示,一次项A的回归系数差异显著,说明液料比对提取的PPO活力差异显著;一次项中B的回归系数差异极显著,说明pH值对提取的PPO活力的影响极显著;一次项中C的回归系数差异较为显著,说明浸提时间对提取的PPO活力有较显著影响;交互项中AB、AC的回归系数显著,说明液料比与pH值、液料比与浸提时间的交互项对PPO活力有显著影响。从方差分析显著性检验结果可以看出,该模型的回归系数差异极显著,失拟项系数不显著,表明该方程对实验有较好的拟合性。
运用响应面设计软件,参照回归方程做出响应面曲线,根据响应面曲线的形状,分析考察浸提溶液体系液料比、pH值、浸提处理时间对PPO活力的影响,结果见图5。由图5可知,液料比、浸提时间和pH值的交互作用都较显著。运用软件进行分析优化,得到提取PPO的理论最优工艺条件为液料比2.88∶1、pH值8.20、浸提时间3.39 h,该条件下PPO活力为90.7 A/(min·mL),提取PPO的回归模型显著性较好(R2=0.9762),拟合性也较好。考虑到实验的实际可操作性,将上述提取参数修正为液料比2∶1、pH值8.0、浸提时间3 h。本实验测得的南美白对虾PPO活力比吕艳芳等[16]研究中测得的PPO活力〔47.18 A/(min·mL)〕提高了近1倍。
在修正方案的条件下对实验结果进行验证,做3组平行,提取的PPO活力为94.8 A/(min·mL),与预测值相比误差为4.52%,两者非常接近,表明该工艺稳定可行,可用于预
测PPO的提取效果。
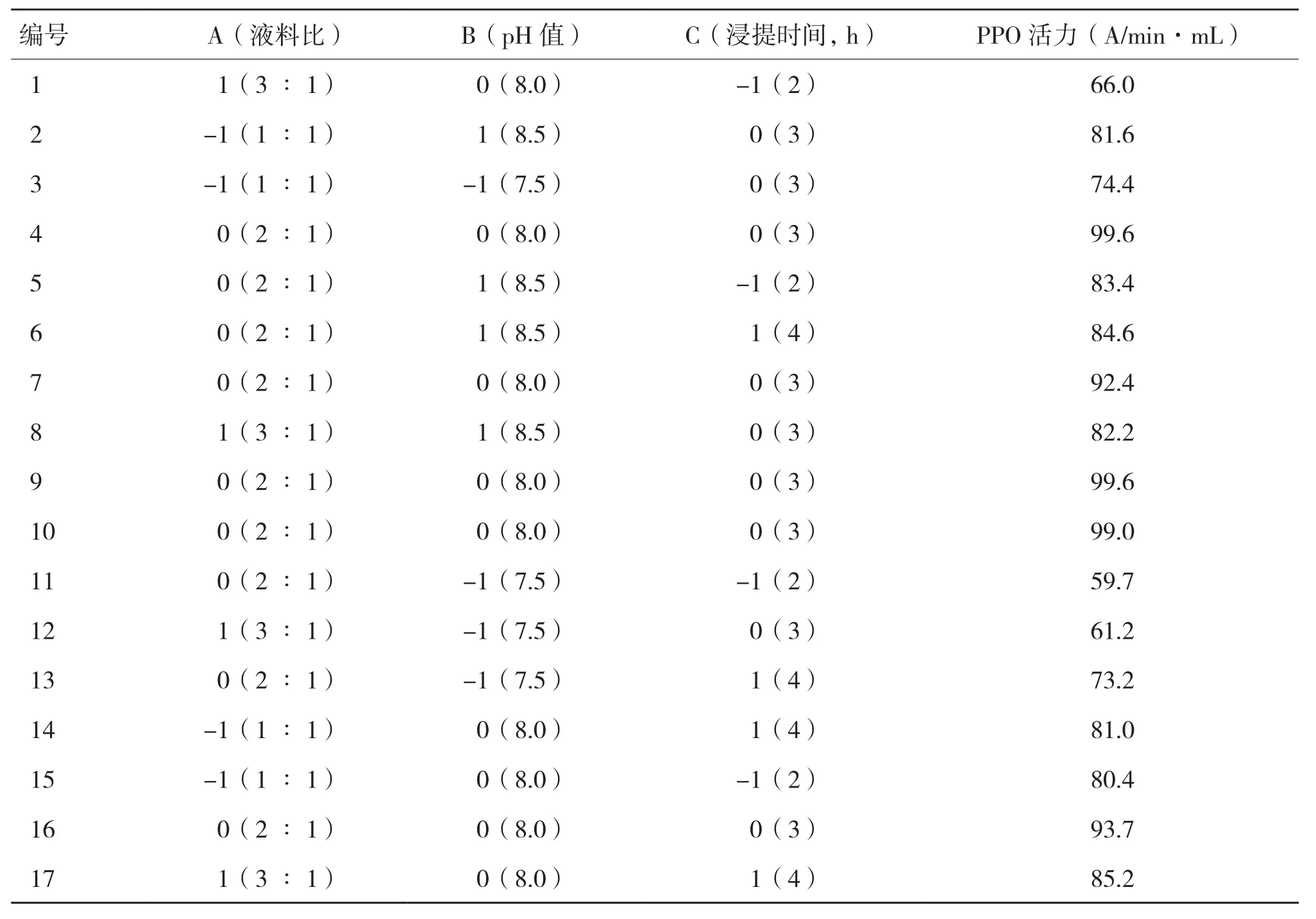
表2 响应面设计方案及结果
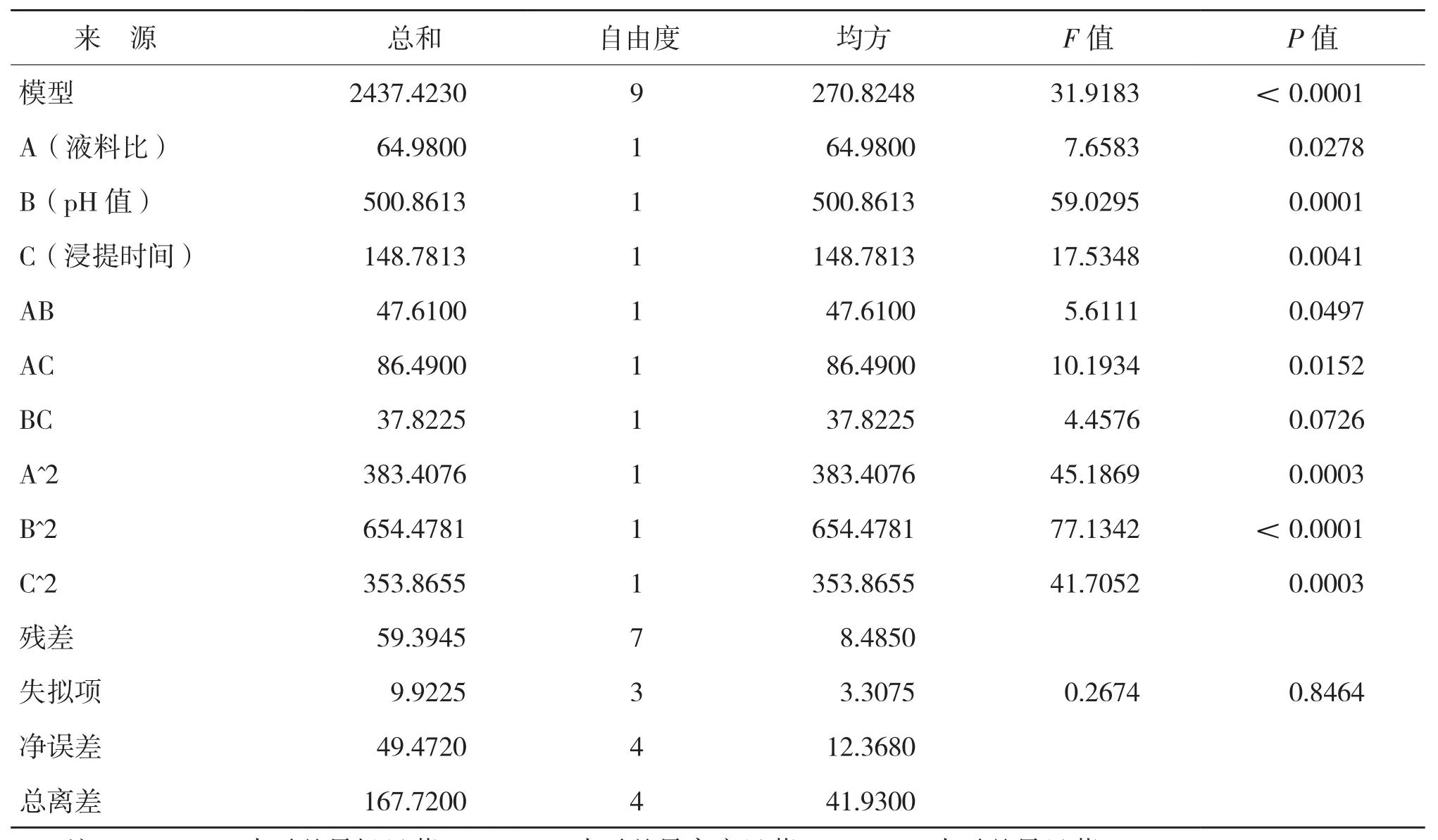
表3 影响PPO活力的方差分析

图5 液料比、pH值和浸提时间对PPO活力的影响
2.4 底物浓度与反应速率的关系及酶促反应动力学试验
从图6可以看出,底物浓度与PPO酶促反应速率有着直接关系,当底物浓度为2~10 mmol/L时,酶促反应速率随底物浓度增加基本呈直线上升的趋势,符合酶动力学一级反应曲线;当底物浓度达到10~16 mmol/L时,酶促反应速率持续增加基本达到最大值,符合酶动力学混合级反应曲线;当反应速率达到最大值时,底物浓度继续增加,酶促反应速率基本不再变化,符合酶动力学零级反应曲线,说明酶蛋白已达到饱和状态,再进一步增加底物也不能提高酶促反应速率。由此可见,底物浓度与PPO酶促反应速率关系基本遵循米氏方程的酶促动力学性质。
2.5 米氏常数及最大反应速率
经响应面试验优化PPO较优提取工艺条件,在此条件下测定PPO的酶动力学常数,以双倒数作图法得到图7,可知PPO的米氏常数Km为30.322 mmol/L,最大反应速率Vmax为0.281 A/min,这与吕艳芳等[16]研究中测得的结果相比米氏常数较小、最大反应速率较大,说明PPO和该底物之间的亲和能力较强。
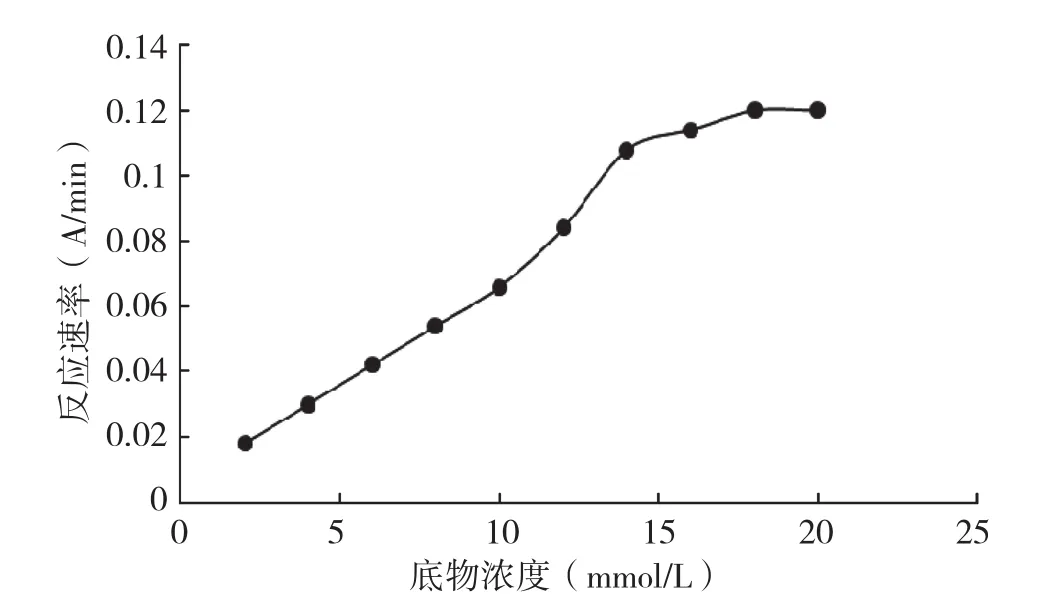
图6 底物浓度与PPO反应速率的关系
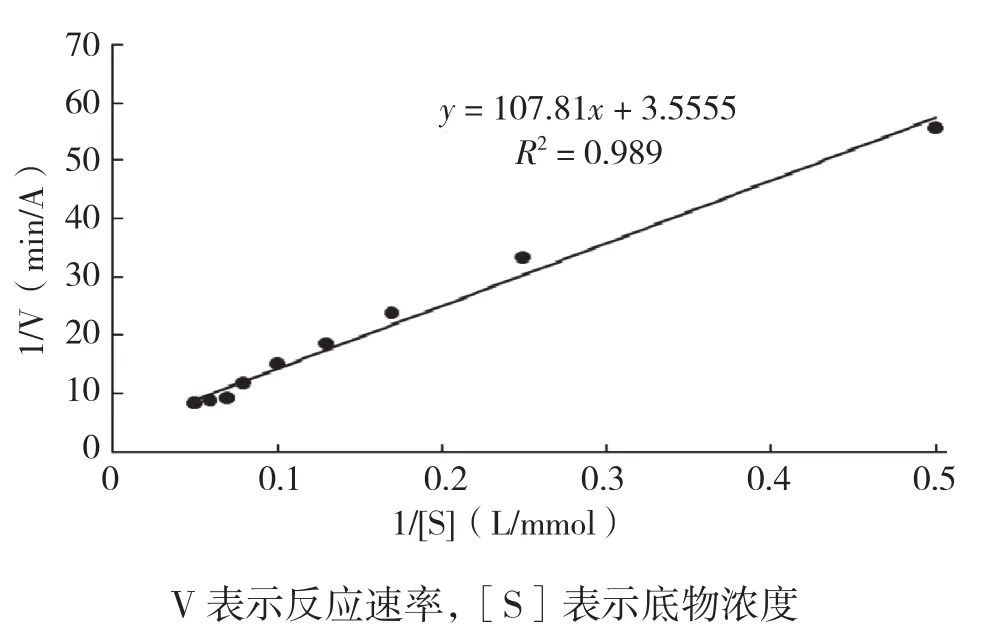
图7 PPO的双倒数图
3 结语
目前研究表明PPO在虾褐变中有较重要的催化作用,对其进行研究有助于揭示虾褐变机理,并对虾体黑变的控制提供理论指导。本试验在单因素试验基础上,采用响应面试验对料液比、pH值和提取时间进行了优化,结果表明,液料比、pH值、提取时间各因素及其二次项和交互作用对PPO的提取有显著影响。综合考虑实际操作各方面的因素,用磷酸盐缓冲液提取南美白对虾中PPO的较优工艺条件为:液料比2∶1(mL/g),提取体系pH为8.0,浸提处理时间为3 h,此条件下提取的PPO活力为94.8 A/(min·mL);本试验以磷酸盐缓冲液为提取液、L-DOPA为酶反应底物、Brij-35为表面活性剂所测的PPO活力比Tris-HCl作为缓冲液、邻苯二酚作为酶反应底物提高了近1倍;米氏方程参数为Km30.322 mmol/L、Vmax0.281 A/min。这与吕艳芳等[16]研究结果相比,酶促最大反应速率增大,米氏常数较小,说明PPO与L-DOPA的亲和能力较强,结果可以为南美白对虾褐变抑制和PPO性质研究提供参考。试验中未对酶活力的抑制剂及激活剂等进行研究,将在后续研究中开展相关研究,通过控制PPO活力抑制虾体黑变,为防虾黑变提供理论依据。
[1]农业部渔业渔政管理局. 2016年中国渔业统计年鉴[M]. 北京:中国农业出版社,2016.
[2]张高静,韩丽萍,孙剑锋,等. 南美白对虾营养成分分析与评价[J]. 中国食品学报,2013,13(8):254-259.
[3]张丽. 日本冷冻虾的加工与保鲜[J]. 食品科学,1990(5):13-15.
[4]谢晶,侯伟峰,朱军伟,等. 复合生物保鲜剂在南美白对虾防黑变中的应用[J]. 农业工程学报,2012,28(5):267-272.
[5]Sara B,Seyed S S,Mahmoud A,et al. The effect of pomegranate peel extract (PPE) on the polyphenol oxidase (PPO) and quality of Pacific white shrimp (Litopenaeus vannamei)during refrigerated storage[J]. LWT-Food Science and Technology,2015(60):1025-1033.
[6]Johansson M W,Soderhall K. Cellular immunity in crustaceans and the pro PO system[J]. Parasitology Today,1989(5):171-176.
[7]刘亮,王如坤,程慧媛,等. 水蜜桃多酚氧化酶分离纯化及酶学特性研究[J]. 核农学报,2015,29(6):1121-1128.
[8]Soderhall K,Cerenius L. Role of the prophenol oxidase-activating system in invertebrate immunity[J]. Current Opinion in Immunology,1998(10):23-28.
[9]Nirmal N P,Benjakul S. Inhibition kinetics of catechin and ferulic acid on polyphenol oxidase from cephalothorax of Pacific white shrimp(Litopenaeus vannamei)[J]. Food Chemistry,2012,131:569-573.
[10]陈丽娇,郑明锋,李怡宾. 南美白对虾多酚氧化酶的生化特性[J]. 福建农林大学学报(自然科学版),2004,33(3):377-380.
[11]Bochi V C,Barcia M T,Rodrigues D,et al. Polyphenol extraction optimisation from Ceylon gooseberry (Dovyalis hebecarpa) pulp[J]. Food Chemistry,2014,164(20):347-354.
[12]Una-Jovana V,Jelica Grujić-Milanović,Jelena Ž,et al. Optimization of extraction of stinging nettle leaf phenolic compounds using response surface methodology[J]. Industrial Crops & Products,2015,74:912-917.
[13]黄万有,吉宏武,刘书成,等. 凡纳滨对虾PPO的组织分布和活性与其贮藏过程中黑变的关系[J]. 现代食品科技,2014,30(2):89-94.
[14]José P Z,Martínez-Álvarez O,Montero P,et al. Characterisation and tissue distribution of polyphenol oxidase of deepwater pink shrimp (Parapenaeus longirostris)[J]. Food Chemistry,2009,112(1):104-111
[15]吴亮亮,杨会成,廖妙飞,等. 不同对虾中多酚氧化酶的提取比较及在虾体的分布研究[J].食品工业科技,2012,33(7):55-57.
[16]吕艳芳,魏春娇,王娇,等. 南美白对虾酚氧化酶的提取及生化特性[J]. 食品科学,2014,35(7):113-117.
(责任编辑 张辉玲)
Extraction and characteristics of polyphenol oxidase from white shrimp
DUAN Xiu-xia1,SHI Wen-zheng1,QIU Wei-qiang1,FANG Bing1,WANG Zhi-he1,JIANG Min2
(1. College of Food Science and Technology,Shanghai Ocean University / Shanghai Engineering Research Center of Aquatic Product Processing and Preservation, Shanghai 201306,China;2. College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China)
The optimization of extraction and biological characteristics of polyphenol oxidase (PPO) of white shrimp (Penaeus vannamei) were studied. The experimental factors and levels were determined by single factor experiments. Response surface methodology was used to explore the effects of solid-liquid ratio,pH and extraction time on PPO activity. The results showed that the optimal extraction conditions were as follows: the solid-liquid ratio was 2∶1,pH was 8.0 and the extraction time was 3.0 h. Under the optimal extractions,the PPO activity could reach 94.8 A/min·mL. Regressive model of extracted PPO was significant (P<0.0001) and better fitting (R2=0.9762),it could be used to predict the PPO extraction. The kinetic equation of enzyme reaction was consistent with Michaelis Menten equation. The Kmwas 30.322 mmol/L and Vmaxwas about 0.281 A/min. Study on properties of PPO could provide theoretical guidance for white shrimp anti-melanosis technology.
white shrimp;polyphenol oxidase;response surface;kinetics
TS254
A
1004-874X(2017)03-0136-07
2016-11-08
国家“十二五”科技支撑计划项目(2015BAD17B01);上海市虾类现代农业产业技术体系建设项目(2014-5);上海市高校知识服务平台项目(ZF1206)
段秀霞(1990-),女,在读硕士生,E-mail:1176914428@qq.com
施文正(1975-),男,博士,副教授,E-mail:wzshi@shou.edu.cn
段秀霞,施文正,邱伟强,等.南美白对虾多酚氧化酶的提取及其性质研究[J].广东农业科学,2017,44(3):136-142.
