溴氰菊酯对中华绒螯蟹主要免疫指标的影响
2017-06-07洪宇航
洪宇航
(西昌学院动物科学学院,四川 西昌 615000)
溴氰菊酯对中华绒螯蟹主要免疫指标的影响
洪宇航
(西昌学院动物科学学院,四川 西昌 615000)
为揭示溴氰菊酯对中华绒螯蟹免疫功能的影响,测定了在不同浓度溴氰菊酯(0、0.19、0.30、0.41、0.52 μg/L)条件下中华绒螯蟹总血细胞数量(THC)、吞噬活性、酚氧化酶(PO)活性、酸性磷酸酶(ACP)活性和碱性磷酸酶(AKP)活性5项主要免疫指标的变化情况。结果表明,溴氰菊酯对中华绒螯蟹免疫有显著影响,低浓度处理(0.19、0.30 μg/L)引起THC 药后6 h和12 h出现极显著上升,随后逐渐恢复;而高浓度处理(0.41、0.52 μg/L)则在药后24 h后持续下降,药后96 h极显著低于对照。各浓度处理均对血细胞吞噬活性有抑制效应,且随着浓度升高抑制效果越强。0.52 μg/L处理PO活性药后6 h出现极显著上升,随后逐渐下降,药后96 h处理间无显著差异;而ACP活性、AKP活性药后6 h出现明显下降,各时间段均极显著低于对照。
溴氰菊酯;中华绒螯蟹;免疫功能;毒性作用
溴氰菊酯属拟除虫菊酯类杀虫剂,是农药敌杀死的有效成分,由于其广谱、高效、低毒和低残留等特点,在世界范围内被广泛使用[1]。随着工农业生产的发展,溴氰菊酯的使用量不断增加,其主要通过农田排水、地表径流等途径进入水体,对水生生物产生危害。溴氰菊酯对哺乳动物属于中等毒性,但对鱼类和甲壳动物毒性很强[2]。目前,关于溴氰菊酯对水生生物的毒性研究已有很多,但主要集中对鱼类、贝类和小型甲壳动物[3-8]的毒性研究,而对于虾蟹类则少见报道。
中华绒螯蟹(Erochier sinensis)又称河蟹、大闸蟹,是我国重要的经济水产品种。随着市场需求量的增加及养殖规模的不断扩大,其质量安全问题越来越受到人们的关注。由于溴氰菊酯的广泛使用,存在对中华绒螯蟹养殖水体污染的潜在危害。关于溴氰菊酯对中华绒螯蟹的毒性研究,目前仅见国内有一例报道[9]。但其主要研究了溴氰菊酯对不同生长阶段中华绒螯蟹的急性毒性作用,而对其生理及免疫机能的影响并未关注。
因此,本试验通过设置不同浓度梯度溴氰菊酯水体,研究其对中华绒螯蟹主要免疫指标,包括总血细胞数量(THC),血细胞吞噬活性,酚氧化酶(PO)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)活性的影响,初步探究了溴氰菊酯胁迫下中华绒螯蟹的免疫应答情况,为后续免疫机理的研究以及生产中溴氰菊酯的规范使用提供理论依据。
1 材料与方法
1.1 试验材料
试验于2016年10月在西昌学院动物科学学院循环水养殖间进行,中华绒螯蟹成蟹采自江苏省常州市金坛区水产技术推广站养殖场。试验前循环水养殖系统中暂养1周以上。挑选健康无病、大小均一的中华绒螯蟹雌雄各半用于试验,平均体重113(±12.8)g。将中华绒螯蟹放入125 cm×60 cm×60 cm水族箱中,每个水族箱加入经充分曝气的自来水50 L,并在箱底放置经消毒处理的PVC管作为遮蔽物。
溴氰菊酯乳剂购自德国拜耳作物科学有限公司,溴氰菊酯有效含量为25 g/L,溶剂丙酮(分析纯)购自成都科龙化工试剂厂。将溴氰菊酯乳剂加入丙酮配制成25 μg/L储备液待用。
1.2 试验设计
参考溴氰菊酯在中华绒螯蟹成蟹毒性试验中的安全浓度和96 h半致死浓度,以及生产中溴氰菊酯在养殖水体中的残留浓度。试验设溴氰菊酯0.19、0.30、0.41、0.52 μg/L 4个浓度处理,另设空白对照及只添加丙酮的溶剂对照。每个处理3次重复,每个重复10只中华绒螯蟹,置于水族箱中。试验采用96 h半静水法,每24 h换水1次,提前配制相同浓度溴氰菊酯溶液以保证试验浓度不变。光暗周期比12∶12,试验期间每天上午8:00和下午19:00投喂人工配合饲料,并于投饵后3 h清除残饵和粪便。试验期间每24 h测定水温和水质指标,保证水温为20(±2)℃,pH为 7.2~7.8,溶氧>5 mg/L,氨氮<0.5 mg/L,亚硝酸盐<0.15 mg/L。分别于药后6、12、24、48、96 h观察河蟹存活情况,每个水族箱任意选取3只取血淋巴用于免疫指标的检测。
1.3 测定指标及方法
1.3.1 THC检测 于中华绒螯蟹第五步足基膜处抽取血淋巴100 μL,1∶1加入抗凝剂(0.1 mol/L葡萄糖,0.14 mol/L氯化钠,30 mmol/L柠檬酸,10 mmol/L EDTA,pH4.6)混匀,立即用血球计数板进行血细胞计数,每个样品计数重复3次取平均值。
1.3.2 吞噬活性 吞噬活性检测参照Xian 等[10]的方法进行改良。抗凝血1000 r/min 离心5 min,去上清,加入生理盐水(NaCl 496 mmol/L,KCl 10 mmol/L,CaCl216 mmol/L,NaHCO36 mmol/L,MgSO4·6H2O 12 mmol/L,MgCl2·6H2O 8 mmol/L,HEPES 20 mmol/L)后缓慢吹打使细胞重悬浮,血细胞计数调整细胞密度至1×106个/mL。细胞悬液每1mL加入稀释后的荧光乳胶微球(粒径1 μm,激发波长470 nm,Sigma,美国)10 μL,混匀后接种至24孔细胞培养板(Corning,美国),黑暗条件下在恒温培养箱中28℃孵育1 h。荧光倒置显微镜(Leica DM i8,德国)下镜检拍照,吞噬活性用吞噬荧光乳胶微球的血细胞占血细胞总数的比例来表示。
1.3.3 PO活性 抽取中华绒螯蟹血淋巴至2 mL 离心管,立即放入4℃冰箱4 h以上。11000 r/min 4℃高速冷冻离心30 min,小心收集上清液即为血清,4℃保存待用。PO活性测定参考Ashida[11]的方法,将50 μL 3 g/L L-dopa、50 μL血清以及50 μL PBS缓冲液(0.1 mol/L,pH 7.0)加入96孔板中,在室温下混匀孵育20 min,Bio-Rad iMark 酶标仪490 nm波长下读取起始和10 min时的光密度值(OD490),以10 min内每分钟光密度值增加0.001为1个酶活力单位计算。
1.3.4 ACP活性 制备血清,ACP活性测定方法遵照ACP活性检测试剂盒说明书(南京建成生物科技有限公司),Bio-Rad iMark 酶标仪520 nm波长下测定96孔板各孔吸光度,以每100 mL血清在37℃与基质作用30 min产生1 mg酚为1个金氏单位。
1.3.5 AKP 活性 制备血清,AKP活性测定方法遵照AKP活性检测试剂盒说明书(南京建成生物科技有限公司),Bio-Rad iMark 酶标仪520 nm波长下测定96孔板各孔吸光度,以每100 mL血清在37℃与基质作用15 min产生1 mg酚为1个金氏单位。
1.4 数据分析
采用SPSS V20.0软件对试验数据进行统计分析,用Levene法进行方差齐性检验,不满足齐性方差时对数据进行反正弦或者平方根处理,采用ANOVA对试验结果进行方差分析,LSD和Duncan 法进行多重比较,在GraphPad Prism 5软件上绘制相关图表。
2 结果与分析
2.1 溴氰菊酯对中华绒螯蟹THC的影响
中华绒螯蟹正常THC约为7.14(±0.32× 106)个/mL,各时间点空白对照与溶剂处理无显著差异,表明溴氰菊酯溶剂对中华绒螯蟹血细胞数量并无影响。而0.19 μg/L和0.13 μg/L溴氰菊酯处理药后6 h出现极显著升高,药后12 h达到顶峰,随后逐渐下降,至药后48 h与对照无显著差异。0.41 μg/L和0.52 μg/L溴氰菊酯处理THC药后6 h也略有上升,但随后持续下降,药后24 h极显著低于对照,且随着浓度增加,下降趋势愈加明显(图1)。
2.2 溴氰菊酯对中华绒螯蟹吞噬活性的影响
中华绒螯蟹血细胞分为大颗粒细胞、小颗粒细胞和透明细胞3类。本试验结果表明,3类细胞均具有吞噬功能,其中透明细胞吞噬能力最强,其次是大颗粒细胞,小颗粒细胞仅见少量吞噬。由图2可见,空白对照和溶剂处理各时间点血细胞吞噬活性均无显著差异,表明溶剂对其吞噬能力并无影响。各浓度处理较对照均呈下降趋势,并随着浓度升高降低越明显。其中高浓度处理(0.41 μg/L和0.52 μg/L)药后6 h即显著低于对照。至药后96 h,0.19 μg/L处理较药后48 h有所回复,吞噬比例为11.34(± 1.33)%,但仍显著低于对照。0.52 μg/L处理仅为6.36(±0.69)%,与对照差异极显著。
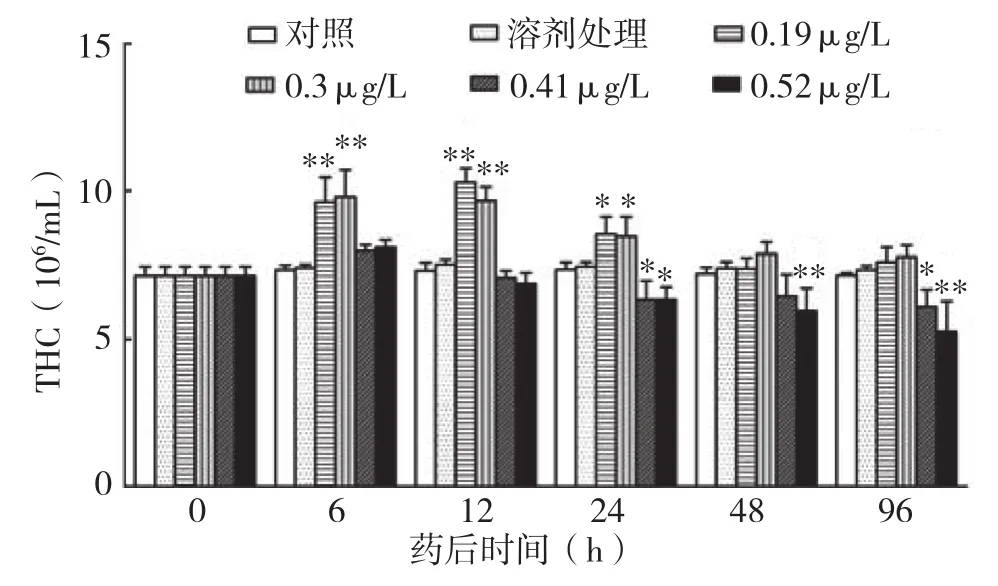
图1 不同浓度溴氰菊酯对中华绒螯蟹THC的影响

图2 不同浓度溴氰菊酯对中华绒螯蟹吞噬活性的影响
2.3 溴氰菊酯对中华绒螯蟹PO活性的影响
药后对照与溶剂处理PO活性无显著差异,表明溶剂对中华绒螯蟹血清PO活性并无影响。除最高浓度0.52 μg/L处理外,其余各浓度处理药后与对照无显著差异,但0.30、0.41 μg/L处理药后6 h出现略微升高,随后逐渐下降的现象。最高浓度0.52 μg/L处理药后6 h极显著高于其他浓度处理,药后12 h升至最高,随后逐渐下降,直至药后96 h与对照无显著差异(图3)。
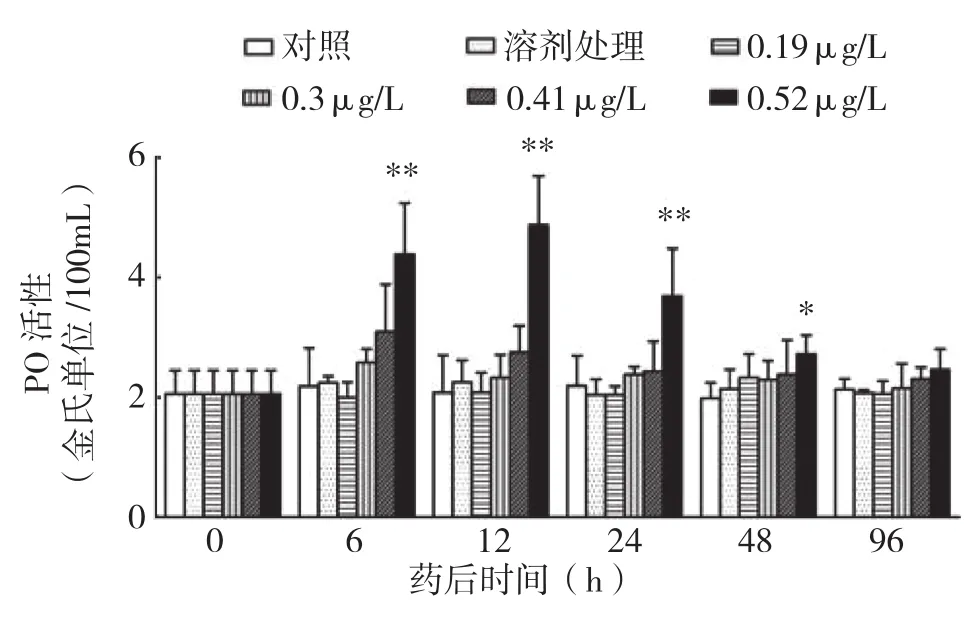
图3 不同浓度溴氰菊酯对中华绒螯蟹PO活性的影响
2.4 溴氰菊酯对中华绒螯蟹ACP活性的影响
从图4可以看出,对照与溶剂处理ACP活性药后并无显著差异。0.19 μg/L和0.30 μg/L处理药后与对照也无显著差异。0.41 μg/L处理出现略微持续下降,药后96 h显著低于对照。而0.52 μg/L处理药后6 h就出现明显下降,随后均显著低于对照。

图4 不同浓度溴氰菊酯对中华绒螯蟹ACP活性的影响
2.5 溴氰菊酯对中华绒螯蟹AKP活性的影响
试验结果(图5)表明,对照与溶剂处理ACP活性无显著差异。除0.19 μg/L处理外,各浓度处理较对照明显下降。但0.30 μg/L和0.41 μg/L处理药后12 h逐渐恢复,至药后96 h与对照无显著差异。而0.52 μg/L处理则持续处于较低水平,药后均极显著低于对照。

图5 不同浓度溴氰菊酯对中华绒螯蟹AKP活性的影响
3 讨论
溴氰菊酯作为高效低毒低残留的农药,被广泛应用于防治各种农作物的害虫。关于溴氰菊酯对水生生物的研究,目前国内外有很多报道,但主要集中在鱼类,而关于甲壳动物的报道较少。魏华等[12]研究了溴氰菊酯对克氏原螯虾的毒性效应,药后96 h LC50为0.0993 μg/L,安全浓度为5.62 ng/L,证实其对克氏原螯虾毒性极强;龚瑞忠等[13]通过在野外稻田进行溴氰菊酯对鲤鱼和日本沼虾的毒性试验表明,溴氰菊酯对日本沼虾药后3 h LC50为0.41 μg/L,大于对鲤鱼的危害。姜辉等[14]通过对菊酯类农药对水田生物影响的总结,认为大多数菊酯类农药对鱼类药后96 h LC50要比虾类高1~2个数量级。因此,生产中存在利用低浓度溴氰菊酯作为治疗鱼类寄生虫病,并用于杀灭鱼塘中甲壳类的情况[15]。大量使用溴氰菊酯随着农田排水或雨水冲淋,对中华绒螯蟹以及其他经济甲壳类养殖水体产生较大安全影响。蔡道基等[16]通过稻田施用溴氰菊酯,并模拟下雨将农田水排入鱼塘,测定了池塘水体及底泥中溴氰菊酯的残留,结果表明,溴氰菊酯排入池塘中4 h后浓度可达0.41 μg/L,随后迅速降解,14 h后不再检出。耿雪冰[9]研究表明,溴氰菊酯对中华绒螯蟹成蟹和幼蟹药后48 h LC50分别为0.65、0.42 μg/L,安全浓度分别为0.46、0.19 μg/L,属于高毒农药。但是他并没有研究溴氰菊酯对于中华绒螯蟹免疫功能的影响。因此,本研究参照溴氰菊酯对中华绒螯蟹的急性毒性结果以及在水体中的残留情况,设置5个浓度梯度,测定包括安全浓度以下不同浓度溴氰菊酯对中华绒螯蟹主要免疫指标的影响,为后续研究及溴氰菊酯的安全使用提供理论依据。
中华绒螯蟹作为甲壳类动物,其先天性免疫主要依靠血淋巴完成。其中,血细胞在免疫应答中发挥主要作用,常被用于衡量甲壳类动物免疫水平指标之一[17]。本试验结果表明,在溴氰菊酯暴露初期,各浓度处理THC均呈现一定上升,低浓度处理(0.19、0.30 μg/L)尤为明显。而高浓度处理(0.41、0.52 μg/L)药后12 h出现下降,至药后96 h显著低于对照。说明在低浓度条件下,溴氰菊酯会激发中华绒螯蟹免疫应答,增加血细胞数量。而较高浓度条件下则会对免疫机能产生抑制,表现为THC降低并保持在较低水平。在Cu2+对斑节对虾毒性研究中[10],低浓度Cu2+(0.05、0.5 mg/L)下斑节对虾THC出现上升,而高浓度(1.5、3.5 mg/L)下则造成THC显著下降,与本试验的结果相符。此外,Pimpão等[18]研究显示,在溴氰菊酯0.1 mg/kg 浓度下药后4 h便可使多棘鈎鲶白细胞水平显著上升,证实低浓度溴氰菊酯可以引起多棘鈎鲶的免疫应答。此外,郑惠东[19]通过溴氰菊酯对真鲷肝胰脏组织及细胞DNA损伤的研究指出,溴氰菊酯对真鲷肝胰脏组织和细胞DNA均可产生不同程度的损伤,且损伤程度与毒物浓度具有高度线性关系。因此,血细胞数量的大量下降可能跟其DNA严重损伤有关。这也间接证实本研究关于高浓度溴氰菊酯显著降低中华绒螯蟹THC的结论。
血细胞被认为是甲壳动物的主要吞噬细胞,在异物入侵过程中起到至关重要的防御作用[20]。一般来说,甲壳动物细胞可以分为大颗粒细胞、小颗粒细胞和透明细胞3类。目前,多数研究表明透明细胞是甲壳动物血细胞中的主要吞噬细胞[21]。例如在艾氏滨蟹血细胞功能的研究中,发现只有透明细胞对酵母菌有吞噬能力[22]。Johansson等[23]研究也表明,小龙虾的透明细胞起到主要的吞噬功能。但在有关圣保罗对虾和螳螂虾的研究中表明,大颗粒细胞和小颗粒细胞分别是其主要的吞噬细胞[24-25]。本研究通过对血细胞接种荧光乳胶微粒证实中华绒螯蟹3类细胞均有一定吞噬能力,其中透明细胞是主要吞噬细胞。这同Lv 等[26]对中华绒螯蟹血细胞吞噬功能研究的结果相同。此外,溴氰菊酯各浓度处理均能引起中华绒螯蟹血细胞吞噬活性的降低,并呈现浓度-效应关系,随着浓度升高吞噬活性降低越明显。至药后48 h各浓度处理均显著低于对照。Xian 等[10]研究指出,较高浓度Cu2+处理下斑节对虾血细胞吞噬活性被严重抑制,这与本试验结果相似,表明即使低浓度溴氰菊酯(低于安全浓度)也可以显著影响中华绒螯蟹血细胞吞噬活性,直至药后96 h仍处于较低水平。吴楠等[27]研究发现即使在溴氰菊酯0.005 μg/L浓度下也会对克氏原螯虾产生细胞毒性,细胞色素氧化酶活性被显著抑制。因此,我们推测溴氰菊酯对甲壳类动物较强的细胞毒性是造成血细胞数量下降从而引起其吞噬活性显著降低的主要原因。
中华绒螯蟹体液中不具有免疫球蛋白,酚氧化酶(PO)作为其体液免疫主体之一是抵御外界不利环境的第一道防线,与机体的免疫有直接的关系[28]。本试验结果表明,高浓度溴氰菊酯会引起中华绒螯蟹血淋巴PO活性药后6 h即明显上升,至药后12 h达到最高随后下降,药后96 h基本恢复至正常水平。这与陆宏达等[29]报道的不同刺激造成中华绒螯蟹机体PO活性增强的结果相似。此外,Xian等[10]研究表明,0.5 mg/L Cu2+作用下斑节对虾血淋巴PO活性会有所上升,药后6 h明显升高随后降低。因此,我们推测溴氰菊酯药后6 h即可激活中华绒螯蟹酚氧化酶系统,引起PO活性显著上升。具体的激活时间点以及激活方式有待进一步研究。
ACP、AKP是甲壳动物体内一组重要的水解酶,在甲壳动物免疫应答中起到重要作用。本试验结果表明高浓度溴氰菊酯可以明显降低中华绒螯蟹血淋巴ACP、AKP活性持续至药后96 h。其中,AKP活性受影响更大,最低浓度0.19 μg/L处理也会引起显著降低。这与Zhao 等[30]在组织胺对中华绒螯蟹免疫影响研究中,不同浓度组织胺注射后6 h均引起中华绒螯蟹血清中ACP和AKP活性显著下降的结论相同。
综上所述,溴氰菊酯对中华绒螯蟹THC、吞噬活性、PO活性、ACP活性、AKP活性等主要免疫指标有明显影响,呈现出浓度-效应关系。即使是在安全浓度以下的各浓度(0.19、0.30、0.41 μg/L)均对其免疫功能有明显抑制作用。因此,虽然溴氰菊酯在生产中由于施药浓度较低、降解较快等特点不易达到中华绒螯蟹的致死浓度,但仍会对其免疫功能造成影响。水体中残留溴氰菊酯可长时间持续影响中华绒螯蟹免疫功能,尤其在高温季节水质恶化,会增大病害发生的风险。因此,我们建议在中华绒螯蟹养殖水体周边应避免使用溴氰菊酯农药。
[1]胡志强,任雪景,郭玉晶. 拟除虫菊酯类杀虫剂的研究进展[J]. 青岛科技大学学报(自然科学版),2002,23(1):48-51.
[2]夏世钧. 农药毒理学[M]. 北京:化学工业出版社,2008:317-329.
[3]Köprücü K,Aydýn R. The toxic effects of pyrethroid deltamethrin on the common carp(Cyprinus carpio L.) embryos and larvae[J]. Pesticide Biochemistry & Physiology,2004,80(1):47-53.
[4]Viran R,Unlü E F,Polat H,et al. Investigation of acute toxicity of deltamethrin on guppies(Poecilia reticulata)[J]. Ecotoxicology & Environmental Safety,2003,55(1):82-85.
[5]王媛,熊丽,刘喜平,等. 氯氰菊酯对鲤鱼亚急性毒性研究[J]. 农业环境科学学报,2006,25(1):200-203.
[6]张新铖,朱新平,刘毅辉,等. 甲苯咪唑、溴氰菊酯和硫酸铜对美洲鲥的急性毒性研究[J].南方水产科学,2015(2):66-71.
[7]胡伟华,何辉,袁勇超,等. 敌百虫、溴氰菊酯对大鳞副泥鳅仔鱼及多刺裸腹溞的急性毒性实验[J]. 淡水渔业,2017,47(1):66-70.
[8]许贻斌,郑惠东,陈宇锋,等. 溴氰菊酯对菲律宾蛤仔体内酶活性和组织损伤的初步探索[J]. 生态毒理学报,2015,10(6):206-212.
[9]耿雪冰. 溴氰菊酯残留的检测方法及对河蟹的毒性研究[D]. 南京:南京农业大学,2010.
[10]Xian J A,Wang A L,Ye C X,et al. Phagocytic activity,respiratory burst,cytoplasmic free-Ca2+concentration and apoptotic cell ratio of haemocytes from the black tiger shrimp,Penaeus monodon under acute copper stress[J]. Comparative Biochemistry & Physiology(Part C):Toxicology & Pharmacology,2010,152(2):182-188.
[11]Ashida M. Purification and characterization of pre-phenoloxidase from hemolymph of the silkworm Bombyx mori[J]. Archives of Biochemistry & Biophysics,1971,144(2):749.
[12]魏华,吴楠,沈竑,等. 溴氰菊酯对克氏原螯虾的氧化胁迫效应[J]. 水产学报,2010 (5):733-739.
[13]龚瑞忠,钟巧云. 溴氰菊酯对鱼虾的毒性与安全评价研究[J]. 农村生态环境,1996,12(1):29-32.
[14]姜辉,林荣华,陶传江,等. 菊酯类农药对水田生物影响研究进展[J].农药科学与管理,2005,26(10):14-19.
[15]杨先乐,陆承平,战文斌. 新编渔药手册[J].北京:中国农业出版社,2005.
[16]蔡道基,龚瑞忠,汤国才,等. 稻田使用溴氰菊酯农药对水生生物的安全评价[J]. 环境科学研究,1997,10(3):30-35.
[17]姚翠鸾,王志勇,相建海. 甲壳动物血细胞及其在免疫防御中的功能[J].动物学研究,2006,27(5):549-557.
[18]Pimpão C T,Zampronio A R,de Assis H C S. Exposure of Ancistrus multispinis(Regan,1912,Pisces,Teleostei) to deltamethrin:Effects on cellular immunity[J]. Fish & Shellfish Immunology,2008,25(5):528-532.
[19]郑惠东. 溴氰菊酯对真鲷肝胰脏组织及细胞DNA 的损伤[J]. 应用生态学报,2017,28(6).
[20]Borges A R,Santos P N,Furtado A F,et al. Phagocytosis of latex beads and bacteria by hemocytes of the triatomine bug Rhodnius prolixus(Hemiptera:Reduvidae)[J]. Micron,2008,39(4):486-494.
[21]Söderhäll K,Smith V J. Separation of the hemocyte populations of Carcinus maenas and other marine decapods[J]. Developmental & Comparative Immunology,1983,7(2):229-239.
[22]Matozzo V,Marin M G. The role of haemocytes from the crab Carcinus aestuarii(Crustacea,Decapoda) in immune responses:A first survey[J]. Fish & Shellfish Immunology,2010,28(4):534-541.
[23]Johansson M W,Keyser P,Sritunyalucksana K,et al. Crustacean haemocytes and haematopoiesis[J]. Aquaculture,2000,191(1–3):45-52.
[24]Gargioni R,Barracco M A. Hemocytes of the palaemonids Macrobrachium rosenbergii and M. acanthurus,and of the penaeid Penaeus paulensis[J]. Journal of Morphology,1998,236(3):209-221.
[25]Gallo C,Schiavon F,Ballarin L. Insight on cellular and humoral components of innate immunity in Squilla mantis(Crustacea,Stomatopoda)[J]. Fish & Shellfish Immunology,2011,31(3):423-431.
[26]Lv S,Xu J,Zhao J,et al. Classification and phagocytosis of circulating haemocytes in Chinese mitten crab (Eriocheir sinensis) and the effect of extrinsic stimulation on circulating haemocytes in vivo[J]. Fish & Shellfish Immunology,2014,39(2):415-422.
[27]吴楠,魏华,沈竑,等. 溴氰菊酯对克氏原螯虾肌肉组织的毒性研究[J]. 水产学报,2015,39(9):1412-1421.
[28]徐海圣,徐步进. 甲壳动物细胞及体液免疫机理的研究进展[J]. 大连海洋大学学报,2001,16(1):49-56.
[29]陆宏达,刘凯,张明辉.中华绒螯蟹血淋巴中酚氧化酶的部分生化特性[J].上海海洋大学学报,2007,16(3):236-241.
[30]Zhao L,Yang X,Cheng Y,et al. Effects of Histamine on survival and immune parameters of the Chinese Mitten Crab,Eriocheir sinensis[J]. Journal of Shellfish Research,2012,31(3):827-834.
(责任编辑 崔建勋)
Effects of deltamethrin on main immune parameters of Chinese mitten crab,Eriochier sinensis
HONG Yu-hang
(Animal Science Faculty,Xichang College,Xichang 615000,China)
In this research,the effects of deltamethrin on immune parameters were revealed by dectecting the changes of total hemocytes count (THC),phagocytic activity,phenoloxidase(PO) activity,acid phosphatase(ACP) activity and alkaline phosphatase(AKP) activity in hemolymph of Chinese mitten crab under different concentrations of deltamethrin(0,0.19,0.30,0.41,0.52 μg/L) exposure. The results showed that deltamethrin had evident effects on immune parameters of Chinese mitten crab,THC increased after 6 h and 12 h exposure to low concentrations of deltamethrin including 0.19 μg/L and 0.30 μg/L,and then decreased to normal level at 96 h. On the contrary,high concentration (0.41μg/L and 0.52μg/L) exposure declined the THC after 24 h,which was significantly lower than that of control group at 96 h. The phagocytic activity decreased under each concentration and the higher concentration made a higher inhibition of phagocytic activity. After exposure to 0.52μg/L deltamethrin,PO activity increased significantly at 6 h and then decreased gradually till 96 h,which had no significant difference among each group. However,both ACP and AKP activity decreased at 6 h exposure to 0.52μg/L deltamethrin and was significantly lower than those of control at each time point.
deltamethrin;Eriochier sinensis;immunity function;toxicity
S948
A
1004-874X(2017)03-0151-07
2017-01-04
四川省教育厅科研一般项目(17ZB0405)
洪宇航(1987-),男,硕士,助教,E-mail:hongyuhang1987@126.com
洪宇航.溴氰菊酯对中华绒螯蟹主要免疫指标的影响[J].广东农业科学,2017,44(3):151-157.
