miR-125b在颈动脉粥样硬化患者外周血单个核细胞中的表达及其对血管平滑肌细胞增殖和迁移的影响*
2017-06-07任志文
谢 岩,任志文,赵 冬
1)新疆石河子大学医学院第一附属医院老干部科 新疆石河子 832008 2)新疆石河子大学医学院第一附属医院神经外科 新疆石河子 832008
miR-125b在颈动脉粥样硬化患者外周血单个核细胞中的表达及其对血管平滑肌细胞增殖和迁移的影响*
谢 岩1),任志文2)#,赵 冬2)
1)新疆石河子大学医学院第一附属医院老干部科 新疆石河子 832008 2)新疆石河子大学医学院第一附属医院神经外科 新疆石河子 832008
#通信作者,男,1978年8月生,硕士,主治医师,研究方向:神经外科疾病,E-mail:9594986@qq.com
动脉粥样硬化;miR-125b;平滑肌细胞;细胞增殖;细胞迁移
目的:探讨miR-125b在颈动脉粥样硬化(AS)患者外周血单个核细胞中的表达及对血管平滑肌细胞增殖和迁移的影响。方法:选取85例颈AS患者(不稳定性斑块39例,稳定性斑块46例)和45例健康者(对照组),采用实时荧光定量PCR法检测外周血单个核细胞中miR-125b的表达。培养人主动脉血管平滑肌细胞,分别转染miR-125b 模拟物、miR-125b抑制物、miR-125b阴性对照,以不作任何处理的细胞为空白对照组,采用实时荧光定量PCR法检测各组细胞中miR-125b的表达,MTT法检测细胞增殖活性,Transwell细胞迁移实验检测细胞迁移能力。结果:与对照组相比,AS患者外周血单个核细胞中miR-125b相对表达量降低,且不稳定性斑块患者低于稳定性斑块患者(P<0.05)。miR-125b模拟物组细胞中miR-125b相对表达量显著高于阴性对照组和空白对照组,且miR-125b抑制物组低于阴性对照组和空白对照组(P<0.05);miR-125b模拟物组细胞增殖抑制率和细胞迁移数显著低于阴性对照组和空白对照组,而miR-125b抑制物组则高于阴性对照组和空白对照组(P<0.05)。结论:miR-125b可能通过抑制血管平滑肌细胞增殖和迁移而发挥保护动脉的作用。
近年来,随着人们生活方式的改变,动脉粥样硬化(atherosclerosis,AS)的发病率呈逐年上升趋势,由此而导致的心脑血管疾病已成为威胁人类健康的重要公共卫生问题[1]。AS发生机制较为复杂,是血液成分、局部血流、血管细胞、细胞外基质、环境和遗传等众多因素相互作用的结果[2],其中,血管内皮细胞损伤、平滑肌细胞增殖和炎症反应是AS形成中的重要因素[3]。微小RNA(miRNA)作为一种内源性高度保守的短小RNA,已被证实参与了多种生理及病理过程[4]。有研究[5]指出,miRNA参与了AS的发生及进展,在调节平滑肌细胞增殖、内皮细胞功能及血细胞聚集中发挥重要作用。miR-125b作为miRNA的重要类型,主要表达于动脉血管平滑肌细胞中,可能参与了血管功能的调控[6]。该研究对miR-125b在颈AS患者外周血单个核细胞中的表达进行了分析,并且探讨其对体外培养的主动脉血管平滑肌细胞增殖、迁移能力的影响,以期为AS机制研究提供基础资料。
1 资料与方法
1.1 一般资料 选取2014年3月至2015年3月在新疆石河子大学医学院第一附属医院住院的颈AS患者85例,男性56例,女性29例,年龄55~81(68.3±9.1)岁,患者血脂均升高,彩色多普勒超声检查显示AS斑块形成。排除重要脏器严重功能障碍者、肿瘤患者。同期,从体检中心选取健康者45例作为对照,男性31例,女性14例,年龄55~79(67.9±8.8)岁,排除糖尿病、高血压等慢性病患者、肿瘤患者、重要脏器严重功能障碍者,均行彩色多普勒超声检查排除AS。该研究通过医院伦理委员会批准,研究对象均知情同意。收集所有研究对象的年龄,性别,血压,体重指数,空腹血糖(FBG),血脂(TC、TG、HDL-C、LDL-C),尿酸等一般资料。根据颈动脉彩色多普勒超声检测[7]结果,将AS患者分为稳定性斑块组和不稳定性斑块组。其中,稳定性斑块组46例,男性34例,女性12例,年龄55~78(68.1±8.9)岁;不稳定性斑块组39例,男性22例,女性17例,年龄55~79(68.7±9.3)岁。
1.2 主要试剂及仪器 人淋巴细胞分离液购自美国Sigma公司,Trizol总RNA提取试剂盒、Lipofectamine 2000转染试剂盒均购自美国Invitrogen公司,反转录试剂盒和PCR试剂盒均购自大连宝生物工程有限公司,miR-125b及内参U6引物序列、miR-125b模拟物、miR-125b抑制物和阴性对照均由上海生工生物工程有限公司设计合成,人主动脉血管平滑肌细胞购自ATCC细胞库,DMEM培养基、胎牛血清及胰酶均购自美国Gibco公司,MTT、DMSO均购自武汉博士德生物公司,Transwell小室购自美国BD公司,实时荧光定量PCR仪购自美国ABI公司。
1.3 实时荧光定量PCR法检测外周血单个核细胞中miR-125b的表达 所有研究对象均晨起抽取空腹静脉血10 mL,抗凝后加入人淋巴细胞分离液,利用密度梯度离心法对外周血单个核细胞进行分离,洗涤、提纯,计数细胞,加入台盼蓝对细胞活力进行测定,以细胞活力>95%为合格,将细胞保存于-80 ℃冰箱。取单个核细胞,加入细胞裂解液裂解,用Trizol法提取总RNA,反转录获得cDNA,以cDNA为模板进行PCR。miR-125b引物序列上游:5’-GGGTCCCTGAGACCCTAACTTGT-3’,下游:5’-GCT GTCAACATACGCTAGGTA-3’;内参U6引物序列上游:5’-TCAGTTTGCTGTTCTGGGTG-3’,下游:5’-CG GTTGGCTGGAAAGGAG-3’。反应体系:10×扩增缓冲液10 μL,dNTP混合物各200 μmol/L,引物各20 pmol,模板DNA 0.5 μg,Taq DNA聚合酶2.5 μL,Mg2+1.5 mmol/L,加双蒸水至100 μL。PCR反应条件:94 ℃ 60 s,92 ℃ 30 s,56 ℃ 30 s,76 ℃ 30 s,连续进行42个循环,每个样品均设置3个平行反应复孔。用2-ΔΔCt法计算miR-125b的相对表达量。
1.4 主动脉血管平滑肌细胞的培养及处理 用DMEM培养基培养人主动脉血管平滑肌细胞,待细胞融合度达到75%以上时,胰酶消化,传代培养。调整细胞密度,接种于6孔板中(3×105/孔),培养24 h,利用Lipofectamine 2000分别转染细胞,根据转染物不同分为:空白对照组(不作任何处理),miR-125b 模拟物组(转染miR-125b模拟物5’-UCCCU GAGACCCUAACUUGUGA-3’),miR-125b抑制物组(转染miR-125b抑制物5’-TCACAAGTTAGGGTCT CAGGGA-3’),阴性对照组(转染miR-125b阴性对照序列5’-UUCUCCGAACGUGUCACGUTT-3’)。
1.5 实时荧光定量PCR检测各组细胞中miR-125b的表达 各组细胞转染48 h,加入细胞裂解液进行裂解,其余步骤同1.3。
1.6 MTT法检测各组细胞增殖活性 转染48 h后,取各组细胞,胰酶消化,用完全培养基(含体积分数10%胎牛血清)稀释成细胞悬液,接种于96孔板中(5×103/孔),每孔终体积200 μL,于恒温培养箱中培养48 h,弃去培养液,洗涤3次,加入MTT液20 μL,避光培养4 h,加入DMSO 150 μL,在摇床上摇动10 min,上酶标仪于490 nm处测定吸光度(A)值,重复实验3次。细胞增殖抑制率=(A实验-A空白)/(A对照-A空白)×100%。
1.7 Transwell细胞迁移实验检测各组细胞迁移能力 转染48 h后,取各组细胞,胰酶消化。取Transwell小室置于无菌24孔板中,将细胞加入上室(1×103/室),将含体积分数10%胎牛血清的DMEM培养液加入下室,置于恒温箱中培养24 h,用多聚甲醛对小室膜上细胞进行固定,用结晶紫染色2 min,于高倍镜(×400)下观察,随机取5个视野计数穿膜细胞数,取均值。
1.8 统计学处理 采用SPSS 21.0处理数据,采用两独立样本t检验或χ2检验比较对照组、AS稳定性斑块组和不稳定性斑块组一般资料及外周血单个核细胞中miR-125b表达的差异。采用单因素方差分析比较各组细胞miR-125b表达、增殖抑制率和穿膜细胞数的差异,两两比较采用LSD-t检验,检验水准α=0.05。
2 结果
2.1 对照组、稳定性斑块组和不稳定性斑块组一般资料及外周血单个核细胞中miR-125b表达的比较 结果见表1。
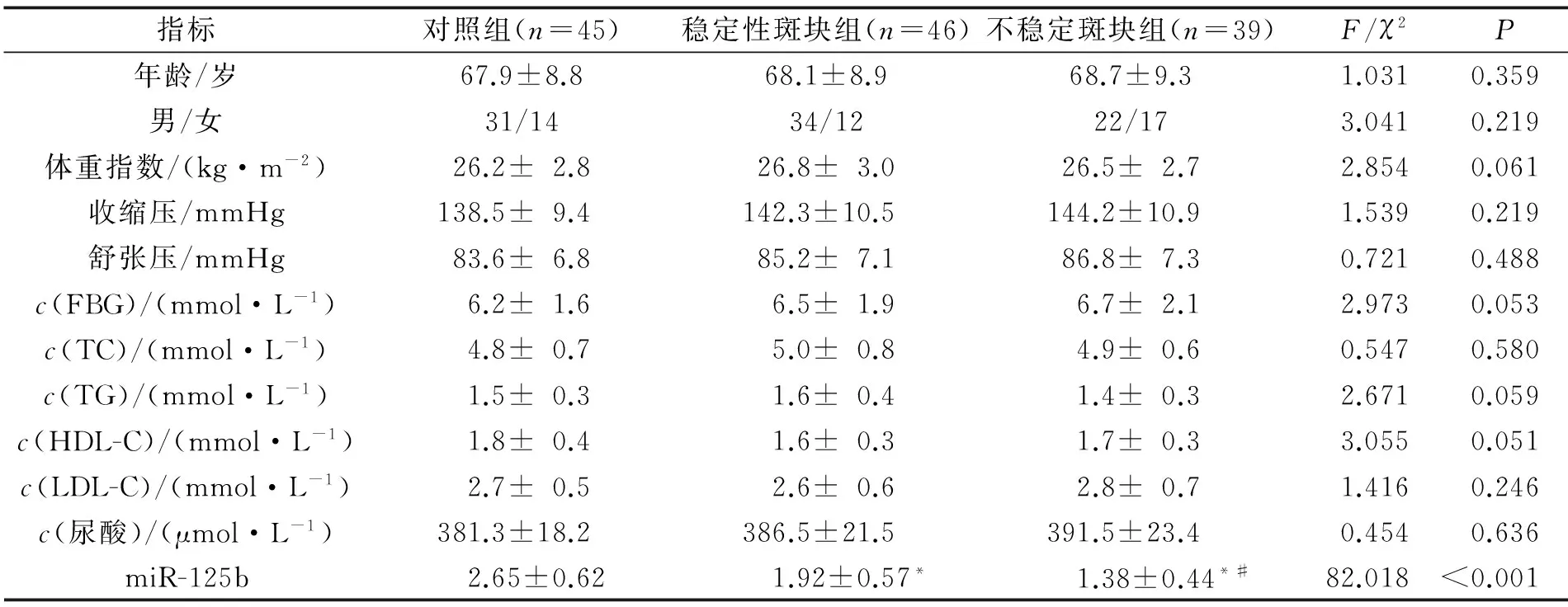
表1 对照组、稳定性斑块组和不稳定性斑块组一般资料及外周血单个核细胞中miR-125b表达比较
1 mmHg=0.133 kPa;*:与对照组比较,P<0.05;#:与稳定性斑块组比较,P<0.05。
2.2 各组细胞中miR-125b表达的比较 miR-125b模拟物组细胞中miR-125b相对表达量高于阴性对照组和空白对照组,miR-125b抑制物组低于阴性对照组和空白对照组,见表2。
2.3 各组细胞增殖抑制率的比较 miR-125b模拟物组细胞增殖抑制率低于阴性对照组和空白对照组,miR-125b抑制物组高于阴性对照组和空白对照组,见表2。
2.4 各组细胞迁移能力比较 结果见表2和图1。
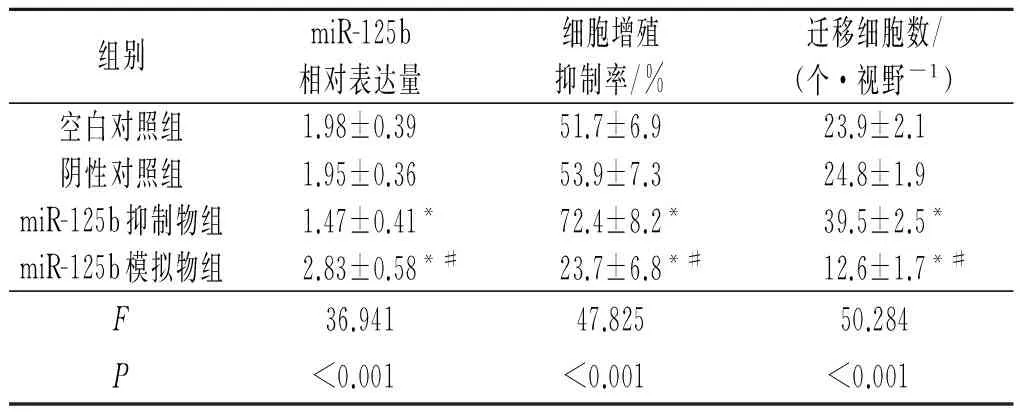
表2 各组细胞中miR-125b相对表达量、细胞增殖抑制率及穿膜细胞数比较(n=3)
*:与阴性对照组和空白对照组相比,P<0.05;#:与miR-125b抑制物组相比,P<0.05。
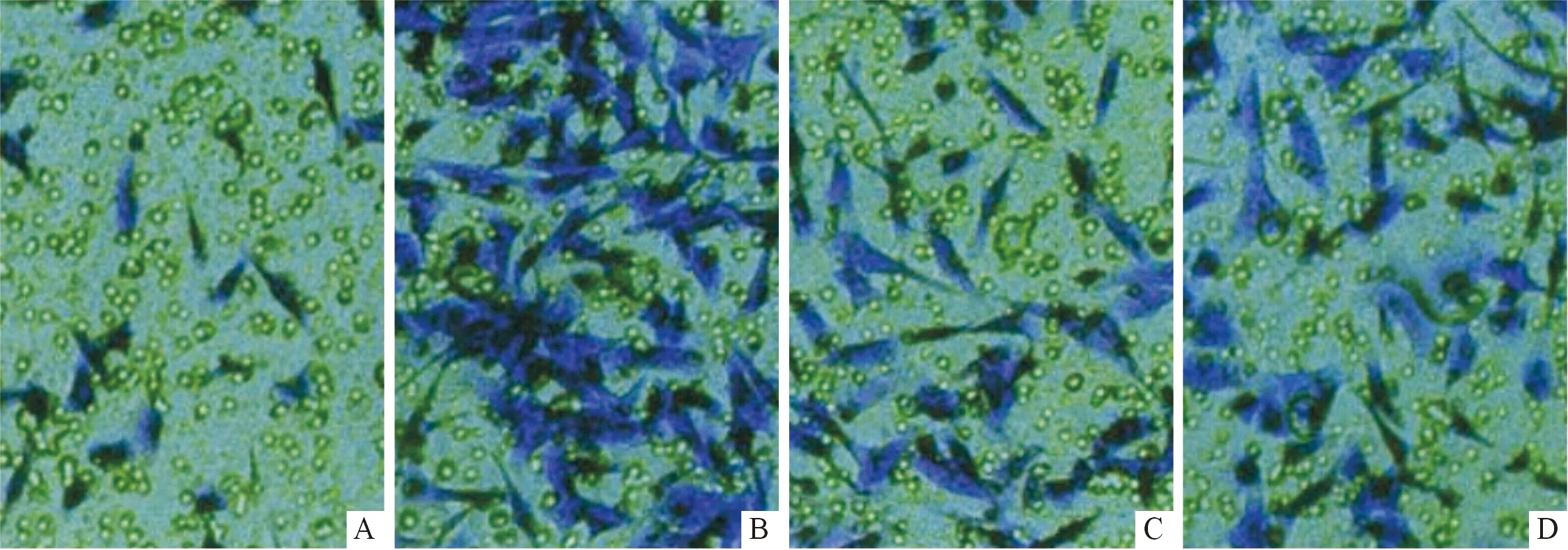
A:miR-125b模拟物组;B:miR-125b抑制物组;C:阴性对照组;D:空白对照组。图1 各组细胞迁移情况
3 讨论
AS作为多种心脑血管疾病的共同病理基础,病因多样,发病机制较为复杂,涉及内皮细胞损伤、炎症激活、平滑肌细胞增殖及迁移等多个病理过程[7]。有研究[8]指出,血管平滑肌细胞异常增殖、迁移在促进AS发生及进展中发挥重要作用。miRNA作为广泛存在生物体内的保守的短小RNA,可调控多种细胞增殖、分化及凋亡过程[9]。研究[10]表明,在损伤后的血管平滑肌中miR-125b表达显著下调。刘现梅等[11]指出,同型半胱氨酸通过促进miR-125b甲基化而促进血管平滑肌细胞增殖。外周血单个核细胞广泛存在于人体,在炎症反应、免疫功能方面发挥重要作用,可真实地反映机体的免疫状况。考虑到炎症反应参与了AS的发生及进展过程[12],该研究对颈AS患者外周血单个核细胞中miR-125b表达进行了检测,结果显示,miR-125b在颈AS患者外周血单个核细胞中相对表达量低于对照组,且不稳定性斑块组低于稳定性斑块组,说明颈AS患者外周血单个核细胞中miR-125b表达下调,且与斑块性质有关,提示miR-125b可能参与了颈AS的进展过程。
为进一步探讨miR-125b参与AS发生的可能机制,作者分别对人主动脉血管平滑肌细胞转染miR-125b模拟物、miR-125b抑制物和阴性对照,结果显示,miR-125b模拟物组细胞中miR-125b相对表达量高于阴性对照组和空白对照组,且miR-125b抑制物组低于阴性对照组和空白对照组;miR-125b模拟物组细胞增殖抑制率显著低于阴性对照组和空白对照组,而miR-125b抑制物组高于阴性对照组和空白对照组,说明特异性上调miR-125b可显著抑制人主动脉血管平滑肌细胞增殖,而下调miR-125b则可促进细胞增殖,提示miR-125b可能参与了人主动脉血管平滑肌细胞增殖过程。有研究[13]指出,血管平滑肌细胞增殖在血管新生内膜形成中发挥关键性作用,提示miR-125b可能通过调控血管平滑肌增殖而参与血管相关生理病理过程。作者在该研究中还发现,miR-125b模拟物组细胞迁移能力显著降低而miR-125b抑制物组则升高,说明上调miR-125b可抑制血管平滑肌细胞迁移,而下调其表达则可促进细胞迁移,提示上调miR-125b可能通过抑制血管平滑肌细胞增殖和迁移而发挥抗AS的作用。
综上所述,miR-125b在颈AS患者外周血单个核细胞中呈低表达,且与斑块稳定性有关,miR-125b可能通过抑制血管平滑肌细胞增殖和迁移而发挥保护动脉的作用,从而减少AS的发生。miR-125b有望成为AS诊断和临床治疗的新靶位。
[1] HONG J,MARON DJ,SHIRAI T,et al.Accelerated atherosclerosis in patients with chronic inflammatory rheumatologic conditions[J].Int J Clin Rheumtol,2015,10(5):365
[2]STANCEL N,CHEN CC,KE LY,et al.Interplay between CRP,atherogenic LDL,and LOX-1 and its potential role in the pathogenesis of atherosclerosis[J].Clin Chem,2016,62(2):320
[3]ZHAI H,CHEN QJ,GAO XM,et al.Inhibition of the NF-κB pathway by R65 ribozyme gene via adeno-associated virus serotype 9 ameliorated oxidized LDL induced human umbilical vein endothelial cell injury[J].Int J Clin Exp Pathol,2015,8(9):9912
[4]ONO K,HORIE T,NISHINO T,et al.MicroRNAs and high-density lipoprotein cholesterol metabolism[J].Int Heart J,2015,56(4):365
[5]张和西.miRNA与动脉粥样硬化研究进展[J].中华实用诊断与治疗杂志,2014,28(1):1
[6]WEN P,CAO H,FANG L,et al.miR-125b/Ets1 axis regulates transdifferentiation and calcification of vascular smooth muscle cells in a high-phosphate environment[J].Exp Cell Res,2014,322(2):302
[7]刘运涌,蔡菁,贺峰,等.前循环进展性脑梗死患者颈动脉硬化分析及血小板CD62p表达[J].中华老年心脑血管病杂志,2015,17(4):396
[8]LEE KJ,KWAK HS,CHUNG GH,et al.Leptomeningeal collateral vessels are a major risk factor for intracranial hemorrhage after carotid stenting in patients with carotid atherosclerotic plaque[J].J Neurointerv Surg,2016,8(5):512
[9]SCHWARTZ SM,VIRMANI R,ROSENFELD ME.The good smooth muscle cells in atherosclerosis[J].Curr Atheroscler Rep,2000,2(5):422
[10]MENG F,ONORI P,HARGROVE L,et al.Regulation of the histamine/VEGF axis by miR-125b during cholestatic liver injury in mice[J].Am J Pathol,2014,184(3):662
[11]刘现梅,曹成建,田珏,等.miR-125b 甲基化在同型半胱氨酸促进血管平滑肌细胞增殖中的作用[J].中国药理学通报,2015,31(7):1023
[12]SALAMANNA F,MAGLIO M,BORSARI V,et al.Peripheral blood mononuclear cells spontaneous osteoclastogenesis:mechanisms driving the process and clinical relevance in skeletal disease[J].J Cell Physiol,2016,231(3):521
[13]SCHLOSSER A,PILECKI B,HEMSTRA LE,et al.MFAP4 promotes vascular smooth muscle migration,proliferation and accelerates neointima formation[J].Arterioscler Thromb Vasc Biol,2016,36(1):122
(2016-08-30收稿 责任编辑李沛寰)
Expression of miR-125b in peripheral blood mononuclear cells of patients with atherosclerosis and its effects on proliferation and migration of smooth muscle cells
XIEYan1),RENZhiwen2),ZHAODong2)
1)DepartmentofVeteranCadres,theFirstAffiliatedHospital,MedicalCollegeofShiheziUniversity,Shihezi,Xinjiang832008 2)DepartmentofNeurosurgery,theFirstAffiliatedHospital,MedicalCollegeofShiheziUniversity,Shihezi,Xinjiang832008
atherosclerosis;miR-125b;smooth muscle cell;cell proliferation;cell migration
Aim: To investigate the expressions of miR-125b in peripheral blood mononuclear cells in patients with atherosclerosis(AS) and its effect on smooth muscle cells. Methods: A total of 85 patients with carotid AS and 45 healthy individuals(control group) were selected. The expression of miR-125b in peripheral blood mononuclear cells were detected by real-time quantitative PCR. The human vascular smooth muscle cells were cultured and were transfected with miR-125b mimics, miR-125b inhibitor, miR-125b negative control, respectively, and cells without any treatment were the blank control group. The expression of miR-125b in the above 4 groups was detected by real-time quantitative PCR, the cell proliferation activity was detected by MTT assay, and the cell migration was detected by transwell cell migration assay. Results: Compared with the control group, the relative expression level of miR-125b in peripheral blood mononuclear cells of AS group was decreased, and which was lower in the unstable plaques patients than that in the stable plaque patients(P<0.05). The relative expression level of miR-125b in miR-125b mimics group was significantly higher than those in the miR-125b inhibitor group, negative control group and blank control group, and that in the miR-125b inhibitor group was lower than those in the negative control group and the blank control group(P<0.05). The cell proliferation inhibition rate and the number of migration cells in miR-125b mimics group were significantly lower than those in the other 3 groups, while those in miR-125b inhibitor group were higher than those in the negative blank control group and the blank control group(P<0.05). Conclusion: The expressions of miR-125b in peripheral blood mononuclear cells in carotid AS patients is low, and is related with the plaque stability. miR-125b has protective effects against AS through inhibit the proliferation and migration of vascular smooth muscle cells.
10.13705/j.issn.1671-6825.2017.03.013
*国家自然科学基金资助项目 81360185
R543.4
