食管鳞癌组织中AMPKα1及磷酸化AMPKα的表达*
2017-06-07刘宗文郭振江楚阿兰袁金金
郭 幸,刘宗文#,张 艳,郭振江,楚阿兰,宋 锐,侯 歌,袁金金,王 成
1)郑州大学第二附属医院肿瘤放疗科 郑州450014 2)郑州大学基础医学院药理学教研室 郑州450001
食管鳞癌组织中AMPKα1及磷酸化AMPKα的表达*
郭 幸1),刘宗文1)#,张 艳2),郭振江1),楚阿兰1),宋 锐1),侯 歌1),袁金金1),王 成1)
1)郑州大学第二附属医院肿瘤放疗科 郑州450014 2)郑州大学基础医学院药理学教研室 郑州450001
#通信作者,男,1966年12月生,博士,主任医师,研究方向:肿瘤的放射治疗,E-mail:liuzwhh@sina.com
腺苷酸活化的蛋白激酶;食管癌;能量代谢
目的:探讨腺苷酸活化的蛋白激酶(AMPK)在食管鳞癌组织中的表达及临床意义。方法:运用免疫组化SP法,对61 例食管鳞癌患者的癌灶及相应正常食管黏膜组织中AMPKα1和p-AMPKα的表达进行检测。结果:食管鳞癌组织中AMPKα1蛋白阳性表达率与正常食管黏膜组织比较,差异不具有统计学意义(P>0.05);不同临床病理特征的食管鳞癌组织中AMPKα1蛋白阳性表达率差异亦无统计学意义(P>0.05)。食管鳞癌组织中p-AMPKα蛋白阳性表达率(32.7%)低于正常食管黏膜组织(73.7%),并且低分化鳞癌组织中p-AMPKα蛋白的阳性表达率低于中高分化组织(P<0.05)。食管鳞癌组织中p-AMPKα和AMPKα1的表达无关联性(rP=0.228,P>0.05)。结论:AMPK信号转导途径异常有可能与食管鳞癌的发生、发展有关。
多项研究[1-2]表明肿瘤细胞中存在能量代谢异常,而腺苷酸活化的蛋白激酶(adenosine 5′-monophosphate-activated protein kinase, AMPK)是能量代谢的调控因子。已有研究[3-4]发现,AMPK与肾细胞癌、卵巢癌、前列腺癌、非小细胞肺癌等肿瘤的发生发展有密切的关系,各种引起细胞内AMP/ATP比值升高的因素均可促使AMPK活化。AMPK磷酸化活化后抑制消耗ATP的合成代谢过程,启动生成ATP的分解代谢过程,维持机体能量代谢平衡[5-6]。作者应用免疫组化方法检测食管鳞癌组织中AMPKα1及磷酸化AMPKα(p-AMPKα)的表达情况,探讨二者与食管鳞癌之间可能存在的关系。
1 材料与方法
1.1 标本来源 组织标本由郑州大学第二附属医院和第一附属医院胸外科提供,来源于2013年11月至2015年11月经手术切除的食管癌患者,共61例,患者在手术前均未接受化疗、放疗以及其他特殊治疗,手术方式均为食管癌根治性手术,病理诊断均由医院病理专家复核确诊为鳞癌。其中男43 例,女18 例;年龄≥60岁者46例,<60岁者15例;中高分化23 例,低分化38 例;29例有淋巴结转移,32 例无淋巴结转移;临床分期为Ⅰ、Ⅱ期46 例,Ⅲ、Ⅳ期15 例;侵及浆膜25例,未侵及浆膜36例。
1.2 AMPKα1及p-AMPKα蛋白的检测 两家医院的标本均在离体30 min内分别于癌灶、癌旁3 cm以外处取材,经病理证实为鳞癌和正常食管黏膜组织。将取下的新鲜组织标本置于40 g/L多聚甲醛中固定并脱水,石蜡包埋,然后连续切片,片厚3~5 μm。免疫组化采用SP法。AMPKα1及p-AMPKα 相关抗体均购自Cell Signaling Technology公司,山羊抗兔SP二抗试剂盒、二氨基联苯胺(DAB)显色试剂盒购自北京中杉金桥生物技术有限公司。严格按照试剂说明书操作。DAB显色并蒸馏水冲洗,苏木精复染,梯度乙醇脱水,二甲苯透明,封片剂封片。以PBS代替一抗作阴性对照,以已知AMPKα1及p-AMPKα蛋白表达阳性的切片作阳性对照。判定标准[7]:阳性细胞内可出现棕黄色颗粒样物质,主要集中于细胞质。于高倍镜下观察,每张切片随机选取5个视野,计数500个细胞,计算阳性细胞比例,阳性细胞比例<25%为阴性,≥25%为阳性。
1.3 统计学处理 应用SPSS 17.0进行统计学分析。正常食管黏膜及食管鳞癌组织中AMPKα1和p-AMPKα阳性表达率的比较采用配对χ2检验,不同临床病理特征食管鳞癌组织中AMPKα1、p-AMPKα阳性表达率的比较采用χ2检验,食管鳞癌组织中p-AMPKα和AMPKα1蛋白表达的关联性分析采用列联系数,检验水准α=0.05。
2 结果
2.1 食管鳞癌和正常食管黏膜组织中AMPKα1和p-AMPKα蛋白的表达情况 AMPKα1和p-AMPKα蛋白均主要表达于细胞质,食管鳞癌组织和正常食管黏膜组织中两蛋白的表达见图1和表1、2。

A:癌组织p-AMPKα蛋白;B:癌组织AMPKα1蛋白;C:正常组织 p-AMPKα蛋白;D:正常组织AMPKα1蛋白。图1 食管鳞癌和正常食管黏膜组织中AMPKα1和p-AMPKα蛋白的表达情况(SP,×400)

表1 食管鳞癌和正常食管黏膜组织中AMPKα1蛋白的表达情况 例
χ2=3.157,P=0.643。
2.2 AMPKα1和p-AMPKα蛋白表达与食管鳞癌患者临床病理指标的关系 见表3。
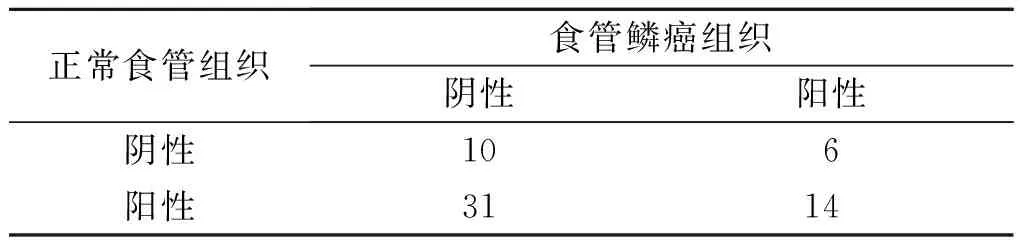
表2 食管鳞癌和正常食管黏膜组织中p-AMPKα蛋白的表达情况 例
χ2=10.015,P=0.014。
2.3 食管鳞癌组织中p-AMPKα与AMPKα1蛋白表达的关联性分析 食管鳞癌组织中p-AMPKα蛋白和AMPKα1蛋白表达无关联性,见表4。

表3 不同临床病理特征的食管鳞癌组织中AMPKα1和p-AMPKα表达的比较 例

表4 食管鳞癌组织中p-AMPKα与AMPKα1蛋白表达的关联性分析 例
rP=0.228,P=0.068。
3 讨论
糖酵解途径和线粒体的有氧氧化是细胞内能量产生的主要方式,肿瘤细胞中能量的产生主要通过糖酵解途径。肿瘤细胞以葡萄糖作为能源物质,其葡萄糖摄取和糖酵解能力维持在较高的水平,以增强其在缺血、缺氧等应激条件下的增殖和存活能力。AMPK广泛存在于真核细胞生物中,为异源三聚体,由α、β和γ亚单位组成,是高度保守的丝氨酸/苏氨酸蛋白激酶。AMPK是体内的能量调节器,在细胞间压力改变、葡萄糖耗竭、缺氧和局部缺血等情况下细胞内AMP/ATP比值增大,可以磷酸化α亚基第172位苏氨酸,从而激活AMPK,活化的AMPK可促进葡萄糖重吸收、糖酵解和脂肪酸氧化,减少脂肪酸、胆固醇和蛋白质的合成,储存能量[8-10]。AMPK的失活可使体内能量代谢及炎症反应失控,促进肿瘤的发生[11]。近年来,诸多研究表明,AMPK具有抑制肿瘤细胞生长和诱导肿瘤细胞凋亡的作用。Woodard等[12-13]应用AMPK激活剂二甲双胍或AICAR处理肾细胞癌细胞后,胞内雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的活性降低,表明二甲双胍或AICAR可增强他汀类药物对肾细胞癌细胞的细胞毒性,起到一定程度的化疗增敏作用。吴春丽等[14]的研究证实,AICAR可通过激活AMPK信号通路抑制三阴性乳腺癌细胞的增殖。Cuthbertson等[15]发现,利用合成的脂肪酸合成酶抑制剂激活AMPK,可导致人卵巢癌细胞株SKOV3细胞的凋亡。AMPK对线粒体的合成、自噬、内源性凋亡均有十分重要的调节作用[16-17]。
该研究对61 例食管鳞癌组织标本及其相应正常黏膜组织进行了AMPKα1与p-AMPKα的检测,结果显示,食管鳞癌组织中AMPKα1蛋白阳性表达率与正常食管黏膜组织比较,差异不具有统计学意义;不同临床病理特征的食管鳞癌组织中AMPKα1蛋白阳性表达率差异亦无统计学意义。但食管鳞癌组织中p-AMPKα蛋白阳性表达率显著低于正常食管黏膜组织;其表达与食管鳞癌患者的年龄、性别、浸润深度、TNM分期、淋巴结转移无关,但与组织分化程度有关,在低分化鳞癌组织中的阳性表达率低于中高分化组织。该研究并未发现食管鳞癌组织中AMPKα1与p-AMPKα的表达相关。上述结果表明食管鳞癌组织中AMPK信号转导途径异常,可能对食管鳞癌的发展及转归产生影响。
综上所述, AMPK信号转导途径异常与食管鳞癌的形成与发展关系较密切,AMPK信号转导途径因子及其活化机制有可能成为食管癌治疗、抗肿瘤药物研究的新方向。
[1]DOWLING RJ,GOODWIN PJ,STAMBOLIC V.Understanding the benefit of metformin use in cancer treatment[J].BMC Med,2011,9:33
[2]PENTA JS,JOHNSON FM,WACHSMAN JT,et al.Mitochondrial DNA in human malignancy[J].Mutat Res,2001,488(2):119
[3]刘宗文,赵志华,赵秋民,等.食管鳞癌组织中线粒体DNA拷贝数量的变化及意义[J].中国肿瘤临床,2007,34(12):667
[4]刘宗文,张中冕,杨家梅,等.人食管鳞癌EC9706细胞线粒体DNA与凋亡的关系[J].肿瘤防治研究,2010,37(8):878
[5]HANAHAN D,WEINBERG RA.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646
[6]LI W,SAUD SM,YOUNG MR,et al.Targeting AMPK for cancer prevention and treatment[J].Oncotarget,2015,6(10):7365
[7]TOWLER MC,HARDIE DG.AMP-activated protein kinase in metabolic control and insulin signaling[J].Circ Res,2007,100(3):328
[8]FAUBERT B,BOILY G,IZREIG S,et al.AMPK is a negative regulator of the Warburg effect and suppresses tumor growthinvivo[J].Cell Metab,2013,17(1):113
[9]GROENENDIJK FH,MELLEMA WW,VAN DER BURG E,et al.Sorafenib synergizes with metformin in NSCLC through AMPK pathway activation[J].Int J Cancer,2015,136(6):1434
[10]WARBURG O.On the origin of cancer cells[J].Science,1956,123(3191):309
[11]宋奎,许晓军.肿瘤细胞的糖酵解能量代谢机制[J]. 中国肿瘤临床,2012,39(16):1239
[12]WOODARD J,JOSHI S,VIOLLET B,et al.AMPK as a therapeutic target in renal cell carcinoma[J].Cancer Biol Ther,2010,10(11):1168
[13]WOODARD J,SASSANO A,HAY N,et al.Statin-dependent suppression of the Akt/mammalian target of rapamycin signaling cascade and programmed cell death 4 up-regulation in renal cell carcinoma[J].Clin Cancer Res,2008,14(14):4640
[14]吴春丽,蔡峰,孙成英.AICAR对三阴性乳腺癌体外抑制作用及其机制的探讨[J].中华肿瘤防治杂志,2013,20(17):1310
[15]CUTHBERTSON DJ,BABRAJ JA,MUSTARD KJ,et al.5-aminoimidazole-4-carboxamide 1-beta-D-ribofuranoside acutely stimulates skeletal muscle 2-deoxyglucose uptake in healthy men[J].Diabetes,2007,56(8):2078
[16]SAHA AK,RUDERMAN NB.Malonyl-CoA and AMP-activated protein kinase: an expanding partnership[J].Mol Cell Biochem,2003,253(1/2):65
[17]FAUBERT B,VINCENT EE,POFFENBERGER MC,et al.The AMP-activated protein kinase(AMPK) and cancer: many faces of a metabolic regulator[J].Cancer Lett,2015,356(2 Pt A):165
(2016-11-08收稿 责任编辑王 曼)
Expressions of AMPKα1 and p-AMPKα in esophageal squamous cell carcinoma tissue
GUOXing1),LIUZongwen1),ZHANGYan2),GUOZhenjiang1),CHUAlan1),SONGRui1),HOUGe1),YUANJinjin1),WANGCheng1)
1)DepartmentofRadiotherapy,theSecondAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450014 2)DepartmentofPharmacology,SchoolofBasicMedicalSciences,ZhengzhouUniversity,Zhengzhou450001
AMPK;esophageal carcinoma;energy metabolism
Aim: To discuss the expression of adenosine 5′-monophosphate-activated protein kinase(AMPK) in esophageal squamous cell carcinoma(ESCC) tissue and its clinical significance. Methods: The ESCC and normal esophageal mucosal epithelial tissue samples were collected from 61 ESCC patients, and the expressions of AMPKα1 and p-AMPKα were detected by immunohistochemical SP method.Results: The AMPKα1 positive expression rate in ESCC tissue had no significant difference compared with the normal esophageal mucosa tissue(P>0.05),and that among different clinical and pathological characteristics ESCC tissue had no significant difference(P>0.05). The positive expression rate of p-AMPKα in ESCC tissue(32.7%) was lower than that of normal esophageal mucosa tissue(73.7%), and that in poor differentiated ESCC tissue was lower than that in medium and high differentiated tissue(P<0.05). There was no correlation between the expressions of p-AMPKα and AMPKα1 in ESCC tissue(rP=0.228,P>0.05).Conclusion: Abnormal activation of AMPK pathway may be related to the occurrence and development of ESCC.
10.13705/j.issn.1671-6825.2017.03.004
*河南省基础与前沿技术研究计划项目 132300410409;河南省医学科技攻关计划项目(省部共建项目) 201401009;郑州市科技计划项目 131PCXTD628
R735.1
