正常宫颈上皮细胞原代培养体系的改良*
2017-06-07荣守华智艳芳樊婷婷李肖甫
李 雅,荣守华,智艳芳,樊婷婷,邱 翠,李肖甫
郑州大学第三附属医院细胞室 郑州 450052
正常宫颈上皮细胞原代培养体系的改良*
李 雅,荣守华,智艳芳,樊婷婷,邱 翠,李肖甫#
郑州大学第三附属医院细胞室 郑州 450052
#通信作者,男,1964 年7 月生,硕士,教授,研究方向:肿瘤细胞病理学,E-mail:lixiaofu1964@163.com
原代培养;宫颈上皮细胞;中性蛋白酶;角质细胞无血清培养基
目的:探索一种高效、可重复的正常宫颈上皮细胞原代培养方法。方法:取60例正常宫颈组织,分成2组,分别采用Ⅱ型中性蛋白酶联合0.25 g/mL胰蛋白酶-EDTA(中性蛋白酶联合法)及Ⅰ型胶原酶消化分离后进行原代培养,比较两种分离效果;观察采用中性蛋白酶联合法消化不同时间对分离效果的影响。观察添加体积分数5%FBS dK-SFM培养基与单纯dK-SFM培养基培养原代宫颈上皮细胞的生长曲线差异,并用形态学、广谱角蛋白免疫细胞化学染色鉴定细胞来源。结果:正常宫颈上皮细胞原代培养总成功率为40%。中性蛋白酶联合法成功率、分离所得细胞密度、原代细胞融合时间及细胞纯度均高于Ⅰ型胶原酶消化法(P<0.05)。中性蛋白酶消化20 h的分离效果优于消化16和24 h(P<0.05)。体积分数5%FBS dK-SFM培养基原代培养的宫颈上皮细胞增殖活性高于单纯dK-SFM培养基(P<0.05)。细胞生长状况良好,可在体外传代至5~6代,并可冻存与复苏,免疫细胞化学染色显示广谱角蛋白表达阳性。结论:Ⅱ型中性蛋白酶联合0.25 g/mL胰蛋白酶-EDTA分离法和体积分数5% FBS dK-SFM培养基培养原代正常宫颈上皮细胞,高效、可重复性好。
刚离体的原代细胞保留有原有的生物学遗传特性,能反映体内细胞生长的一般特征,适用于药物及癌症治疗等研究[1-2]。正常宫颈上皮细胞原代培养对于深入研究人类乳头瘤病毒(human papilloma virus,HPV)在宫颈癌发生发展中的作用机制至关重要。从理论及实际操作的角度而言,建立正常宫颈上皮细胞及携带HPV的宫颈上皮细胞的体外细胞模型,有利于更好地了解HPV 感染宫颈上皮细胞的病理改变,而且较体内动物实验更为简便易行。但原代细胞获得过程较复杂、细胞纯度低且培养困难,限制了宫颈原代细胞的应用。虽然目前已有少量对正常宫颈上皮细胞原代培养的研究[3-5],但一直尚无公认且成熟稳定的正常宫颈上皮细胞原代培养方法。因此,该研究通过比较不同分离方法、不同培养基对正常宫颈上皮细胞原代培养的影响,旨在探寻一种最佳的正常宫颈上皮细胞原代培养方法,为宫颈癌发病机制的研究打下坚实的基础。
1 材料与方法
1.1 主要试剂与仪器 Ⅰ型胶原酶、Ⅱ型中性蛋白酶购于美国Sigma公司,无血清角质细胞培养基dK-SFM购于美国Gibco公司,DMEM/F12培养基购于美国Hyclone公司,0.25 g/mL胰蛋白酶-EDTA、D-PBS、Ⅰ型鼠尾胶原均购于北京索莱宝科技有限公司,鼠抗人广谱细胞角蛋白单克隆抗体购于美国Cell Signaling Technology公司,兔抗人波形蛋白多克隆抗体、即用型免疫组织化学试剂盒购于上海生工生物工程有限公司,CCK-8购于日本同仁公司,无菌细胞爬片购于无锡耐思生物科技有限公司。CO2培养箱为美国Thermo公司产品,倒置相差显微镜(日本Olympus公司产品)。1.2 正常宫颈上皮组织来源 选取2015年9月至2016年4月在郑州大学第三附属医院妇科因良性子宫病变(如子宫肌瘤、子宫腺肌病等)行子宫全切术患者的宫颈标本60例,患者年龄43~54岁,中位年龄47岁;术前液基细胞学及HPV检测结果均为阴性,且术后追踪组织学结果提示无宫颈异常病变。所有患者均签署知情同意书。无菌条件下术中子宫离体后立即取宫颈鳞柱交界区上皮组织2~3块,每块大小约1 cm×1 cm×1 cm,置于含10 mL提前预冷的DMEM-F12转移培养基的离心管中,转移至含双抗(青、链霉素)的培养基内,20 min内4℃低温转运。1.3 实验分组 分为2组,每组30例,分别采用中性蛋白酶联合法及Ⅰ型胶原酶法进行分离及原代培养。
1.4 正常宫颈上皮细胞的体外分离
1.4.1 宫颈上皮细胞的分离 将标本转移至含双抗预冷D-PBS溶液的培养皿中,剪去血污及结缔组织,浸泡5 min,并用预冷D-PBS溶液冲洗5次。①中性蛋白酶联合法:将标本平均分为3份,加入5 mL(2.4 U/mL)Ⅱ型中性蛋白酶溶液并转移至15 mL离心管中,4 ℃ 过夜消化,分别消化16、20和24 h后,室温下于超净工作台静置1 h,用眼科弯镊沿一个方向完整分离整块上皮组织,再次用含双抗的D-PBS溶液冲洗3次,用眼科剪将其剪碎,加入0.25 g/mL胰蛋白酶-EDTA 5 mL,转移至15 mL离心管,37 ℃消化10 min后,加入体积分数10%完全基础培养基终止消化,吹打离散2 min,静置2 min。②Ⅰ型胶原酶法:用眼科剪将组织剪碎至糊状,加入Ⅰ型胶原酶(0.2 g/mL)溶液5 mL并转移至15 mL离心管,37 ℃消化50 min,待组织边缘模糊、酶消化液变稍浑浊,加入体积分数10%完全基础培养基稀释终止消化。吸取上清液,用200目滤网过滤至15 mL离心管中,1 500 r/min离心5 min,弃上清,用5 mL的dK-SFM培养基重悬细胞。
1.4.2 原代培养及传代培养 原代培养:调整细胞悬液浓度为3×105mL-1,接种于Ⅰ型鼠尾胶原(2 μg/cm2)预包被的25 cm2培养瓶,置于体积分数5% CO2、37 ℃培养箱进行原代培养。48 h后首次换液,之后每2 d更换新鲜培养液。若细胞背景干净,可每2 d给予半换液,细胞对数生长期除外。倒置相差显微镜下观察细胞的生长状况及细胞融合时间。 传代培养:当细胞生长至70%~80%融合,PBS冲洗,加入1 mL 0.25 g/mL胰蛋白酶-EDTA,室温下放置0.5 min,吸弃胰酶,置于37 ℃培养箱3 min,倒置相差显微镜下观察细胞逐渐变亮、变圆,并出现流沙样运动时,立即加入完全培养基终止消化,将单细胞悬液分为两等份,1 500 r/min分别离心5 min,弃上清液,进行传代培养。实验分为两组,一组为原代和传代培养均添加体积分数5%FBS的dK-SFM组,另一组为原代和传代培养均采用的单纯dK-SFM组。
1.5 细胞计数 倒置相差显微镜下用细胞计数板计数所得的细胞密度及中性蛋白酶联合法消化不同时间所得的细胞数量。实验重复3次。
1.6 细胞活力的测定 将细胞悬液与0.4 g/mL台盼蓝以体积比9:1混匀,3 min内在倒置相差显微镜下计数活细胞与死细胞,死细胞被染成蓝色,活细胞呈透明状,不着色。细胞活力=活细胞数/(活细胞数+死细胞数)×100%。实验重复3次。
1.7 正常宫颈上皮细胞的免疫细胞化学鉴定 选取广谱细胞角蛋白抗体为上皮细胞鉴定标志物,间质细胞标志物波形蛋白抗体为阴性对照,将细胞接种于同样预包被的6孔培养板中,调整细胞密度为(1~2)×105mL-1,生长约3 d细胞融合至70%~80%,用40 g/L多聚甲醛常温固定 20 min后,加入广谱细胞角蛋白抗体和波形蛋白抗体,4 ℃过夜孵育,按二抗试剂盒操作说明加入二抗,DAB显色,苏木精复染,中性树胶封片。以胞质呈棕黄色为阳性染色细胞。倒置相差显微镜下随机选取5个高倍视野(×400),计数阳性细胞和同一视野下细胞总数。正常宫颈上皮细胞的纯度/(%)=阳性细胞数/细胞总数×100%,实验重复3次。
1.8 CCK-8法绘制细胞生长曲线 取第2代对数生长期添加体积分数5%FBS dK-SFM培养基和单纯dK-SFM培养基的细胞。常规0.25 g/mL胰蛋白酶-EDTA消化,调整细胞密度至1×104mL-1,将细胞悬液接种于96孔板,100 μL/孔,每组设5个复孔。细胞贴壁后第1天开始,每孔加入CCK-8试剂10 μL,37 ℃继续孵育2 h,检测450 nm处吸光度(OD)值。实验重复3次,绘制第1~7天细胞生长曲线。
1.9 统计学处理 采用SPSS 17.0进行分析。两种分离方法分离的细胞密度、原代细胞融合时间的比较采用两独立样本t检验,成功率的比较采用χ2检验,细胞纯度的比较采用Fisher精确概率法。中性蛋白酶联合法不同消化时间的分离细胞密度、细胞活力、原代细胞融合时间、原代所获细胞数量比较采用单因素方差分析,两两比较采用Bonfrroni检验。检验水准α=0.05。
2 结果
2.1 细胞的原代培养情况 共收集标本60例,培养成功24例(总培养成功率为40%)。其中中性蛋白酶联合法培养成功16例,Ⅰ型胶原酶法培养成功8例。
2.2 两种分离方法对细胞原代培养效果的影响 中性蛋白酶联合法成功率、分离所得细胞密度、原代细胞融合时间及细胞纯度均高,见表1。中性蛋白酶联合消化法分离所得细胞数量明显多于Ⅰ型胶原酶法,见图1。
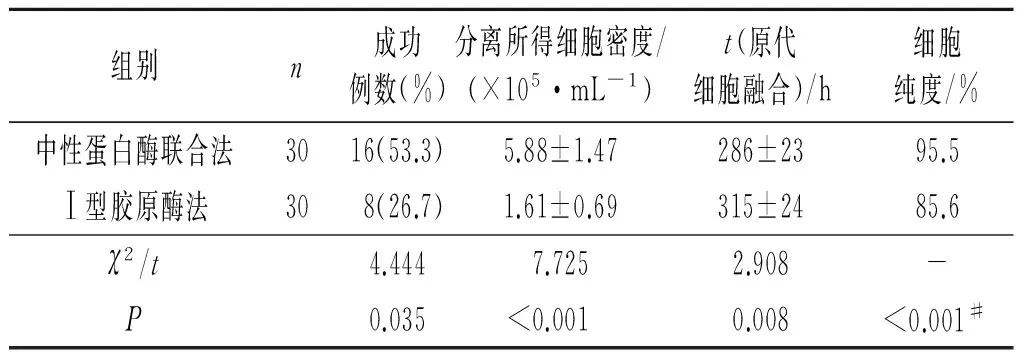
表1 不同方法分离效果的比较
#:精确概率法。
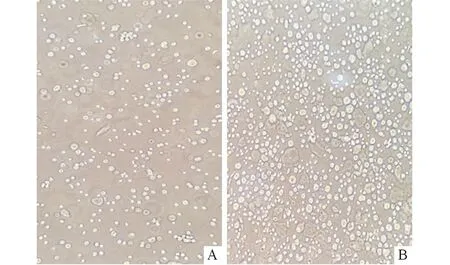
A:Ⅰ型胶原酶消化法;B:中性蛋白酶联合法。图1 两种方法分离所得的原代正常宫颈上皮细胞(×200)
2.3 中性蛋白酶联合法不同消化时间对培养效果的影响 中性蛋白酶联合法在消化20 h时所得细胞密度、细胞活力、原代细胞融合时间及原代所获细胞量均高于消化16和24 h,见表2。
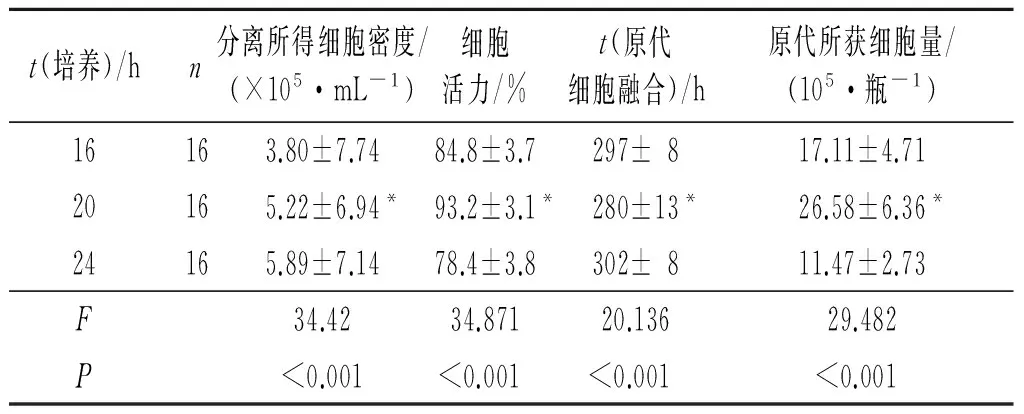
表2 中性蛋白酶联合法不同消化时间培养效果的比较
*:与培养16和24 h比较,P<0.05。
2.4 细胞原代和传代培养的形态学观察 经中性蛋白酶联合消化分离、采用体积分数5% FBS dK-SFM培养基培养48 h,可见细胞大部分贴壁伸展,呈多角形或圆形,成团聚集分布,胞核明显,少量成纤维细胞呈纺锤形,围绕上皮细胞呈旋涡状或放射状排列。细胞从第5天开始增殖速度明显加快,生长至大约第12天细胞融合可达70%~80%,细胞之间紧密相连,胞核清晰,呈典型铺路石样形态,见图2A。
传代细胞于24 h即可贴壁伸展,第3~4代细胞形态略大小不等,呈多角形或圆形,胞体饱满,胞质丰富,胞核清晰,可见明显核仁,增殖速度较快,第7~8天细胞融合可达70%~80%,见图2B。第5~6代细胞形态大小不等,胞体增大,胞质颗粒增多,胞核较大,空泡化明显,增殖速度较前减慢,约8~10 d细胞融合达70%左右,见图2C。正常宫颈上皮细胞在体外可传至5~6代,最终衰老从瓶底脱落。原代培养的正常宫颈细胞可进行冻存及复苏,细胞复苏后可保持正常形态,见图2D,且可继续传1~2代。
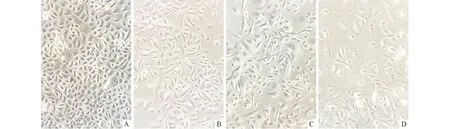
A:原代正常宫颈上皮细胞体外培养12 d;B:第2次传代的正常宫颈上皮细胞体外培养7 d; C:第4次传代的正常宫颈上皮细胞体外培养9 d;D:正常冻存宫颈上皮细胞复苏后7 d。图2 正常宫颈上皮细胞培养的形态学特征(×200)
2.5 宫颈上皮细胞的免疫细胞化学鉴定结果 培养的原代细胞95%以上角蛋白染色阳性表达,见图3。
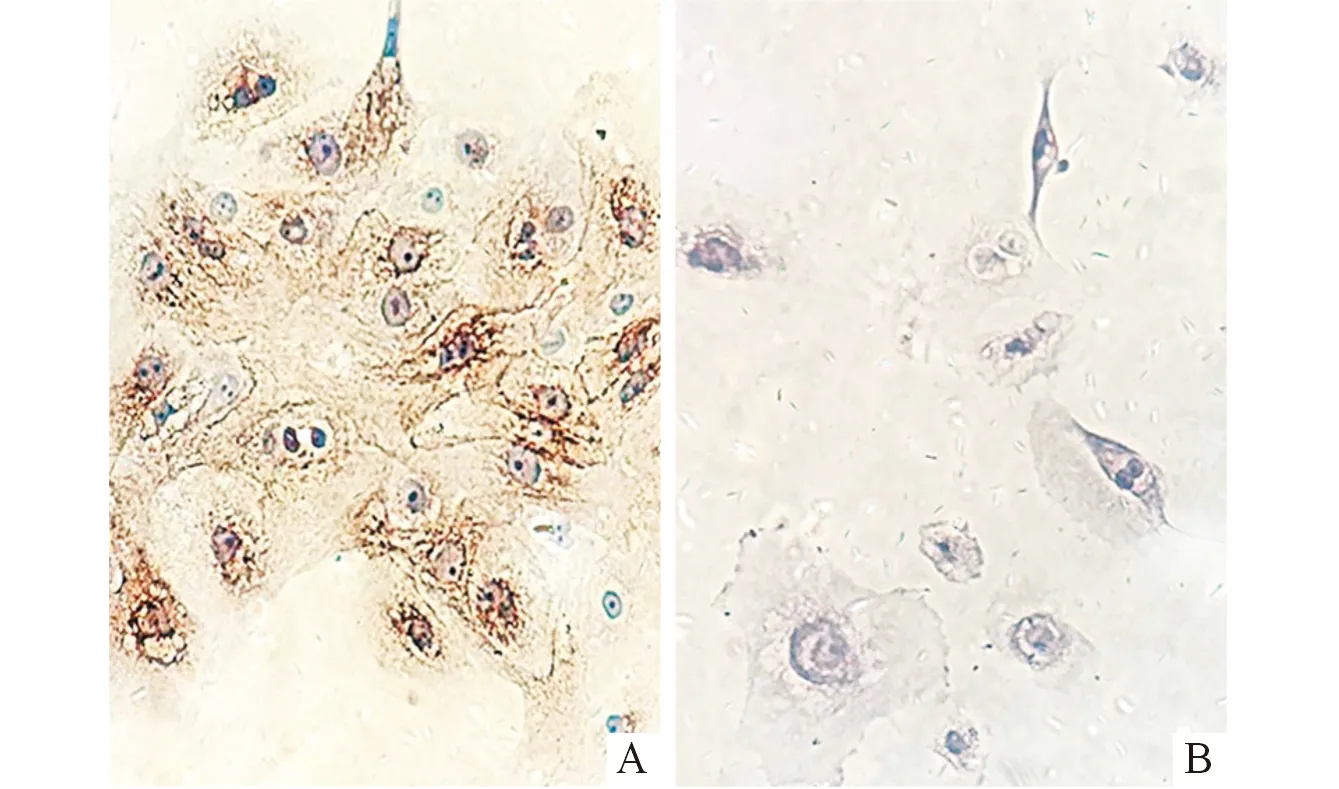
A:抗广谱角蛋白抗体染色;B:抗波形蛋白抗体染色。图3 原代正常宫颈上皮细胞免疫细胞学鉴定结果(×400)
2.6 两种培养基培养的第2代细胞生长曲线 体积分数5% FBS dK-SFM培养基培养的细胞增殖活性高于单独dK-SFM培养基,见图4。
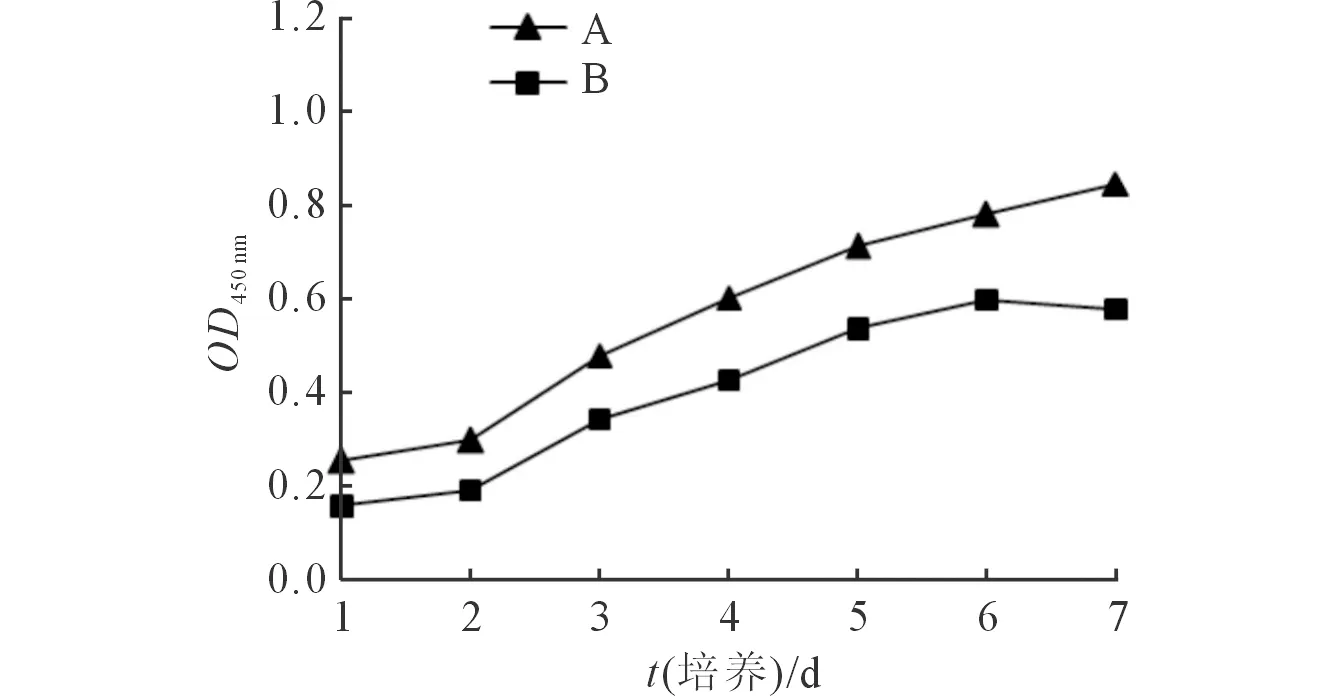
A:体积分数5%FBS dK-SFM培养基;B:dK-SFM培养基。图4 两种培养基培养的第2代细胞生长曲线
3 讨论
既往研究[6]报道,单独采用0.25 g/mL胰蛋白酶-EDTA分离法和单独采用Ⅰ型胶原酶37 ℃消化40 min均能成功对正常宫颈上皮细胞进行原代培养,但分离的细胞纯度及细胞量不令人满意。作者也尝试单独采用0.25 g/mL胰蛋白酶-EDTA在不同的消化时间进行消化分离,但所得宫颈上皮细胞密度低、活性差且不易贴壁,究其原因可能与胰蛋白酶可降解细胞表面的蛋白质,容易消化过度造成细胞损伤有关。中性蛋白酶消化不破坏表皮间的细胞连接,可完整地将上皮层从结缔组织分离,保留基底层,从而减少具有增殖能力细胞的损伤[7]。所以该研究采用Ⅱ型中性蛋白酶联合胰蛋白酶进行消化分离,发现中性蛋白酶联合法与单独Ⅰ型胶原酶消化法相比,可完整分离上皮组织,消化所得上皮细胞纯度较高,且随上皮细胞的增长,纤维细胞逐渐减少,无需进行特殊纯化。中性蛋白酶联合法分离成功率、所得细胞密度、原代细胞融合时间及细胞纯度均高于单独使用Ⅰ型胶原酶。曾有学者[8-10]报道,采用Ⅱ型中性蛋白酶联合0.25 g/mL胰蛋白酶和0.01%Ⅰ型胶原酶的分离方法,但缺乏原代培养方法的具体消化时间点及具体步骤。作者对中性蛋白酶过夜消化的时间进行反复摸索,最终选择16、20和24 h 3个时间点,分别对其消化效果进行比较分析,结果表明中性蛋白酶消化20 h所得的细胞数量、细胞活力最佳,细胞达融合的时间最短。
报道[11]称用3T3照射过的小鼠成纤维细胞与上皮细胞共培养,其提供的生长因子可促进上皮细胞的生长。后来,有研究[12]发明了无3T3照射细胞,含牛垂体浸膏且专用于宫颈上皮细胞培养的MCDB153培养基,直至目前进一步改良的无血清KSFM培养基。KSFM培养基因无血清成分,可有效抑制成纤维细胞的生长,其添加的表皮生长因子(EGF)、牛脑垂体提取物(BPE)等能够特异地促进上皮细胞贴壁与生长,已广泛应用于各种类型上皮细胞的原代培养[13-15]。但是血清中所含有的某些营养成分又是人工无血清培养基无法替代的。因此,该研究选择体积分数5%FBS dK-SFM培养基与单独dK-SFM培养基进行比较,结果显示前者细胞贴壁和增殖活性优于单独dK-SFM,且不至于导致纤维细胞的过度增长,与Liu等[6]的报道相似。且作者在细胞贴壁后采用含体积分数5%FBS的dK-SFM进行原代及传代培养,经免疫细胞化学鉴定角蛋白表达阳性,证明培养的细胞为上皮细胞来源,并可判断培养细胞的纯度。采用此方法培养的原代细胞,第3~4代细胞形态最佳,增殖速度最快,而第5~6代的细胞逐渐老化、增殖缓慢,因此,建议采用第3~4代细胞进行实验。
由于宫颈在体内处于半开放环境,而患者术前常伴有阴道细菌、真菌感染或者阴道出血病史,且原代培养操作步骤繁多,均大大增加了宫颈细胞原代培养污染的概率。该研究在培养期间出现过污染现象,推测很可能与高压后的器械未及时烘干,导致器具污染、试剂污染或组织本身污染等有关。
总之,采用Ⅱ型中性蛋白酶联合0.25 g/mL胰蛋白酶-EDTA分离细胞和体积分数5%FBS dK-SFM培养基培养的原代正常宫颈上皮细胞生长状况最佳,可在体外增殖及传至5~6代。
[1]SCHÖNTHAL AH, WARREN DW, STEVENSON D, et al. Proliferation of lacrimal gland acinar cells in primary culture.Stimulation by extracellular matrix,EGF,and DHT [J].Exp Eye Res,2000,70(5):639
[2]王雪峰,何援利,刘木彪,等.携带Bcl-2基因的慢病毒对原代培养的人卵巢颗粒细胞的影响[J].解放军医学杂志,2012,37(8):760
[3]曹颖,金哲,于妍妍,等.成人宫颈上皮细胞的原代培养及鉴定[J].现代生物医学进展,2012,12(2):204
[4]江静,邓齐,马营营,等.成人宫颈上皮细胞的原代培养及影响因素[J].中国妇幼保健,2014,29(10):1495
[5]王雪银,刘玉珍,陈昭日,等.人正常宫颈上皮细胞的体外分离及细胞活性比较[J].现代妇产科进展,2014,23(3):188
[6]LIU YZ,LÜ XP,PAN ZX,et al.Establishment of a novel method for primary culture of normal human cervical keratinocytes[J].Chin Med J,2013,126(17):3344
[7]STENN KS,LINK R,MOELLMANN G,et al.Dispase, a neutral protease from Bacillus polymyxa, is a powerful fibronectinase and type Ⅳ collagenase[J].J Invest Dermatol,1989,93(2):287
[8]TREMELLEN G, MOTTERSHEAD B, TREMELLEN K, et al. TGF-β mediates proinflammatory seminal fluid signaling in human cervical epithelial cells[J].J Immunol,2012,189(2):1024
[9]SHARKEY DJ,MACPHERSON AM,TREMELLEN KP.Seminal plasma differentially regulates inflammatory cytokine gene expression in human cervical and vaginal epithelial cells[J].Mol Hum Reprod,2007,13(7/8):491
[10]PALANTAVIDA S,GUZ NV,WOODWORTH CD,et al.Ultrabright fluorescent mesoporous silica nanoparticles for prescreening of cervical cancer[J].Nanomedicine,2013,9(8):1255
[11]PEEHL DM,HAM RG.Growth and differentiation of human keratinocytes without a feeder layer or conditioned medium[J].In Vitro,1980,16(6):516
[12]BOYCE ST,HAM RG.Calcium-regulated differentiation of normal human epidermal keratinocytes in chemically de-fined clonal culture and serum-free serial culture[J].J Invest Dermatol,1983,81(1 Suppl):33s
[13]YOKOO S,YAMAGAMI S,USUI T,et al.Human corneal epithelial equivalents for ocular surface reconstruction in a complete serum-free culture system without unknown factors[J].Invest Ophthalmol Vis Sci,2008,49(6):2438
[14]JEAN J,BERNARD G,DUQUE-FERNANDEZ A,et al.Effects of serum-free culture at the air-liquid interface in a human tissue-engineered skin substitute[J].Tissue Eng Part A,2011,17(7/8):877
[15]赵超,白丽霞,屠铮,等.人乳头状瘤病毒16型E6、E7基因转染的人宫颈上皮永生化细胞系的建立及鉴定[J].中国妇产科临床杂志,2006,7(4):278
(2016-09-23收稿 责任编辑李沛寰)
An improved culture system for the primary culture of normal cervical epithelial cells
LIYa,RONGShouhua,ZHIYanfang,FANTingting,QIUCui,LIXiaofu
DepartmentofCytopathology,theThirdAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
primary culture;cervical epithelial cell;dispase;dK-SFM
Aim: To explore an effective and repeatable method for the primary culture of normal cervical epithelial cells. Methods: A total of 60 normal human ectocervical tissue were collected and divided into two groups, primarily cultured using combined type Ⅱdispase and 0.25 g/mL trypsin-EDTA digestion method and type Ⅰ collagenase digestion method separately, and to compare the effectiveness of isolation, furthermore, to observe the detached effectiveness of combined dispase digestion method after digestion for different time. Cervical epithelial cells were cultured in 5% FBS dK-SFM and dK-SFM alone, respectively, to observe the growth of the primary cervical cells. The cultured cells were identified by the morphological analysis and pancytokeratin was identified by immunocytochemistry.Results: The total success rate of the primary culture in this study was 40%. The success rate, density, primary cell fusion time and purity of cells of the dispase digestion group were all higher than those of collagenase digestion group(P<0.05). The dispase digestion for 20 h was more effective than digestion for 16 and 24 h(P<0.05). The cell growth curve showed that the cells cultured in 5% FBS dK-SFM grew better and had a higher viability than cells cultured in dK-SFM alone(P<0.05). The primary cultured cells grew well and could be subcultured for five to six generations,and they also could be cryopreserved and resuscitated. Pancytokeratin positive staining was determined by immunocytochemistry. Conclusion: It is an effective and repeatable method for primary culture of normal cervical epithelial cells by using combined type Ⅱ dispase and 0.25 g/mL trypsin-EDTA digestion and 5% FBS dK-SFM medium.
10.13705/j.issn.1671-6825.2017.03.032
*河南省医学科技攻关计划资助项目 201503112
R711.74