细胞因子诱导杀伤细胞对结肠癌HCT116细胞株的杀伤作用
2017-06-05李智奇崔勇
李智奇,崔勇
(1 广东医科大学研究生院,广东湛江 524000;2 深圳市南山区蛇口人民医院)
细胞因子诱导杀伤细胞对结肠癌HCT116细胞株的杀伤作用
李智奇1,崔勇2
(1 广东医科大学研究生院,广东湛江 524000;2 深圳市南山区蛇口人民医院)
目的 探讨细胞因子诱导杀伤(CIK)细胞对结肠癌HCT-116细胞株的杀伤作用。方法 分离提取健康人外周血单个核细胞诱导成CIK细胞并进行体外扩增培养;采用WST-1法检测CIK细胞对结肠癌HCT116细胞株的杀伤活性,ELISA法检测单独CIK细胞及效靶细胞(CIK细胞混合HCT116细胞)的TNF-α分泌水平。结果 CIK细胞数量在体外培养的第14天达峰值,在培养第9天免疫表型趋于成熟。CIK细胞培养第19天,当效靶比为20∶1时,单独CIK细胞及效靶细胞培养液TNF-α浓度分别为(18.30±4.87)、(33.57±9.05)ng/mL;效靶细胞培养液TNF-α浓度高于单独CIK细胞(P<0.05)。效靶比为20∶1时,在培养第14天CIK细胞杀瘤能力最强(P均<0.05)。效靶比为40∶1时,在第9天CIK细胞的杀瘤能力最强(P均<0.05)。结论 CIK细胞在体外对结肠癌HCT-116细胞有较强的杀伤作用,在杀瘤过程中CIK细胞可以促进细胞因子TNF-α的分泌。
结肠肿瘤;HCT-116细胞;CIK细胞;肿瘤坏死因子-α
细胞因子诱导杀伤(CIK)细胞是由 CD3单抗、IFN-γ及IL-2 等细胞因子在体外刺激外周血单核细胞(PBMC)而产生的一类非特异性新型免疫活性细胞。该细胞既有T 淋巴细胞强大的抗瘤活性,又具备非主要组织相容性复合物限制性杀瘤特点[1]。因此,抗肿瘤过继免疫治疗首选CIK细胞。结肠癌是我国常见的恶性肿瘤之一,中晚期患者治疗效果尚不能令人满意。2016年4~10月本研究通过体外诱导并培养扩增CIK细胞,检测CIK细胞对结肠癌HCT-116细胞株的杀伤能力以及CIK细胞在杀伤HCT-116时的TNF-α分泌水平,以期为利用CIK细胞治疗结肠癌提供理论依据。
1 材料与方法
1.1 主要材料 ELISA试剂盒(美国BioLegend公司)、WST-1试剂盒(中国华夏远洋公司)、FACSCantoⅡ流式细胞仪(美国BD公司)、酶标仪(美国Thermo公司)、人结肠癌 HCT116 细胞株(北科生物公司细胞库)。
1.2 CIK细胞制备 将20 mL DPBS加入CKⅠ、CKⅡ、CKⅢ试剂盒,4 ℃避光过夜包被T175培养瓶制备PBMC细胞。第2天视情况补加CIK细胞培养液60 mL、血浆5 mL、CKⅦ 1 mL。第4天视情况补加CIK细胞培养液50 mL,加入血浆5 mL。第5天加入CKⅧ 1 mL于培养瓶中,将培养瓶中的细胞完全吹打下来以后全部转移至培养袋,培养基添加细胞至浓度为1×105/mL。
1.3 CIK细胞增观察及表型检测 培养过程中动态观察细胞增殖情况,台盼蓝细胞染色计数细胞扩增倍数。第9天开始收集细胞进行间接免疫荧光抗体染色,经流式细胞仪分析CIK细胞表型,测定CD3+CD56+、 CD3+CD8+双阳性细胞百分比。
1.4 CIK细胞对结肠癌HCT-116细胞株作用的形态学观察 把 CIK细胞和结肠癌HCT-116细胞以效靶比5∶1、10∶1、20∶1、40∶1、80∶1接种于96孔板,放于37 ℃ 、 5% CO2培养箱培养,设同时铺板单纯培养的结肠癌HCT-116细胞为对照,24 h后置于倒置显微镜下观察共培养细胞与同时铺板结肠癌HCT-116细胞的形态学差异。
1.5 CIK细胞TNF-α分泌水平检测 首先通过试剂盒检测不同浓度TNF-α与吸光度值的关系。然后选取杀瘤能力较强的CIK细胞杀伤结肠癌HCT-116细胞株24 h后,采用ELISA试剂盒检测不同比例效靶细胞及CIK细胞的TNF-α分泌水平。
1.6 CIK细胞杀伤作用检测 调整HCT-116细胞浓度为1.0×104/mL,置于96孔平底培养板中,每孔100 μL,于37℃、5%CO2细胞培养箱中培养24 h后加入不同培养天数不同浓度的CIK细胞100 μL为效应细胞(即效靶细胞组),并设置效靶比为5∶1、10∶1、20∶1、40∶1、80∶1。同时设单独效应细胞和单独靶细胞组为对照组,每组设5个复孔,放于37 ℃、5%CO2培养箱培养24 h,然后每孔加WST-1 10 μL,轻微震荡后继续培养2.5 h。将96孔板置于酶标仪于450 nm处测定吸光度值(A值),并计算CIK细胞对HCT-116细胞株的杀伤活性。杀伤活性(%)=1-(效靶细胞A值-单纯CIK细胞A值)/单独靶细胞A值
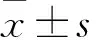
2 结果
2.1 CIK细胞增殖动态及其表型 PBMC在加入相关刺激因子后,细胞体积逐渐变大,细胞胞质越来越丰富,细胞核逐渐增大。第3~5天细胞开始聚集,成簇状克隆样生长。第0~5天CIK细胞增殖不明显,第9天细胞增值50倍,第5~12天处于快速增殖期,第14天达到增殖高峰,第16~25天细胞数增长不明显,保持稳定。见图1。第9天CIK细胞中CD3+CD8+表达为 77.46%,CD3+CD56+表达为7.79%。此时的CIK细胞已经具备一定的杀瘤能力。
2.2 CIK细胞作用后HCT116细胞形态变化 倒置显微镜下,结肠癌HCT-116细胞株呈多角贴壁生长,包膜完整,生长旺盛。但CIK细胞与HCT-116作用24 h后,效应细胞聚集在HCT-116周围,细胞融合胀大并发生吞噬作用,肿瘤细胞HCT-116轮廓模糊不清,外形皱缩,部分细胞裂解。

图1 不同培养天数CIK细胞数量
2.3 效靶细胞及CIK细胞TNF-α分泌变化 选取培养第19天观察CIK杀瘤24 h 后不同效靶比的效靶细胞及CIK细胞TNF-α分泌水平,显示当CIK细胞数为2×105/100 μL,亦即效靶比为20∶1时,效靶细胞TNF-α分泌水平最高(P<0.05)。见表1。
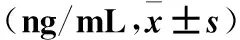
表1 培养19天时不同效靶比效靶细胞及单独CIK细胞TNF-α分泌水平
2.4 CIK细胞对HCT-116细胞的杀伤效果 在第9、12、14、17、19、24天取效靶比分别为40∶1、20∶1、10∶1及5∶1检测CIK 细胞进对HCT-1细胞的杀伤效应。当效靶比为20∶1时,在第14天CIK细胞的杀伤效应最强,与第9、12、17、19、24天CIK细胞杀瘤能力两两对比有统计学差异(P均<0.05)(见图2);在效靶比为40∶1时,在第9天CIK细胞的杀瘤能力最强,分别与12、17、19、24天CIK细胞杀瘤能力两两对比有统计学意义(P均<0.05)(见图3)。
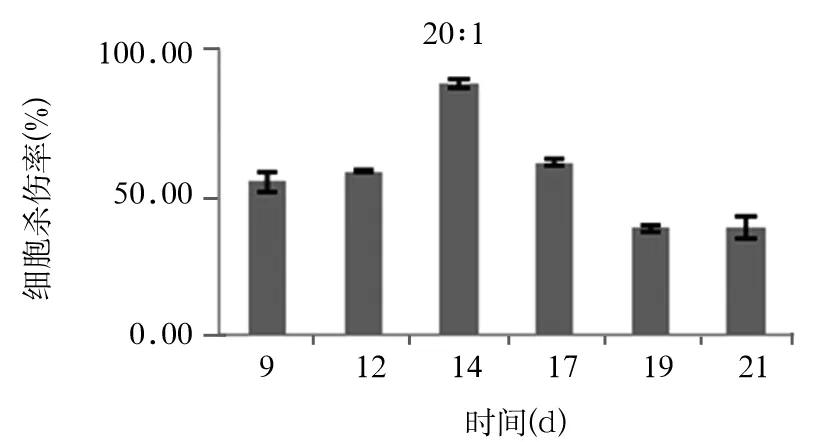
图2 效靶比20∶1时不同培养时间CIK细胞杀瘤效果
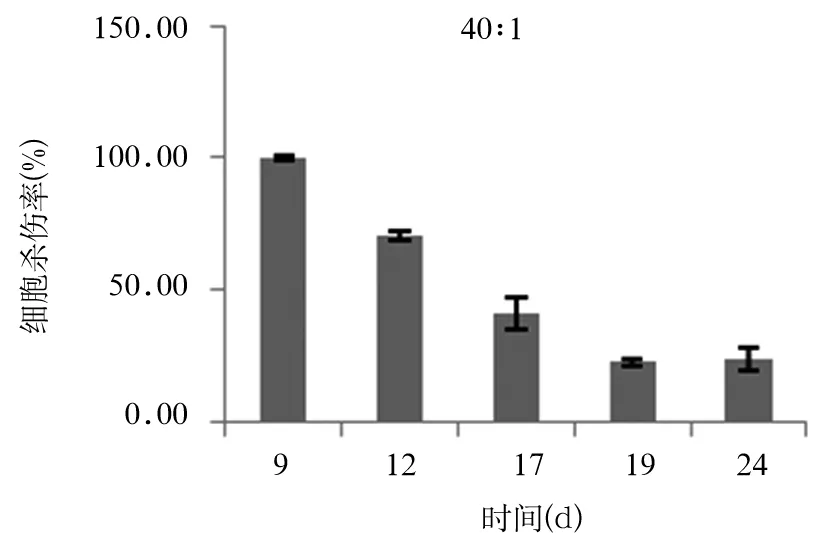
图3 效靶比40∶1时不同培养时间CIK细胞杀瘤效果
3 讨论
结肠癌是全球第三大常见的癌症,其发病率和病死率仅次于肺癌和胃癌[2],中晚期患者治疗效果不尽如人意。近年来,体外扩增CIK细胞回输患者体内治疗晚期结肠癌已经成为继手术、放疗、化疗后的第四种治疗模式[3,4]。CIK主要的效应细胞是CD3+CD56+细胞。由于同时表达 CD3 和 CD56 两种膜蛋白分子,CIK 细胞在表型上兼具 NK 细胞和 T 细胞的表型特征,在功能上也兼具二者的杀伤特点[5,6]。本研究发现,在培养开始的第3~4天, PBMC细胞增殖不明显, 在第5天,其中的单核细胞开始进入对数生长,第12~14天CIK细胞数达到峰值,在第16天开始细胞数基本保持稳定。提示如收获CIK细胞用于体外实验或临床治疗应选择培养后的第12~16天,这与王家祥等[7]报道稍有不同,此可能与外周血来源及培养方法不同有关。因本研究培养CIK细胞用培养瓶而非培养袋,一定程度上限制了CIK细胞的增殖。CIK细胞在第9天时,CD3+CD8+表达为 77.46%,CD3+CD56+表达为7.79%,此时的CIK细胞已基本成熟,与王士勇等[8,9]报道在成熟时间上有一定差异,这可能与献血者的个人身体状况有关。
研究证实,CIK细胞除直接对肿瘤细胞产生杀伤作用外,还能够通过分泌IL-2、IL-6、IFN-γ、TNF-α以及GM-CSF等多种细胞因子继而调节机体的免疫来进一步增强CIK细胞抗肿瘤活性[10,11]。其中肿瘤坏死因子TNF-α是来源于巨噬细胞和单核细胞的细胞因子,通过活化肿瘤血管导致组织出血坏死和诱导肿瘤细胞凋亡在体内具有抗肿瘤活性。本研究通过检测不同效靶比情况CIK细胞杀伤HCT-116细胞时TNF-α的分泌水平,证实CIK细胞在杀伤肿瘤细胞HCT-116的过程中能够促进TNF-α的分泌,
当效靶比为20∶1时,能显著促进TNF-α的分泌。CIK细胞对多种肿瘤细胞具有杀伤作用,在本研究发现在第9~19天CIK细胞对HCT细胞株的杀伤能力不同效靶比之间存在差异。当效靶比为20∶1时,在第14天CIK细胞的杀伤效应最强;在效靶比为40∶1时,在第9天CIK细胞的杀瘤能力最强。提示采用CIK细胞对结肠癌患者进行临床细胞免疫治疗时不仅要选择适当培养天数的CIK细胞,而且还需要保证输注足够数量的细胞才能确保疗效。至于临床治疗所需的最佳细胞培养时间以及针对不同患者所需的细胞数量尚需体内实验进一步研究。
[1] 黄刚,薛重重. CIK与DC细胞免疫治疗在血液肿瘤中的临床应用[J].中华全科医学,2009,7(7):758-760.
[2] Purushotham AD, Lewison G, Sullivan R. The state of research and development in global cancer surgery[J]. Ann Surg, 2012,255(3):427-432.
[3] Wu C,Jiang J,Shi L,et al. Prospective study of chemotherapy in combination with cytokine-induced killer cells in patients suffering from advanced non-small cell lung cancer[J].Anticancer Res, 2008,28( 6B):3997-4002.
[4] 蒋敬庭,吴昌平,Nilsson-Ehle P,等. CIK细胞治疗老年人中晚期胃癌的副反应分析[J]. 肿瘤,2006,26(10):950-952.
[5] Schmidt-Wolf IG, Lefterova P, Mehta BA, et al. Phenotypic characterization and identification of effector cells involved in tumor cell recognition of cytokine-induced killer cells[J]. Exp Hematol, 1993,21 (13):1673-1679.
[6] 林丽,陈忠平. 细胞因子诱导的杀伤细胞体外抗胶质瘤的实验研究[J]. 中国神经肿瘤杂志,2003,1(2):69-72.
[7] 王家祥,郑树,刘秋亮. 不同来源CIK细胞的体外扩增和杀伤活性的比较[J]. 第四军医大学学报,2005,26(7):616-618.
[8] 王士勇,杜微丽,张晖,等. 重组人纤维连接蛋白诱导的CIK细胞的生物学特性和对肺癌细胞株杀伤活性的体外研究[J]. 中国肺癌杂志,2010,12(4):277-281.
[9] 李亚芬,周如苑,孟会敏,等. 建立改良型人NK细胞体外扩增技术[J]. 免疫杂志,2015,31(3):250-254.
[10] Linn YC,Wang SM,Hui KM. Comparative gene expression profiling of cytokine-induced killer cells in response to acute myloid lekemic and acute lymphoblastic lekemic stimulators using oligonucleotide arrays[J]. Exp Hematol, 2005,33(6):671-681.
[11] Dorner BG,Scheffold A,Rolph M,et al. MIP-1α,MIP-1β,RANTES,and ATAC/lymphotactin function together with IFN-γas type 1 cytokines [J]. Proc Natl Acad Sci U S A , 2002,99(9):6181-6186.
崔勇(E-mail:akot@163.com)
10.3969/j.issn.1002-266X.2017.17.013
R735.3
A
1002-266X(2017)17-0039-03
2017-02-20)
