不同能量超声破坏微泡对内皮细胞炎症因子和VEGF表达的影响
2017-06-05黄驰雄景远文李海瑞王世飞杨莉宾建平
黄驰雄,景远文,李海瑞,王世飞,杨莉,宾建平
(南方医科大学南方医院,广州510515)
不同能量超声破坏微泡对内皮细胞炎症因子和VEGF表达的影响
黄驰雄,景远文,李海瑞,王世飞,杨莉,宾建平
(南方医科大学南方医院,广州510515)
目的 探索不同能量超声破坏微泡对内皮细胞炎性介质和血管内皮生长因子(VEGF)表达的影响。方法 培养人脐静脉内皮细胞,使培养液中微泡浓度为1×107/mL,根据接受超声能量处理情况将内皮细胞分为0、1.0、2.0、3.0、4.0 MPa 5组。超声处理1.5 h后采用全自动酶标仪检测活性氧(ROS)表达荧光强度,8 h后 采用MTT、Western blotting和免疫荧光分别检测内皮细胞活性以及VEGF、 P选择素表达。同时2.0 MPa组中加入ROS抑制剂(GSH)或P选择素抑制剂(rPSLG-Ig),8 h后检测VEGF表达。结果 与0 MPa组相比,1.0 、2.0 MPa组内皮细胞活性无变化(P均>0.05),3.0、4.0 MPa组内皮细胞活性降低(P均<0.05)。与0 MPa组相比,1.0、2.0、3.0、4.0 MPa 组ROS、P选择素和VEGF的表达增高(P均<0.05)。3.0 MPa组与4.0 MPa组比较ROS、P选择素和VEGF的表达无统计学差异(P均>0.05)。2.0 MPa组中加入GSH或rPSLG-Ig后,VEGF表达低于单纯2.0MPa组(P均<0.05)。结论 超声破坏微泡可通过诱导内皮细胞的炎性反应增加VEGF的表达,促进血管再生;其中超声能量2.0MPa对内皮细胞炎性介质和VEGF的影响较理想。
内皮细胞;血管生成;超声;微泡;炎性反应;血管内皮生长因子
目前,现代再灌注治疗手段如搭桥术、经皮介入治疗等能较明显地改善冠心病患者的症状及预后[1],但无法避免血管再狭窄,对直径较小的血管亦无有效干预方法[2]。因此,促血管新生治疗有望成为现代再灌注治疗手段的重要补充。研究显示,超声破坏微泡产生的空化效应可在体内外引起多种生物学效应,具有促血管生成的潜能,但较高能量的超声可能对细胞或较脆弱的新生血管产生损伤。血管内皮生长因子(VEGF)是促进血管新生的重要因子,P选择素、活性氧(ROS)等炎性介质与VEGF的表达高度相关[3]。2016年7~11月,本研究于体外通过不同能量超声破坏微泡刺激内皮细胞,以探讨其对细胞活性和细胞ROS、P选择素、VEGF表达的影响。
1 材料与方法
1.1 细胞培养及微泡制备 人脐静脉内皮细胞(HUvE-12)(广州吉赛生物)用含有10%胎牛血清(FBS)和1%双抗的DMEM-F12(均为Gibco产品,美国)培养基在37 ℃、CO2浓度为5%的培养箱中培养。细胞复苏后至少传代3次才用于实验干预。采用既往报道方法[4]制备全氟丙烷脂质微泡,使干预细胞时培养基中微泡浓度为1×107/mL。
1.2 细胞分组及活性检测 取对数期内皮细胞,胰酶消化后用含10%FBS的DMEM-F12培养液重悬,保持培养液中微泡浓度为1×107/mL。把内皮细胞分为5个不同超声能量处理组(0、1.0、2.0、3.0、4.0 MPa组),用超声空化治疗仪进行辐照破坏微泡。然后每个处理组接种3个复孔,并设置3个空白对照孔,每孔接种1×104个细胞于96孔板。8 h后用MTT试剂盒检测吸光度,以空白对照孔细胞活性为100%计算5个处理组的细胞活性。
1.3 内皮细胞ROS表达检测 将5×105细胞接种于6孔板,培养24 h待细胞贴壁。细胞分组和微泡浓度同前。超声干预后再培养1.5 h,用无血清培养基洗3次,避光条件下加入含1 μmol/L DCFH-DA的无血清培养基于37 ℃、5%CO2培养箱中避光孵育20 min。用胰酶把细胞消化并用200 μL PBS重悬,加入96孔板于全自动酶标仪下检测ROS荧光强度(激发波长488 nm,发射波长520 nm),每组重复3次。
1.4 内皮细胞P选择素表达检测 将5×104细胞接种于共聚焦培养皿,培养24 h待细胞贴壁。细胞分组和微泡浓度同前。超声干预后再培养8 h。取出细胞PBS洗3次,然后用4%的多聚甲醛固定15 min。PBS洗去多聚甲醛,1%的BSA封闭液封闭20 min。用兔抗大鼠P选择素一抗(1∶300)4 ℃孵育过夜,洗去一抗,避光条件下用羊抗兔二抗Alexa488(1∶300)孵育30 min。避光洗去二抗,DAPI染色5 min后用PBS洗3次,吸尽皿中的PBS常温下避光凉干。最后在激光共聚焦显微镜下观察拍照。
1.5 内皮细胞VEGF表达检测 将5×105细胞接种于60 mm培养皿,培养24 h后待细胞贴壁。细胞分组和微泡浓度同前。超声干预之后再培养8 h。取出细胞PBS洗3次,RIPA裂解液提取总蛋白,BCA试剂盒测蛋白浓度。10%的SDS凝胶电泳1.5 h,将蛋白转至PVDF膜,3%的BSA封闭1 h,一抗孵育4 ℃过夜。TBST洗3次(5 min/次)后二抗孵育1 h,TBST洗3次(10 min/次)并晾干,最后用ODYSSEY近红外成像系统曝光条带。Western blotting方法检测5组细胞VEGF的表达以及2.0 MPa时分别加入ROS抑制剂(GSH)或P选择素抑制剂(rPSLG-Ig)时内皮细胞VEGF的表达。
2 结果
2.1 不同能量超声破坏微泡对内皮细胞活性的影响 0、1.0、2.0、3.0、4.0 MPa 5组细胞活性分别为(99.80±9.15)%、(97.41±8.29)%、(98.64±9.72)%、(75.86±8.71)%、(61.08±7.74)%。与0 MPa组相比,1.0、2.0 MPa组细胞活性差异无统计学意义(P均>0.05),3.0 MPa组和4.0 MPa组细胞活性显著降低(P均<0.05)。同时,4.0 MPa组细胞活性也显著低于3.0 MPa组(P<0.05)。
2.2 不同能量超声破坏微泡对内皮细胞ROS和P选择素表达影响 0、1.0、2.0、3.0、4.0 MPa 5组细胞ROS荧光强度分别为24.51±6.83、304.36±57.82、1 200.17±98.95、1 905.24±139.83、2 001.64±115.49。3.0 MPa组和4.0 MPa组ROS荧光强度达到同一平台水平,组间差异无统计学意义(P>0.05);其余各组间细胞ROS荧光强度比较差异有统计学意义(P均<0.05)。P选择素的表达与ROS的变化趋势相同,也随着超声强度的增加而增加,3.0 MPa和4.0 MPa时达到同一平台水平。
2.3 不同能量超声破坏微泡对内皮细胞VEGF表达影响 0 MPa组无VEGF表达。随着超声强度的增加,VEGF的表达逐渐增高,但3.0 MPa组和4.0MPa组细胞VEGF表达差异无统计学意义(P>0.05);其余各组间细胞VEGF表达差异有统计学意义(P均<0.05)。在2.0 MPa组中加入GSH或者rPSLG-Ig时,VEGF的表达相对于单纯2.0 MPa处理组显著下降(P均<0.05)。见图1。
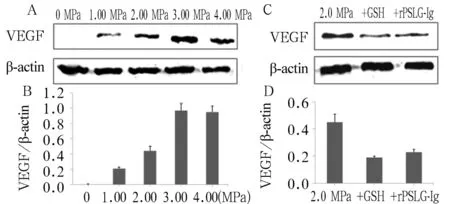
注:A、B:不同超声能量时VEGF表达差异。C、D:2.0 MPa时加入GSH或rPSLG-Ig VEGF表达变化。
图1 超声破坏微泡对内皮细胞VEGF表达量的影响
3 讨论
冠状动脉粥样硬化性心脏病、外周血管病等缺血性疾病发病率、致残率高,现代再灌注治疗手段如搭桥术、经皮介入治疗等能较明显地改善疾病的症状及预后,但仍具有一定局限性,如血管再狭窄、无法干预直径较小的血管等。促血管新生治疗亦被称为分子搭桥[5],有望成为上述现代再灌注治疗手段的重要补充。
目前促血管新生的主要方法是外源性注射干细胞[6]、促血管形成因子或相关基因[7],但因靶向性较低的问题,其促血管生成的效果欠理想。超声破坏微泡产生的空化效应可在体内外引起多种生物学效应,具有促血管生成的潜能。Song等[8]研究发现,超声破坏微泡可促进大鼠缺血后肢的血管新生、改善缺血组织血供,但对其具体机制尚不清楚。
既往研究提示,低能超声破坏微泡产生的空化效应可诱导细胞的炎性反应,ROS、P选择素表达增高[9];亦有研究证实,P选择素、ROS等炎性介质增高与VEGF的表达相关[3];同时大量研究已证实,VEGF可有效促进血管新生、改善组织血供[10]。因此我们假设超声破坏微泡可通过诱导内皮细胞的炎性反应而增加VEGF的表达量,从而促进缺血组织的血管生成。Song等[8]在大鼠后肢缺血模型中发现超声破坏微泡可促进大鼠后肢的血管生成、增加肌肉血流灌注,但并未对具体机制进行阐明。本研究发现,超声破坏微泡可促进VEGF的表达,这与Nazer 等[11]研究结果相似,但Nazer 等未对VEGF表达增加的相关分子机制进行研究。从理论上而言,较高能量的超声除可能对脆弱的新生血管产生破坏外,也可能对细胞产生不可逆损伤,导致细胞坏死。因此,探讨既能有效促进血管新生而又不产生血管损伤及细胞坏死的超声能量十分重要。
我们发现,在一定范围内(≤ 2.0 MPa)随着能量的增加,超声破坏微泡使内皮细胞ROS、P选择素和VEGF的表达量逐渐增高,且细胞活性未发生明显改变;当能量为3.0 MPa时,这三种分子的表达量进一步增高,但细胞活性明显下降;当能量为4.0 MPa时,这三种分子的表达量不再增高,且细胞活性进一步下降。我们还发现,当加入ROS和P选择素抑制剂后,VEGF表达量明显下降。这提示超声破坏微泡可通过诱导内皮细胞的炎性反应而增加VEGF的表达,2.0 MPa是较理想的超声能量。
需要说明的是,本研究仅局限于体外的内皮细胞试验,未进行相关动物研究。我们后续研究拟在大鼠缺血性心脏病模型中探讨超声破坏微泡促进血管生成的具体机制及最佳能量,为超声破坏微泡促进血管生成用于治疗缺血性疾病提供理论依据。
[1] 王颍骅, 薛松. 冠状动脉搭桥与冠脉介入治疗的比较[J]. 国际心血管病杂志, 2007,34(2):104-107.
[2] 宋杰丽, 曾锦培, 陈次滨. 血浆总胆红素浓度与经皮冠状动脉介入治疗后支架内再狭窄的研究[J]. 岭南心血管病杂志, 2014,20(3):293-296.
[3] 张清华, 陈玲, 蒋知新, 等. 炎症细胞因子对人脐静脉内皮细胞分泌VEGF、ICAM-1的影响[J]. 心血管康复医学杂志, 2009,18(2):93-96.
[4] 潘弟仪, 杨莉, 侯连兵. 超声造影剂全氟丙烷脂质微球的制备与评价[J]. 中国药学杂志, 2012,47(10):818-821.
[5] 关勤, 刘志勇. 分子搭桥技术研究进展[J]. 东南大学学报(医学版), 2006,25(3):212-215.
[6] 李晓玲, 朱旅云, 宋光耀. 脐带间充质干细胞促血管新生在治疗下肢缺血中的研究与应用[J]. 中国组织工程研究, 2015,19(36):5878-5885.
[7] 李玉玲, 李红, 胡明均, 等. 腺病毒装载人vegf-165基因转染的间充质干细胞对下肢缺血性坏死大鼠模型促血管新生的作用[J]. 中国实验血液学杂志, 2010,18(6):1568-1573.
[8] Song J. Microvascular remodeling and accelerated hyperemia blood flow restoration in arterially occluded skeletal muscle exposed to ultrasonic microbubble destruction[J]. AJP: Heart Circulatory Physiol, 2004,287(6):H2754-H2761.
[9] 房良华, 姜藻, 顾晓怡. 低频超声联合微泡剂对肝癌细胞SMMC-7721的生物学效应[J]. 东南大学学报(医学版), 2008,27(4):264-267.
[10] Senturk B, Cubuk MO, Ozmen MC, et al. Inhibition of VEGF mediated corneal neovascularization by anti-angiogenic peptide nanofibers[J]. Biomaterials, 2016,107:124-132.
[11] Nazer B, Ghahghaie F, Kashima R, et al. Therapeutic ultrasound promotes reperfusion and angiogenesis in a rat model of peripheral arterial disease[J]. Circ J, 2015,79(9):2043-2049.
Effects of different pressure of ultrasound-targeted microbubble destruction on expression of inflammatory factor and VEGF
HUANGChixiong,JINGYuanwen,LIHairui,WANGShifei,YANGLi,BINJianping
(NanfangHospital,SouthernMedicalUniversity,Guangzhou510515,China)
Objective To explore the influence of different pressure of ultrasound-targeted microbubble destruction on the expression of inflammatory factor and vascular endothelial growth factor (VEGF) in human umbilical vein endothelial cells (HUvE-12 cells).Methods We cultured HUvE-12 cells in the DMEM-F12 medium containing 1×107/mL microbubbles. HUvE-12 cells were divided into 5 groups exposed to different ultrasound pressure (0, 1.0, 2.0, 3.0 and 4.0 MPa). After 1.5 h of ultrasound exposure, we detected the expression of reactive oxygen species (ROS) by using full-automatic microplate reader. At 8 h after corresponding interventions, the cell viability, P-selectin and VEGF expression was determined by MTT, immunofluorescence and Western blotting, respectively. Additionally, ROS inhibitor (GSH) or P-selectin inhibitor (rPSLG-Ig) were added into the 2.0 MPa group, and VEGF expression was determined by Western blotting, respectively. Results The cell viability presented to be no difference in the 1.0 MPa and 2.0 MPa groups as compared with 0 MPa group (all P>0.05), while it decreased significantly in the 3.0 MPa and 4.0 MPa groups (allP<0.05). The expression of ROS, P-selectin and VEGF increased in the 1.0, 2.0, 3.0, and 4.0 MPa groups as compared with that of the 0 MPa group (allP<0.05). No difference was found in the expression of ROS, P-selectin and VEGF between the 4.0 MPa and 3.0 MPa groups (allP>0.05). When GSH or rPSLG-Ig were added in the 2.0 MPa group , the expression of VEGF was inhibited significantly as compared with that of 2.0 MPa applied only (allP<0.05). Conclusion Ultrasound-targeted microbubble destruction can increase the expression of VEGF through inducing inflammatory reaction and promote angiogenesis, and 2.0 MPa is the optimal ultrasound pressure.
endotheliocytes; angiogenesis; ultrasound; microbubbles; inflammatory reaction; vascular endothelial growth factor
国家自然科学基金面上项目(81571698)。
黄驰雄(1991-),男,在读硕士,研究方向为超声微泡在疾病诊断和治疗中的应用。E-mail:435683314@qq.com
宾建平(1964-),男,主任医师,教授,博士生导师,研究方向为超声微泡在疾病诊断和治疗中的应用。E-mail:jianpingbin@126.com
10.3969/j.issn.1002-266X.2017.17.002
R541.4
A
1002-266X(2017)17-0004-03
2016-12-14)
