帕金森病细胞模型的构建及氨基酸表达观察
2017-06-05李双李双双张晓莹郭春燕王治宝
李双,李双双,张晓莹,郭春燕,王治宝
(河北北方学院,河北张家口075000)
帕金森病细胞模型的构建及氨基酸表达观察
李双,李双双,张晓莹,郭春燕,王治宝
(河北北方学院,河北张家口075000)
目的 建立帕金森病(PD)人神经母细胞瘤细胞模型,并筛选PD细胞中的氨基酸标志物。方法 将人神经母细胞瘤细胞SH-SY5Y分为正常组、溶媒组、鱼藤酮组。鱼藤酮组分别加入0.15、0.25 μmol/L的鱼藤酮,溶媒组加入二甲基亚砜(DMSO),正常组不加药物。分别于给药24、48 h后采用MTT法测算细胞存活率,倒置显微镜观察细胞形态,选择对细胞存活、形态影响较小的鱼藤酮作用浓度及作用时间(0.15 μmol/L、24 h),采用Western blotting法检测SH-SY5Y细胞中的α-突触核蛋白以验证PD模型。采用高效液相色谱法检测PD细胞中的谷氨酸(Glu)、丝氨酸(Ser)、谷氨酰胺(Gln)、组氨酸(His)、甘氨酸(Gly)、丙氨酸(Ala)、脯氨酸(Pro)、色氨酸(Trp)、苯丙氨酸(Phe)、异亮氨酸(Ile)、亮氨酸(Leu)、赖氨酸(Lys),对鱼藤酮组和溶媒组差异有统计学意义的氨基酸进入偏最小二乘判别分析,选择P<0.05且变量重要性投影值(VIP)>1的氨基酸为PD的标志物。结果 鱼藤酮组细胞中α-突触核蛋白相对表达量高于溶媒组(P均<0.05),表明SH-SY5Y细胞PD模型制作成功。给药24 h时,鱼藤酮组细胞中Glu、Ser、Gln、His、Gly、Pro、Phe、Ile、Leu、Lys水平低于溶媒组(P均<0.05);给药48 h时,鱼藤酮组除Gln外,其余11种氨基酸水平均低于溶媒组(P均<0.05)。筛选氨基酸标志物为Glu、Ser、Gly、Pro(给药24 h时VIP值分别为1.016、1.016、1.016、1.009,给药48 h时VIP值均为1.001)。结论 利用鱼藤酮诱导成功建立了PD细胞模型,筛选出Glu、Ser、Gly、Pro可能为PD的潜在标志物。
帕金森病;鱼藤酮;人神经母细胞瘤细胞;氨基酸
帕金森病(PD)是最常见的神经退行性疾病之一,严重威胁人类健康和生活质量[1~3]。大量研究表明经常接触工农业毒性物质的人群患PD的风险较大。鱼藤酮是一种广泛使用的天然杀虫剂,研究[4,5]证实与其接触可引起PD。α-突触核蛋白的聚集与PD发病和相关功能障碍密切相关[6,7]。目前PD初期有少量对症治疗方法,但尚无病因治疗方法,中后期PD的治疗方法仍在探寻中[8,9]。故PD的早期诊断对有效治疗和提高患者生活质量有重要意义。已有文献[9~12]报道了兴奋性氨基酸变化在PD发病过程可能发挥作用。已知与神经系统结构和功能发挥重要作用的必需氨基酸有赖氨酸(Lys,K)、色氨酸(Trp,W)、苯丙氨酸(Phe,F)、异亮氨酸(Ile,I)、亮氨酸(Leu,L),非必需氨基酸有组氨酸(His,H)、谷氨酸(Glu,E)、丝氨酸(Ser,S)、谷氨酰胺(Gln,Q)、甘氨酸(Gly,G)、丙氨酸(Ala,A)、脯氨酸(Pro,P)[13~17],而在PD的发生和发展过程中上述氨基酸发生了怎样的变化,能否作为PD诊断的潜在标志物仍有待研究。为此,我们采用鱼藤酮诱导建立了PD人神经母细胞瘤细胞模型,观察PD模型中上述12种氨基酸的代谢变化,以筛选有望作为PD标志物的氨基酸,现报告如下。
1 材料与方法
1.1 主要实验材料 人神经母细胞瘤细胞株SH-SY5Y购自中国医学科学院基础医学研究所细胞资源中心。DMEM/F-12培养基、磷酸盐缓冲液干粉(PBS固体)、0.25%胰蛋白酶溶液、胎牛血清(FBS)、噻唑蓝(MTT)、鱼藤酮、兔抗α-突触核蛋白、色谱纯甲醇、乙腈。Glu、Ser、Gln、His,、Gly、Ala、Pro、Trp、Phe、Ile、Leu、Lys标准品纯度均>98%。2,4-二硝基氟苯(DNFB)、碳酸氢钠、无水乙酸钠,生理盐水。CO2细胞培养孵箱,分析天平,sigma3K30超速离心机,HH-4恒温水浴箱,SW-CJ-1FD超净工作台,WH-2旋涡振荡器,ECLIPSE Ti-U倒置荧光显微镜,XDS-1B光学显微镜,美国waters e2695高效液相色谱仪,自动进样器、柱温箱及色谱数据处理系统,waters2998二极管阵列检测器。
1.2 PD细胞模型的建立 SH-SY5Y细胞在含10%胎牛血清DMEM/F12培养液中,于37 ℃饱和湿度、5% CO2条件下培养。取对数生长期细胞进行实验。将细胞分为正常组、溶媒组、鱼藤酮组。消化细胞配制成密度为6×104/mL的细胞悬液,种于96孔板,每孔加入100 μL细胞悬液,每组6个复孔,当细胞贴壁、汇合度达70%~80%时,鱼藤酮组分别加入终浓度为0.15、0.25 μmol/L的鱼藤酮;溶媒组加入终浓度为0.012 5%的DMSO,正常组不加药物。分别于给药24、48 h后采用MTT法测算细胞存活率,倒置显微镜观察细胞形态。给药24、48 h鱼藤酮组细胞存活率低于正常组和溶媒组,且鱼藤酮0.25 μmol/L亚组细胞存活率低于0.15 μmol/L亚组(P均<0.05);给药48 h鱼藤酮组细胞存活率低于给药24 h时(P均<0.05)。正常组与溶媒组细胞形态无显著性变化,鱼藤酮组与溶媒组相比,细胞皱缩、变圆,体积变小,排列松散;其中0.25 μmol/L亚组较0.15 μmol/L亚组存活细胞数量更少,大多数细胞漂浮(见图1)。选择对细胞存活、形态影响较小的鱼藤酮作用浓度0.15 μmol/L、作用时间24 h。采用Western blotting法检测SH-SY5Y细胞中的α-突触核蛋白验证PD模型制作情况。α-突触核蛋白表达显著升高判定为模型制作成功。目的蛋白相对表达量=目的蛋白光密度值/内参蛋白光密度值。
1.3 PD模型细胞中氨基酸标志物的筛选
1.3.1 PD细胞中氨基酸检测 采用高效液相色谱法。①氨基酸的衍生化:参照文献[18]方法,采用DNFB柱前衍生化法进行细胞中氨基酸衍生化。②液相色谱条件:色谱柱为Thermo BDS Hypersil(5 μm,4.6 mm×250 mm),检测波长360 nm,体积流量1 mL/min,柱温30 ℃,进样量10 μL,流动相为甲醇-水(0.1 mol/L乙酸钠);梯度洗脱条件为15%甲醇0~10 min,15%~42%甲醇10~15 min,42%~51%甲醇15~18 min,65%甲醇18~26 min,维持5 min。③线性范围的考察:配制12种氨基酸标准系列溶液,以氨基酸峰面积(Y)对浓度(X)进行线性回归,得到12种氨基酸的回归方程。④系统适应性试验:在上述色谱条件下,连续进样氨基酸标准品混合物,计算氨基酸峰面积的日内精密度;连续进样5 d,计算日间精密度;取已知含量的样品,分别加入高、中、低三个浓度的氨基酸对照品储备液,每个浓度平行3份,测定峰面积,代入回归方程,计算氨基酸含量和各种氨基酸的回收率。样品含量测定:分别于适宜浓度的鱼藤酮作用细胞24、48 h后收集细胞,DNFB柱前衍生化,在上述色谱条件下进样10 μL,记录色谱图,将峰面积带入回归方程计算细胞内氨基酸水平,并与溶媒组进行比较。

注:A、B、C、D分别为给药24 h正常组、溶媒组、鱼藤酮0.15 μmol/L亚组、鱼藤酮0.25 μmol/L亚组细胞形态;E、F、G、H分别为给药48 h正常组、溶媒组、鱼藤酮0.15 μmol/L亚组、鱼藤酮0.25 μmol/L亚组细胞形态。
1.3.2 统计分析 采用SPSS18.0软件。组间比较采用单因素方差分析。对鱼藤酮组和溶媒组差异有统计学意义的氨基酸再应用SIMCA-P+11软件进行偏最小二乘分析法(PLS-DA)分析,以P<0.05且变量重要性投影值(VIP)>1判定为PD模型的氨基酸标志物。
2 结果
2.1 PD细胞模型建立情况 溶媒组和鱼藤酮组细胞中α-突触核蛋白相对表达量分别为0.23和0.47,鱼藤酮组细胞中α-突触核蛋白相对表达量高于溶媒组(P均<0.05),表明SH-SY5Y细胞PD模型制作成功。
2.2 PD细胞模型中氨基酸标志物的筛选结果 Glu、Ser、Gln、His、Gly、Ala、Pro、Trp、Phe、Ile、Leu、Lys回归方程分别为y=3.98x+9.32、y=6.26x+8.06、y=4.87x+8.38、y=4.66x+1.79、y=12.17x+4.59、y=7.14x+21.03、y=9.50x+3.98、y=13.90x+3.21、y=6.28x+3.01、y=6.47x+4.65、y=6.04x+4.94、y=6.98x+6.45,相关系数r>0.988 7,所试浓度范围内线性关系良好。12种氨基酸日内、日间精密度良好,RSD均小于2.5%。在实验色谱条件下各氨基酸分离良好(图2)。12种氨基酸的平均回收率在90%~105%,RSD<3.6%,方法回收率良好。给药24 h时,鱼藤酮组10种氨基酸(Glu、Ser、Gln、His、Gly、Pro、Phe、Ile、Leu、Lys)水平低于溶媒组(P均<0.05);给药48 h时,除Gln外,其余11种氨基酸水平均低于溶媒组(P均<0.05)。见表1。应用SIMCA-P+11软件分析得出氨基酸得分图与载荷图(图3),选取远离原点且VIP>1的氨基酸为标志物,分别为Glu、Ser、Gly、Pro(给药24 h时VIP值分别为1.016、1.016、1.016、1.009,给药48 h时VIP值均为1.001)。
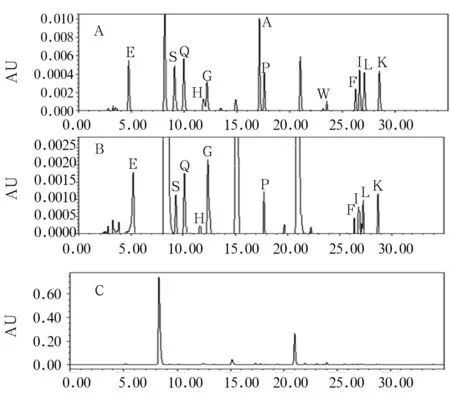
注:A为标准品色谱图;B为细胞中氨基酸色谱图;C为衍生试剂及衍生化副产物色谱图。
3 讨论
鱼藤酮具有极强的亲脂性,能透过血脑屏障和细胞膜,鱼藤酮模型不仅能复制PD的行为学改变,而且能再现人类PD的病理学特征。人神经母细胞瘤细胞SH-SY5Y具有神经突样的细胞质突起,可以表达多巴胺-β 羟化酶、α-突触核蛋白,被广泛用于PD模型的建立。所以,我们选择鱼藤酮作用于SH-SY5Y细胞诱导PD模型。目前PD确切的发病机制尚不清楚,公认的临床病理特征有黑质纹状体多巴胺功能障碍、纹状体α-突触核蛋白聚集。本研究结果显示,鱼藤酮可使SH-SY5Y细胞存活率下降、细胞固缩、α-突触核蛋白表达增高,且作用呈浓度、时间依赖性,选择对细胞存活、形态影响较小的鱼藤酮作用浓度0.15 μmol/L、作用时间24 h,鱼藤酮组细胞中α-突触核蛋白相对表达量高于溶媒组,成功建立了SH-SY5Y细胞PD模型。
表1 鱼藤酮组与溶媒组细胞中12种氨基酸水平比较
注:与相同给药时间溶媒组相比,▲P<0.01。
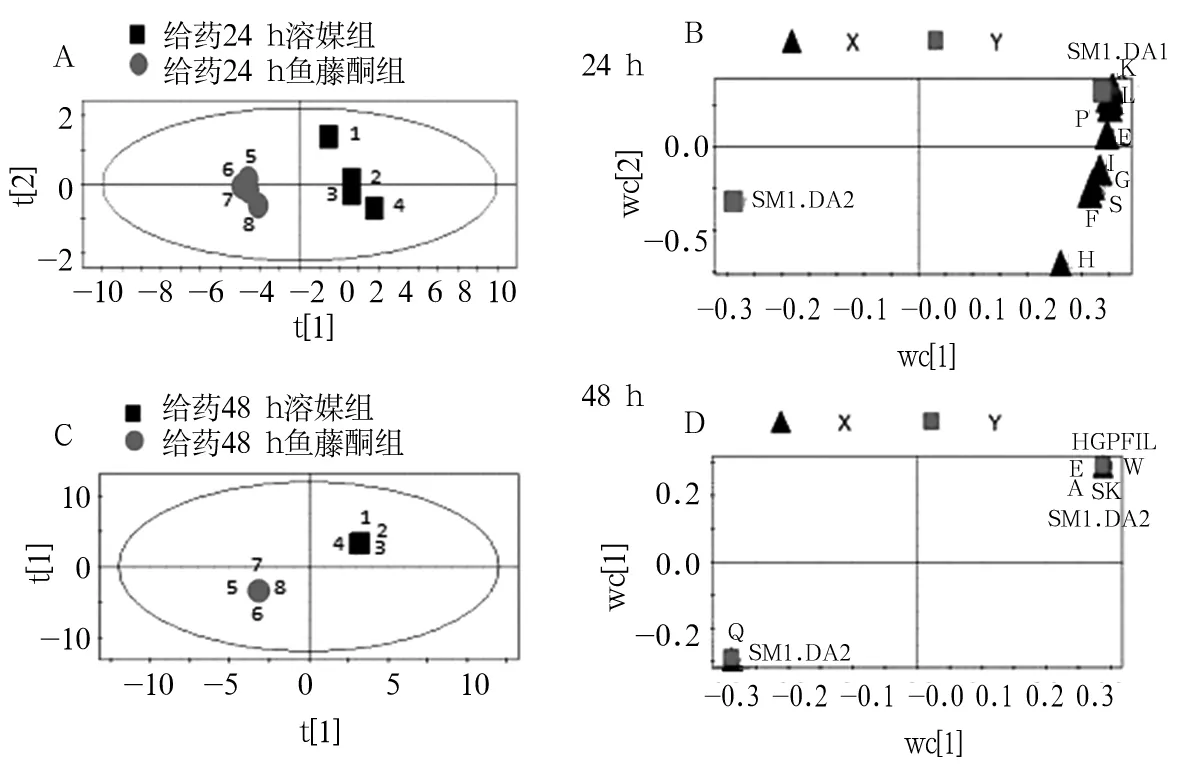
注:A、C为得分图;B、D为载荷图;得分图中每个点代表一个样本;从图A、C可见,溶媒组和鱼藤酮组区分明显,说明鱼藤酮作用细胞后,细胞内氨基酸的表达有了较明显的变化;在载荷图B、D中,每点代表一个氨基酸变量,离原点距离较远的点可能为标志物,进一步通过VIP值确定为标志物。
氨基酸是细胞中蛋白合成的生物底物,氨基酸的吸收、转运、代谢对生物体生长发育至关重要。神经系统中存在着大量的游离氨基酸,参与神经系统的代谢、神经兴奋及抑制调节[19]。其中,Glu和Gly是重要的氨基酸递质[13];Glu、Gln、Gly、Ala、Ser、His、Trp在谷氨酰胺合成酶反馈抑制系统中起关键作用;谷氨酸-谷氨酰胺循环是星形胶质细胞和神经元代谢耦联最重要的途径之一[14];Gly、Ser、His、Trp代谢是一碳单位的重要来源;Leu及其异构体Ile是最重要的支链氨基酸;Pro、Phe、Lys在细胞氧化应激反应中发挥重要作用[15]。Lys对人中枢神经和周围神经系统均起重要作用,在mTORC1信号通路中也发挥重要作用[16]。基于上述理论,我们选取了12种氨基酸作为待测指标。
代谢组学主要考察生物体系受扰动或损伤后内源性代谢物的变化[20,21],统计分析方法包括主成分分析、聚类分析、显著性分析和PLS-DA[22]。PLS-DA是一种多因变量对多自变量的回归建模方法,可同时实现多元线性回归、主成分分析及两组变量间的典型相关分析,是代谢组学中最常规的方法。我们首先对鱼藤酮组和溶媒组细胞中12种氨基酸水平进行比较,对差异有统计学意义的氨基酸进行PLS-DA,以VIP>1为依据[23],筛选出4种氨基酸生物标志物(Glu、Ser、Gly、Pro)。
Glu是主要的兴奋性神经递质,以往研究[24]发现慢性应激性抑郁发生时Glu水平显著升高。Glu的聚集具有神经毒性[25],是神经性疾病发生的诱因之一。而本实验结果显示,PD细胞中Glu水平显著下降,由此可认为Glu水平变化并不是诱发PD的原因,而是PD发生后机体细胞做出应激的结果,提示Glu可作为评估PD进程的氨基酸标志物[26]。除Glu聚集会诱发神经毒性外,未见其他氨基酸神经毒性的报道,可认为PD体外细胞模型内其他氨基酸水平变化也是疾病发生后引起的机体应激反应所致。Ser是N-甲基-D天冬氨酸发挥其神经传递作用的激动剂,Gly可抑制神经细胞过度兴奋[27,28],Pro的初级代谢为氧化应激反应必不可少的过程[29,30],这三种氨基酸会随着细胞氧化应激反应的增强而代谢加速[31]。另外Glu、Ser、Gly同为谷氨酰胺合成酶反馈抑制系统的关键氨基酸,均可在一定情况下参与Gln的转化。在PD细胞中,为防止兴奋性氨基酸Glu的聚集造成进一步神经损伤,Glu转化为Gln的速度加快,同时带动此反馈抑制系统中的Ser、Gly代谢转化加快,致使Gln水平随着损伤加重下降程度降低,甚至超过正常水平。
总之,鱼藤酮可引起SH-SY5Y细胞损伤,诱导PD模型;利用PLS-DA技术筛选得到Glu、Ser、Gly、Pro为PD的潜在标志物。本研究结果为PD的早期诊断提供了新思路和新方法。
[1] 尹雪,苏新云,王秀华,等.原儿茶酸对帕金森病模型小鼠中脑和纹状体D2DR、iNOS和TH表达的影响[J].中草药,2015,46(6):866-870.
[2] 胡雅琼,罗理勇,曾亮.茶叶提取物对帕金森病的防治作用研究进展[J].中草药,2014,45(9):1342-1348.
[3] Chorfa A, Temps D, Morignat E, et al. Specific pesticide-dependent increases inα-synuclein levels in human neuroblastoma (SH-SY5Y) and melanoma(SK-MEL-2) cell lines[J]. Toxicol Sci, 2013,133(2):289-297.
[4] Klingelhoefer L, Reichmann H. Pathogenesis of Parkinson disease--the gut-brainaxis and environmental factors[J]. Nat Rev Neurol, 2015,11(11):625-636.
[5] Sequra-Aquilar J, Kostrzewa RM. Neurotoxin mechanisms and processes relevantto Parkinson′s disease: an update[J]. Neurotox Res, 2015,27(3):328-354.
[6] 白莹,徐斌.利用诱导性多能干细胞技术研究环境致病因素诱导帕金森病发病的进展[J].环境与职业医学,2015,32(2):181-185.
[7] 柴星星,鲍波,叶成,等.鱼藤酮诱导制备SD大鼠帕金森病模型的可行性[J].山东医药,2015,55(1):9-14.
[8] Corbillé AG, Letournel F, Kordower JH, et al. Evaluation of alpha-synuclein Immuno-histochemical methods for the detection of Lewy-type synucleinopathy in gastrointestinal biopsies[J]. Acta Neuropathol Commun, 2016,4(1):35-41.
[9] Wenzel S, Mollenhauer B, Trenkwalder C. Diagnosis and clinical therapy for Parkinson′s disease[J]. Nervenarzt, 2006,77(12):1439-1443.
[10] Meredith GE, Totterdell S, Beales M, et al. Impaired glutamate homeostasis and programmed cell death in a chronic MPTP mouse model of Parkinson′s disease[J]. Exp Neuro, 2009,219(1):334-340.
[11] Assous M, Had-Aissouni L, Gubellini P, et al. Progressive Parkinsonism by acute dysfunction of excitatory amino acid transporters in the rat substantia nigra[J]. Neurobio Dis, 2014,65(1):69-81.
[12] 罗瑞静,何建成.兴奋性氨基酸与帕金森病研究进展[J].医学研究杂志,2010,39(10):13-15.
[13] 王军玲,杨阳,高健,等.基于氨基酸代谢的抗脑缺血益气解毒配伍中药协同作用研究[J].中国药理学通报,2014,30(5):725-731.
[14] Xia T, Zhang Q, Xiao Y, et al. CREB/TRH pathway in the central nervous system regulates energy expenditure in response to deprivation of an essential amino acid[J]. Int J Obes (Lond), 2015,39(1):105-113.
[15] 杨晓运,李智,秦绿叶,等.星形胶质细胞和神经元之间谷氨酸-谷氨酰胺的代谢偶联[J].生理科学进展,2003,34(4):350-352.
[16] Phang JM, Liu W, Hancock CN, et al. Proline metabolism and cancer: emerginglinks to glutamine and collagen[J]. Curr Opin Clin Nutr Metab Care, 2015,18(1):71-77.
[17] Wolfson RL, Chantranupong L, Saxton RA, et al. Sestrin2 is a leucine sensor for the mTORC1 pathway[J]. Science, 2016,351(6268):43-48.
[18] 李双,王小琴,郭春燕,等.低浓度DMSO对SH-SY5Y细胞存活率和氨基酸代谢的影响[J].神经药理学报,2015,5(4):9-13.
[19] Maynard TM, Manzini MC. Balancing Act: Maintaining Amino Acid Levels in the Autistic Brain[J]. Neuron, 2017,93(3):476-479.
[20] 李鞠,唐凤英.原发性肾病综合征患者血清异常代谢通路的代谢组学分析[J].山东医药,2016,56(30):1-4.
[21] 王风萍,郭春燕.代谢组学及其研究新进展[J].神经药理学报,2012,2(6):49-55.
[22] Zheng P, Chen JJ, Zhou CJ, et al. Identification of sex-specific urinary biomarkers for major depressive disorder by combined application of NMR- and GC-MS-based metabonomics[J]. Transl Psychiatry, 2016,6(11):e955.
[23] 吴宏伟,高健,李韶菁,等.基于液相色谱-串联质谱的氨基酸代谢组学方法研究黄芪注射液治疗脑缺血[J].分析化学,2013,41(3):344-348.
[24] Da Silva LB, Poulsen JN, Arendt-nielsen L, et al. Botulinum neurotoxin type A modulates vesicular release of glutamate from satellite glial cells[J]. J Cell Mol Med, 2015,19(8):1900-1909.
[25] 吴帅,安书成,陈慧彬,等.慢性应激性抑郁发生中大鼠眶额叶多巴胺D1受体对谷氨酸及其NMDA受体的调节[J].心理学报,2014,46(1):69-78.
[26] 吴倩,汪宁,王艳,等.藁本内酯对谷氨酸诱导的PC12细胞凋亡的保护作用[J].药学学报,2015,50(2):162-168.
[27] Fossat P, Turpin FR, Sacchi S, et al. Glial D-Serine Gates NMDA Receptors at Excitatory Synapses in Prefrontal Cortex[J]. Cereb Cortex, 2012,22(3):595-606.
[28] 何文娟,阮怀珍.D-丝氨酸在神经元-胶质细胞间通讯的新进展[J].生理科学进展,2009,40(4):303-307.
[29] Maguire EP, Mitchell EA, Greig SJ, et al. Extrasynaptic Glycine Receptors of Rodent Dorsal Raphe Serotonergic Neurons:A Sensitive Target for Ethanol[J]. Neuropsychopharmacology, 2014,39(5):1232-1244.
[30] Lu Y, Dong H, Gao Y, et al. A feed-forward spinal cord glycinergic neural circuit gates mechanical allodynia[J]. J Clin Invest, 2013,123(9):4050-4062.
[31] Wyse AT, Netto CA. Behavioral and neurochemical effects of proline [J]. Metab Brain Dis, 2011,26(3):159-172.
Construction of Parkinson 's disease cell model and observation of amino acid expression
LIShuang,LIShuangshuang,ZHANGXiaoying,GUOChunyan,WANGZhibao
(HebeiNorthUniversity,Zhangjiakou075000,China)
Objective To establish the human neuroblastoma cell model with Parkinson's disease (PD), and screen out the amino acid biomarkers in PD cells. Methods Human neuroblastoma SH-SY5Y cells were divided into the normal group, solvent group and rotenone group. Cells in the rotenone group were given 0.15, 0.25 μmol/L rotenone, cells in the solvent group were given dimethyl sulfoxide (DMSO), and the normal group was not added with any drug. Cell viability was assessed by MTT assay at 24, 48 h after medication, and inverted microscope was used to observe the cell morphology. Then we determined the concentration (0.15 μmol/L) and treatment time (24 h) of rotenone which had the little effect according to the changes of cell viability and cell morphology. The expression of α-synuclein was detected by Western blot to validate the success of PD model. And 12 kinds of amino acids, including glutamic acid (Glu), serine (Ser), glutamine (Gln), histidine (His), glycine (Gly), alanine (Ala), proline (Pro), tryptophan (Trp ), phenylalanine (Phe), isoleucine (Ile), leucine (Leu), and lysine (Lys), in PD cells were determined by high performance liquid chromatography, and we analyzed the significant changed amino acids between solvent group and rotenone group with partial least squares discriminant analysis (PLS-DA). Amino acid biomarkers in the PD model were determined with a variable importance in the projection (VIP) value greater than 1 and a P value less than 0.05. Results The expression of α-synuclein in the cells of the rotenone group was significantly higher than that of the solvent group (P<0.05), indicating the successful construction of SH-SY5Y cell model with PD. At 24 h, the Glu, Ser, Gln, His, Gly, Pro, Phe, Ile, Leu, Lys levels in the rotenone group were lower than those in the solvent group (allP<0.05). At 48 h, the levels of 11 kinds of amino acid except Gln in the rotenone group were lower than those in the solvent group (allP<0.05). Glu, Ser, Gly, Pro were screened out as the amino acid biomarkers (At 24 h, VIP values were 1.016, 1.016, 1.016, 1.009; at 48 h, all VIP values were 1.001). Conclusion The PD cell model is successfully established by rotenone induction and Glu, Ser, Gly, and Pro may be the potential diagnostic biomarkers for PD.
Parkinson's disease; rotenone; human neuroblastoma cells; amino acid
河北省教育厅重大项目(ZD2014075);河北北方学院博士科研启动基金项目。
李双(1994-),女,本科,主要研究方向为药物制剂。E-mail: 1037881424@qq.com
郭春燕(1968-),女,博士,教授,硕士生导师,主要研究方向为神经药理学、药物分析。E-mail: guochy0311@163.com
10.3969/j.issn.1002-266X.2017.15.006
R742.5
A
1002-266X(2017)15-0021-05
2016-12-17)
