经尿道灌注SCL基因重组慢病毒的DCP豚鼠膀胱Cajal样间质细胞数量、分布及超微结构观察
2017-06-05王子雄王勤章钱彪
王子雄,王勤章,钱彪
(石河子大学医学院附属第一医院,新疆石河子832000)
经尿道灌注SCL基因重组慢病毒的DCP豚鼠膀胱Cajal样间质细胞数量、分布及超微结构观察
王子雄,王勤章,钱彪
(石河子大学医学院附属第一医院,新疆石河子832000)
目的 观察经尿道灌注干细胞白血病(SCL)基因重组慢病毒的糖尿病膀胱病(DCP)豚鼠膀胱Cajal样间质细胞(ICC)的数量、分布及超微结构变化。方法 构建SCL基因重组慢病毒且标定滴度。选择雄性豚鼠70只,单次腹腔注射链尿佐菌素12周后构建DCP豚鼠模型,将成功造模的27只豚鼠随机分为实验组、阳性对照组、空白对照组,每组9只。实验组、阳性对照组、空白对照组豚鼠分别经尿道灌注(转染)SCL基因重组慢病毒、空慢病毒和等量PBS液。分别于转染后7、14、28 d每组各处死3只豚鼠,取膀胱组织,制作切片,激光共聚焦显微镜下观察GFP表达、膀胱ICC数量及分布变化,透射电镜下观察膀胱ICC的超微结构变化。结果 实验组随转染时间延长,ICC数量逐渐增多(P均<0.01),分布越发密集,但绿色荧光逐渐减退;空白组和对照组未见绿色荧光,随转染时间延长,ICC数量逐渐减少(P均<0.05),分布稀疏;转染14、28 d时,实验组ICC数量较空白组和对照组增加(P均<0.01)。实验组随转染时间延长,ICC细胞器数量增多,形态趋于正常,细胞内空泡减少,胞周突起延长变多,ICC超微结构处于不断恢复之中;而阳性对照组和空白对照组ICC超微结构病理变化逐渐加重。结论 经尿道灌注SCL基因重组慢病毒转染DCP豚鼠膀胱后,膀胱ICC数量增多,分布更加密集,细胞超微结构得到修复,提示SCL基因对DCP可能有一定治疗效果。
干细胞白血病基因;Cajal样间质细胞;糖尿病膀胱病
糖尿病是严重危害人体健康的多发病及常见病[1]。糖尿病膀胱病(DCP)又称糖尿病神经源性膀胱(DNB),是糖尿病常见并发症之一,发生率为19%~84%[2],早期表现为尿频、尿急,后期表现为尿不尽、残余尿增多等膀胱功能失代偿征象[3]。糖尿病患者常因膀胱功能障碍、排尿异常导致生活质量严重下降[4]。目前,DCP的发病机制和治疗措施在不断探索之中。研究[5,6]发现,人类、豚鼠、小鼠、大鼠等多种动物的膀胱逼尿肌有一特殊间质细胞,形态与胃肠道Cajal样间质细胞(ICC)类似,称为膀胱ICC。膀胱逼尿肌的收缩受膀胱ICC的调控[7]。ICC细胞膜和细胞质中存在一特异性酪氨酸蛋白激酶生长因子受体c-kit[8],c-kit与其配体干细胞因子(SCF)结合后可激活SCF/c-kit信号通路,该通路在维持ICC生理特性和表型中发挥重要作用[9,10]。然而,DCP会使膀胱ICC逐步衰退和减少,进而使SCF/c-kit信号转导通路受阻[11]。干细胞白血病(SCL)基因是c-kit上游的重要调控基因,SCL过表达能使c-kit表达增强,促进DCP中ICC功能和表型恢复[12]。本研究设计通过尿道灌注SCL基因重组慢病毒转染DCP豚鼠膀胱,观察ICC形态变化,为进一步利用SCL基因重组慢病毒治疗DCP提供实验基础。
1 材料与方法
1.1 实验动物与主要材料 选取英国种普通级雄性豚鼠70只,鼠龄3~6个月,体质量350~450 g,购自新疆医科大学动物实验中心。携带绿色荧光蛋白(GFP)的SCL基因重组慢病毒由上海吉凯基因化学技术有限公司协助制作,链尿佐菌素购自美国Sigma公司,恒冷冰冻切片机,大鼠抗小鼠c-Kit抗体购自美国Millipore公司,兔抗大鼠罗丹明标记荧光抗体购自Sigma公司,醋酸双氧铀购自美国TED PELLA公司,激光共聚焦显微镜,透射电子显微镜。
1.2 SCL基因重组慢病毒的构建与鉴定 对SCL基因质粒进行PCR扩增,上游引物序列为5′-GAGGATCCCCGGGTACCGGTCGCCACCATGACCGAGCG-GCCGCCGAG-3′,下游引物序列为5′-TCACCATG-GTGGCGACCGGCCGAGGGCCGGCTCCATC-3′。将P-CR扩增产物提纯后与GV287-EGFP结合,形成重组质粒GV287-EGFP/SCL,通过PCR法进行基因扩增,分装后测序。选择293T细胞为包装细胞,制备编码慢病毒重组病毒质粒,以pHelper1.0与pHelper2.0载体质粒作为辅助包装原件。用Lipofectamine2000转染试剂盒共转染293T细胞,以GV287-5EGFP空质粒转染293T细胞作为阴性对照。收集培养上清取得慢病毒,检测GFP以测定滴度,慢病毒滴度为5×108TU/mL。
1.3 构建DCP豚鼠模型
1.3.1 糖尿病豚鼠模型的建立 70只豚鼠用全价饲料适应性喂养1周,喂养过程中死亡2只。将链尿佐菌素(STZ)溶于新鲜配制的枸橼酸缓冲液(pH 4.4、浓度0.1 mol/L)中。给豚鼠单次腹腔注射200 mg/kg的STZ,3只在注射STZ后4~10 d内死亡。饲养6周后禁食12 h,采用剪耳法为豚鼠测定血糖,每周1次,连续4周,随机血糖≥16.7 mmol/L为糖尿病模型诱导成功,共31只豚鼠进入下步实验。34只豚鼠诱导失败,已剔除。
1.3.2 DCP豚鼠模型的建立 根据前期研究[13]结果,STZ单次腹腔注射豚鼠12周后,88.89%的糖尿病豚鼠发生失代偿期DCP,从而确定豚鼠失代偿期DCP发生的时间窗口,可建立较为可靠的DCP豚鼠动物模型。将“1.3.1”中诱导成功的糖尿病豚鼠继续饲养2周后建立DCP模型,期间4只豚鼠死亡,从研究中剔除;剩余27只符合DCP诊断标准(膀胱残余尿大于膀胱容量的10%,逼尿肌收缩力下降,膀胱容量及顺应性增加等[14,15]),进入后续实验。
1.4 SCL基因重组慢病毒灌注(转染)方法 将DCP豚鼠按体质量大小编号,用随机数字表法分为3组,其中实验组9只、空白对照组9只、阳性对照组9只。准备各组灌注液:实验组为5×108TU/mL的SCL慢病毒40 μL加ENi.S.至400 μL混匀后分成两等份;阳性对照组为5×108TU/mL的空慢病毒40 μL加ENi.S.至400 μL混匀后分成两等份;空白对照组为2等份200 μL的PBS液。将各组豚鼠禁食水12 h,100 mg/mL水合氯醛按200 mg/kg进行腹腔注射麻醉;将豚鼠四肢固定于操作台上暴露阴茎,碘伏消毒后铺一次性洞巾,插入尿管(硬膜外导管改良而成)8~10 cm后见尿液流出;放空尿液,用注射器反复抽吸0.4 mL生理盐水进行膀胱冲洗,待液体清亮后,实验组、阳性对照组、空白对照组分别于当天和第3天灌注SCL慢病毒、空慢病毒、PBS液,每次200 μL,灌注完毕后结扎尿管1~2 h,待豚鼠苏醒后拨除尿管,回笼继续饲养。
1.5 膀胱ICC数量计算及分布观察 各组分别于转染后7、14、28 d采用颈部脱臼法各处死3只豚鼠,无菌环境下取膀胱组织标本,经OCT包埋后置入恒冷冰冻切片机进行切片,每个膀胱标本制作4张冰冻切片,厚度为20 μm。将新鲜切片在100%丙酮中固定15 min,1% PBS漂洗3次;用0.03% H2O2溶液将内源性过氧化物酶密封处理30 min,1%PBS漂洗3次;用1∶100胎牛血清封闭,室温孵育30 min,滴加1∶200特异性一抗(大鼠抗小鼠c-kit抗体),在4 ℃环境中孵育2 h后放入-4 ℃冰箱内继续孵育12 h,1% PBS漂洗3次;加浓度1∶100二抗(兔抗大鼠罗丹明标记荧光抗体),置于25 ℃湿盒内避光孵育60 min,1% PBS漂洗3次;最后用50%甘油封片,置于激光共聚焦显微镜下观察,沿单孔板垂直于每张切片水平连续观测20个视野(200×),观察GFP表达、ICC数量及分布变化。激光共聚焦显微镜下观察发现正常膀胱ICC呈梭形或纺锤形,细胞核未被抗体标记、无荧光着色,呈椭圆形,位于细胞中央,每个细胞两端有特征性的长突起(图1)。
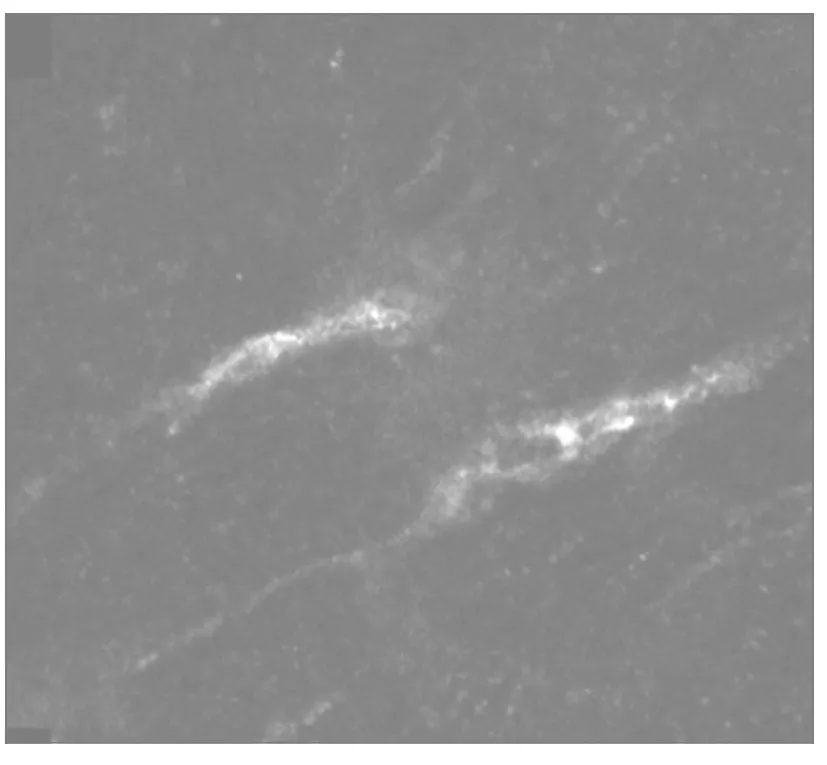
图1 激光共聚焦显微镜下正常豚鼠膀胱ICC形态
1.6 膀胱ICC超微结构观察 将“1.5”中取到的膀胱组织置于滴加3%戊二醛的玻片上,切割为1 mm3的组织块,置于3%戊二醛固定液中固定48 h,再置入0.1%锇酸中固定2 h,移至1%醋酸铀内在室温下染色2 h;将组织块脱水后浸泡于丙酮和中性树胶混合液中,37 ℃烘箱内过夜;将标本包埋、修块后置于超薄切片机上切割制作2 μm厚切片,甲苯蓝染色后置于光学显微镜下定位;在超薄切片机上切割制作100 nm的超薄组织切片,用饱和醋酸双氧铀和柠檬酸铅双重电子染色15 min;于透射电镜下观察ICC超微结构。根据ICC超微结构特点定位。ICC多为单个,也有成对的,呈梭型或星形,胞体长度约为20 μm;细胞核呈椭圆形,体积较大,可见染色质边聚现象,少量胞质围绕细胞核分布;胞质内见较多的线粒体、粗面内质网等细胞器,细胞内无肌纤维;胞体常形成2个或更多细胞突起,ICC间可以通过细胞突起相互连接。
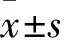
2 结果
2.1 各组豚鼠膀胱ICC数量及分布变化 实验组镜下可见GFP发出的绿色荧光,证明SCL基因转染成功。实验组随转染时间延长,ICC数量逐渐增多,分布越发密集,但绿色荧光逐渐减退;空白组和对照组未见绿色荧光,随转染时间延长,ICC数量逐渐减少,分布稀疏。实验组转染7 d时见少量ICC呈零星分布,绿色荧光很强;转染14 d时ICC数量较7 d时明显增多(P<0.01),ICC散在分布于膀胱平滑肌束间,绿色荧光较强;转染28 d时ICC数量较14 d时增加(P<0.01),分布较为密集,绿色荧光较弱。空白对照组和阳性对照组豚鼠膀胱ICC中无GFP表达,未见绿色荧光;转染7、14 d时ICC数量少,在膀胱平滑肌束间呈零星分布;转染28 d时ICC数量更少,偶尔可见单个ICC出现,较转染7、14 d时数量减少(P均<0.01)。转染14、28 d时,实验组ICC数量较空白组和对照组增加(P均<0.01)。见表1。
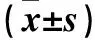
表1 转染不同时间后各组豚鼠膀胱ICC数量比较
注:与同组转染7 d时相比,*P<0.05;与同组转染14 d时相比,#P<0.01;与同时点实验组相比,△P<0.01。
2.2 各组豚鼠膀胱ICC超微结构变化 实验组转染7 d时ICC内细胞器数量少,线粒体肿胀,有空泡样变,内质网扩张,胞周突起少而短;转染14 d时ICC核质比例大,细胞核大,染色质多,粗面内质网脱颗粒,胞质广泛溶解、有大量空泡形成,细胞周突起少而长;转染28 d时ICC内细胞器数量增多,形态趋于正常,胞内稀少空泡,胞周突起明显多且长。空白对照组和阳性对照组转染7、14 d时ICC内细胞器数量减少,形态欠规则,胞内空泡样少,胞周突起少且短;转染28 d时ICC细胞器数量少,形态不规则,线粒体肿胀、空泡样变甚至溶解,内质网少且明显扩张,大量空泡沿质膜分布,胞周突起稀少(见图2)。

图2 各组豚鼠膀胱ICC超微结构
3 讨论
在豚鼠DCP模型及体外高糖环境下培养膀胱ICC中发现,伴随ICC数量的减少、形态及电生理功能的改变,ICC中c-kit mRNA及c-kit蛋白表达明显降低[16]。因此,高糖环境引起c-kit mRNA及c-kit蛋白表达下调是导致ICC数量减少、形态和功能损害的主要原因。由此推测,如果通过某方式恢复或者上调c-kit的表达,就可能促进膀胱ICC增殖,进而重塑受损的ICC表型及功能,逐渐恢复膀胱功能,达到治疗DCP的目的。对于SCL功能和慢病毒的研究探索使我们对DCP的基因治疗研究的可行性大大提升。糖尿病导致的高血糖环境使ICC表达c-kit信号分子减少,从而影响SCF/c-kit的信号转导功能[17]。相关研究表明,SCL基因结合位点在c-kit转录调控区,SCL主要是通过作用于c-kit基因启动子发挥功能,从而调节c-kit表达;SCL过表达能上调c-kit表达且恢复SCF的反应性[18]。鉴于SCL的上述作用,本课题组设想通过基因治疗的手段将SCL基因重组慢病毒转染DCP豚鼠膀胱,逆转受损ICC的功能和表型,为DCP的基因治疗提供思路。
多项研究[19~22]表明,基因治疗可能会为DCP的治疗方式带来新的进展。基因治疗是将目的基因导入患者的靶组织细胞进行表达,从而补偿或纠正基因异常或基因缺陷,达到治疗的目的[23]。要将外源基因运送至特定的靶细胞,需要合适的载体负载目的基因。病毒载体是一种常用工具,能将目的基因转入细胞。目前常用的病毒载体包括慢病毒载体、逆转录病毒载体、腺病毒载体和腺病毒相关病毒载体等。慢病毒载体因其具有高效稳定的转移效率成为常用的载体工具[24~26],广泛用于疾病的基因治疗相关临床试验与研究[27,28]。本研究制作了SCL基因重组慢病毒载体,经尿道灌注DCP豚鼠膀胱。由于膀胱是半开放性器官,在实验操作中可利用天然孔道采取无创和微创方式进行实验,我们通过插尿管将重组慢病毒直接灌入膀胱,避免实验过程中对组织的直接损伤,也避免了慢病毒的过量使用造成的浪费及慢病毒在全身的蔓延分布。我们镜下发现实验组GFP蛋白表达,表明SCL基因已成功转染至豚鼠膀胱组织,为下一步实验提供了前提。
我们在激光共聚焦显微镜下观察ICC数量及分布改变,发现随着转染时间延长,发红色荧光的膀胱ICC数量逐渐增多,分布密集程度增加,但GFP发出的绿色荧光会逐渐减弱,这可能与膀胱组织自身新陈代谢有关;而阳性对照组和空白对照组随转染时间延长,ICC数量逐渐减少,分布稀疏。上述结果提示,SCL基因重组慢病毒灌入DCP膀胱后,能够使ICC数量得到提升和恢复,增加了ICC密集程度。我们在透射电镜下观察ICC超微结构改变,发现实验组转染SCL基因后ICC细胞器数量增多、形态趋于正常、细胞内空泡减少、胞周突起延长变多,ICC超微结构处于不断恢复之中;而阳性对照组和空白对照组ICC超微结构病理变化逐渐加重。上述结果说明,SCL基因的导入使得ICC的超微结构处于不断的恢复之中,反之,随着病情的延长,ICC的超微结构在不断损伤。
综上所述,经尿道灌注SCL基因重组慢病毒转染豚鼠DCP膀胱后,膀胱ICC数量、分布及超微结构得到不同程度的恢复,提示SCL基因可能对DCP有一定治疗效果,本实验结果为DCP的治疗提供了新的手段和思路。但本实验也存在不足,如豚鼠尿管是通过硬膜外导管改良制成,豚鼠个体差异导致尿管与尿道的吻合程度有偏差,在灌注SCL基因重组慢病毒时,有个别豚鼠会出现少量病毒液从管壁旁渗出现象,这会导致慢病毒灌注量有一定偏差。
[1] Shi Z. Prevalence of diabetes among men and women in China[J]. N Engl J Med, 2010,362(25):1090-1101.
[2] Liu G, Daneshgari F. Diabetic bladder dysfunction[J]. Chin Med J, 2014,127(7):1357-1364.
[3] Tin SS, Wiwanitkit V. Bladder dysfunction in women with type 2 diabetes mellitus[J]. Indian J Endocrinol Metab, 2015,19(1):191.
[4] Lin TL, Chen GD, Chen YC, et al. Aging and recurrent urinary tract infections are associated with bladder dysfunction in type 2 diabetes[J]. Taiwan J Obstet Gynecol, 2012,51(3):381-386.
[5] Wang JP, Ding GF, Wang QZ. Interstitial cells of Cajal mediate excitatory sympathetic neurotransmission in guinea pig prostate[J]. Cell Tissue Res, 2013,352(3):479-486.
[6] Ward SM, Sanders KM, Hirst GDS. Role of interstitial cells of Cajal in neural control of gastrointestinal smooth muscles[J]. Neurogastroenterol Motility, 2004,16(Suppl 1):112-117.
[7] Mccloskey KD. Interstitial cells and bladder pathophysiology--passive bystanders or active participants[J]. J Urol, 2011,185(5):1562-1573.
[8] Wojciech A, Piotr K, Zdzislaw W, et al. The distribution of interstitial cells of Cajal in congenital ureteropelvic junction obstruction[J]. Int J Nephrol Urol, 2013,45(3):607-612.
[9] 范勇洪,丁国富,王勤章,等.高糖环境对豚鼠膀胱ICCs细胞超微结构的影响[J].现代生物医学进展,2009,9(23):4422-4424.
[10] 徐礼臻,王勤章,韩涛,等.高糖环境对豚鼠膀胱Cajal样间质细胞内向电流的影响[J].山东医药,2011,51(34):25-26.
[11] 刘永国,王勤章.膀胱ICCs细胞SCF/c-kit信号通路研究现状[J].中国现代医药杂志,2010,12(10):124-126.
[12] 王勤章,纪世琪,朱国栋,等.糖尿病豚鼠膀胱Cajal样间质细胞形态学变化及意义[J].临床与实验病理学杂志,2009,25(6):631-634.
[13] 罗广承,何志华,罗建珍,等.构建糖尿病膀胱病豚鼠模型及其尿动力学评价[J].中国组织工程研究,2014(7):1063-1068.
[14]Hagstroem S, Kamperis K, Rittig S, et al. Monosymptomatic nocturnal enuresis is associated with abnormal nocturnal bladder emptying[J]. J Urol, 2004,171(2):2562-2566.
[15]Daneshgari F, Huang X, Liu G, et al. Temporal differences in bladder dysfunction caused by diabetes, diuresis, and treated diabetes in mice[J]. Am J Physiol Regul Integr Comp Physiol, 2006,290(6):1728-1735.
[16] 刘永国,王勤章,丁国富,等.干细胞因子对高糖环境下豚鼠膀胱Cajal样间质细胞c-kit mRNA及蛋白表达的影响[J].临床与实验病理学杂志,2011(3):282-285.
[17] 徐礼臻,王勤章,韩涛,等.高糖环境对豚鼠膀胱Cajal样间质细胞内向电流的影响[J].山东医药,2011,51(34):25-26.
[18] Lang RJ, Tonta MA, Zoltkowski BZ, et al. Pyeloureteric peristalsis: role of atypical smooth muscle cells and interstitial cells of Cajal-like cells as pacemakers[J]. J Physiol, 2006,576(3):695-705.
[19] 魏艳青,马路平,王江平,等.经尿道灌注干细胞白血病基因慢病毒转染豚鼠糖尿病膀胱病变的效果研究[J].中国全科医学,2016,19(33):4079-4082.
[20] 孙士敏,徐斌,范红梅.以AdMax载体系统构建携带HCV NS5B基因的重组腺病毒表达载体[J].医学综述,2010,16(15):2379-2382.
[21] 于建超,王勤章,王江平,等.含人干细胞白血病基因慢病毒载体转染Cajal样间质细胞的效果研究[J].中国全科医学,2016,19(15):1796-7802.
[22] 魏艳青,王江平,王勤章,等.经尿道灌注慢病毒转染豚鼠膀胱的研究[J].天津医药,2015,43(11):1275-1277.
[23] Bose R, Kavuri SM, Searleman AC, et al. Activating HER2 mutations in HER2 gene amplification negative breast cancer[J]. Cancer Dis, 2013,3(2):224-237.
[24] Meng F, Chen C, Wan H, et al. Advances of lentiviral vectors[J]. Chin J Lung Cancer, 2014,17(12):870-876.
[25] Han GZ, Worobey M. Endogenous Lentiviral Elements in the Weasel Family (Mustelidae)[J]. Mol Biol Evol, 2012,29(10):2905-2908.
[26] Zhu DX, Zhu W, Fang C, et al. miR-181a/b significantly enhances drug sensitivity in chronic lymphocytic leukemia cells via targeting multiple anti-apoptosis genes[J]. Carcinogenesis, 2012,33(7):1294-1301.
[27] Lawson SK, Dobrikova EY, Shveygert M, et al. p38α Mitogen-Activated Protein Kinase Depletion and Repression of Signal Transduction to Translation Machinery by miR-124 and -128 in Neurons[J]. Mol Cell Biol, 2013,33(1):127-135.
[28] Li D, Wang Q, Liu C, et al. Aberrant expression of miR-638 contributes to benzo(a)pyrene-induced human cell transformation.[J]. Toxicol Sci, 2012,125(2):382-391.
Observation on number, distribution and ultrastructure of interstitial cells of Cajal in guinea pig with DCP after transurethral perfusion of SCL recombinant lentiviral vector
WANGZixiong,WANGQinzhang,QIANBiao
(TheFirstAffiliatedHospitalofShiheziUniversityMedicalCollege,Shihezi832000,China)
Objective To observe morphological changes in the number, distribution and ultrastructure of interstitial cells of Cajal (ICC) in guinea pig with diabetic cystopathy (DCP) after transurethral perfusion of stem cell leukemia (SCL) gene recombinant lentiviral vector. Methods We constructed the recombinant lentiviral vector of SCL gene and demarcated its titer. Seventy guinea pigs were selected and a single intraperitoneal injection of streptozotocin (STZ) was used to construct the DCP models of guinea pigs at the end of the 12th week. Twenty-seven successful DCP models of guinea pigs were randomly divided into the experimental group, positive control group and blank control group (n=9 in each group). The experimental group, the positive control group and the blank control group were injected with SCL gene recombinant lentivirus, empty lentivirus and the same amount of PBS solution, respectively. On day 7, 14 and 28 after transfection, 3 guinea pigs were sacrificed from each group to obtain the bladder tissue to make the section. The expression of GFP, bladder ICC number and distribution was observed under laser confocal microscope, and the ultrastructural changes of bladder ICC were observed by transmission electron microscope. Results In the experimental group, the number of ICC increased with the increase of transfection time (P<0.01), and the distribution was more and more intensive, but the green fluorescence decreased gradually. The blank group and the control group had no green fluorescence, and the number of ICC decreased with the increase of transfection time (P<0.05) and the distribution was sparse; on day 14 and 28, the number of ICC in the experimental group was higher than that in the blank group and the control group (allP<0.01). In the experimental group, with the transfection time prolonged, the number of ICC cells increased, morphology tended to normal, intracellular vacuole decreased, and the ultrastructure of ICC continuously recovered; however, in the positive control group and blank control group, ICC pathological ultrastructure changes gradually aggravated. Conclusions After the SCL gene is transfected into the bladder of DCP guinea pig, the number of ICC increases, the distribution becomes more intensive, and the ultrastructure of the cells is repaired. It suggests that SCL gene might have a certain therapeutic effect on DCP.
stem cell leukemia (SCL) gene; interstitial cells of Cajal; diabetic cystopathy
国家自然科学基金资助项目(81360120)。
王子雄(1988-),男,硕士研究生在读,主要研究方向为泌尿外科学。E-mail: 115141179@qq.com
王勤章(1969-),男,博士,教授,主要研究方向为泌尿外科学。E-mail: wqz1969@sina.com
10.3969/j.issn.1002-266X.2017.15.007
R587.2
A
1002-266X(2017)15-0026-05
2016-11-01)
