原发性肝细胞癌组织中长链非编码RNA MINCR、CDK2 mRNA的表达变化及其意义
2017-06-05王娟付文广
王娟,付文广
(西南医科大学附属医院,四川泸州 646000)
原发性肝细胞癌组织中长链非编码RNA MINCR、CDK2 mRNA的表达变化及其意义
王娟,付文广
(西南医科大学附属医院,四川泸州 646000)
目的 观察原发性肝细胞癌(HCC)组织中长链非编码RNA MINCR(LncRNA-MINCR)与周期蛋白依赖性激酶2(CDK2)mRNA的表达变化,并探讨其意义。方法 41例HCC患者,手术治疗中均留取癌组织和癌旁组织,采用Real-time PCR法检测癌、癌旁组织中lncRNA-MINCR和CDK2 mRNA,采用 Pearson相关性方法分析HCC组织中lncRNA-MINCR与CDK2 mRNA相关性,并分析lncRNA-MINCR、CDK2 mRNA的表达与原发性肝细胞癌患者临床病理参数的关系。结果 HCC癌组织及癌旁组织lncRNA-MINCR的相对表达量分别为5.20±4.50、1.32±1.18,二者比较,P<0.001。HCC癌组织及癌旁组织CDK2的相对表达量分别为4.90±4.62、1.71±1.98,二者比较,P<0.001。相关性分析显示,HCC患者癌组织lncRNA-MINCR与CDK2 mRNA水平呈正相关(R2=0.260 1,P<0.001)。lncRNA-MINCR的表达与HCC患者肿瘤直径、有无肝硬化有关(P均<0.05),CDK2 mRNA的表达与HCC患者肿瘤直径、AFP水平有关(P均<0.05)。结论 HCC癌组织中存在lncRNA-MINCR、CDK2 mRNA高表达,二者在HCC的发生、发展中起协同作用。
肝肿瘤;肝细胞癌;长链非编码RNA;lncRNA-MINCR;周期蛋白依赖性激酶2
原发性肝细胞癌(HCC)是我国最常见的恶性肿瘤之一,其发病机制目前仍不明确,临床尚无有效治疗方法,目前HCC患者五年生存率仍较低。研究表明,长链非编码RNA(lncRNA)在基因表达调控中具有重要作用[1,2]。MINCR是一个新近发现的lncRNA,既往研究发现转录因子MYC不仅可促进lncRNA-MINCR高表达,lncRNA-MINCR可反向调节转录因子MYC的功能,在癌症的发生、发展中起协同驱动作用[3]。周期蛋白依赖性激酶2(CDK2)是关键的细胞周期调节因子,其表达与包括肝癌在内的多种肿瘤的恶性增殖有关[4,5]。转录因子MYC可通过调节CDK/Rb/E2F通路影响CDK2的表达[6]。目前lncRNA-MINCR、CDK2 在HCC中的研究报道较少。本研究观察了HCC癌组织中lncRNA-MINCR与CDK2 mRNA的表达变化,分析其与HCC临床病理参数的关系。现将结果报告如下。
1 资料与方法
1.1 临床资料 选择2012年1月~2015年12月间我院诊治的41例HCC患者,其中男29例、女12例,年龄42~74岁,中位年龄56岁;术前均未行任何放化疗或其他抗肿瘤治疗,手术中均留取癌组织和距离肿瘤组织5 cm以外的癌旁正常组织,液氮保存备用,术后病理学均确认为HCC。本研究经医院伦理委员会批准,所有患者均知情同意并签署知情同意书。
1.2 癌组织及癌旁组织lncRNA-MINCR、CDK2 mRNA检测方法 采用Real-time PCR法检测癌、癌旁组织中lncRNA-MINCR和CDK2 mRNA。应用TRIzol(Invitrogen)抽提组织总RNA,对所得的RNA进行逆转录。采用SYBR Green染料法,利用实时荧光定量PCR仪(Bio-Rad)检测lncRNA-MINCR与CDK2 mRNA的表达。每个样本设置复孔3个。以GAPDH为内参。引物由Sangon Biotech合成。lncRNA-MINCR上游引物:5′-AGACTTGAATGGAGACATCAGC-3′,下游引物:5′-CCAGAGAAACAGAACCAATGA-3′;CDK2上游引物:5′-GTGGTACCGAGCTCCTGAAA-3′,下游引物:5′-AAAGATCCGGAAGAGCTGGT-3′;GAPDH上游引物:5′-CGGAGTCAACGGATTTGGTCGTAT-3′;下游引物:5′-AGCCTTCTCCATGGTGGTGAAGAC-3′。lncRNA-MINCR、CDK2 mRNA的的相对表达量以2-ΔΔCt表示。ΔCt=Ct靶基因-CtGAPDH;ΔΔCt=ΔCt实验组-ΔCt对照组。以lncRNA-MINCR、CDK2 mRNA相对表达量的中位数及其以上水平判为高表达。
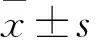
2 结果
2.1 癌组织及癌旁组织lncRNA-MINCR、CDK2 mRNA相对表达量比较 癌组织及癌旁组织lncRNA-MINCR的相对表达量分别为5.20±4.50、1.32±1.18,二者比较,P<0.001。癌组织及癌旁组织CDK2 mRNA的相对表达量分别为4.90±4.62、1.71±1.98,二者比较,P<0.001。
2.2 HCC组织lncRNA-MINCR表达与CDK2 mRNA表达的相关性 相关性分析显示,HCC患者癌组织lncRNA-MINCR与CDK2 mRNA水平呈正相关(R2=0.260 1,P<0.001)。
2.3 lncRNA-MINCR、CDK2 mRNA表达与HCC患者临床病理参数的关系 lncRNA-MINCR的表达与HCC患者肿瘤直径、有无肝硬化有关(P均<0.05),CDK2 mRNA的表达与HCC患者肿瘤直径、AFP水平有关(P均<0.05)。见表1。
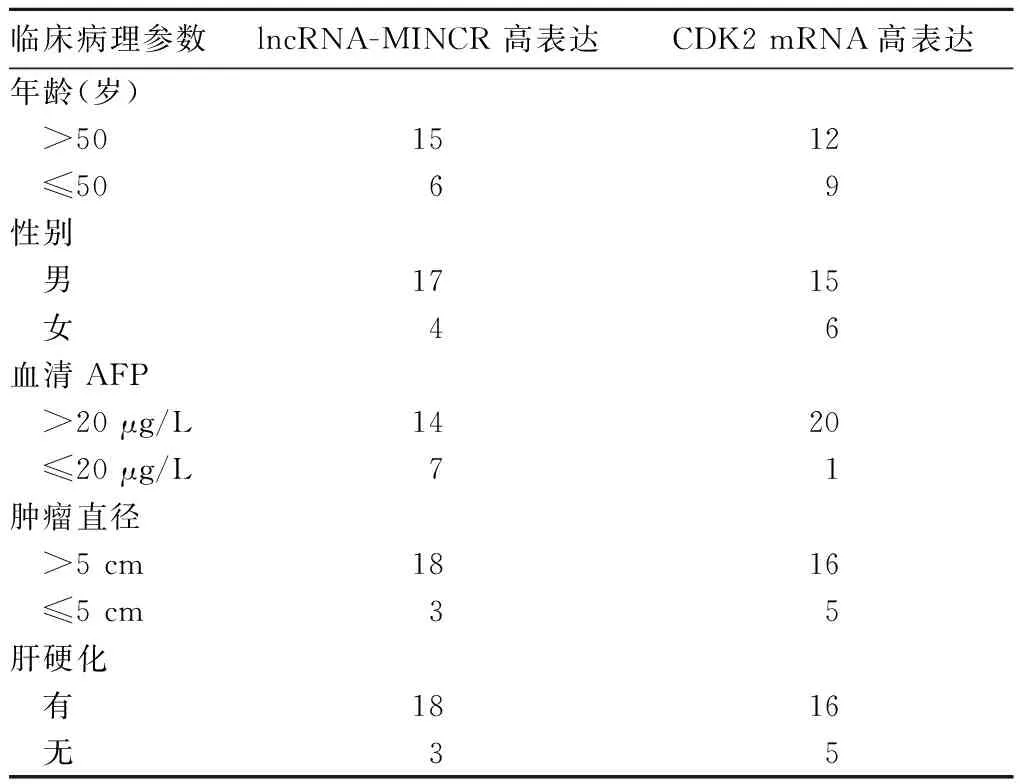
表1 lncRNA-MINCR、CDK2 mRNA表达与HCC患者临床病理参数的关系(例)
3 讨论
HCC是一种高病死率的恶性肿瘤,每年超过100万患者死亡[7]。肝癌发生、进展与转移的机制十分复杂,目前临床尚未发现可靠治疗靶点。研究[8]发现,单纯DNA改变并不能解释HCC的复杂进程。对基因在不同水平参与表达调控的机制进行深入而广泛的探讨是目前HCC诊断和治疗的研究热点。
myc基因是较早发现的一组癌基因,与之同源的病毒癌基因存在于MC29及其它一些具有高度致癌性的猿逆转录病毒中。myc基因高水平表达时可转化啮齿类成纤维细胞。MYC家族是一类具有转录因子效应的核蛋白类调控基因,其可以通过靶向调节Bcl-2、CDK4、CDC25A、CCND1等蛋白,在细胞增殖、分化与凋亡等方面发挥重要的调控作用[8]。MYC作为原癌基因,在多数肿瘤中异常扩增,驱动肿瘤恶性转化,并导致患者预后不良。但目前关于调节MYC表达与功能的分子机制还尚不清楚。lncRNA是一类长度大于200 nt不具有蛋白编码能力的转录本。近年,lncRNA参与基因表达调控的作用越来越受到人们的重视,但绝大多数的lncRNA的功能仍然知之甚少[1]。Doose等[3]发现MYC过表达的细胞系与MYC基因变异扩增的B淋巴细胞瘤患者中,一个长链非编码RNA异常高表达,具有原癌基因的功能,且与MYC的表达存在正相关性,并命名为MINCR。同样,Wang等[9]发现lncRNA-MINCR在胆囊癌中异常过表达,并促进了胆囊癌的进展,导致更差的总体的幸存。本研究发现,HCC癌组织中存在lncRNA-MINCR高表达,与HCC患者临床病理参数的关系显示,lncRNA-MINCR的表达与HCC患者肿瘤直径、有无肝硬化有关。肿瘤直径增大与癌细胞的增殖能力增强有关,另外,肝硬化的发生与广泛肝细胞、结缔组织过度再生与重建关系密切。因此可猜测,lncRNA-MINCR在HCCF癌组织的异常表达将导致细胞恶性增殖,但lncRNA-MINCR调节HCC癌细胞增殖的具体机制还需要深入探讨。
CDK2是细胞周期依赖性蛋白家族成员,其主要是通过与周期蛋白结合形成活化状态的蛋白激酶复合物,催化RB磷酸化,驱动周期进程并促进细胞分裂[10]。大量研究发现CDK2在肺癌、黑色素瘤、骨肉瘤、乳腺癌与恶性胶质瘤等肿瘤过度表达与活化[11,12]。本研究发现,HCC癌组织中CDK2 mRNA异常高表达;与HCC患者临床病理参数的关系显示,CDK2 mRNA的表达与HCC其表达量与血清AFP水平、肿瘤直径有关。Mizejewski等[13]研究表明,AFP与一些细胞周期依赖性蛋白存在相互作用并参与调控细胞周期。肝细胞癌组织中存在CDK2异常过表达,并可促进癌细胞的增殖能力增强[14]。
本研究还发现, HCC患者癌组织lncRNA-MINCR与CDK2 mRNA水平呈正相关,这提示lncRNA-MINCR与CDK2 mRNA间可能存在正性调控机制,过表达的lncRNA-MINCR可能促进CDK2 mRNA的表达,从而促进HCC癌细胞的恶性增殖。早在1999年,Mateyak等[17]就发现MYC的缺失将抑制Cyclin E-CDK2复合物形成,阻滞细胞周期进程。但MYC是通过何种机制调节Cyclin E-CDK2复合物的形成尚不清楚。lncRNA-MINCR是MYC诱导表达的一个长链非编码RNA分子,作为MYC的下游分子,MYC可能通过lncRNA-MINCR途径直接参与调节CDK2的表达。Doose等[3]发现,干涉lncRNA-MINCR表达之后,MYC作为转录因子结合于CDK2启动子区域的能力大大减弱,从而引起CDK2表达的降低。但目前研究仍没有揭示lncRNA-MINCR是通过何种作用影响MYC的功能。lncRNA-MINCR在肝细胞癌中调控CDK2表达进而促进细胞增殖的机制仍需进一步探究。
综上所述,HCC癌组织中存在lncRNA-MINCR、CDK2 mRNA高表达,二者在HCC的发生、发展中起协同作用。
[1] Ulitsky I, Bartel DP. LincRNAs: genomics, evolution, and mechanisms [J]. Cell, 2013,154(1):26-46.
[2] 龚艳清,韩涛,章坤,等.长链非编码RNA在肝癌中的研究进展[J].山东医药,2016,56(10):96-98.
[3] Doose G, Haake A, Bernhart SH, et al. MINCR is a MYC-induced lncRNA able to modulate MYC′s transcriptional network in Burkitt lymphoma cells [J]. Proc Natl Acad Sci U S A, 2015,112(38):5261-5270.
[4] Malumbres M, Barbacid M. Mammalian cyclin-dependent kinases [J]. Trends Biochem Sci, 2005(11):630-641.
[5] 王文礼,李丽梅,关则红,等.CDK2干扰RNA对人肝癌细胞HepG2细胞周期和增殖的影响[J].内蒙古医学院学报,2008,30(3):153-157.
[6] Niu Z, Liu H, Zhou M, et al. Knockdown of c-Myc inhibits cell proliferation by negatively regulating the Cdk/Rb/E2F pathway in nasopharyngeal carcinoma cells [J]. Acta Biochim Biophys Sin, 2015,47(3):183-191.
[7] Forner A, Llovet JM, Bruix J. Hepatocellular carcinoma [J]. Lancet, 2012,379(9822):1245-1255.
[8] Shachaf CM, Felsher DW. Tumor dormancy and MYC inactivation: pushing cancer to the brink of normalcy [J]. Cancer Res, 2005,65(11):4471-4474.
[9] Wang SH, Yang Y, Wu XC, et al. Long non-coding RNA MINCR promotes gallbladder cancer progression through stimulating EZH2 expression [J]. Cancer Lett, 2016,380(1):122-133.
[10] Sengupta S, Henry RW. Regulation of the retinoblastoma-E2F pathway by the ubiquitin-proteasome system [J]. Biochim Biophys Acta, 2015,1849(10):1289-1297.
[11] Wang J, Yang T, Xu G, et al. Cyclin-dependent kinase 2 promotes tumor proliferation and induces radio resistance in glioblastoma [J]. Transl Oncol, 2016,9(6):548-556.
[12] Yang CC, LaBaff A, Wei Y, et al. Phosphorylation of EZH2 at T416 by CDK2 contributes to the malignancy of triple negative breast cancers [J]. Am J Transl Res, 2015,7(6):1009-1020.
[13] Mizejewski GJ. The alpha-fetoprotein (AFP) third domain: a search for AFP interaction sites of cell cycle proteins [J]. Tumour Biol, 2016,37(9):12697-12711.
[14] Chohan TA, Qian H, Pan Y, et al. Cyclin-dependent kinase-2 as a target for cancer therapy: progress in the development of CDK2 inhibitors as anti-cancer agents [J]. Curr Med Chem, 2015,22(2):237-263.
10.3969/j.issn.1002-266X.2017.19.026
R657.3
B
1002-266X(2017)19-0083-03
2016-09-26)
