淮安地区孕妇ToRCH感染血清抗体筛查结果分析
2017-06-05张媛媛刘蓓蓓张迎梅
张媛媛,刘蓓蓓,张迎梅
(南京医科大学附属淮安第一医院 检验科,江苏 淮安 223300)
·论 著·
淮安地区孕妇ToRCH感染血清抗体筛查结果分析
张媛媛,刘蓓蓓,张迎梅
(南京医科大学附属淮安第一医院 检验科,江苏 淮安 223300)
目的:探讨淮安地区孕妇ToRCH感染的血清学证据,为优生优育、妇幼预防保健提供参考数据。方法:应用酶联免疫法(ELISA)检测2014年1月至2015年12月我院4981例孕妇血清中ToRCH特异性IgM和IgG,并对筛查结果进行回顾性分析。结果:在IgM检测中巨细胞病毒(CMV)阳性率最高,为1.67%;在IgG检测中风疹病毒(RV)、CMV 阳性率分别为89.78%和89.26%,明显高于弓形虫(TOX)和单纯疱疹病毒(HSVⅡ)的阳性率;CMV IgG在≥35岁年龄组阳性率显著高于<35岁年龄组(P<0.01);TOXIgM秋季阳性检出率高于其他季节(P<0.05);2015年CMV IgM阳性率高于2014年水平(P<0.05);既往有不良妊娠史孕妇ToRCH IgM阳性率明显高于正常孕妇(P<0.01);孕妇ToRCH多重感染检出4201例,占84.34%,主要为RV和CMV混合感染。结论:产前应进行ToRCH感染的定期筛查,并实施早期干预以防止胎儿感染造成不良后果。
ToRCH;免疫球蛋白M;免疫球蛋白G
ToRCH这个概念最初由免疫学家Andre Nahmia提出,它是一个引发急性感染的复合词,即弓形虫(toxoplasma,TOX)、风疹病毒(rubella virus,RV)、巨细胞病毒(cytomegalovirus,CMV)、单纯疱疹病毒Ⅰ/Ⅱ型(herpes simplex virus,HSVⅠ/Ⅱ)。孕产妇妊娠阶段ToRCH感染可以通过子宫内传播,导致流产、胎儿宫内死亡、先天畸形等[1]。孕妇ToRCH感染最初无症状,所以临床对ToRCH感染的诊断取决于血清学证据。本研究旨在检测和分析江苏省淮安地区孕妇ToRCH感染的血清学证据,为优生优育、妇幼预防保健提供参考数据。
1 资料与方法
1.1 一般资料
选择2014年1月至2015年12月在我院产前筛查的 4981例孕妇,年龄18~45岁;其中<35岁孕妇4429例,≥35岁孕妇552例;筛查孕妇春季1706例、夏季951例、秋季976例、冬季1348例。
1.2 研究方法
采集研究对象空腹外周静脉血3ml,以3 500r·min-1离心5min,收集血清。采用酶联免疫捕获法及间接法检测TOX、RV、CMV、HSVⅡIgM和IgG,使用北京贝尔生物工程有限公司生产的试剂盒。检测结果判定:采用雷杜RT-6000酶标分析仪读取各孔吸光度值。测定标本吸光度值<临界值时,判定为阴性;测定标本吸光度值≥临界值时,则判定为阳性。
1.3 统计学处理
研究数据采用SPSS 22.0软件进行统计学分析,计数资料用百分率表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 孕妇ToRCH感染IgM和IgG阳性率比较
见表1。
表1 孕妇ToRCH感染IgM和IgG阳性率(n=4981)
Tab 1 Positive rate of ToRCH IgM and IgG in pregnant women(n=4981)

病原体IgMIgG阳性/例阳性率/%阳性/例阳性率/%TOXRVCMVHSVⅡ6128360.120.241.670.12122447244463442.4589.7889.266.91
由表1可见,CMV IgM的阳性率最高;RV、CMV IgG的阳性率明显高于TOX和HSVⅡ;ToRCH 4种病原体IgM和IgG检测阳性率比较,差异有统计学意义(P<0.01)。
2.2 不同年龄组孕妇ToRCH感染IgM、IgG阳性率比较
见表2。
表2 不同年龄组孕妇ToRCH感染IgM、IgG阳性率比较
Tab 2 Comparison of positive rate of IgM and IgG against ToRCH infections in pregnant women with different ages

IgMIgG病原体<35岁(n=4429)≥35岁(n=552)<35岁(n=4429)≥35岁(n=552)阳性/例阳性率/%阳性/例阳性率/%阳性/例阳性率/%阳性/例阳性率/%TOXRVCMVHSVⅡ4107160.090.231.600.14221200.360.362.170.00108397539243042.4489.7588.606.8614497522402.5490.0494.577.25
<35岁年龄组孕妇中TOX、RV、CMV IgM检出阳性率低于≥35岁年龄组,而HSVⅡ IgM检出阳性率却高于≥35岁年龄组,但差异均无统计学意义(P>0.05);TOX、RV、CMV、HSVⅡ IgG在≥35岁年龄组阳性检出率均高于<35岁年龄组,仅CMV IgG在两个年龄组之间差异有统计学意义(P<0.01),其余差异均无统计学意义(P>0.05)。
2.3 孕妇ToRCH IgM在不同季节阳性检出情况
TOX、RV、CMV、HSVⅡ IgM秋季的阳性检出率均高于其他3个季节,其中TOX IgM阳性检出率在不同季节差异有统计学意义(P<0.05),而RV、CMV、HSVⅡ IgM阳性检出率无明显季节性变化,差异均无统计学意义(P>0.05)。
2.4 孕妇ToRCH IgM在不同年份阳性率
ToRCH IgM在2015年仅CMV IgM的阳性检出率高于2014年水平,差异有统计学意义(P<0.05),其余差异均无统计学意义(P>0.05),见表3。
表3 不同年份孕妇ToRCH IgM阳性情况
Tab 3 Positive rate of ToRCH IgM in pregnant women with different years

年份nTOXRVCMVHSVⅡ2014年2015年185631250(0.00)6(0.19)2(0.11)10(0.32)21(1.13)62(1.98)a2(0.11)4(0.13)
注:括号内为百分比;与2014年比较,aP<0.05
2.5 ToRCH感染与既往不良妊娠史之间的关系
既往有不良妊娠史(多次习惯性流产、胎儿宫内死亡、先天性出生缺陷等)的孕妇ToRCH IgM阳性率明显高于正常孕妇,差异有统计学意义(P<0.01),见表4。
表4 既往有或无不良妊娠史孕妇ToRCH IgM阳性情况
Tab 4 Positive rate of ToRCH IgM in pregnant women with or without a previous history of adverse pregnancy outcomes
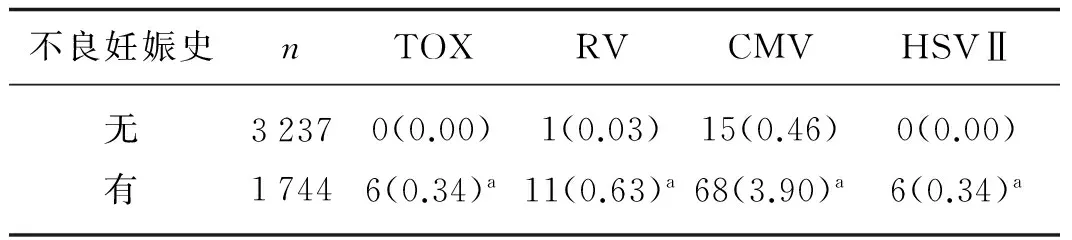
不良妊娠史nTOXRVCMVHSVⅡ无有323717440(0.00)6(0.34)a1(0.03)11(0.63)a15(0.46)68(3.90)a0(0.00)6(0.34)a
注:括号内为百分比;与无不良妊娠史比较,aP<0.01
2.6 孕妇ToRCH多重感染情况
同时检出含2种以上病原体多重感染孕妇4201例,占84.34%;其中仅1例血清中同时检出RV和CMV IgM、IgG阳性;2种病原体IgG多重感染构成比以RV+CMV为最高,占85.17%;3种病原体IgG多重感染以RV+CMV+HSVⅡ为最多,占6.67%;4种病原体IgG多重感染占0.19%。
3 讨 论
多数孕妇ToRCH感染后本身症状不明显,但可导致胎儿先天性宫内感染或新生儿多系统多器官损害,更可能引发严重疾病、后遗症或致命结局[2-3]。为此,临床需深入普及并加强对育龄女性和孕产妇的宣传教育工作,积极做好早期ToRCH感染的血清学筛查,以便早期干预治疗。
世界各个国家或地区ToRCH感染存在巨大差别。本研究发现:CMV IgM的阳性率(1.67%)与一些国内外研究[4-6]结果相符合,但ToRCH IgM阳性率又低于另一些国家或地区的报道[1,7-8];RV、CMV IgG的阳性率明显高于TOX和HSVⅡ,与胡风华等[9]报道一致,但低于邓刚等[10]研究。国内外ToRCH感染差别之大或许是由人群种族各异、地域环境气候、经济发展速度快慢、社会医疗卫生条件、生活饮食习惯、病原体传播特点、接触易感因素不同、所采用检测方法学及试剂互异、疫苗接种情况、个人防护意识强弱不一、普及筛查状况等原因造成的。
本研究结果显示:ToRCH IgM检出阳性率在<35岁和≥35岁年龄组差异均无统计学意义(P>0.05);CMV IgG在≥35岁年龄组检出率明显高于<35岁年龄组(P<0.01),而其他3种病原体IgG在不同年龄组差异均无统计学意义(P>0.05)。导致此结果的原因也许是CMV为最多见宫内感染病原体,多数人群可被广泛感染,一般无症状为隐性感染,特别对高龄孕产妇而言其细胞免疫功能相对薄弱,愈加轻易激活引发感染。
本研究孕妇ToRCH IgM在不同季节和不同年份阳性检出结果显示,ToRCH IgM在四季和2014年、2015年两个年份感染率均不高,但秋季阳性检出率高于其他3个季节,仅TOX阳性检出率在不同季节比较差异有统计学意义(P<0.05);2015年仅CMV IgM阳性率高于2014年(P<0.05)。此结果提示,对于ToRCH病原体感染相对多发季节和年份,应该注重加大对其的筛查力度,并采取适当的预防措施,以有效降低对胎儿及新生儿造成的危害。
本研究中既往有不良妊娠史(习惯性流产、胎儿夭折、先天性出生缺陷等)的孕妇,ToRCH IgM阳性率明显高于正常孕妇(P<0.01)。此研究结果与Kishore等[11]报道一致,进一步表明ToRCH感染与不良妊娠结局存在紧密联系。妊娠期ToRCH感染致妊娠不良后果的原因也许为感染引起母体在怀孕期健康状况及免疫功能改变造成对胎儿生长发育的影响,又或是病原体直接经胎盘侵害胎儿,致使发生不良妊娠结局。
本研究表明,同时检出含2种以上病原体多重感染孕妇占84.34%,其中ToRCH IgG多重感染比例较高,主要是RV和CMV,与国外[12]报道结论相符。证实国内外孕产妇广泛易感RV和CMV是由于妊娠期孕妇存在细胞、体液免疫抑制,妊娠期间既往ToRCH感染潜在体内的病原体被激活,导致孕妇多重或复发感染。
综上所述,淮安地区孕妇ToRCH血清学筛查结果值得关注,其对于先天性感染的预防策略制定有重要意义。应建议育龄女性、孕产妇定期常规开展ToRCH检查以避免不良胎儿结局。另一方面采用安全有效可行的孕妇免疫,可以为孕妇、胎儿及新生儿提供保护。弓形虫疫苗研究较多的是DNA疫苗和基因工程疫苗,由于两者具有安全性、有效性和实用性而成为现今研制的焦点;目前国际应用最广泛的是RA27/3株风疹减毒活疫苗,尽管免疫效果不错,但仍存在问题,为此正致力于RV E1转基因植物的研究工作;靶向巨细胞病毒与宿主细胞膜融合过程中的糖蛋白复合物亚单位疫苗及几个候选疫苗目前均已进入Ⅰ、Ⅱ期临床试验;当今许多候选疫苗(HSV-Ⅰ和HSV-Ⅱ)可预防孕期HSV感染,而仍有几个候选疫苗处于进一步研究。在此研究背景下,特别是在发展中国家,针对ToRCH感染的疫苗研究发展策略应予以考虑。
[1] RASTI S,GHASEMI FS,ABDOLI A,et al.ToRCH "co-infec-
tions" are associated with increased risk of abortion in pregnant women[J].Congenit Anom(Kyoto),2016,56(2):73-78.
[2] 石伟娟,徐秀叶,潘继美,等.孕妇TORCH感染筛查结果分析[J].中华医院感染学杂志,2015,25(4):925-927.
[3] 陈敬林,黄湘,万志丹,等.2012—2013年中山市育龄期女性ToRCH筛查结果分析[J].现代预防医学,2016,43(1):62-64.
[4] PUCCIO G,CAJOZZO C,CANDUSCIO LA,et al.Epidemiology of Toxoplasma and CMV serology and of GBS colonization in pregnancy and neonatal outcome in a Sicilian population[J].Ital J Pediatr,2014,40(1):23-30.
[5] WANG C,DOLLARD SC,AMIN MM,et al.Cytomegalovirus IgM seroprevalence among women of reproductive age in the United States[J].PLoS One,2016,11(3):e0151996.
[6] 江春梅,杨艳.连云港地区早期妊娠妇女TORCH感染状况分析[J].国际检验医学杂志,2015,36(24):3646-3648.
[7] HALAWA S,MCDERMOTT L,DONATI M,et al.TORCH screening in pregnancy.Where are we now? An audit of use in a tertiary level centre[J].J Obstet Gynaecol,2014,34(4):309-312.
[8] 吴佳丽,朱建昌.365例妊娠期妇女TORCH感染的血清学检测及妊娠结局分析[J].中国微生态学杂志,2015,27(10):1218-1220.
[9] 胡风华,陶月,朱天礼,等.南京地区育龄女性TORCH感染状况调查[J].职业与健康,2014,30(20):2919-2921.
[10] 邓刚,张平安,吴薇.2760例育龄妇女TORCH监测数据分析[J].公共卫生与预防医学,2015,26(4):116-118.
[11] KISHORE J,MISRA R,PAISAL A,et al.Adverse reproductive outcome induced by parvovirus B19 and TORCH infections in women with high-risk pregnancy[J].J Infect Dev Ctries,2011,5(12):868-873.
[12] LITO D,FRANCISCO T,SALVA I,et al.TORCH serology and group B streptococcus screening analysis in the population of a maternity[J].Acta Med Port,2013,26(5):549-554.
Analysis of serum antibodies screening to ToRCH infection in pregnant women in Huai′an
ZHANG Yuan-yuan,LIU Pei-pei,ZHANG Ying-mei
(DepartmentofLaboratory,Huai′anFirstPeople′sHospital,NanjingMedicalUniversity,Huai′an223300,China)
Objective:To explore the serological evidence of the ToRCH infection in pregnant women of Huai′an so as to provide reference data for prenatal and postnatal care,maternal and child preventive health care.Methods:Enzyme-linked immunosorbent assay(ELISA) were used to detect the serum ToRCH specific IgM and IgG in 4 981 cases of pregnant women during Jan 2014 to Dec 2015,and screening results were analyzed respectively.Results:For IgM detection,cytomegalovirus (CMV) had the highest positive rate (1.67%).For IgG detection,the positive rates of rubella virus(RV),CMV were 89.78%,89.26% respectively and significantly higher than those of toxoplasma(TOX) and herpes simplex virus (HSVⅡ).The positive rate of CMV IgG in pregnant women ≥35 years old group were significantly higher than that in pregnant women <35 years old group,the difference was statistically significant(P<0.01).The positive rate of TOX IgM in autumn was higher than in other seasons(P<0.05).The positive rate of CMV IgM in 2015 was higher than that in 2014 (P<0.05).ToRCH IgM positive rates of pregnant women with previous history of adverse pregnancy was significantly higher than normal pregnant women (P<0.01). ToRCH multiple infections of pregnant women detected in 4201 cases,accounting for 84.34%,mixed infections were mainly RV and CMV.Conclusion: Antenatal should be routinely screened for the ToRCH infections,for carrying out early interventions to prevent fetal infection and adverse consequences.
ToRCH;immunoglobulin M;immunoglobulin G
2016-06-10
2016-08-30
张媛媛(1980-),女,江苏淮安人,主管检验师,医学硕士。E-mail:kujzyy@163.com
张媛媛,刘蓓蓓,张迎梅.淮安地区孕妇 ToRCH感染血清抗体筛查结果分析[J].东南大学学报:医学版,2017,36(1):78-81.
R17
A
1671-6264(2017)01-0078-04
10.3969/j.issn.1671-6264.2017.01.019
