过表达miR-7对卵巢癌SKOV3细胞增殖及侵袭的影响
2017-06-05巨少龙吴迪张莹窦骏
巨少龙,吴迪,张莹,窦骏
(1.东南大学 医学院,江苏 南京 210009;2.东南大学医学院 病原生物学与免疫学系,江苏 南京 210009)
·论 著·
过表达miR-7对卵巢癌SKOV3细胞增殖及侵袭的影响
巨少龙1,吴迪2,张莹1,窦骏2
(1.东南大学 医学院,江苏 南京 210009;2.东南大学医学院 病原生物学与免疫学系,江苏 南京 210009)
目的:探讨miRNA-7(miR-7)过表达对上皮性卵巢癌SKOV3细胞增殖及侵袭能力的影响。方法:从人类基因组中扩增出带有酶切位点的miR-7目的基因,将其连接到pIRES质粒构成重组质粒并予以鉴定。将pIRES-miR-7重组质粒及空质粒转染到SKOV3细胞,用qRT-PCR检测转染的SKOV3细胞miR-7的表达。极限稀释法筛选稳定转染的pIRES-miR-7 SKOV3及pIRES SKOV3细胞克隆。利用CCK8法测定过表达miR-7 SKOV3的增殖能力,Transwell小室法测定过表达miR-7 SKOV3的侵袭能力。结果与结论:成功构建了pIRES-miR-7重组质粒,将其转染SKOV3细胞后筛选出稳定转染pIRES-miR-7 的SKOV3细胞克隆,其表达的miR-7水平显著高于pIRES SKOV3组(P<0.01)及野生型SKOV3组(P<0.001),且细胞增殖及侵袭能力pIRES-miR-7 SKOV3组比pIRES SKOV3组下降。
卵巢癌细胞;miR-7;过表达;增殖;侵袭
微小RNA(miRNA)是一组真核细胞中长度大约为21~23个核苷酸序列的小分子RNA,为非编码序列,参与转录后水平的调节,在细胞的生物学行为中扮演着至关重要的角色。目前,有大量研究表明,miRNA表达水平的改变与人类恶性肿瘤的发病及进展相关,如乳腺癌[1]、结肠癌[2]、肝癌[3]、结直肠癌[4]等。
卵巢癌正在损害着广大女性的健康,并且其发病率在逐步升高,随着医学的发展,近年来对肿瘤标志物的研究及早期筛查使得卵巢癌的早期发现及诊断率有所提高,但近30年来卵巢癌生存率并未有明显升高。由于卵巢的解剖位置较深,导致其在疾病早期表现往往不明显,大部分患者在确诊时已处于晚期阶段,5年存活率较低,且死亡率很高[5]。本实验旨在通过测定miRNA-7在卵巢癌SKOV3细胞系中的水平,探究其对卵巢癌细胞增殖与侵袭等行为的影响。
1 材料与方法
1.1 材料
人类卵巢癌SKOV3细胞系购买于中科院上海生科院细胞库,1640培养基购买于南京市雨花台区百伏生物技术研发中心,胰蛋白酶、无支原体胎牛血清采购于南京赛凯公司,TRIzol Reagent及Lipofectamine 2000 Transfection Reagent购买于苏州睿捷生物科技有限公司,逆转录试剂盒购买于TaKaRa,实时定量聚合酶链式反应(qRT-PCR)试剂盒购于优宁维生物,质粒提取试剂盒购于康宁生命科学(吴江)有限公司。
1.2 方法
1.2.1 细胞培养 SKOV3用含有10%血清的1640培养基培养,培养箱条件为37℃、5%CO2,大约每3d换1次培养基。
1.2.2 构建重组质粒并鉴定 从Pubmed上获取miRNA-7的核苷酸顺序,从人卵巢癌SKOV3细胞中用TRIzol抽提基因组RNA,进行逆转录得到cDNA,以cDNA为模板扩增并纯化Pre-miR-7,利用CaCl2法将pIRES质粒转入DH5α大肠杆菌,选取阳性克隆菌扩增培养,采用试剂盒提取pIRES空载质粒并双酶切(NotⅠ及XbaⅠ)鉴定Pre-miR-7及pIRES空载质粒,割胶回收。目的基因及空载质粒双酶切后按照说明书利用T4DNA酶连接,将重组质粒利用CaCl2法转化、培养,挑单克隆进行菌落PCR。提取阳性DH5α大肠杆菌克隆的PIRES-miR-7质粒后扩增,再进行双酶切鉴定;同时对PIRES-miR-7测序检测。
1.2.3 稳转细胞克隆筛选以及miR-7水平测定 利用脂质体Lipo2000分别将pIRES-miR-7重组质粒及pIRES空载质粒转入SKOV3细胞,A液:10μl质粒+无血清1640培养基50μl,B液:Lipo 2000 10μl+无血清1640培养基50μl,将A液和B液室温静置5min后混合,再室温静置20~30min,在混合液内加入400μl无血清的1640培养基后室温静置5min,用无血清1640培养基或PBS清洗培养有卵巢癌SKOV3细胞的6孔板后分别加入混合液(其中两孔含pIRES-miR-7重组质粒,两孔含pIRES空载质粒,两孔加相同量的无血清1640培养液),4~6h后洗去无血清1640,每孔添加2ml含有10%血清的1640培养基,1~2d后添加G418进行2周的筛选,将得到的细胞利用极限稀释法传至96孔板中,每孔约1个,并添加适当量G418,至其长出单个克隆。选出生长状态最好的细胞克隆集落进行培养,并连续扩大培养建立细胞系。利用qRT-PCR法检测miR-7在pIRES-miR-7 SKOV3组、pIRES SKOV3组及野生型SKOV3组细胞中的表达水平。
1.2.4 细胞增殖实验 稳定转染pIRES-miR-7重组质粒组及pIRES空载质粒组卵巢癌SKOV3细胞,以3000个·孔-1接种于96孔板中,设置5个复孔,于第4天及第7天分别添加10μlCCK8,并在培养箱中孵育3h,于酶标仪上检测不同孔的吸光度值。根据所测得的吸光度值画出生长曲线。
1.2.5 细胞侵袭实验 在接种细胞前,分别在上室加入200μl、下室加入500μl无血清培养基水化小室基底膜,将铺有基质胶的膜放在上室和下室中间,有基质胶的一面朝上,并将趋化因子加入下室,将Transwell小室重新置于细胞板中,将无血清培养基预先加温后在上室添加大约300μl,并再静置约半个小时,然后吸走剩下的培养液。pIRES-miR-7 SKOV3组及pIRES SKOV3组消化计数,上室200μl种入细胞105个,下室加入500μl完全培养基,37℃下培养16h(Transwell小室)后取出,乙醛固定后用0.1%的结晶紫进行染色,并擦除上室的细胞后在显微镜下镜检、计数并拍照。
1.3 统计学处理
利用graphpad prism6软件处理实验数据,结果采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 pIRES-miR-7重组质粒的构建及鉴定
设计miRNA-7的引物序列及酶切位点(NotⅠ及XbaⅠ)、miR-7、pIRES空载及pIRES-miR-7双酶切鉴定结果显示pIRES-miR-7构建成功。pIRES-miR-7测序显示目的基因插入理论值与扩增相符。见图1。

1、2.miR-7及pIRES空载质粒双酶切鉴定电泳图;3~6.重组质粒双酶切鉴定电泳图;M1.DL10000;M2.DL2000
图1 pIRES-miR-7重组质粒酶切鉴定
Fig 1 Identification of recombinant pIRES-miR-7 digested by enzymes
2.2 细胞稳定转染后miR-7表达水平
以野生型SKOV3组为对照,qRT-PCR检测结果显示,miR-7在pIRES-miR-7 SKOV3组中表达水平显著高于SKOV3(P<0.001)和pIRES-SKOV3(P<0.01)对照组。见图2。
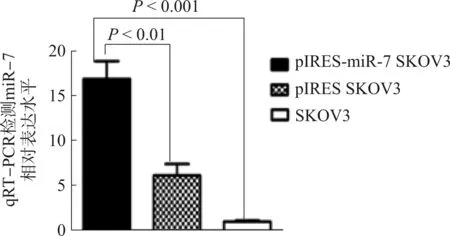
图2 miR-7在不同细胞表达水平
Fig 2 miR-7 expression in different cells
2.3 miR-7对SKOV3细胞增殖的影响
从酶标仪检测结果可见,pIRES-miR-7 SKOV3组细胞的增殖速度明显低于pIRES SKOV3组,在第4天时两组细胞增殖速度即可见微小差异,且在逐步增大,至第7天两组结果差异明显。见图3。提示miRNA-7能够抑制SKOV3细胞的增殖能力。

图3 miR-7对SKOV3细胞增殖的影响
Fig 3 Effect of miR-7 on SKOV3 cell proliferation
2.4 miR-7对SKOV3细胞侵袭能力的影响
pIRES-miR-7 SKOV3细胞的侵袭能力明显低于pIRES SKOV3及SKOV3细胞组。见图4,镜下图像见图5。说明过表达miRNA-7能够降低SKOV3细胞的侵袭能力。
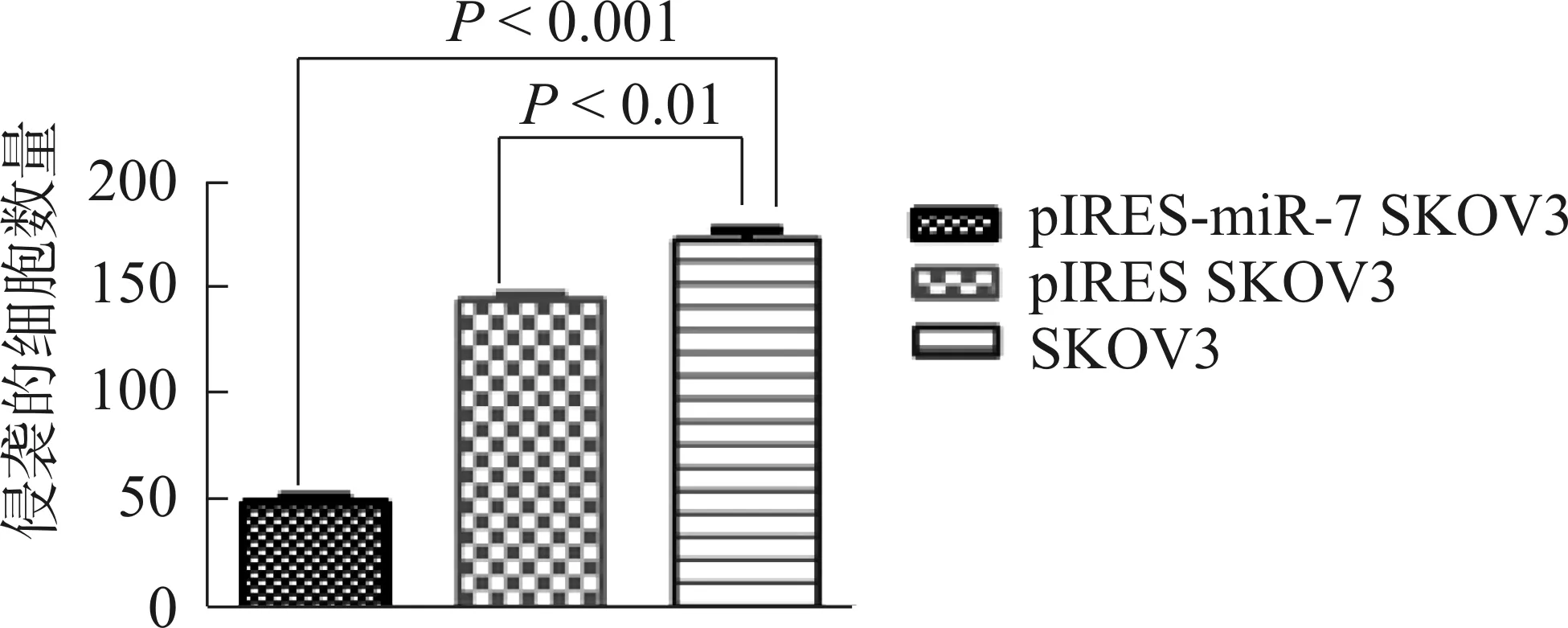
图4 miR-7对SKOV3细胞侵袭力影响
Fig 4 Effect of miR-7 on invasiveness of SKOV3 cell

图5 Transwell 实验检测 miR-7对SKOV3细胞侵袭力影响 HE×100Fig 5 Effect of miR-7 on SKOV3 cell invasiveness detected by transwell assay HE×100
3 讨 论
研究证实,micro RNA在肿瘤的的自然进程中具有极其重要的功能,其主要与靶信使RNA的碱基结合从而在很多方面起作用[5]。Webster等[6]研究证明,miRNA-7可通过调节EGFR信号途径来抑制数种人类恶性肿瘤的发生发展;Zhao等[7]研究表明,miRNA-7可抑制胃癌的转移,但在卵巢癌中鲜有报道。在本研究中通过qRT-PCR检测,发现miR-7的表达在 pIRES-miR-7 SKOV3细胞中较野生型及仅转入pIRES空载质粒的细胞中表达水平更高,并且实验观察到pIRES-miR-7 SKOV3生长更缓慢,这启发我们miRNA-7可能在卵巢癌中具有类似抑癌基因的功能。
目前,对于miR-7在肿瘤中的具体作用机制尚不确定,有大量的实验对其进行探究。Zhang等[1,8]研究发现,miR-7在乳腺癌中被lincRNA HOTAIR、SETDB1等抑制而表达水平下降,通过调节miR-7使其高表达可抑制乳腺癌细胞转移。Comamala等[9]证实,过表达miR-7通过靶向EGFR,阻碍 AKT 和 ERK1/2蛋白磷酸化,从而抑制卵巢癌的侵袭能力。本实验证实,miRNA-7能够明显使SKOV3细胞的增殖及侵袭能力降低。
综上所述,本研究表明,miRNA-7在卵巢癌SKOV3细胞系中低表达,迫使miRNA-7过表达可明显使SKOV3细胞的增殖与侵袭等生物学特性受到抑制,然而miRNA-7在体内对卵巢癌的效应还需要更深入的探索。
[1] ZHANG H,CAI K,WANG J,et al.MiR-7,inhibited indirectly by lincRNA HOTAIR,directly inhibits SETDB1 and reverses the EMT of breast cancer stem cells by downregulating the STAT3 pathway [J].Stem Cells,2014,32(11):2858-2868.
[2] SCHETTER A J,LEUNG S Y,SOHN J J,et al.MicroRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma [J].JAMA,2008,299(4):425-436.
[3] FANG Y,XUE J L,SHEN Q,et al.MicroRNA-7 inhibits tumor growth and metastasis by targeting the phosphoinositide 3-kinase/Akt pathway in hepatocellular carcinoma [J].Hepatology,2012,55 (6):1852-1862.
[4] LI Y,LI Y,LIU Y,et al.PAX6,a novel target of microRNA-7,promotes cellular proliferation and invasion in human colorectal cancer cells [J].Dig Dis Sci,2014,59:(3)598-606.
[5] CHEN D,ZHANG Y,WANG J,et al.MicroRNA-200c overexpression inhibits tumorigenicity and metastasis of CD117+ CD44+ ovarian cancer stem cells by regulating epithelial-mesenchymal transition[J].J Ovarian Res,2013,6(1):50.
[6] WEBSTER R J,GILES K M,PRICE K J,et al.Regulation of epidermal growth factor receptor signaling in human cancer cells by microRNA-7[J].J Biol Chem,2009,284(9):5731-5741.
[7] ZHAO X,DOU W,HE L,et al.MicroRNA-7 functions as an anti-metastatic microRNA in gastric cancer by targeting insulin-like growth factor-1 receptor[J].Oncogene,2013,32(11):1363-1372.
[8] 唐权,窦骏.顾宁.癌干细胞研究进展[J].东南大学学报医学版,2005,24(4):196-198.
[9] COMAMALA M,PINARD M,THERIAULT C,et al.Downregulation of cell surface CA125/MUC16 induces epithelial-to-mesenchymal transition and restores EGFR signalling in NIH:OVCAR3 ovarian carcinoma cells [J].Br J Cancer,2011,104(6):989-999.
Effects of miR-7 over expression on the abilities of proliferation and invasion of ovarian cancer SKOV3 cells
JU Shao-long1,WU Di2,ZHANG Ying1,DOU Jun2
(1.SchoolofMedicine,SoutheastUniversity,Nanjing210009,China;2.DepartmentofPathogenicBiologyandImmunologySchoolofMedicine,SoutheastUniversity,Nanjing210009,China)
Objective:To explore the effects of miR-7 over expression on the abilities of proliferation and invasion of ovarian cancer SKOV3 cells. Methods: The target gene miR-7 was amplified from human genome,digested and linked to the plasmid pIRES.The pIRES-miR-7 recombined plasmid and pIRTS plasmid were respectively transferred into SKOV3 ovarian cancer cells,and miR-7cellular expression was confirmed by qRT-PCR.CCK8 and Transwell assays were used to detect the abilities of proliferation and invasion in SKOV3 cells stably transfected with the recombinant pIRES-miR-7.Results and Conclusion: The recombinant pIRES-miR-7 is successfully constructed,and transfected into SKOV3 cells.The expression of miR-7 in SKOV3 cells stably transfected with pIRES-miR-7 is significantly higher than that in SKOV3 cells stably transfected with pIRES (P<0.01) and in wild type SKOV3 cells (P<0.001).In addition,the abilities of proliferation and migration in SKOV3 cells stably transfected with the recombinant pIRES-miR-7 is lower than that in pIRES SKOV3 and SKOV3 cells.The overexpression of miR-7 inhibits the abilities of proliferation and invasion in ovarian cancer SKOV3 cells.
ovarian cancer cells;miR-7;over expression;proliferation;invasion
2016-07-10
2016-08-31
2015年国家大学生创新性实验计划 (1510286102)
巨少龙(1993-),男,陕西宝鸡人,在读医学专业四年级本科生。E-mail:269641430@qq.com
窦骏 E-mail:njdoujun@seu.edu.cn
巨少龙,吴迪,张莹,等.过表达miR-7对卵巢癌SKOV3细胞增殖及侵袭的影响[J].东南大学学报:医学版,2017,36(1):30-33.
R737.31
A
1671-6264(2017)01-0030-04
10.3969/j.issn.1671-6264.2017.01.008
