人TRB3过表达载体的构建及检测
2017-06-05李杨胡斌关亚萍徐敏孟祥军
李杨,胡斌,关亚萍,徐敏,孟祥军,3
(1.南京医科大学上海一院临床医学院 消化科,上海 200080;2.上海交通大学附属第一人民医院 消化科,上海 200080;3.上海交通大学附属第九人民医院 消化科,上海 200030)
·论 著·
人TRB3过表达载体的构建及检测
李杨1,2,胡斌2,关亚萍2,徐敏1,2,孟祥军2,3
(1.南京医科大学上海一院临床医学院 消化科,上海 200080;2.上海交通大学附属第一人民医院 消化科,上海 200080;3.上海交通大学附属第九人民医院 消化科,上海 200030)
目的:构建TRB3真核表达重组质粒,并用肝癌细胞MHCC-97H检测其表达。方法:从肝癌组织中提取并扩增TRB3基因的编码区,将其克隆到真核表达载体pcdh-CMV-MCS-GFP中,酶切并检定,将克隆成功的质粒转染至MHCC-97H细胞中,用qPCR和Western Blot检测TRB3的表达水平。结果与结论:成功扩增了TRB3的编码区,并克隆至真核表达载体中;转染后72、96h,MHCC-97H细胞的TRB3 mRNA和蛋白表达显著增高;成功构建的TRB3过表达载体可用于后续实验。
TRB3;过表达;肝细胞癌
肝癌是导致人类死亡的第6大恶性肿瘤,据统计,2012年全球有745500人死于肝癌,其中大约半数的病例来自于中国[1]。由于肝癌早期临床症状不明显,发现时常常处于终末期,手术切除难度大,药物化疗往往成为终末期肝癌患者的最佳选择[2]。随着肝癌分子生物学研究的不断深入以及精准医疗的提出,人们发现了许多与肝癌诊疗相关的靶基因,TRB3(Tribbles pseudokinase 3)就是其中之一。TRB3最初发现于果蝇,其含有丝/苏氨酸蛋白激酶样结构,但缺乏ATP的结合位点,故没有激酶活性,也被称为假激酶[3],其生理功能包括调节葡萄糖和脂类代谢、调节脂肪细胞分化、调控胶原表达、参与细胞应激和凋亡等[4-5]。近期研究发现,TRB3与肝癌的发生密切相关[6],但其具体机制仍未被完全阐明。本实验拟通过构建真核TRB3表达载体并使其在肝癌细胞MHCC-97H中稳定表达,为进一步研究TRB3对肝癌发生、发展的作用机制奠定基础。
1 材料与方法
1.1 材料
人肝癌组织和细胞系MHCC-97H为上海交通大学胰腺病重点实验室保存,载体pcdh-CMV-MCS-GFP、大肠杆菌感受态细胞DH5α购自上海吉玛基因公司。DEME培养基、胎牛血清(FBS)购自Sigma公司。DNA限制性内切酶(NotI、NsiI、XhoI和NotI)、T4 DNA连接酶、DNA聚合酶、dNTP、凝胶回收试剂盒、质粒提取试剂盒购自Fermentas公司。基因测序由上海吉玛基因公司完成。脂质体Lipofectamine 2000购于Invitrogen 公司;SYBR qPCR 试剂盒购于TaKaRa 公司。人TRB3引物F:GCTGCCAACAGTGGATTGA,R:GCTTCTGCCTTTCTCCCTTCT和HGAPDH引物F:ATGAGAAGTATGACAACAGCCT,R:AGTCCTTCCACGATACCAAAGT均由上海生工生物工程有限公司合成。TRB3多克隆鼠抗购于ABCLONAL公司,GAPDH多克隆鼠抗购于SIGMA公司,山羊抗小鼠HRP标记购于JIR公司。
1.2 方法
1.2.1 目的基因获取和扩增 从人肝癌组织中提取总RNA,并逆转录为cDNA,然后以此为模板通过PCR方法扩增目的基因TRB3。PCR反应完成后利用琼脂糖电泳并切胶回收TRB3基因片段[7]。
1.2.2 真核表达载体的构建 用NotI和NsiI对TRB3基因片段进行酶切,用XhoI和NotI对载体pcdh-CMV-MCS-GFP进行酶切。然后用DNA 凝胶回收试剂盒回收TRB3基因片段和载体pcdh-CMV-MCS-GFP,用T4 DNA 连接双酶切得到TRB3基因片段和线性化的载体。将连接产物转化感受态细胞,培养16h后选取1孔抽提质粒,将抽提好的质粒进行双酶切鉴定并送测序。将测序结果与目的基因序列进行比对,正确无误后,进行大量质粒抽提,得到足够量的重组质粒[7]。
1.2.3 细胞培养与转染 肝癌细胞MHCC-97H用含有10% FBS的DMEM 培养基,于37℃、5%CO2的环境中培养。收集处于对数生长期的细胞,铺于6 孔板中,待细胞密度达到80%~90%时进行转染。细胞分为3组:未处理组(B组,未进行转染)、对照组(NC组,转染空质粒)和实验组(TRB3组,转染重组质粒),每组2孔。最后,按照脂质体转染试剂盒说明书的操作步骤进行转染,转染4h后更换培养液,继续培养72、96h后进行qPCR或Western Blot检测[8]。
1.2.4 转染后TRB3表达的检测 分别使用qPCR和Western Blot检测转录72、96h后肝癌细胞MHCC-97H的TRB3 mRNA和蛋白表达量[7]。
1.3 统计学处理
所有数据均使用SPSS19.0软件进行统计分析,计量资料采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 TRB3基因扩增
用cDNA作为模板进行PCR扩增,进行琼脂糖凝胶电泳检测,出现单一条带,大小与TRB3实际扩增的大小相符(图1A)。将双酶切得到的TRB3片段与线性化的载体用DNA连接酶连接,将载体接入感受态细胞培养,抽提质粒并进行双酶切电泳,可见目的基因片段(图1B);而后将抽提的质粒送公司测序,测序结果与GenBank中的序列一致,证实TRB3过表达载体构建成功。

A.泳道1、2、3、4为人TRB3 PCR扩增产物(如箭头所示);B.泳道1为质粒酶切后产物,如箭头所示。M为Fermeatas SM0331标记物
A.Lane 1,2,3 and 4 are PCR amplified products of human TRB3(as the arrow showed);B.Lane 1 is PCR amplified product after double enzymatic digestion(as the arrow showed).M is Fermeatas SM0331 marker
图1 TRB3目的片段PCR电泳图
Fig 1 Telectrophresis of TRB3 target fragment
2.2 转染细胞株TRB3基因mRNA的相对表达量
TRB3过表达质粒转染肝癌细胞MHCC-97H,4h后更换培养液,继续培养72、96h后对细胞进行qPCR检测。培养72h后,TRB3组的TRB3 mRNA相对表达量高于NC组 (图2A);培养96h后,TRB3组的TRB3 mRNA相对表达量同样高于NC组(图2B)。

图2 转染后qPCR检测TRB3 mRNA的表达
Fig 2 Expression of TRB3 mRNA by qPCR after transfected
2.3 转染细胞株TRB3蛋白的相对表达量
对转染后的细胞继续培养72、96h,进行Western Blot检测,可见过表达转染组细胞内的TRB3蛋白表达水平均显著增高,说明筛选得到的细胞株为成功转染重组质粒并稳定表达TRB3的肝癌细胞MHCC-97H(图3)。
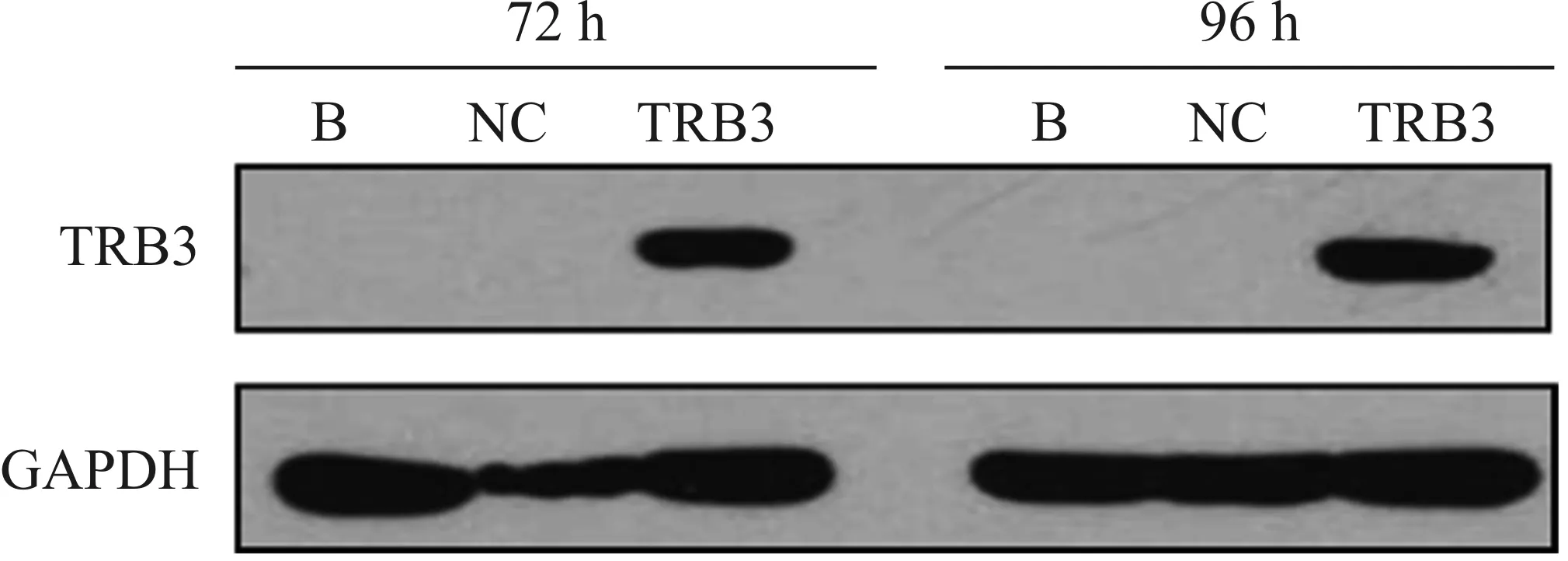
图3 转染后TRB3蛋白的表达Fig 3 Expression of TRB3 protein by Western Blot after transfect
3 讨 论
多项研究结果已证实,TRB3在包括肝癌、结直肠癌、舌鳞癌、乳腺癌等多种肿瘤细胞和人类肿瘤组织中高表达[9]。对TRB3调控肿瘤的机制研究主要集中在3条信号通路:第一,TRB3可抑制MAPK的激活,从而抑制Ras/Raf以及下游的ERK(extracellular regulated kinase),改变细胞内基因表达状态,参与调控细胞代谢[10];第二,TRB3可抑制AKT磷酸化,通过调节AKT-mTOR通路进而调控肿瘤细胞的凋亡和自噬[11];第三,TRB3与内质网应激(ERS)信号途径相关,在诱导肿瘤细胞凋亡过程中起着重要作用。其中TRB3与ERS是近年的研究热点。当肿瘤细胞不断生长时,肿瘤周围代谢产物蓄积,诱导ERS产生,从而使内质网折叠和转运蛋白功能下降甚至消失[12]。TRB3作为ERS通路中ATF4-CHOP下游的信号分子,最终介导了细胞的死亡[13]。许多抗肿瘤代谢药物,例如盐霉素即可通过调节TRB3引起细胞凋亡,说明TRB3可作为某些化疗药物的靶点[14]。
为了进一步探讨TRB3在肝癌发生、发展中的作用,深入研究TRB3介导肝癌细胞凋亡的作用机制以及TRB3对肝癌治疗的意义,我们成功地构建了TRB3过表达真核载体,并检测转染细胞后其蛋白和mRNA表达情况,为后续的研究提供了有利工具。
[1] TORRE L A,BRAY F,SIEGEL R L,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2] 田贵金,刘军红,刘涛,等.白介素2联合胸腺肽α1对肝癌术后患者肝纤维化指标和肝功能的影响[J].现代医学,2016,35(1):68-71.
[3] GROSSHANS J,WIESCHAUS E.A genetic link between morphogenesis and cell division during formation of the ventral furrow in Drosophila[J].Cell,2000,101(5):523-531.
[4] DU K,HERZIG S,KULKARNI R N,et al.TRB3:a tribbles homolog that inhibits Akt/PKB activation by insulin in liver[J].Science,2003,300(5625):1574-1577.
[5] HEGEDUS Z,CZIBULA A,KISS-TOTH E.Tribbles:A family of kinase-like proteins with potent signalling regulatory function[J].Cell Signal,2007,19(2):238-250.
[6] XU J,LV S,QIN Y,et al.TRB3 interacts with CtIP and is overexpressed in certain cancers[J].Biochim Biophys Acta,2007,1770(2):273-278.
[7] 冯作化,药立波,方定志,等.生物化学与分子生物学[M].3版.北京:人民卫生出版社,2015:500-530.
[8] HAMID A S,LI J,WANG Y,et al.Recombinant human decorin upregulates p57KIP2 expression in HepG2 hepatoma cell lines[J].Mol Med Rep,2013,8(2):511-516.
[9] ZHANG J,WEN H J,GUO Z M,et al.TRB3 overexpression due to endoplasmic reticulum stress inhibits AKT kinase activation of tongue squamous cell carcinoma[J].Oral Oncol,2011,47(10):934-939.
[10] MIYOSHI N,ISHII H,MIMORI K,et al.Abnormal expression of TRIB3 in colorectal cancer:a novel marker for prognosis[J].Br J Cancer,2009,101(10):1664-1670.
[11] ERAZO T,LORENTE M,LOPEZ-PLANA A,et al.The new antitumor drug ABTL0812 inhibits the Akt/mTORC1 axis by upregulating Tribbles-3 pseudokinase[J].Clin Cancer Res,2016,22(10):2508-2519.
[12] SANO R,REED J C.ER stress-induced cell death mechanisms[J].Biochim Biophys Acta,2013,1833(12):3460-3470.
[13] BROMATI C R,LELLIS-SANTOS C,YAMANAKA T S,et al.UPR induces transient burst of apoptosis in islets of early lactating rats through reduced AKT phosphorylation via ATF4/CHOP stimulation of TRB3 expression[J].Am J Physiol Regul Integr Comp Physiol,2011,300(1):R92-100.
[14] LI T,SU L,ZHONG N,et al.Salinomycin induces cell death with autophagy through activation of endoplasmic reticulum stress in human cancer cells[J].Autophagy,2013,9(7):1057-1068.
Construction and identification of human TRB3 gene overexpression vector
LI Yang1,2,HU Bin2,GUAN Ya-ping2,XU min2,MENG Xiang-jun2,3
(1.DepartmentofGastroenterology,ShanghaiFirstPeople′sHospitalofNanjingMedicalUniversity,Shanghai200080,China;2.DepartmentofGastroenterology,ShanghaiFirstPeople′sHospitalofShanghaiJiaotongUniversity,Shanghai200080,China;3.DepartmentofGastroenterology,ShanghaiNinthPeople′sHospitalofShanghaiJiaotongUniversity,Shanghai200080,China)
Objective: To construct human TRB3 gene overexpression vector and identify its expression in hepatocellular carcinoma cells MHCC-97H.Methods: TRB3 gene was extracted from liver cancer tissue of human and amplified it by reverse transcription.Then it was cloned into pcdh-CMV-MCS-GFP vector for constructing eukaryotic expression vector.The successful cloned vector was transfected into hepatocellular carcinoma cells MHCC-97H,and TRB3 expression was determined by qPCR and Western blot.Results and Conclusion:The coding region of human TRB3 gene is successfully amplified,and cloned into the vector;the expression of TRB3 mRNA and protein are upregulated in MHCC-97H cells after transfected;TRB3 overexpression vector is successfully constructed,which could be used into the post-study.
TRB3;overexpression;hepatocellular carcinoma
2016-06-18
2016-08-30
国家自然科学基金面上项目(81072007);江苏省研究生培养创新工程项目(SJLX15_0433)
李杨(1990-),男,安徽滁州人,在读硕士研究生。 E-mail:ayly0550@163.com
孟祥军 E-mail:xiangjunmeng@aliyun.com
李杨,胡斌,关亚萍,等.人TRB3过表达载体的构建及检测[J].东南大学学报:医学版,2017,36(1):17-20.
R734.7
A
1671-6264(2017)01-0017-04
10.3969/j.issn.1671-6264.2017.01.005
