昆虫次生内共生菌Rickettsia研究进展
2017-06-05张毅波薛延韬张桂芬万方浩
张 婧,张毅波,薛延韬,刘 怀,张桂芬,万方浩*
(1.西南大学植物保护学院,重庆 500070;2.中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
昆虫次生内共生菌Rickettsia研究进展
张 婧1,2,张毅波2,薛延韬1,2,刘 怀1,张桂芬2,万方浩2*
(1.西南大学植物保护学院,重庆 500070;2.中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
Rickettsia隶属于变形菌纲Proteobacteria的α亚群立克次体科Rickettsiaceae革兰氏阴性菌,是形态多样的次生真核细胞内共生菌。Rickettsia的功能是多样的,在一些宿主中为营养共生菌,在另一些宿主中为生殖调控因子,或以昆虫为载体的植物病原菌,此外,Rickettsia还能增强宿主抗药性,提高宿主抵御天敌、高温或者其它致死因素的能力。本综述主要从Rickettsia的起源、分类、在昆虫体内的分布、传播方式、与昆虫生殖调控的关系以及基因组进化等方面,简述Rickettsia的研究进展,重点提出了Rickettsia研究中一些尚未解决的问题,期望通过这些研究进一步明确Rickettsia与昆虫之间的互作关系。
Rickettsia;传播;分布;生殖调控;基因组进化
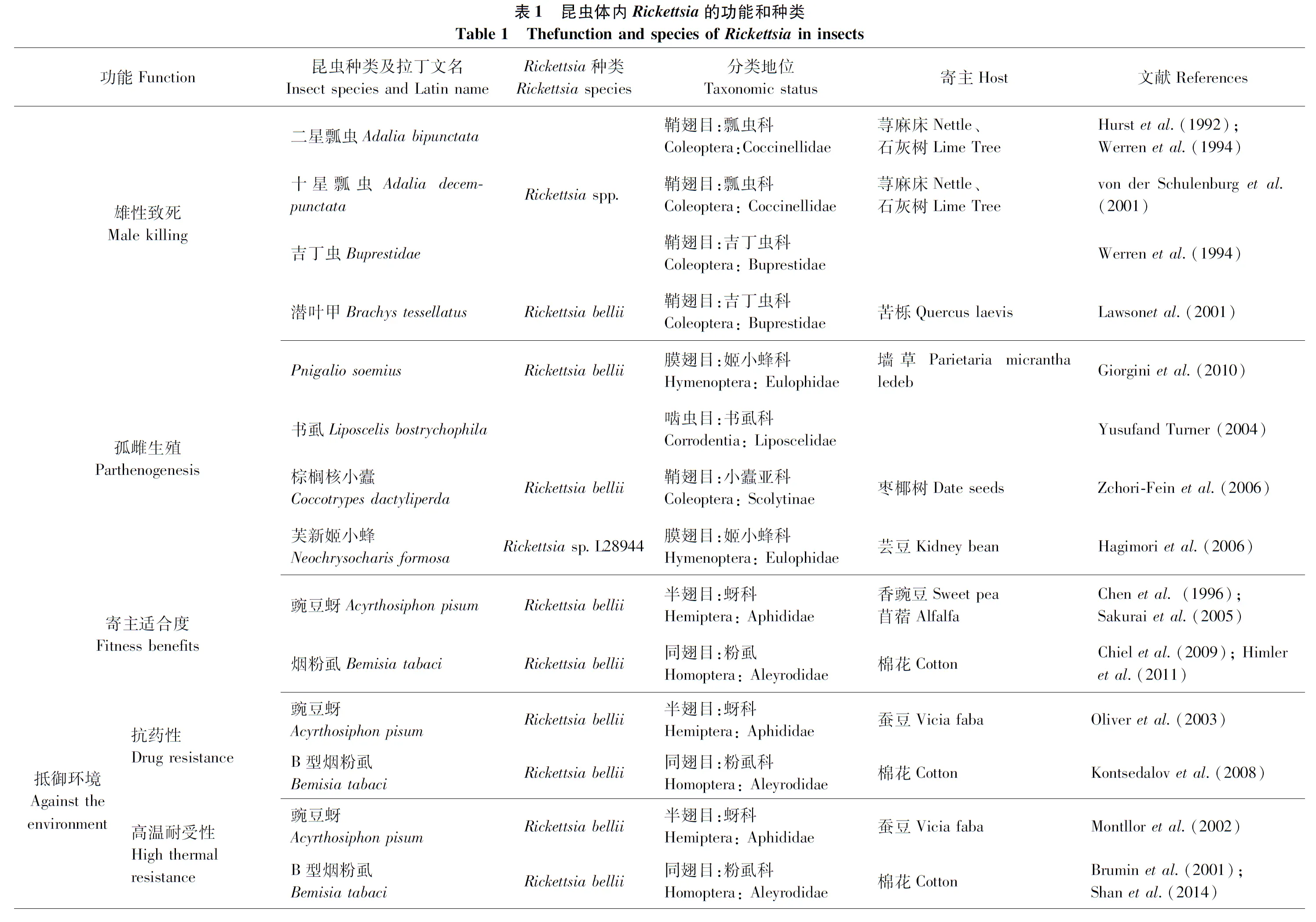
昆虫普遍携带可遗传的共生细菌(Moranetal., 2008),且主要传播方式为母代遗传(Oliveretal., 2010)。昆虫的内共生细菌可分为2类:初生共生菌(即专性内共生菌,primary symbiont)和次生内共生菌(即兼性内共生菌,secondary symbiont)。初生内共生菌一般存在于宿主细胞中的特定位置,称为菌胞bacteriocytes(Moran and Baumann, 2000; Baumann, 2005)。多个菌胞聚集在一起组成的器官称为类菌体bacteroids。相对于初生内共生菌,次生内共生菌具有个体小,形状不规则,分布广泛且无规律的特点。次生共生菌与入侵病原菌类似,可入侵不同类型细胞,包括生殖器官,也能定殖在细胞体以外的血淋巴中。与初生内共生菌相比,次生内共生菌在不同宿主生态学和生物学上表现不同(Oliveretal., 2010)(见表1)。目前研究比较深入的次生内共生菌有:Wolbachia(Werrenetal., 2008)、Rickettsia(Perlmanetal., 2006)、Regiella(Scarboroughetal., 2005)等。本文主要针对次生共生菌Rickettsia的研究进展进行总结。
Rickettsia最先在嗜血节肢动物体内发现,并作为脊椎动物病原菌被广泛熟知(Raoult and Roux, 1997)。但最近研究发现Rickettsia也存在于非嗜血节肢动物体内(Perlmanetal., 2006; Weinertetal., 2009),例如烟粉虱Bemisiatabaci(Himleretal., 2011)、蚜虫Acyrthosiphonpisum(Chenetal., 1996)、叶蝉Empoascapapayae(Davisetal., 1998)、瓢虫Adaliadecempunctata(von der Schulenburgetal., 2001)、豆象甲虫Kytorhinussharpianus(Fukatsu and Shimada, 1999)等。虽然Rickettsia在绝大多数宿主中的作用未知(Perlmanetal., 2006; Beharetal., 2010),但随着对昆虫内共生菌的研究逐渐深入,可知Rickettsia在一些宿主中作为营养共生菌,在另一些宿主中为生殖调控因子,或以昆虫为载体的植物病原菌(Werrenetal., 1995; Davisetal., 1998; Perottietal., 2006; Inbar and Gerling, 2008)。除此之外,Rickettsia还具有增强宿主抗药性,提高宿主抵御天敌、高温或者其它致死因素的能力。基于此,本文从Rickettsia的起源、分类、在昆虫体内的分布、传播方式、与昆虫生殖调控的关系以及基因组进化等方面展开综述。
1 Rickettsia的起源与分类
α变形菌门目前分为3个科:无形小体科Anaplasmataceae、 立克次氏体科Rickettsiaceae,以及全孢菌科Holosporaceae(Booneetal., 2001)。Rickettsia属于变形菌纲Proteobacteria的α亚群立克次体科Rickettsiaceae革兰氏阴性菌,是形态多样的真核细胞次生内共生菌。Rickettsia在1909年由美国病理学副教授Howard Taylor Ricketts(1871-1910)在研究洛基山斑疹热时首次发现,次年Ricketts博士在研究过程中不幸感染洛基山斑疹热去世,后人从斑疹伤寒病人的体虱中找到了相同的病原菌。为了纪念为研究此病原菌献身的Ricketts博士,此菌定名为普氏立克次体R.prowazekii,这就是Rickettsia名称的最早由来(Zchori-Feinetal., 2011)。
Rickettsia菌通常分为脊椎动物Rickettsia和节肢动物Rickettsia,两者的区别在于:前者部分生活史在节肢动物体内完成,后传播感染脊椎动物并使其致病;后者则全部生活史在节肢动物体内完成。Rickettsia作为共生菌在节肢动物体内垂直传播,作为病原菌在脊椎动物体内传播,是多种人类疾病的病原体,人体通过带菌昆虫的叮咬或直接接触其粪便而感染Rickettsia,这种感染多发生于热带与亚热带国家和地区。例如流行性斑疹伤寒症(Epidemic typhus),此病导致1917-1923年间俄罗斯300万人死亡(Delaney, 1963);落基山斑疹热(Rocky Mountain spotted fever)也曾在2004年的美国达到最高发病率(Dumler and Walker, 2005)。
据此,Rickettsia菌属可以被分为:(1)斑疹伤寒组(typhus group, TG),包括R.typhi和R.prowazekii,前者可引起鼠型斑疹伤寒,由跳蚤传播,后者可引起流行斑疹伤寒,由虱子传播;(2)斑疹热组(spotted fever group, SFG),可进一步划分为4个子组:R.rickettsii、R.massiliae、R.helvetica、R.akari(Merhej and Raoult, 2011);(3)R.belli组;(4)R.canadensis组。与斑疹热组Rickettsia不同,斑疹伤寒组Rickettsia不会直接通过唾液感染至脊椎动物,而是通过粪便接触粘膜表面或破损皮肤进行感染。R.Prowazekii可作为复发性斑疹伤寒或Brill-Zinsser疾病病原菌存留在人类体内,并能被虱子所获从而进行传播。非嗜血宿主烟粉虱体内的Rickettsia经鉴定属于R.belli组(Chieletal., 2009)。以上分类是基于分子系统发育学的出现及其在细菌分类学中的广泛应用从而对Rickettsia菌分类进行的重新定义,比如恙虫病(Tsutsugamushidisease)的病原菌与Rickettsia16S rDNA序列相似度只有91%,已改名为Orientiatsutsugamushi。
2 Rickettsia在昆虫体中的分布及传播规律
共生菌的传播方式一般可分为3类:垂直传播、水平传播以及混合传播。垂直传播是共生菌直接由母代遗传至后代,水平传播是指寄主从周围环境中获得共生菌,混合传播是垂直和水平传播并存的传播方式。研究共生菌在昆虫体内的传播规律,往往先从共生菌在昆虫体内的分布着手。
次生内共生菌Rickettsia在宿主中的位置呈现多样性。有报道称内共生细菌存在于昆虫的多个组织中,如马氏管(Butionetal., 2008)、血淋巴(Braquart-Varnieretal., 2008)、大脑(Min and Benzer, 1997)和唾液腺(Macalusoetal., 2008)。Rickettsia在烟粉虱中的存在方式分为菌胞内部(集中型)和菌胞外部(分散型),不同环境中分布的差异表明内共生菌的分布可能受宿主生物学效应的影响(Caspi-Flugeretal., 2011)。Gottliebetal.(2006)利用荧光原位杂交技术(FISH)检测发现Rickettsia在各个发育阶段的烟粉虱体内均有信号;在胚胎形成初期,Rickettsia的信号仅能在类菌体之间检测出;而在后期,Rickettsia的信号随机分布于整个胚胎;随后在蛹期,Rickettsia的分布在质量和空间上似乎是随机的,且信号在肠道中呈“Y”型轮廓分布,这一结果与Ghanimetal.(2001)结论相似;最后在成虫体内,Rickettsia集中分布于腹部肠道的多边形特定结构内,在中肠浓度较高,表明其在消化食物过程中可能起到了作用(Ghanimetal., 2001)。同时,在所有烟粉虱的血淋巴中均可检测到Rickettsia,并表现出随机分布。Rickettsia能侵染烟粉虱所有部位,包括头部和足。此外,Rickettsia在雌性体内更丰富,可能是为了确保细菌能够传播到下一代(Gottliebetal., 2006)。Bruminetal.(2012)利用电子荧光显微镜来研究Rickettsia入侵的特性,发现烟粉虱的消化器官、唾液腺、生殖器官均被感染;但是无论如何,它都不存在于类菌体中;仅在一种情况下,观察到类似Rickettsia的信号附在菌胞外表面并可能被菌胞内吞,这种现象与Munderloh and Kurtti(1995)所报道的Rickettsia能通过引起吞噬泡的形成而频繁地在寄主细胞和组织之间移动的结论相一致。总之,昆虫体内Rickettsia的分布研究为未知的细菌-昆虫间特殊相互作用和可能的传播途径提供了一些线索。
Gottliebetal.(2006)研究结果表明在烟粉虱卵内可检测出Rickettsia,并贯穿整个发育过程,暗示此菌可垂直传播。Himleretal.(2011)进一步研究证明染菌烟粉虱雌虫垂直传播Rickettsia到雌性后代机率接近100%(约99.17%),但染菌雄虫向未感染的雌虫水平传播的机率几乎是0。相似的结果在一些嗜血昆虫内也曾被报道,例如有研究证明蜱(ticks)内的R.peacockii难以水平传播到脊椎动物体内,但却能够严格地在宿主体内垂直传播(Azad and Beard, 1998)。此外,Bruminetal.(2012)对Rickettsia入侵正在发育的卵母细胞的观察证明未成熟的卵母细胞感染Rickettsia的情况较严重,并集中在卵泡细胞周围分布,证明Rickettsia是通过卵母细胞,而不是菌胞,来确保它垂直传播到下一代。由此可见,垂直传播的重要性无可替代。
尽管水平传播很少见,仍有一些研究证明Rickettsia在宿主体内存在水平传播,但这些水平传播主要是通过交配或取食同一类寄主植物获菌,而且这些途径只限制在同一物种内(Bruminetal., 2012; Caspi-Flugeretal., 2012)。Bruminetal.(2012)利用荧光原位杂交技术(FISH)发现烟粉虱精巢和受精囊中存在Rickettsia菌,证明雄虫和雌虫通过交配可使内共生菌进行水平传播。与其它刺吸式昆虫一样,烟粉虱内共生菌的水平传播也需要通过一些障碍,主要是唾液腺细胞如何通过唾液腺导管进入口针。Bruminetal.(2012)的研究结果表明粉虱口针内Rickettsia的存在仅限于上颌骨,上颌骨组成运输食物和唾液的管道,表明细菌能通过植物汁液进入或离开粉虱个体。Munderloh and Kurtti(1995)推测共生菌可通过植物进行水平传播的原因是血淋巴中游离的共生菌可入侵昆虫的唾液腺,并最终通过刺吸注入植物韧皮部,但是分布于菌胞内部的共生菌不能通过这种方式传播。Ayeletetal.(2012)在研究烟粉虱Rickettsia水平传播过程中首次证明Rickettsia能从粉虱体内传播到植物的韧皮部(棉花、罗勒和黑龙葵),并能在韧皮部内移动且可被其它粉虱获得,此时,Rickettsia并没有对植物引起任何可见的致病症状。这些结果与Caspi-Flugeretal.(2012)和Purcelletal.(1994)的结果相似,Purcelletal.(1994)发现叶蝉Euscelidius中的共生菌(designated BEV)可通过饲喂同一植物(黑麦草Loliumperenne)达到从一个寄主体传播到另一寄主的目的。寄主植物可作为Rickettsia进行水平传播的容器,在一定程度上解释了没有关联的植食性昆虫体内为何会出现系统发育相似的共生菌。
除了烟粉虱外,许多研究也围绕共生菌在烟粉虱的优势寄生蜂的分布和功能展开。Chieletal.(2009)研究表明Rickettsia在寄生蜂Eretmocerusemiratus和Eretmoceruseremicus体内没有进入卵母细胞,仅局部存在于卵泡细胞,所以Rickettsia无法在两种寄生蜂体内进行垂直传播,在寄生蜂Encarsiapergandiella体内也只是短暂存在于消化道中,并在化蛹前排出体外;同时,水平传播实验的结果则表示3种蜂通过与感染Rickettsia的烟粉虱接触后能够普遍获菌,但是一旦离开含菌粉虱,寄生蜂的感菌率又会急剧下降。陆玉恒(2015)研究发现海氏桨角蚜小蜂Eretmocerushayati可通过寄生和接触粉虱来获得Rickettsia。但是该研究认为通过接触获得的Rickettsia不能在寄生蜂体内一直存在,而通过寄生获得的Rickettsia能在寄主体内一直存在,且这两种方式所获的Rickettsia均分布在腹部肠道位置。
3 Rickettsia对昆虫生物学功能的影响
昆虫次生内共生菌对其生物学功能的影响主要包括生殖调控、生活史适合度、外界环境耐受性等方面。结合目前昆虫Rickettsia的研究结果(见表1),笔者从如下几个方面总结该菌对昆虫生物学功能的影响:
3.1Rickettsia对宿主昆虫孤雌生殖的影响
Rickettsia可引起一些宿主昆虫产生孤雌生殖。日本学者Hagimorietal.(2006)首次报道了Rickettsia与潜叶蝇类害虫的优势寄生性天敌昆虫芙新姬小蜂Neochrysocharisformosa(膜翅目:姬小蜂科)的孤雌生殖有关。在该蜂的孤雌品系里,携带Rickettsia菌的雌性个体占雌虫总量的比例大于99.5%,四环素处理后导致未感染此菌的雄性后代的出现。随后Hagimorietal.(2008)又进行了芙新姬小蜂体内Rickettsia的研究,结果表明感染Rickettsia的寄生蜂的卵母细胞只进行了一次减数分裂,并没有进行减数分裂重组,证明Rickettsia菌通过改变寄生蜂卵母细胞的减数分裂而达成孤雌品系寄生蜂的目的。Giorginietal.(2010)研究发现含有Rickettsia的寄生蜂Pnigaliosoemius(膜翅目:姬小蜂科)仅产生雌虫后代,用浓度为20 mg/mL的利福平处理24 h消除Rickettsia后,几乎全部为雄性后代。Rickettsia因此成为继Wolbachia和Cardinium之后第3个表现出与Wolbachia引起的表现型一致的细菌世系(Stouthameretal., 1999)。孤雌生殖的书虱—嗜卷书虱Liposcelisbostrychophila(啮虫目:书虱科)也含有Rickettsia,通过1%利福平处理4周后产生不含共生菌的书虱,后代数量和存活率也大幅度下降(Yusuf and Turner, 2004)。Zchori-Feinetal.(2006)将切碎的种子分别浸泡1%、3%、5%的四环素溶液24 h后风干12 h,然后用其饲喂龄期为2 d并已经交配过的雌性甲虫,饲喂4 d后带有Rickettsia和Wolbachia的树皮甲虫—棕榈核小蠹Coccotrypesdactyliperda(鞘翅目:小蠹亚科)卵子形成终止,产生了大量不育的雌性后代,但该研究还不够深入,共生菌在其体内的分布及传播机制有待进一步研究证明。
3.2Rickettsia对宿主昆虫的适合度的影响
Rickettsia也对多种昆虫宿主的适合度产生影响。Chieletal.(2009)发现在以色列感染Rickettsia的B型烟粉虱(MEAM1隐种)成虫前期发育速率加快,但是成虫寿命、后代总数、性比以及蛹的存活率并没有显著差异。随后Himleretal.(2011)发现美国南部携带有Rickettsia的B型烟粉虱(MEAM1隐种)的后代雌虫比例、存活率、产卵量以及发育速度与不含Rickettsia的相比均显著提高。此外,Leonardo and Muiru(2003)发现R.insecticola菌仅对取食三叶草的蚜虫有促进作用;以5种欧洲豆蚜为研究对象的结果证实只有一种含有R.insecticola菌的蚜虫能够显著增加对红三叶草的取食(Ferrarietal., 2007)。Rickettsia能够提高一些宿主昆虫的适合度,但也可能降低另一些宿主的适合度。Chenetal.(2000)表示Rickettsia可以降低豌豆蚜虫Acyrthosiphonpisum(半翅目:蚜科)的适合度,包括减轻宿主个体体重,降低繁殖力,抑制Buchnera密度等等。
3.3Rickettsia对宿主昆虫抵御环境能力的影响
Rickettsia能够一定程度上改变宿主对环境的抵御能力,比如耐热性、抗药性和天敌昆虫的攻击等等。Rickettsia可以提高烟粉虱对高温的抵御能力,研究表明这种能力与热激蛋白基因(heat shock protein, HSP)的诱导表达有关(Bruminetal., 2011)。Bruminetal.(2011)研究发现以色列地区携带Rickettsia菌的B型烟粉虱(MEAM1隐种)能够通过诱导热激蛋白基因的表达,达到抵御极端高温的目的;并且在40℃高温下,分散型Rickettsia菌的含量显著下降。Shanetal.(2014)将携带Rickettsia菌的B型烟粉虱(MEAM1隐种)和Q型烟粉虱(MED隐种)置于40℃高温下24 h,发现分散型Rickettsia菌的含量并没有像Bruminetal.(2011)所述的显著减少,这可能与物种和种群特异性有关。Montlloretal.(2002)也曾表明Rickettsia可提高豌豆蚜对高温的抵御能力。同时,Rickettsia也影响了宿主昆虫对一些化学杀虫剂的抵御能力。Kontsedalovetal.(2008)比较了感染Rickettsia的B型烟粉虱种群(MEAM1隐种)与未感染的种群对啶虫咪、噻虫嗪、蚊蝇醚、螺甲螨酯、吡虫啉和丁醚脲6种药剂的敏感性差异,结果显示染菌种群对前4种药剂更敏感尤其是蚊蝇醚,对吡虫啉和丁醚脲的敏感度无差异;随后Ghanim and Kontsedalov(2009)比较了双重感染Rickettsia-Arsenophonus的Q型烟粉虱(MED隐种)比只含Arsenophonus的烟粉虱对噻虫嗪、蚊蝇醚、螺甲螨酯、吡虫啉4种药剂的死亡率显著提高,对丁醚脲无显著差异。
此外,Rickettsia菌还能提高宿主对天敌昆虫和其他病原菌的抵御能力。Oliveretal. (2003)研究发现Rickettsia具有提高宿主豌豆蚜抵御寄生蜂的能力。相似的,Mahadavetal.(2008)发现携带Rickettsia菌的烟粉虱也可以抵御寄生蜂Eretmocerusmundus的寄生。目前,这种保护作用机制仍是未知的。Moranetal.(2005)研究发现此机制可能与共生菌产生的毒素有关,而这种毒素的产生与噬菌体紧密相连,但到目前为止还没有更进一步的研究结果。Rickettsia除了能改变宿主对寄生性天敌的防御能力外,也能改善其对一些有害微生物的防御能力。Scarboroughetal.(2005)通过显微注射将含有R.insecticola的蚜虫Acyrthosiphonpisum品系体液注射到不含菌的个体中,发现后者对新蚜虫疠霉Pandoraneoaphidis的防御力显著增加。同样,Hendryetal.(2014)研究表明烟粉虱取食感染丁香假单胞菌Pseudomonassyringae的寄主植物后死亡率显著增加,但当烟粉虱携带Rickettsia菌后,死亡率显著降低,这表明携带Rickettsia菌增加了烟粉虱对该病原菌的抵御能力。
3.4Rickettsia对宿主昆虫雄性致死的影响
二星瓢虫Adaliabipunctata中的Rickettsia与雄性胚胎死亡率相关,十星瓢虫Adaliadecempunctata体内也存在能够引起雄性致死的Rickettsia,并且这两种瓢虫的Rickettsia经过16S rDNA分析后发现亲缘关系非常近(Hurstetal., 1993,1996; Werrenetal., 1994)。除了Rickettsia之外,A.bipunctata、螺原体和Wolbachia菌株,都被认为涉及雄性致死现象(Hurst and Jiggins, 2000)。在甲虫Brachystessellatus中感染Rickettsia同样与雄性胚胎致死有关,抗生素处理增加了雄性羽化的数量(Lawsonetal., 2001),Lawsonetal.(2001)认为Brachystessellatus所出现的较低水平的孤雌生殖(约10%)要么是因为缺少雄虫,要么是因为甲虫本身的共生菌感染,但目前还没有更深入的研究。吉丁虫Buprestidae(鞘翅目:吉丁虫科)同样如此,用四环素处理后可增加其雄性胚胎的孵化率和存活率(Werrenetal., 1994)。
3.5Rickettsia其它方面的影响
Rickettsia也可能是植物病害的病原菌。Rickettsia被鉴定为植物病原体的代表性研究是1998年Davis在木瓜上饲养携带Rickettsia的叶蝉的过程中发现Rickettsia可引起番木瓜束顶病(PBT),但其致病机制是否与脊椎动物立克次氏体病相关仍未知。Gottliebetal.(2010)认为番茄黄化曲叶病毒(Tomato yellow leaf curl virus,TYLCV)的传播依赖于宿主粉虱体内所含内共生菌的GroEL蛋白,此蛋白质量为63 kDa ,酵母双杂交和蛋白质折叠实验证明Hamiltonella产生的GroEL蛋白与TYLCV的外壳蛋白相互作用,Rickettsia和Portiera菌则不存在,且这种相互作用只发生在B型(MEAM1隐种)烟粉虱上,可能是因为以色列的Q型(MED隐种)烟粉虱体内不含Hamiltonella。随后,Kliotetal.(2014)发现相同遗传背景下携带Rickettsia菌的烟粉虱比不带菌烟粉虱对TYLCV的传播效率提高接近两倍,且带毒时间更长。
同样的,Rickettsia也可能是脊椎动物疾病的病原菌。La Scola and Raoult(1997)提出所有Rickettsia菌都对脊椎动物具有潜在致病性,并声称Rickettsia菌传播到脊椎动物体内的概率是决定致病率的主要因素,然而这个假设是有争议的。例如,蜱体内的某些Rickettsia与脊椎动物致病性无关,包括R.bellii和R.tarasevichiae,二者虽是蜱内共生菌,但却与非嗜血宿主内共生菌距离很近。
尽管这些年对昆虫内共生菌Rickettsia的研究取得了不少成果,越来越多的人开始关注Rickettsia对宿主生态和进化方面的影响,但由于昆虫内共生菌具有不可培养和交叉感染的特性,昆虫内共生菌的研究仍然面临巨大的挑战。
4 Rickettsia基因组学和系统进化分析
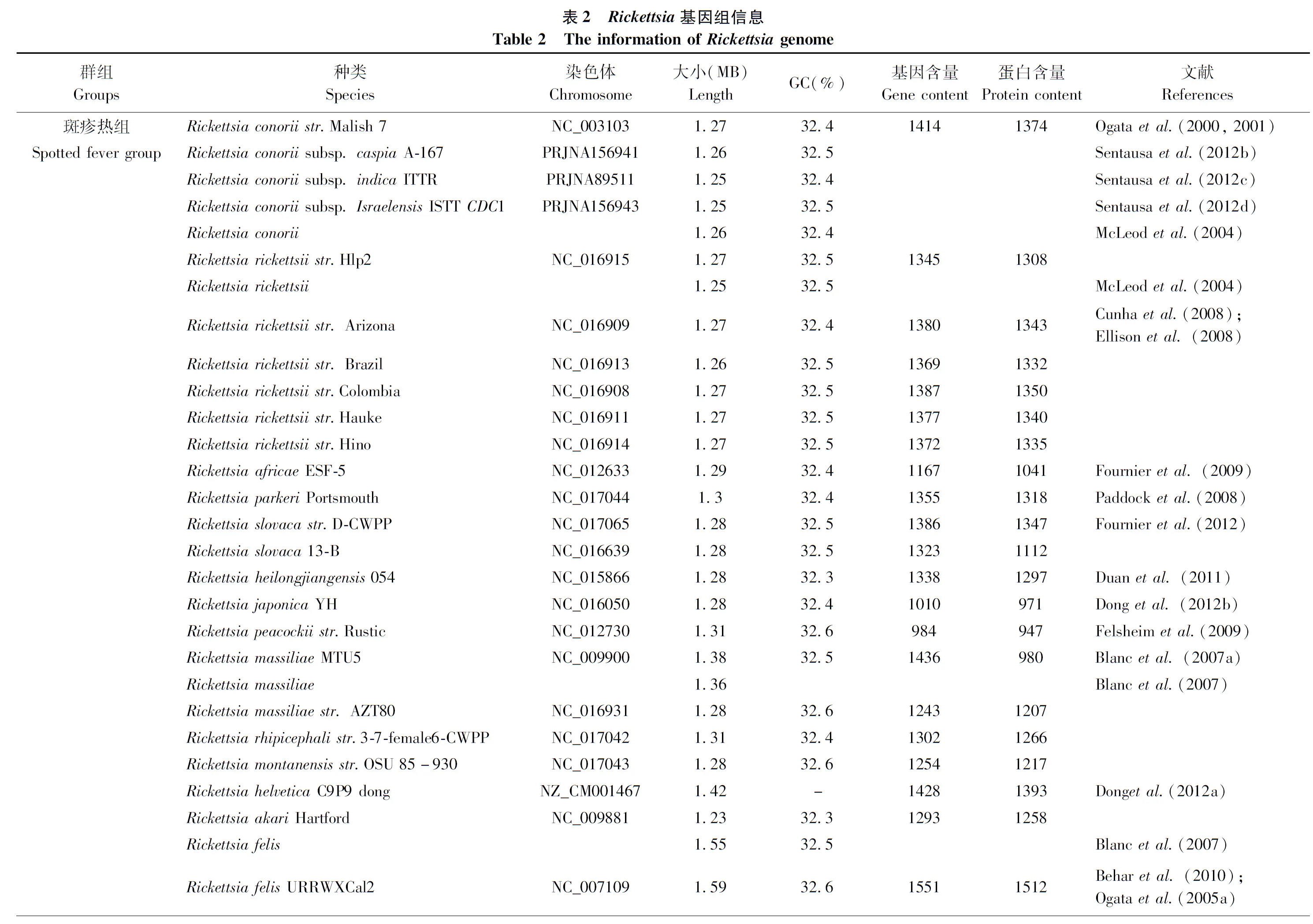
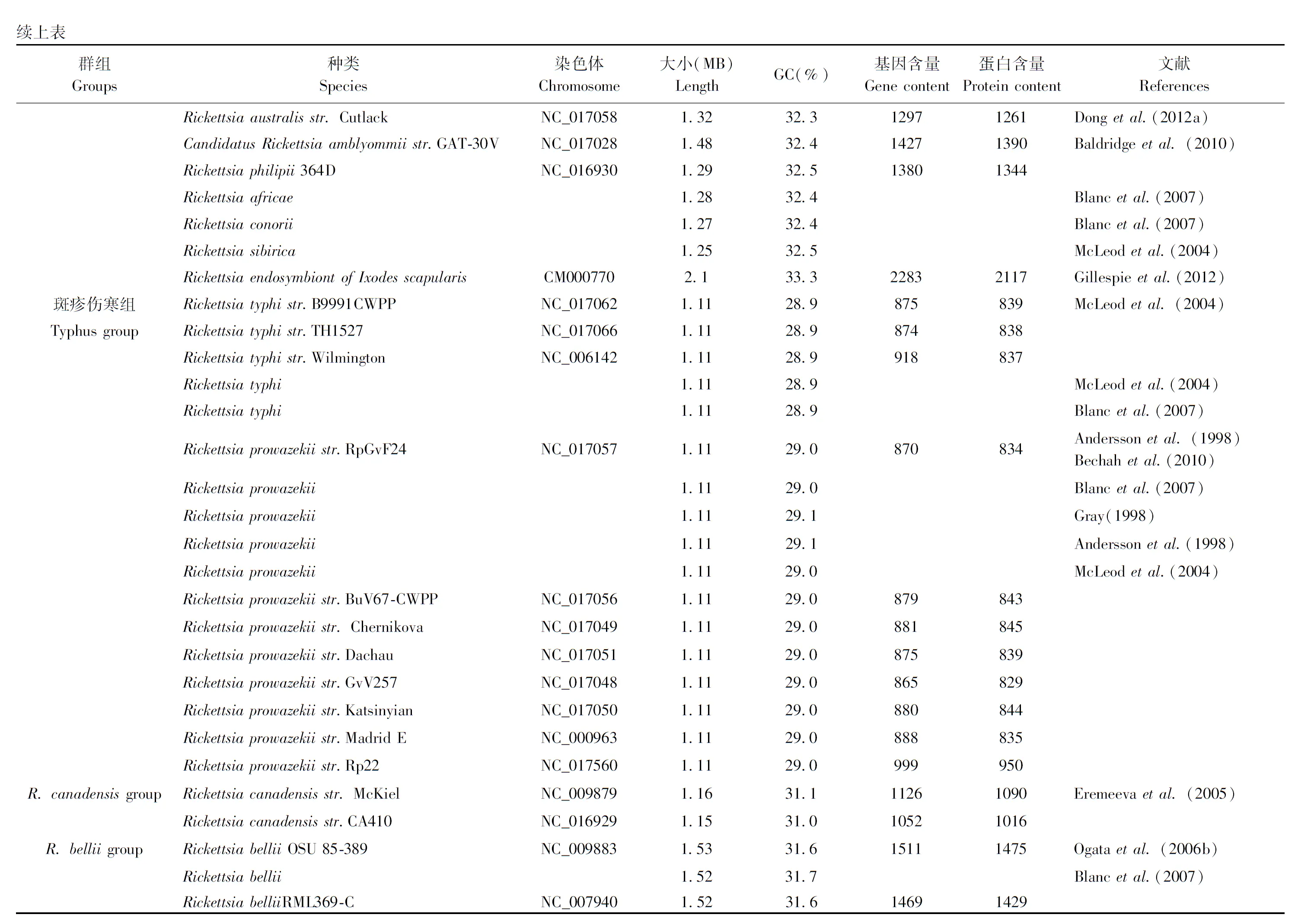
Rickettsia基因组,是一个较小的、杆状的、较简化的基因组。Rickettsia基因组是研究还原进化的最佳参照,其种类之间,大小各不相同(1.1-1.5 Mb),编码基因(约900-1500个基因)为基因组的减少提供参照(Andersonetal., 1998)。根据形态、抗原、新陈代谢等特性,Rickettsia被分为第一部分所讲述的4组,目前已测得45种Rickettsia菌种的基因组序列(见表2),这些序列的大小和基因含量差别很大(Georgiades and Raoult, 2011; Georgiadesetal., 2011)。与其它胞内细菌一样,基因缺失导致Rickettsia基因组通常较小(Moran, 2002; Merhejetal., 2009; Toft and Andersson, 2010)。基因组大小范围从R.typhi和R.prowazekii的1.1 Mb到肩突硬蜱Ixodesscapularis的2.1 Mb,平均基因含量1236.54±281.22,平均GC含量31.5%±1.52%。由于基因缺失率和基因获得率的不同导致基因组大小不一,基因大小和基因含量在共生菌转化为胞内共生的过程中逐渐减少,限制了水平获得DNA的能力(Merhejetal., 2009)。Zhuetal.(2016)测得了中国和以色列的B型烟粉虱(MEAM1隐种)体内Rickettsia的基因组序列,二者均含有较高的编码密度并富含AT碱基,编码序列超过1000 bp。中国B型烟粉虱(MEAM1隐种)的基因组包含1233863 bp,平均GC含量为31.89%,编码密度为81.23%;以色列B型烟粉虱(MEAM1隐种)的基因组包含1202987 bp,平均GC含量为32.19%,编码密度为81.17%。 Ogataetal.(2006)测得了昆虫携带机率最高的Rickettsiabellii的基因组序列,约1522076 bp,基因组大小与R.felis相差无几,与其它Rickettsia相差较大,染色体也与其它Rickettsia基因组无同源性,编码一整套DNA转移基因。R.bellii可在真核细胞核内高效繁殖,并能在具有噬菌作用的变形虫Acanthamoebapolyphaga体内幸存,R.bellii拥有的节肢动物宿主种类在Rickettsia属中范围最广,包括烟粉虱、扁虱、蚜虫等,并能使哺乳类动物致病。Hiroyukietal.(2006)表示R.bellii保留了Rickettsia的原始特征,其基因组序列可使早期的基因组进化重现,所以对R.bellii基因组进一步研究意义重大。
Rickettsia的系统发育分析经历了很长一段时间的研究和完善,它是由基因和衍生蛋白序列的比对推断,然后利用简约法、最大似然法和邻近法而得。这些基因和衍生蛋白主要包括柠檬酸合酶(gltA)、17 kDa抗原、外膜蛋白A(OmpA)、外膜蛋白B(OmpB)、以及“基因D”。gltA基因编码柠檬酸合酶,是Rickettsiae的中心代谢途径中较保守的酶,其序列在系统进化距离较远的生物体之间显著不同;OmpA是编码洛基山斑疹热SFGrickettsiae特异性外膜蛋白的基因,但不是所有种类的Rickettsia都有;OmpB是一个S-layer晶体蛋白,S-layer晶体蛋白是一种表面层蛋白,一般呈单分子晶体排列,具有方形或六边形对称结构,分子量约为40-200 kDa。大量的研究表明,S-layer蛋白可能与细菌的粘附有关(Sleytr and Messner, 1988)。S-layers影响细菌的硬度和形状,并发挥着分子筛和离子阱的功能,促进了细胞粘附和表面识别。“基因D”是Rickettsiae里相对前面几个基因来说较近被描述的基因,是PS120蛋白编码基因,首次在Rickettsiaconorii和日本特有的Rickettsia中描述,具有保护性免疫的作用(Schuenke and Walker, 1994)。“基因D”片段的序列分析用于完整先前通过比对编码柠檬酸合酶、17 kDa抗原、rOmpA和rOmpB基因序列的而得的系统发育分析。测序数据表明“基因D”与先前已测序的基因没有明显的同源性。Olsen and Woese(1993)建议,比对几个基因的序列然后评估它们对建立系统发育树的价值是很重要的,目前还在寻找一个所有Rickettsiae都可获得的通用DNA标记。Sekeyovaetal.(2001)利用“基因D”序列比对来推断Rickettsiae的系统发育,结果与先前报道的gltA、ompA和ompB的主要分歧是R.montanensis是否属于R.rickettsii组。如果使用gltA和ompA分析,R.montanensis就不在R.rickettsii组内,R.massiliae,R.rhipicephali和R.aeschlimannii同样如此。然而,如果使用ompB进行分析,R.montanensis便属于此组且具有88%的引导值。基因D分析表明R.montanensis也属于R.rickettsii但是引导值却没有那么显著仅有51%。Sekeyovaetal.(2001)表示Rickettsia的系统发育关系的比较取决于所使用的方法。所以,在今后的研究过程中,需收集更多的信息来准确判断R.montanensis的系统发育位置。基于多种分子序列的分析方法,已鉴定出的Rickettsia菌属代表种的数量在过去20年里显著增加,随着越来越多的基因序列被测得,科研工作者应有效利用多基因的方法来完善Rickettsia菌属的系统发育分析。

5 结语与展望
Rickettsia是节肢动物体内一个重要的内共生菌类群,对宿主的生殖、发育、抗药性及免疫防御都有重要的影响。自然界中不同种类的昆虫能够携带不同种类的Rickettsia,对Rickettsia多样性和传播特点进行深入研究,阐明Rickettsia对昆虫生理发育的功能以及对昆虫种内分化及进化机制等方面的影响,对解释某些入侵害虫的适应和扩散机制具有重大意义。
本篇综述从Rickettsia的分类、在昆虫体内的分布、传播方式、与昆虫生殖调控的关系以及基因组进化等方面,简述了Rickettsia目前的研究进展。Rickettsia可通过垂直、水平和混合传播在同种或不同种群之间扩散,虽然部分室内试验证明了Rickettsia能通过植物或寄生蜂进行水平传播,但这些结果仅证明烟粉虱对植物中Rickettsia的摄取,新获得的细菌是否能传播到下一代还有待检测。坚持不懈的研究跨种转移的频率将会有助于深入了解植物中细菌如何传播、以及哪一种Rickettsia能够与新寄主建立永恒的关系。由于Rickettsia在寄主体外很难培养,并且用抗生素除去后也很难维持,所以Rickettsia在寄主体内具体起到了什么作用还是未知的,或者说即使Rickettsia能够影响宿主昆虫的生殖调控,例如孤雌生殖和后代性比,但是它在昆虫发育过程中哪些环节起到作用以及具体作用又是什么,还有待进一步探索。
至今为止,越来越多的昆虫Rickettsia基因组被测序及其功能基因研究的不断深入,有助于研究人员更为深入全面地对昆虫Rickettsia进行分子和遗传学方面的研究,也有助于了解共生菌主要的动态变化和预测Rickettsia感染频率对农业害虫的影响,为共生菌与宿主昆虫之间的交互作用的进一步阐释奠定基础。
References)
Adachi-Hagimori T, Miura K, Stouthamer R. A new cytogenetic mechanism for bacterial endosymbiont-induced parthenogenesis [J].ProceedingsoftheRoyalSocietyBBiologicalSciences, 2008, 275 (1652): 2667-2673.
Andersson SG, Zomorodipour A, Andersson JO,etal. The genome sequence ofRickettsiaprowazekiiand the origin of mitochondria [J].Nature, 1998, 396: 133-140.
Azad AF, Beard CB.Rickettsialpathogens and their arthropod vectors [J].EmergingInfectiousDiseases, 1998, 4 (2): 179-186.
Baumann P. Biology of bacteriocyte-associated endosymbionts of plant sap-sucking insects [J].AnnualReviewofMicrobiology, 2005, 59: 155-189.
Behar A, Mccormick LJ, Perlman SJ.Rickettsiafelisinfection in a common household insect pest,Liposcelisbostrychophila(Psocoptera: Liposcelidae) [J].Applied&EnvironmentalMicrobiology, 2010, 76: 2280-2285.
Benson MJ, Gawronski JD, Eveleigh DE,etal. Intracellular symbionts and other bacteria associated with deer ticks (Ixodesscapularis) from Nantucket and Wellfleet, Cape Cod, Massachusetts [J].Applied&EnvironmentalMicrobiology, 2004, 70: 616-620.
Boone DR, Castenholz RW, Garrity GM. Bergey’s Manual of Systematic Bacteriology [M]. Berlin:Springer, 2001.
Braquart-Varnier C, Lachat M, Herbinie’re J,etal.Wolbachiamediate variation of host immunocompetence [J].PLoSONE, 2008, 3(9): e3286.
Brumin M, Kontsedalov S, Ghanim M.Rickettsiainfluences thermotolerance in the whiteflyBemisiatabaciB biotype [J].InsectScience, 2011, 18 (1): 57-66.
Brumin M, Levy M, Ghanim M. Transovarial transmission ofRickettsiaspp. and organ-specific infection of the whiteflyBemisiatabaci[J].Applied&EnvironmentalMicrobiology, 2012, 78 (16): 5565-5574.
Bution ML, Caetano FH, Zara FJ. Contribution of the Malpighian tubules for the maintenance of symbiotic microorganisms incephalotesants [J].Micron, 2008, 39 (8): 1179-1183.
Caspi-Fluger A, Inbar M, Mozes-Daube N,etal. Horizontal transmission of the insect symbiontRickettsiais plant-mediated [J].ProceedingsoftheRoyalSocietyBBiologicalSciences, 2012, 279 (1734): 1791-1796.
Caspi-Fluger A, Inbar M, Mozes-Daube N,etal.Rickettsia‘in’ and ‘out’: Two different localization patterns of a bacterial symbiont in the sameinsect species [J].PLoSONE, 2011, 6 (6): e21096.
Chen DQ, Campbell BC, Purcell AH. A newRickettsiafrom a herbivorous insect, the pea aphidAcyrthosiphonpisum(Harris) [J].CurrentMicrobiology, 1996, 33: 123-128.
Chen DQ, Montllor CB, Purcell AH. Fitness effects of two facultative endosymbiotic bacteria on the pea aphid,Acyrthosiphonpisum, and the blue alfalfa aphid,A.kondoi[J].EntomologiaExperimentalisEtApplicata, 2000, 95 (3): 315-323.
Chiel E, Inbar M, Mozesdaube N,etal. Assessments of fitness effects by the facultative symbiontRickettsiain the Sweetpotato whitefly (Hemiptera: Aleyrodidae) [J].AnnalsoftheEntomologicalSocietyofAmerican, 2009, 102 (3): 413-418.
Chiel E, Zchori-Fein E, Inbar M,etal. Almost there: Transmission routes of bacterial symbionts between trophic levels [J].PLoSONE, 2009, 4 (3): e4767.
Davis MJ, Ying Z, Brunner BR,etal.Rickettsialrelative associated with Papaya Bunchy Top disease [J].CurrentMicrobiology, 1998, 36: 80-84.
Delaney AD. Rats, lice, and history. The Atlantic Monthly [M]. Boston: Little, Brown and Company, 1963.
Dumler JS, Walker DH. Rocky Mountain spottedfever-changing ecology and persisting virulence [J].NewEnglandJournalofMedicine, 2005, 353 (353): 551-553.
Ferrari J, Scarborough CL, Godfray HCJ. Genetic variation in the effect of a facultative symbiont on host-plant use by pea aphids [J].Oecologia, 2007, 153 (2): 323-329.
Fukatsu T, Shimada M. Molecular characterization ofRickettsiasp. in a bruchid beetleKytorhinussharpianus(Coleoptera: Bruchidae) [J].AppliedEntomology&Zoology, 1999, 34: 391-397.
Georgiades K, Merhej V, EI KK,etal. Gene gain and loss events inRickettsiaandOrientiaspecies [J].BiologyDirect, 2011, 6 (1): 6.
Georgiades K, Raoult D. Genomes of the most dangerous epidemic bacteria have a virulence repertoire characterized by fewer genes but more toxinantitoxin modules [J].PLoSONE, 2011, 6(3): e1387.
Ghanim M, Kontsedalov S. Susceptibility to insecticides in the Q biotype ofBemisiatabaciis correlated with bacterial symbiont densities [J].PestManagementScience, 2009, 65 (9): 939-942.
Giorgini M, Bernardo U, Monti MM,etal.Rickettsiasymbionts cause parthenogenetic reproduction in the parasitoid waspPnigaliosoemius(Hymenoptera: Eulophidae) [J].Applied&EnvironmentalMicrobiology, 2010, 76 (8): 2589-2599.
Gottlieb Y, Ghanim M, Chiel E,etal. Identification and localization of aRickettsiasp. inBemisiatabaci(Homoptera: Aleyrodidae) [J].Applied&EnvironmentalMicrobiology, 2006, 72 (5): 3646-3652.
Gottlieb Y, Zchori-Fein E, Mozes-Daube N,etal. The transmission efficiency of tomato yellow leaf curl virus by the whiteflyBemisiatabaciis correlated with the presence of a specific symbiotic bacterium species [J].JournalofVirology, 2010, 84 (18): 9310-9317.
Hagimori T, Abe Y, Date S,etal. The first finding of aRickettsiabacterium associated with parthenogenesis induction among insects [J].CurrentMicrobiology, 2006, 52 (2): 97-101.
Hendry TA, Hunter MS, Baltrus DA. The facultative symbiontRickettsiaprotects an invasive whitefly against entomopathogenicPseudomonassyringaestrains [J].Applied&EnvironmentalMicrobiology, 2014, 80 (23): 7161-7168.
Himler AG, Adachi-Hagimori T, Bergen JE,etal. Rapid spread of a bacterial symbiont in an invasive whitefly is driven by fitness benefits and female bias [J].Science, 2011, 332 (6026): 254-256.
Hunter MS, Perlman SJ, Kelly SE. A bacterial symbiont in the Bacteroidetes induces cytoplasmic incompatibility in the parasitoid waspEncarsiapergandiella[J].ProceedingsoftheRoyalSocietyBBiologicalSciences, 2003, 270: 2185-2190.
Hurst GDD, Jiggins FM. Male-killing bacteria in insects:Mechanisms, incidence, and implications [J].EmergingInfectiousDiseases, 2000, 6: 329-336.
Hurst GDD, Majerus MEN, Walker LE. The importance of cytoplasmic male killing elements in natural populations of the two spot ladybird,Adaliabipunctata(Linnaeus)(Coleoptera: Coccinellidae) [J].BiologicalJournaloftheLinneanSociety, 1993, 49 (2): 195-202.
Hurst GDD, Walker LE, Majerus MEN. Bacterial infections of hemocytes associated with the maternally inherited male-killing trait in British populations of the two spot ladybird,Adaliabipunctata[J].JournalofInvertebratePathology, 1996, 68 (3): 286-292.
Inbar M, Gerlin D. Plant-mediated interactions between whiteflies herbivores and natural enemies [J].AnnualReviewofEntomology, 2008, 53: 431-448.
Jiggins FM, Hurst GDD, Jiggins CD,etal. The butterflyDanauschrysippusis infected by a male-killingSpiroplasmabacterium [J].Parasitology, 2000, 120 (5): 439-446.
Kliot A, Cilia M, Czosnek H,etal. Implication of the bacterial endosymbiontRickettsiaspp. in interactions of the whiteflyBemisiatabaciwith tomato yellow leaf curl virus [J].JournalofVirology, 2014, 88 (10): 5652-5660.
Kontsedalov S, Zchori-Fein E, Chiel E,etal. The presence ofRickettsiais associated with increased susceptibility ofBemisiatabaci(Homoptera : Aleyrodidae) to insecticides [J].PestManagementScience, 2008, 64 (8): 789-792.
La Scola B, Raoult D. Laboratory diagnosis ofrickettsioses: Current approaches to diagnosis of old and newrickettsialdiseases [J].JournalofClinicalMicrobiology, 1997, 35: 2715-2727.
Lawson ET, Mousseau TA, Klaper R,etal.Rickettsiaassociated with male-killing in a buprestid beetle [J].Heredity, 2001, 86: 497-505.
Leonardo TE, Muiru GT. Facultative symbionts are associated with host plant specialization in pea aphid populations [J].ProceedingsoftheRoyalSocietyBBiologicalSciences, 2003, 270: S209-S212.
Lu YH. Distribution, Transmission and Function ofRickettsiainEretmocerushayati[D]. Zhejiang: Zhejiang University, 2015. [陆玉恒. 海氏浆角蚜小蜂共生菌Rickettsia的体内分布、传播和功能研究 [D]. 浙江大学, 2015]
Macaluso KR, Pornwiroon W, Popov VL,etal. Identification ofRickettsiafelisinthe salivary glands of cat fleas [J].VectorBorne&ZoonoticDiseases, 2008, 8 (3): 391-396.
Mahadav A, Gerling D, Gottlieb Y,etal. Parasitization by the waspEretmocerusmundusinducestranscription of genes related to immune response and symbiotic bacteria proliferation in the whiteflyBemisiatabaci[J].BMCGenomics, 2008, 9 (1): 413-421.
Merhej V, Raoult D.Rickettsialevolution in the light of comparative genomics [J].BiologicalReviews, 2011, 86: 379-405.
Merhej V, Royercarenzi M, Pontarotti P,etal. Massive comparative genomic analysis reveals convergent evolution of specialized bacteria [J].BiologyDirect, 2009, 4 (1): 13.
Min KT, Benzer S.Wolbachia, normally a symbiont ofDrosophila, can be virulent, causing degeneration and early death [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 1997, 94 (20): 10792-10796.
Moran NA, Baumann P. Bacterial endosymbionts in animals [J].CurrentOpinioninMicrobiology, 2000, 3 (3): 270-275.
Moran NA, McCutcheon JP, Nakabachi A. Genomics and evolution of heritable bacterial symbionts [J].AnnualReviewofGenetics, 2008, 42 (1): 165-190.
Moran NA. Microbial minimalism: Genome reduction in bacterial pathogens [J].Cell, 2002, 108 (5): 583-586.
Moran NA, Russell JA, Koga R,etal. Evolutionary relationships of three new species ofEnterobacteriaceaeliving as symbionts of aphids and other insects [J].Applied&EnvironmentalMicrobiology, 2005, 71 (6): 3302-3310.
Munderloh UG, Kurtti TJ. Cellular and molecular interrelationships between ticks and prokaryotic tick-borne pathogens [J].AnnualReviewofEntomology, 1995, 40: 221-243.
Nakabachi A, Yamashita A, Toh H,etal. The 160 kb genome of the bacterial endosymbiontCarsonella[J].Science, 2006, 314: 267.Ogata H, La SB, Audic S,etal. Genome sequence ofRickettsiabelliiilluminates the role of amoebae in gene exchanges between intracellular pathogens [J].PLoSGenetics, 2006, 2 (5): 733-744.
Oliver KM, Degnan PH, Burke GR,etal. Facultative symbionts in aphids and the horizontal transfer of ecologically important traits [J].AnnualReviewofEntomology, 2010, 55: 247-266.
Oliver KM, Russell JA, Moran NA,etal. Facultative bacterial symbionts in aphids confer resistance to parasitic wasps [J].ProceedingsoftheNationalAcademyofSciences, 2003, 100 (4): 1803-1807.
Olsen GJ, Woese CR. Ribosomal RNA:A key to phylogeny [J].Faseb.Journal, 1993, 7 (1): 113-123.
Perotti MA, Clarke HK, Turner BD,etal.Rickettsiaas obligate and mycetomic bacteria [J].Faseb.JournalOfficialPublicationoftheFederationofAmericanSocietiesforExperimentalBiology, 2006, 20 (13): 2372-2374.
Perlman SJ, Hunter MS, Zchori-Fein E. The emerging diversity ofRickettsia[J].ProceedingsoftheRoyalSocietyBBiologicalSciences, 2006, 273: 2097-2106.
Perlman SJ, Kelly SE, Hunter MS. Population biology of cytoplasmic incompatibility:Maintenance and spread ofCardiniumsymbionts in a parasitic wasp [J].Genetics, 2008, 178: 1003-1011.
Purcell AH, Suslow KG, Klein M. Transmission via plants of an insect pathogenic bacterium that does not multiply or move in plants [J].MicrobialEcology, 1994, 27 (1): 19-26.
Rao Q, Rollat-Farnier PA, Zhu DT,etal. Genome reduction and potential metabolic complementation of the dual endosymbionts in the whiteflyBemisiatabaci[J].BMCGenomics, 2015, 16 (1): 226-239.
Raoult D, Roux V.Rickettsiosisas paradigms of new or emerging infectious diseases [J].ClinicalMicrobiologyReviews, 1997, 10 (4): 694-719.
Santos-Garcia D, Farnier PA, Beitia FJ,etal. Complete genome sequence of “CandidatusPortiera aleyrodidarum” BT-QVLC, an obligate symbiont that supplies amino acids and carotenoids toBemisiatabaci[J].Bacteriol., 2012, 194 (23): 6654-6655.
Scarborough CL, Ferrari J, Godfray HC. Aphid protected from pathogen by endosymbiont [J].Science, 2005, 310 (5755): 1781-1781.
Schuenke KW, Walker DH. Cloning, sequencing and expression of the gene coding for an antigenic 120-kilodalton protein ofRickettsiaconorii[J].Infection&Immunity, 1994, 62 (3): 904-909.
Sekeyova Z, Roux V, Raoult D. Phylogeny ofRickettsiaspp. inferred by com paring sequences of 'gene D', which encodes an intracytoplasmic protein [J].InternationalJournalofSystematic&EvolutionaryMicrobiology, 2001, 51 (4): 1353-1360.
Shan HW, Lu YH, Bing XL,etal. Differential responses of the whiteflyBemisiatabaciSymbionts to unfavorable low and high temperatures [J].MicrobialEcology, 2014, 68 (3): 472-482.
Sleytr UB, Messner P. Crystalline surface layers in procaryotes [J].JournalofBacteriology, 1988, 170 (7): 2891-2897.
Sleytr UB, Messner P. Crystalline surface layers on bacteria [J].AnnualReviewofMicrobiology, 1983, 37 (3): 311-339.
Sloan DB, Moran NA. Endosymbiotic bacteria as a source of carotenoids in whiteflies [J].BiologyLetters, 2012, 8 (6): 986-989.
Stouthamer R, Breeuwer JAJ, Hurst GDD.Wolbachiapipientis: Microbial manipulator of arthropod reproduction [J].AnnualReviewofMicrobiology, 1999, 53 (1-2): 71-102.
Toft C, Andersson SG. Evolutionary microbial genomics, insights into bacterial host adaptation [J].NatureReviewsGenetics, 2010, 11 (7): 465-475.
van der Schulenburg JHG, Habig M, Sloggett JJ,etal. Incidence of male-killingRickettsiaspp. in the ten-spot ladybird beetleAdaliadecempunctataL. (Coleoptera: Coccinellidae) [J].Applied&EnvironmentalMicrobiology, 2001, 67 (1): 270-277.
Weeks AR, Velten R, Stouthamer R. Incidence of a new sex-ratio-distorting endosymbiotic bacterium among arthropods [J].ProceedingsoftheRoyalSocietyBBiologicalSciences, 2003, 270: 1857-1865.
Weinert LA, Werren JH, Aebi A,etal. Evolution and diversity ofRickettsiabacteria [J].BMCBiology, 2009, 7 (1): 6-21.
Werren JH, Baldo L, Clark ME.Wolbachia: Master manipulators of invertebrate biology [J].NatureReviewsMicrobiology, 2008, 6 (10): 741-751.
Werren JH, Hurst GDD, Zhang W,etal.Rickettsialrelative associated with male killing in the ladybird beetle (Adaliabipunctata) [J].JournalofBacteriology, 1994, 176 (2): 388-394.
Werren JH, Zhang W, Guo LR. Evolution and phylogeny ofWolbachia-reproductive parasites of arthropods [J].ProceedingsoftheRoyalSocietyBBiologicalSciences, 1995, 261 (1360): 55-63.
Yusuf M, Turner B. Characterisation ofWolbachia-like bacteria isolated from the parthenogenetic stored product pest psocidLiposcelisbostrychophila(Badonnel)(Psocoptera) [J].JournalofStoredProductsResearch, 2004, 40 (2): 207-225.
Zchori-Fein E, Borad C, Harari AR. Oogenesis in the date stone beetle,Coccotrypesdactyliperda, depends on symbiotic bacteria [J].PhysiologicalEntomology, 2006, 31 (2): 164-169.
Zchori-Fein E, Bourtzis K, Zchorifein E,etal. Manipulative tenants: Bacteria associated with arthropods [J].ManipulativeTenantsBacteriaAssociatedwithArthropods, 2011.
Zchori-Fein E, Gottlieb Y, Kelly SE,etal. A newly discovered bacterium associated with parthenogenesis and a change in host selection behavior in parasitoid wasps [J].ProceedingsoftheNationalAcademyofSciencesUSA, 2001, 98 (22): 12555-12560.
Zchori-Fein E, Perlman SJ. Distribution of the bacterial symbiontCardiniumin arthropods [J].MolecularEcology, 2004, 13 (7): 2009-2016.
Zhu DT, Xia WQ, Rao Q,etal. Sequencing and comparison of theRickettsia, genomes from the whiteflyBemisiatabaci, Middle East Asia minor I [J].InsectScience, 2016, 23 (4): 531-542.
Research advances on a secondary endosymbiontRickettsiain insect
ZHANG Jing1,2, ZHANG Yi-Bo2, XUE Yan-Tao1,2, LIU Huai1, ZHANG Gui-Fen2, WAN Fang-Hao2 *
(1. College of Plant Protection, Southwest University, Chongqing 500070, China; 2. State Key Laboratory for the Biology of Plant Diseases and Insect Pests, Plant Protection Institute, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Rickettsiaare sorts of negative-grambacteria of theRickettsiaceaebelonging to theα-Proteobacteria and the morphologically diverse secondary endosymbionts in eukaryotic cells.Rickettsiacan be nutritional symbiont in some insects, but be reproduction manipulators in other insects, or as a kind of plant pathogenic bacteria in insects. Moreover,Rickettsiashowed many host phenotypes in insect, such as enhancing insecticide resistance, natural enemy resistance, high temperature tolerance and so on. This review mainly focused on the research advances ofRickettsiain insect, including origins, diversity classification, distribution and transmission pathways, reproductive manipulation and genome evolution. Furthermore, we emphasized some controversial subjects and suggested ways in which study of nonpathogenicRickettsiacan advance our understanding of their relatives betweenRickettsiaand insects.
Rickettsia; transmission; distribution; reproduction manipulate; genome evolution
国家重点研发计划(2016YFC1202100),中国博士后科学面上基金(2015M570183),农业部“引进国际先进农业科学技术”948专项(2016-X48)
张婧,女,1993年生,硕士,研究方向为入侵生物学
*通讯作者Author for correspondence, E-mail: wanfanghao@caas.cn
Received:2016-08-26;接受日期 Accepted:2017-02-15
Q968;S476
A
1674-0858(2017)02-431-13
张 婧1,2,张毅波2,薛延韬,等.昆虫次生内共生菌Rickettsia研究进展[J].环境昆虫学报,2017,39(2):431-443.
