大青叶蝉内共生菌的检测及其16S rRNA基因序列分析
2017-06-05练启仙刘健锋杨茂发周小芸
练启仙,刘健锋,杨茂发*,罗 亭,吴 广,周小芸
(1. 贵州大学昆虫研究所,贵州省山地农业病虫害重点实验室,贵阳 550025;2. 兴义民族师范学院,贵州兴义 562400)
大青叶蝉内共生菌的检测及其16S rRNA基因序列分析
练启仙1,2,刘健锋1,杨茂发1*,罗 亭1,吴 广1,周小芸1
(1. 贵州大学昆虫研究所,贵州省山地农业病虫害重点实验室,贵阳 550025;2. 兴义民族师范学院,贵州兴义 562400)
用细菌通用引物27F-1513R对大青叶蝉内共生菌的16S rRNA基因进行PCR扩增,琼脂糖凝胶电泳,克隆、测序、序列比对与分析,用贝叶斯法和极大似然法构建系统发育树。结果表明:从大青叶蝉体内鉴定出Sulciamuelleri和Sodalissp.2种内共生菌,Sulciamuelleri隶属于拟杆菌门Bacteroidetes黄杆菌纲Flavobacteria黄杆菌目Flavobacteriales黄杆菌科Flavobacteriaceae,该内共生菌获得13个新单倍型,14个变异位点,其序列间的一致率为和遗传距离分别为99.40%-99.80%和0.001-0.004;系统发育树显示,Sulciamuelleri与大叶蝉亚科中检测到的Sulciamuelleri聚在一起,其变异程度低,所有单倍型为同一个种。Sodalissp.属于变形杆菌门Proteobacteria伽马变形菌纲Gammaproteobacteria肠杆菌目Enterobacteriale肠杆菌科Enterobacteriaceae,本研究获得5个新单倍型,20个变异位点,其序列间的一致率为96.10%-99.70%,遗传距离范围为0.012-0.040;系统发育树显示,Sodalissp.与采采蝇检测到的Sodalisglossinidius聚在一起,其变异程度相对较大,属于同一个属。
大青叶蝉;内共生菌;16S rRNA基因;单倍型;系统发育
内共生菌(Endosymbiont)和昆虫之间的共生关系是一个普遍存在的现象。Buchner(1965)用组织学的方法检测到昆虫具有两种内共生菌,即初生内共生菌(Primary endosymbiont)和次生内共生菌(Secondary endosymbiont)。初生内共生菌生活在昆虫的特定细胞中,与昆虫几乎同时发生,协同进化(Clarketal., 1992),为寄主提供必要的营养成分,如氨基酸等(Baumann, 2005);次生内共生菌可使雄虫雌性化(Werren and Windsor, 2000; Negrietal., 2008, 2009)、有杀雄作用(Werrenetal., 1994; Lawson,etal., 2001; von der Schulenburgetal., 2001)以及影响昆虫的生长发育等(Kontsedalov, 2008; Nodaetal., 2012)。刺吸式口器的昆虫主要是刺吸植物韧皮部和木质部的汁液为食,然而植物的汁液主要成分是蔗糖形式的碳水化合物,缺乏脂类和蛋白质,碳水化合物可合成脂类,但缺乏了必须氨基酸就不能合成蛋白质,而植物汁液中存在的氨基酸多数是不必要的氨基酸(Moranetal., 2008),为此,大多数刺吸植物汁液的昆虫需要体内的共生菌为其提供必需氨基酸等营养成分(Montlloretal., 2002; Daleetal., 2003; Douglas, 2009)。
大青叶蝉Cicadellaviridis隶属于半翅目Hemiptera叶蝉科Cicadellidae大叶蝉亚科Cicadellinae,可为害160多种植物,在为害过程中还传带一些病毒病,是重要的农林害虫(朱弘复和邓国藩,1950;康芝仙等,1996)。该害虫主要取食寄主植物嫩绿的枝梢茎叶汁液,和其他昆虫一样体内具有共生菌,具有为其提供营养等作用。Takiya等(2006)在大青叶蝉中检测到Sulciamuelleri内共生菌;Michalik等(2014)检测有Sulciamuelleri初生内共生菌和Sodalis-likeendosymbiont次生内共生菌,Lian等(2016)检测有Rickettsiasp.次生内共生菌。在中国,目前对大青叶蝉的生物学特性和化学防治研究较多,而对其内共生菌的研究较少,本实验利用通用引物对大青叶蝉内共生菌的16S rRNA 基因进行PCR扩增、克隆及测序等,然后对检测出的内共生菌Sulciamuelleri和Sodalissp.序列的特征进行了详细分析,以期为内共生菌对寄主的生长发育的影响、不同地理种群大青叶蝉内共生菌的差异以及大青叶蝉地理种群的遗传分化与共生菌的协同进化等进一步深入研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试虫源
于2013-2014年在贵州省贵阳市花溪区采集大青叶蝉成虫,75%酒精清洗3次后用无水乙醇浸泡,于-20℃下保存,供检测其内共生菌用。
1.2 方法
1.2.1 大青叶蝉DNA的提取
将-20℃下保存的大青叶蝉雌雄成虫放在无菌滤纸上,待乙醇挥发后用无菌水清洗5次,然后置于1.5 mL的离心管中,用研磨棒将其磨碎,最后按照血液/组织、细胞基因组提取试剂盒说明书(天根生化科技(北京)有限公司)提取DNA,提取的DNA置于-20℃下保存备用。
1.2.2 PCR扩增
用细菌通用引物27F(5′-AGAGTTTGATCM TGGCTCAG-3′)和1513R(5′-ACGGYTACCTTGTT ACGACTT-3′)(Weisburgetal., 1991)对提取的DNA进行PCR扩增。反应体系为25 μL,其中包括2.5 μL 10×buffer(含Mg2+),2 μL dNTP(Takara,宝生物工程(大连)有限公司),引物各0.5 μL(10 μM),0.5 μLTaqDNA聚合酶(Takara),1 μL DNA模板,最后加18 μL ddH2O。PCR反应程序为95℃预变性5 min,95℃变性30 s,63.5℃退火30 s,72℃延伸1 min,30个循环,最后72℃延伸10 min。扩增完成后取4 μL用1.5%琼脂糖凝胶电泳检测。
1.2.3 克隆与序列的测定
PCR产物电泳回收纯化后,连接到pMD®18-T载体上(Takara),连接产物转化到Trans1-T2感受态细胞中,涂板并37℃培养过夜,然后挑取白色菌落至600 μL的LB培养液(含5 μL,50 μg/mL Amp)中,37℃下震荡10 h左右。随机挑选PCR鉴定的阳性克隆送上海生工公司测序,每个PCR产物挑取10-12个单菌落用于序列测定。
1.2.4 序列分析
测序后获得的序列用DNAstar 5.03软件包中的SeqMan软件去除载体,结合测序峰图,对序列进行人工校对,并拼接正反序列。然后把序列放在GenBank中进行比对,下载与之对应的大青叶蝉内共生菌Sulciamuelleri和Sodalissp.的16S rRNA基因序列(AY676915,KJ660084,KJ660085)(Takiyaetal., 2006; Michaliketal., 2014),用Mega 6.05在默认设置下进行比对,并用DnaSP 5软件包计算所获序列的单倍型个数以及单倍型变异位点、多样度(Hd)、多样度分歧、核苷酸多样度(Pi)和核苷酸差异均数(K),用Bioedit 7.0对大青叶蝉单倍型序列进行一致性检验,用Mega 6.05计算其遗传距离。
从GenBank中另外选取一致性较高的序列与之相对应的测序序列用Mega 6.05进行比对,用Jmodetest软件计算出最佳模型,最后用MrBayes 3.2 和PAUP 4.0建系统发育树,极大似然法(Maximum-likelihood)分支置信度采用Bootstrap重复1000次。
2 结果与分析
2.1 大青叶蝉内共生菌16S rRNA基因序列在GenBank中Blast同源序列检索
对10头大青叶蝉(雌雄各5头)提取的DNA,用27F-1513R引物对16S rRNA基因进行PCR扩增后,用1.5%琼脂糖凝胶电泳检测,其片段大约为1500 bp(图1),然后对PCR产物进行纯化、克隆与测序,并在GenBank中Blast同源序列检索,结果表明,克隆的所有序列中有50条克隆序列(31条来自于雌虫,19条来自于雄虫)与拟杆菌门Bacteroidetes黄杆菌纲Flavobacteria黄杆菌目Flavobacteriales黄杆菌科Flavobacteriaceae的Sulciamuelleri同源性很高,DNA序列片段大小为1522-1523 bp;28条克隆序列(18条来自于雌虫,10条来自于雄虫)与变形杆菌门Proteobacteria伽马变形菌纲Gammaproteobacteria肠杆菌目Enterobacteriales肠杆菌科Enterobacteriaceae的Sodalis属同源性很高,DNA序列片段大小为1499-1511 bp。同时,这两种内共生菌在10头大青叶蝉中均被检测到。

图1 大青叶蝉内共生菌16S rRNA基因扩增产物Fig.1 PCR prouducts of endosymbiotic bacteria 16S rRNA gene from Cicadella viridis注:M,2000 bp分子质量标准;3/5/7/9/10,雌虫;1/2/4/6/8,雄虫;11,空白对照。Note: M, 2000 bp DNA marker; 3/5/7/9/10, Female;1/2/4/6/8, Male; 11, Blank control.
2.2 单倍型序列特征分析
2.2.1Sulciamuelleri16S rRNA基因序列特征分析
获得的50条Sulciamuelleri克隆序列与GenBank中原有大青叶蝉内共生菌Sulciamuelleri的两条序列(AY676915,KJ660084)进行分析,结果表明,从10个样品中获得14个单倍型,新单倍型有13个(Hap2-14)。来自10个样品的35条克隆序列(雌22条,雄13条)与AY676915和KJ660084共享单倍型1(Hap1),该单倍型的比率为70%;Hap10有来自两头雌虫的两条序列共享,其余12个单倍型均为来自同一雌或雄个体的克隆序列(表1)。这些单倍型序列中检测到14个变异位点(Variable sites),该单倍型多样度(Haplotype diversity,Hd)为0.496,单倍型多样度分歧(Variance of Haplotype diversity)为0.0075,核苷酸多样度(Nucleotide diversity,Pi)为0.00107±0.00025,平均核苷酸差异(Average number of pairwise nucleotide differences,k)为0.64932。序列中碱基T、C、A、G的平均含量分别为25.3%、18.0%、30.3%、26.5%,A+T含量(55.5%)高于G+C含量(44.5%);其序列的一致率在99.40%-99.80%,一致性非常高(表2)。此外,表1显示,所有单倍型无插入缺失,但有碱基变换,既有颠换,也有转换。表3显示,单倍型的遗传距离范围为0.001-0.004。
2.2.2Sodalissp. 16S rRNA基因序列特征分析
用Dnasp 5.0软件对本实验获得的28条Sodalissp.序列与GenBank中的大青叶蝉Sodalis-like endosymbiont序列(KJ660085)进行单倍型分析。结果表明,共获得6个单倍型;新单倍型5个(Hap2-6),有2个单倍型(Hap2,4)均有来自雌雄个体的克隆序列共享,KJ660085单独为一个单倍型(表4)。这些单倍型序列中检测到20个变异位点,该单倍型多样度Hd为0.766,单倍型多样度分歧为0.00221,核苷酸多样度Pi为0.001016±0.00192,平均核苷酸差异k为4.42857。新单倍型序列中碱基T、C、A、G的平均含量分别为20.6%、22.5%、25.4%、31.5%,此基因序列中富含G+C(54.0%)。从表4中可看出,Sodalissp.单倍型碱基发生了变换,但没有插入缺失。表5显示,该单倍型序列的一致率为96.10%-99.70%。遗传距离最小为0.002,最大为0.040(表6)。

表 1 大青叶叶蝉内共生菌Sulcia muelleri不同单倍型的变异位点

表2 大青叶蝉内共生菌Sulcia muelleri单倍型序列一致性检验

表3 大青叶蝉内共生菌Sulcia muelleri单倍型序列的遗传距离

表4 大青叶叶蝉内共生菌Sodalis sp.不同单倍型变异位点

表 5 大青叶蝉内共生菌Sodalis sp.单倍型序列一致性检验
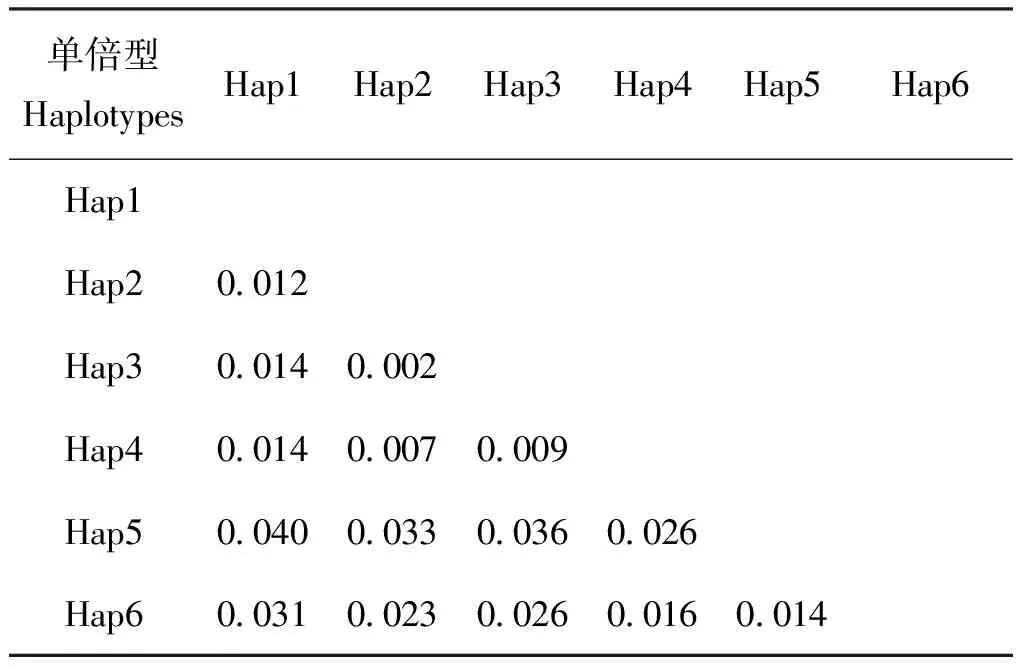
表 6 大青叶蝉内共生菌Sodalis sp.单倍型序列的遗传距离
2.3 单倍型序列GenBank登录号
大青叶蝉内共生菌Sulciamuelleri和Sodalis sp. 16S rRNA基因序列提交到GenBank数据库中,获得了相应的GenBank登录号,其中Sulciamuelleri16S rRNA基因序列的登录号为KY765568-KY765581,Sodalis sp. 16S rRNA基因序列登录号为KY765563-KY765567。
2.4 单倍型序列系统发育树的构建
通过 DnaSP 5.0软件计算获得的单倍型序列与GenBank中的序列用Mega 6.05进行比对,然后用jModeltest计算,获得贝叶斯(Bayesian,BA)和极大似然法(Maximum-likelihood,ML)建树的最佳模型,用Mrbayes 3.2和PAUP 4.0构建Sulciamuelleri和Sodalis sp. 16S rRNA基因序列的BA树和ML树,结果表明:用两种方法构建的系统发育树是一致的。大青叶蝉Sulciamuelleri内共生菌的14个单倍型序列与来自大叶蝉亚科的Sulciamuelleri(Bacteroidetes)序列形成同一个进化支,其支持率为1/98(BA/ML);同时可从图中看出,半翅目昆虫的Sulciamuelleri内共生菌16S rRNA基因序列以相同亚科的昆虫形成同一个进化分支(图2)。大青叶蝉内共生菌Sodalissp.与采采蝇中检测到的Sodalisglossinidius聚在一起,其支持率为1/87(BA/ML),但6个单倍型序列在不同的进化支上;Hap1(KJ660084)、Hap4单独为一支,Hap2和Hap3处在一个进化支上,Hap5和Hap6形成一个进化支(图3)。

图2 大青叶蝉内共生菌Sulcia muelleri 16S rRNA 基因系列系统发育分析Fig.2 Molecular phylogenetic analysis of the Sulcia muelleri endosymbiont from Cicadella viridis based on the 16S ribosomal RNA gene sequence

图3 大青叶蝉内共生菌Sodalis sp. 16S rRNA 基因系列系统发育分析.Fig.3 Phylogenetic placement of Sodalis sp.endosymbiont of Cicadella viridis on the basis of the 16S ribosomal RNA gene sequence
3 结论与讨论
Buchner(1965)研究认为,每种叶蝉中至少有两种类型的内共生菌。本研究用细菌通用引物27F-1513R检测到大青叶蝉中有Sulciamuelleri、Sodalissp.和Rickettsiasp.(Lianetal. , 2016)3种内共生菌,和前人的结论一致。本研究与国外的大青叶蝉中检测到的内共生菌Sulciamuelleri,其16S r RNA基因序列之间的一致率非常高,达99.0%以上,而Sodalissp. 16S rRNA基因序列的一致率在96.1%-99.7%;内共生菌Sulciamuelleri16S r RNA基因序列之间遗传距离范围为0.001-0.004,Sodalissp. 16S rRNA基因序列的遗传距离最大为0.04,最小为0.002。由此说明,虽然大青叶蝉的地理分布差异很大,但Sulciamuelleri16S rRNA基因的变异不大,相对保守,这与McCutcheon等(2010)的研究结果(Sulciamuelleri的基因有非常高的保守性)是一致的;而Sodalissp. 16S rRNA基因的变异程度相对较大。Devereux等(1990)认为,16SrDNA序列一致率低于98%,属于不同的种,一致率低于95%,则属于不同的属; 王佳玉(1983)根据遗传距离,提出划分种的范围:0.05-0.30,由此推测,Sulciasp.所有单倍型属于同一个种,即Sulciamuelleri;本研究获得的Sodalissp.属于同一个属,基因序列之间发生了一定的变异,导致其变异的原因和机制有待研究。
本研究基于16S rRNA基因的进行了系统发育分析,发现大青叶蝉体内的Sulciamuelleri共生菌与叶蝉科昆虫体内的Sulciamuelleri共生菌最为接近,而与菱蜡蝉科昆虫体内的Sulciamuelleri共生菌距离较远,同时相同亚科昆虫的Sulciamuelleri聚在一起,与昆虫的分类系统一致,这一结果与Noda等(2012)分析构建的黑尾叶蝉Nephotettixcincticeps内共生菌Sulciamuelleri的系统发育树的结果相同。Sodalissp.为次生内共生菌,最早在采采蝇Glossinamorsitansmorsitans中发现(Dale and Maudlin, 1999),后来在象鼻虫(Tojuetal., 2013)等鞘翅目昆虫中也检测到了该内共生菌,目前在已研究的叶蝉科昆虫中,仅在大青叶蝉中检测到。
据研究,Sulciamuelleri是叶蝉、沫蝉、蜡蝉等半翅目刺吸式昆虫中普遍存在的初生内共生菌(Moranetal., 2005; Urban and Cryan, 2012; Kogaetal., 2013),是一种古老的内共生菌;Sodalissp.在采采蝇中报道为次生内共生菌,可分离纯培养(Dale and Maudlin, 1999)。Thao等(2000)认为初生内共生菌16S rRNA基因序列的(A+T)mol%含量高,而次生内共生菌16S rRNA基因序列富含(G+C)mol%,Moran等(1998)认为低的(G+C)mol%是一个反应寄生物与寄主在远古时代就结合的特征,而高的(G+C)mol%则反应其接近自由生活细菌的方面。大青叶蝉内共生菌Sulciamuelleri富含(A+T)mol%(55.5%),Sodalissp. 16S rRNA 基因序列(G+C)mol%含量高(54.0%),由此可见,本实验结果与前人的研究结果一致,Sulciamuelleri为大青叶蝉的初生内共生菌,低的(G+C)mol%含量,说明与宿主起源的一致性;Sodalissp.为次生内共生菌,但是Sodalissp.能否分离纯培养仍需进一步研究。
蝉亚目Cicadomorpha的昆虫具有双重初生内共生菌,即Sulciamuelleri具有伴随初生内共生菌(Urban and Cryan, 2012),如:Sulciamuelleri+Baumanniacicadellinicola(Takiyaetal., 2006; Nodaetal., 2012)、Sulciamuelleri+Zinderiainsecticola(McCutcheon and Moran, 2010)、Sulciamuelleri+Vidaniafulgoroideae(Urban and Cryan, 2012)、Sulciamuelleri+Nasuiadeltocephalinicola(Ishiietal., 2013)、Sulciamuelleri+Hodgkiniacicadicola(McCutcheonetal. , 2009)。大青叶蝉Sulciamuelleri内共生菌是否具有伴随初生内共生菌,本次对测序获得的所有序列进行了Blast检索与分析,未检测到,有待进一步研究。
本研究对Sulciamuelleri和Sodalissp. 16S rRNA基因序列做了详细分析,其结果为内共生菌对寄主的生长发育的影响以及大青叶蝉地理种群的遗传分化与共生菌的协同进化等进一步深入研究提供了基础资料。
References)
Baumann P. Biology of bacteriocyte-associated endosymbionts of plant sap-sucking insects [J].AnnualReviewofMicrobiology, 2005, 59: 155-189.
Buchner P. Endosymbiosis of Animals with Plant Microorganisms [M]. New York: Wiley, 1965.
Clark MA, Baumann L, Munson MA,etal. The eubacterial endosymbionts of whiteflies (Homoptera: Aleyrodoidea) constitute a lineage distinct from the endosymbionts of aphids and mealybugs [J].CurrentMicrobiology, 1992, 25 (2): 119-123.
Dale C, Maudlin I.Sodalisgen. nov. andSodalisglossinidiussp. nov., a microaerophilic secondary endosymbiont of the tsetse flyGlossinamorsitansmorsitans[J].InternationalJournalofSystematicandEvolutionaryMicrobiology, 1999, 49 (1): 267-275.
Dale C, Wang B, Moran N,etal. Loss of DNA recombinational repair enzymes in the initial stages of genome degeneration [J].MolecularBiologyandEvolution, 2003, 20 (8): 1188-1194.
Devereux R, He SH, Doyle CEA,etal. Diversity and origin ofDesulfovibriospecies: Phylogenetic definition of a family [J].JournalofBacteriology, 1990, 172 (7): 3609-3619.
Douglas AE. The microbial dimension in insect nutritional ecology [J].FunctionalEcology, 2009, 23 (1): 38-47.
Ishii Y, Matsuura Y, Kakizawa S,etal. Diversity of bacterial endosymbionts associated withMacrostelesleafhoppers vectoring phytopathogenic phytoplasmas [J].AppliedandEnvironmentalMicrobiology, 2013, 79 (16): 5013-5022.
Kang ZX, Lu H, Yi BR,etal. Study on the biological charactors ofTettigellaviridis[J].JournalofJilinAgriculturalUniversity, 1996, 18 (3): 19-26. [康芝仙, 路红, 伊伯仁, 等. 大青叶蝉生物学特性的研究 [J]. 吉林农业大学学报, 1996, 18 (3): 19-26]
Koga R, Bennett GM, Cryan JR,etal. Evolutionary replacement of obligate symbionts in an ancient and diverse insect lineage [J].EnvironmentalMicrobiology, 2013, 15 (7): 2073-2081.
Kontsedalov S, Zchori-Fein E, Chiel E,etal. The presence ofRickettsiais associated with increased susceptibility ofBemisiatabaci(Homoptera: Aleyrodidae) to insecticides [J].PestManagementScience, 2008, 64 (8): 789-792.
Lawson ET, Mousseau TA, Klaper R,etal.Rickettsiaassociated with male-killing in a buprestid beetle [J].Heredity, 2001, 86 (4): 497-505.
Lian QX, Liu JF, Yang MF,etal. Molecular identification and detection ofRickettsiaendosymbiont in the green leafhopper:Cicadellaviridis(Hemiptera: Cicadellidae) [J].JournalofAsia-PacificEntomology, 2016, 19: 659-664.
McCutcheon JP, McDonald BR, Moran NA. Convergent evolution of metabolic roles in bacterial co-symbionts of insects [J].ProceedingsoftheNationalAcademyofSciences, 2009, 106 (36): 15394-15399.
McCutcheon JP, Moran NA. Functional convergence in reduced genomes of bacterial symbionts spanning 200 My of evolution [J].GenomeBiologyandEvolution, 2010, 2: 708-718.
Michalik A, Jankowska W, Kot M,etal. Symbiosis in the green leafhopper,Cicadellaviridis(Hemiptera, Cicadellidae). Association instatunascendi?[J]ArthropodStructure&Development, 2014, 43 (6): 579-587.
Montllor CB, Maxmen A, Purcell AH. Facultative bacterial endosymbionts benefit pea aphidsAcyrthosiphonpisumunder heat stress [J].EcologicalEntomology, 2002, 27 (2): 189-195.
Moran NA, McCutcheon JP, Nakabachi A. Genomics and evolution of heritable bacterial symbionts [J].AnnualReviewofGenetics, 2008, 42: 165-190.
Moran NA, Telang A. Bacteriocyte-associated symbionts of insects [J].Bioscience, 1998, 48 (4): 295-304.
Moran NA, Tran P, Gerardo NM. Symbiosis and insect diversification: An ancient symbiont of sap-feeding insects from the bacterial phylum Bacteroidetes [J].AppliedandEnvironmentalMicrobiology, 2005, 71 (12): 8802-8810.
Negri I, Franchini A, Gonella E,etal. Unravelling theWolbachiaevolutionary role: The reprogramming of the host genomic imprinting [J].ProceedingsoftheRoyalSocietyofLondonB:BiologicalSciences, 2009, 276: 2485-2491.
Negri I, Franchini A, Mandrioli M,etal. The gonads ofZyginidiapullulamales feminized byWolbachiapipientis[J].BulletinofInsectology, 2008, 61 (1): 213-214.
Noda H, Watanabe K, Kawai S,etal. Bacteriome-associated endosymbionts of the green rice leafhopperNephotettixcincticeps(Hemiptera: Cicadellidae) [J].AppliedEntomologyandZoology, 2012, 47 (3): 217-225.
Takiya DM, Tran PL, Dietrich CH,etal. Co-cladogenesis spanning three phyla: leafhoppers (Insecta: Hemiptera: Cicadellidae) and their dual bacterial symbionts [J].MolecularEcology, 2006, 15 (13): 4175-4191.
Thao ML, Moran NA, Abbot P,etal. Cospceiation of psyllids and their primary Prokaryotic endosymbionts [J].AppliedandEnvironmentalMicrobiology, 2000, 66 (7): 2898-2905.
Toju H, Tanabe AS, Notsu Y,etal. Diversification of endosymbiosis: Replacements, co-speciation and promiscuity of bacteriocyte symbionts in weevils [J].TheISMEJournal, 2013, 7 (7): 1378-1390.
Urban JM, Cryan JR. Two ancient bacterial endosymbionts have coevolved with the planthoppers (Insecta: Hemiptera: Fulgoroidea) [J].BMCEvolutionaryBiology, 2012, 12 (1): 87-106.
von der Schulenburg JHG, Habig M, Sloggett JJ,etal. Incidence of male killingRickettsiaspp. (α-proteobacteria) in the ten-spot ladybird beetleAdaliadecempunctataL. (Coleoptera: Coccinellidae) [J].AppliedandEnvironmentalMicrobiology, 2001, 67 (1): 270-277.
Wang JY. Molecular Population Genetics and Evolution [M]. Beijing: China Agriculture Press, 1983:169-196. [王家玉(译).分子群体遗传学与进化论[M].北京: 中国农业出版社, 1983: 169-196]
Weisburg WG, Barns SM, Pelletier DA,etal. 16S ribosomal DNA amplification for phylogenetic study [J].JournalofBacteriology, 1991, 173 (2): 697-703.
Werren JH, Hurst GDD, Zheng W,etal.Rickettsialrelative associated with male killing in the ladybird beetle (Adaliadipunctata) [J].JournalofBacteriology, 1994, 176 (2): 388-394.
Werren, JH, Windsor D.Wolbachiainfection frequencies in insects: Evidence of a global equilibrium?[J].ProceedingsoftheRoyalSocietyofLondonB:BiologicalSciencesB, 2000, 267: 1277-1285.
Zhu HF, Deng GF. Lifespan of the green leafhopper:Cicadellaviridis(Hemiptera: Cicadellidae) [J].ActaEntomologicaSinica, 1950, 1 (1): 14-40. [朱弘复, 邓国藩. 青叶跳蝉的生活史[J]. 中国昆虫学报, 1950,1 (1): 14-40]
Detection of endosymbionts and the sequences analysis of 16S rRNA gene in the green leafhopper (Cicadellaviridis)
LIAN Qi-Xian1,2, LIU Jian-Feng1, YANG Mao-Fa1*, LUO Ting1, WU Guang1, ZHOU Xiao-Yun1
(1. Guizhou Provincial Key Laboratory for Agricultural Pest Management of the Mountainous Regions, Institute of Entomology,Guizhou University, Guiyang 550025, China; 2. Department of Chemical Biology, Xingyi Normal University for Nationalities, Xingyi 562400, Guizhou Province, China)
PCR was performed using universal primers (27F-1513R) for 16S rRNA gene of endosymbiotic bacteria fromCicadellaviridis, followed by agarose gel electrophoresis, cloning, sequencing, sequence alignment and analysis. The phylogenetic trees were generated by the Bayesian and maximum-likelihood methods. The results showed thatSulciasp. was classified as Flavobacteriaceae, Flavobacteriales, Flavobacteria Bacteroidetes. The 16S rRNA gene sequences ofSulciasp. got 13 new haplotypes and 14 variable sites, and identity rate and genetic distance of which were 99.40%-99.80% and 0.001-0.004, respectively. The phylogenetic tree revealed thatSulciasp. was associated withSulciamuelleridetected from the leafhoppers of Cicadellinae.Sulcissp. had a low degree of variation, and all haplotypes belonged toSulciamuellerispecies.Sodalissp. belonged to Enterobacteriaceae, Enterobacteriales, Gammaproteobacteria, Proteobacteria. The 16S rRNA gene sequences ofSodalissp. obtained 5 new haplotypes and 20 variable sites in this study, and identity rate and genetic distance of which were 96.10%-99.70% and 0.002-0.040, respectively. The phylogenetic tree showed thatSodalissp. was most closely related toSodalisglossinidiusdetected from the Tsetse flies.Sodalissp. has a high degree of variation, and all haplotypes belong one genus.
Cicadellaviridis; endosymbiont; 16S rRNA gene; haplotype; phylogeny
贵州省高层次创新型人才(“百”层次)项目(黔科合人才20164022);贵州省研究生卓越人才计划项目(黔教研合ZYRC字[2013]010号);中国烟草总公司贵州省公司科技项目(中烟黔科[2016]6号);贵州省农科院专项(黔农科院自主创新科研专项字[2014]009号);正安县绿色产业发展办公室委托项目。
练启仙,女,1978年生,贵州湄潭人,在读博士,副教授,研究方向为昆虫生态与害虫防治,E-mail: llx0713@163.com
*通讯作者Author for correspondence, E-mail: gdgdly@126.com
Received: 2016-12-08;接受日期Accepted: 2017-03-24
Q963;S433.39
A
1674-0858(2017)02-0342-09
练启仙,刘健锋,杨茂发,等.大青叶蝉内共生菌的检测及其16S rRNA基因序列分析[J].环境昆虫学报,2017,39(2):342-350.
