黄葵茎腐病病原菌的分离与鉴定
2017-06-05房云彬刘常宏
房云彬, 刘常宏
(南京大学生命科学学院, 南京 210093)
黄葵茎腐病病原菌的分离与鉴定
房云彬, 刘常宏*
(南京大学生命科学学院, 南京 210093)
针对江苏宜兴黄葵主产区发生的黄葵茎腐病,通过分离黄葵植株不同部位(根、茎、叶)以及根际土壤、根围土壤的微生物,经形态学观察,结合分子进化分析构建了黄葵不同生态位的微生物物种系统发育树,对其种类和分布进行了分析。结果表明,细菌优势类群为芽胞杆菌,而真菌无明显优势类群。同时,根据柯赫氏法则测定了分离得到的微生物菌株的致病性,确定了菌株F28可引起黄葵茎腐病,经ITS分子进化分析及形态学观察,将其鉴定为变紫青霉Penicilliumsanguineum。
黄葵; 茎腐病; 分离; 鉴定; 变紫青霉
黄葵AbelmoschusmanihotL. Medicus为锦葵科Malvaceae秋葵属Abelmoschus一年生草本植物,又被称为黄蜀葵花、蜀葵等,分布于我国中南、西南及河北、陕西、山东、浙江、江西、福建等地[1]。黄葵是我国传统中药材,其全草入药具有清热、凉血、解毒等功效,用黄葵治病疗伤在我国历代医籍中均有记载,民间应用十分普遍,其药用历史悠久,疗效明确[2]。
随着对其有效成分、药效等研究的深入,黄葵的潜在价值已愈来愈为人们所认识。黄葵集约化种植的发展,使得黄葵病害的防治问题日趋突出。然而,目前关于黄葵的研究多集中于对其种植方式、药理、活性成分及新药开发等,而鲜有关于黄葵病害的研究,对严重影响黄葵产量的茎腐病的研究尚无报道,其致病菌的分离与鉴定仍是空白。近年来,黄葵茎腐病频繁暴发,且病害一旦发生即迅速蔓延至整块栽培地,难以控制,严重影响黄葵产业的发展。
本研究采用常规组织分离法,从经表面消毒的茎腐病黄葵植株体内和病田土壤中分离可能的致病微生物,并根据柯赫氏法则,通过致病性试验确定黄葵茎腐病致病菌株,并采用rDNA ITS分子进化分析和形态学分析方法鉴定该病原菌株,为黄葵茎腐病的防治研究提供一定的参考。
1 材料与方法
1.1 黄葵茎腐病调查及样品的采集
黄葵病害调查和样品采集在江苏省宜兴市太华镇茂花村进行。分别于2013年7月22日和9月22日,在连作3年的大田中,选取3个区域,每个区域选取1个病株小区、1个健株小区(病情分级为0),每个小区选取3株黄葵,每株黄葵采集部位为根、茎、叶及株下土壤(病株采集部位为发病部位茎、茎叶交界处的叶、茎叶交界处的茎、根及株下土壤,健株采集部位为对应部位)。每个小区面积为1 m2,每个大田区域内小区间的距离为10 m。将采集到的样品带回实验室,对样品进行编号,详细描述发病症状并统计病情分级情况,病情分级由低到高分为0、1、2、3、4级[3],保存样本并记录数据。
1.2 样品微生物的分离与纯化
对采集自18株黄葵的所有植株样品采用常规组织分离法分离,土壤样品采用稀释涂布平板法进行分离。具体如下。
植株样品微生物的分离纯化:每株黄葵按1.1所述选取根、茎、叶3个部位,先用无菌水冲洗,放入75%的乙醇中消毒1 min后,再用无菌水冲洗3次,然后用无菌滤纸吸去多余的水分,剪成0.5 cm×0.5 cm的组织块,用无菌镊子将组织块放在培养基上培养。分离细菌使用LB琼脂,37℃培养24 h后挑取单菌落转接至新的培养皿获得纯培养物;分离真菌使用PDA(加入0.5 mg/mL硫酸链霉素抑制细菌生长),28℃,黑暗培养5 d后,从长出的菌落边缘挑取菌丝转接至新的培养皿,按此方法反复转接纯化,获得纯培养物。
土壤样品微生物分离和纯化:采用稀释涂布平板法进行细菌和真菌的分离。细菌采用LB平板进行分离,通过画线获得单菌落之后,进行液体LB的扩大培养,保种;分离真菌使用PDA(加入0.5 mg/mL硫酸链霉素抑制细菌生长),28℃,黑暗培养5 d后,从长出的菌落边缘挑取菌丝转接至新的培养皿,按此方法反复转接纯化,获得纯培养物。
真菌单孢株系的制备保存[4]:对分离到的易于产孢的真菌菌株,将其在PDA培养基上(25±1)℃黑暗条件下培养10 d,在无菌操作台中将菌丝刮下并放入无菌水中用玻璃棒搅拌,用无菌纱布过滤,制备孢子悬浮液,取制备好的孢子悬浮液用血球计数板测浓度,并用浓度梯度稀释法将孢子浓度稀释为5×102个/mL,分别取10、20、40 μL涂布于7 cm的培养皿中,(25±1)℃黑暗条件下培养,待刚长出菌落时将其转接至新的培养皿,得到单孢菌株,于4℃保存菌种备用。
1.3 微生物致病性的测定
细菌:将分离得到的细菌菌株于LB平板37℃培养24 h后,制成3×108cfu/mL菌悬液。用灭菌毛细管在叶片或茎部轻压组织造成伤口,将菌悬液用灭菌棉签蘸取,涂布于伤口处,外套塑料袋在28℃恒温条件下保湿培养。对照组为接种无菌水的叶片和茎,每处理3个重复。48 h后观察发病情况,描述症状并记录结果。
真菌:选取健康的黄葵植株,采用刺伤接种法。将单孢病原菌菌株活化后,挑少量菌丝转接到PDA平板上,置于28℃恒温箱黑暗培养5 d后,沿菌落边缘用直径为5 mm的打孔器制菌饼。将健康的黄葵用无菌水冲洗干净之后,用灭菌毛细管在叶片或茎部轻压组织造成伤口,将菌饼接在伤口处,外套塑料袋在30℃恒温条件下保湿培养。对照为接种与菌饼相同大小纯PDA培养基的叶片和茎,每处理3个重复。于不同时间持续观察发病情况,描述症状并记录结果。
选取接种后发病的组织,用前述相同方法再次对病原菌进行分离。获得再分离菌株后,观察其与原接种菌株在形态上是否吻合。
1.4 黄葵茎腐病病原菌鉴定
1.4.1 真菌的形态特征观察
真菌:形态学鉴定以菌株的菌落形态、产孢结构、孢子类型为主要鉴定依据。将菌株接种在PDA平板并在28℃恒温培养箱黑暗培养5 d。观察菌落颜色、形态及分生孢子,随机测量100个分生孢子长宽、纵横分隔、喙等形态特征的数据,记录其形态特征,并与文献描述的特征属性进行比对。
1.4.2 PCR扩增与分子鉴定
细菌:对分离得到的细菌培养物,挑取单菌落,37℃,150 r/min过夜培养,取3 mL菌液离心弃上清。采用BacteriaGen Kit提取细菌基因组DNA,用细菌16S rDNA通用引物(8f:5′-AGAGTTTGATCCTGGCTCAG-3′;1492r:5′-TACGGCTACCTTGTTACGACTT-3′)进行PCR并测序。
真菌:无菌操作刮取平板培养真菌新鲜菌丝100 mg,采用Ezup柱式真菌基因组DNA抽提试剂盒[生工生物工程(上海)股份有限公司,Cat:SK8259)]提取真菌基因组DNA,用真菌ITS通用引物(ITS1:5′-TCCGTAGGTGAACCTGCGC-3′; ITS4:5′-TCCTCCGCTTATTGATATGC-3′)进行PCR并测序。
分子鉴定:测序结果分别用http:∥blast.ncbi.nlm.nih.gov/Blast.cgi网站中的BLAST程序与GenBank中的核酸序列库进行同源性比较,并从GenBank数据库中下载相关菌株的16S rDNA 或ITS序列,用软件MEGA 6.0构建基于16S rDNA 和ITS序列的系统进化树。
2 结果与分析
2.1 病害调查和病情描述
黄葵于2013年4月10日播种,7月16日第1次发病,发病率小于10%,调查完毕拔除病株。9月22日第2次调查发病情况,发病区域内,单块病株区内的植株发病率为100%。发病时天气湿热。发病部位一般在新梢上,先从新梢向阳面距地面较近处出现一条暗灰色的似烫伤状的病斑,长约1.5~5.5 cm,宽0.6~1.2 cm。主要危害茎基部或地下主侧根,病部开始为暗褐色,以后绕茎基部扩展一周,使皮层腐烂,地上部叶片变黄、萎蔫,木质部变褐坏死,后期整株枯死,病部表面常有白色菌丝覆盖。
2.2 黄葵不同部位及病田土壤中微生物的分离
2.2.1 细菌的分离鉴定与分布
采用常规组织分离法及稀释涂布平板法从感病黄葵叶部、根茎部及其病田土壤中共分离得到13株细菌,16S rDNA分子鉴定和形态学分析结果见表1。其中,所有13株细菌都能从茎部分离得到,11株能从根中分离得到,3株能从叶中分离得到,而6株能从土壤中分离得到(表1)。
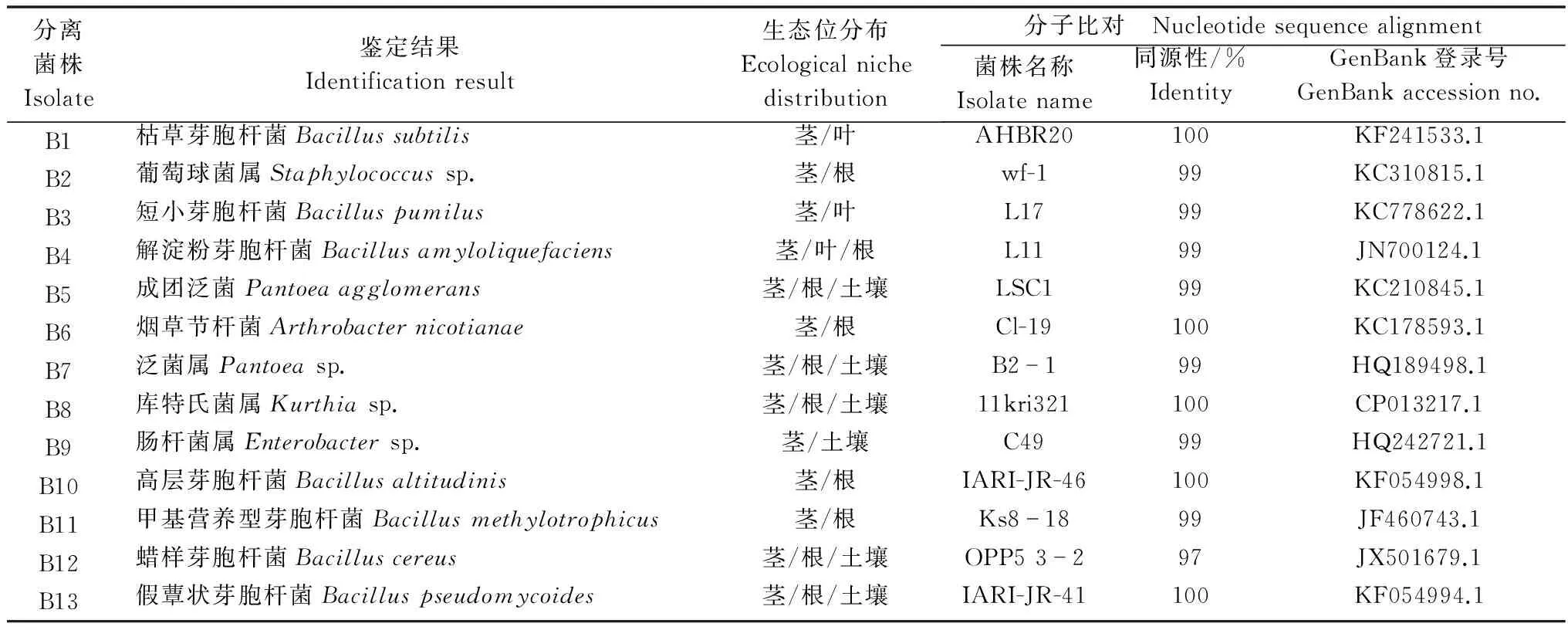
表1 细菌鉴定结果及其生态位分布
根据黄葵不同生态位分离细菌的16S rDNA序列同源性,构建细菌的系统发育树。可将分离到的13株细菌归为6个属:芽胞杆菌属7株(Bacillussp.),葡萄球菌属1株(Staphylococcussp.),泛菌属2株 (Pantoeasp.),节杆菌属1株 (Arthrobactersp.),库特氏菌属1株 (Kurthiasp.);肠杆菌属1株 (Enterobactersp.),结果表明,细菌在黄葵不同生态位的分类相对比较集中,以芽胞杆菌属为绝对优势种群(图1)。
2.2.2 真菌的分离鉴定与分布
从黄葵植株体内和病田土壤中共分离得到15株真菌,鉴定结果见表2。其中,茎中分离得到15株,根中分离得到10株,而土壤中分离得到9株。
基于ITS序列同源性构建的分离得到真菌菌株的系统发育树可以看出,真菌比细菌的分支更多更细,相对没有绝对优势的种属,但也主要分为两支,一支包括F21、F22、F23、F25、F26(97%),这一支主要是藻菌纲的霉菌,另一支则为半知菌类的霉菌和酵母(图2)。
2.3 茎腐病病原菌的确定
致病性测试结果表明:13株细菌均不能使黄葵感染茎腐病,说明细菌不是黄葵茎腐病的致病菌。而测试真菌中只有编号为F28的分离物能引起典型的茎腐病症状(三组重复均发病),且与田间发病症状相似,说明F28菌株即为黄葵茎腐病的致病菌。具体表现为:采用刺伤接种法接种健康植株并保湿培养2 d后,观察到菌块长出白色菌丝覆盖住伤口位置,5 d后出现黑褐色病斑,引起的症状与自然发病相同,对照组黄葵则未发病(图3)。而通过剪取接种点上下部茎秆,并按照常规组织分离法分离,获得分离物的纯培养在菌落特征、分生孢子梗、分生孢子形态大小与原始分离物纯培养一致,表明F28为黄葵茎腐病病原菌。
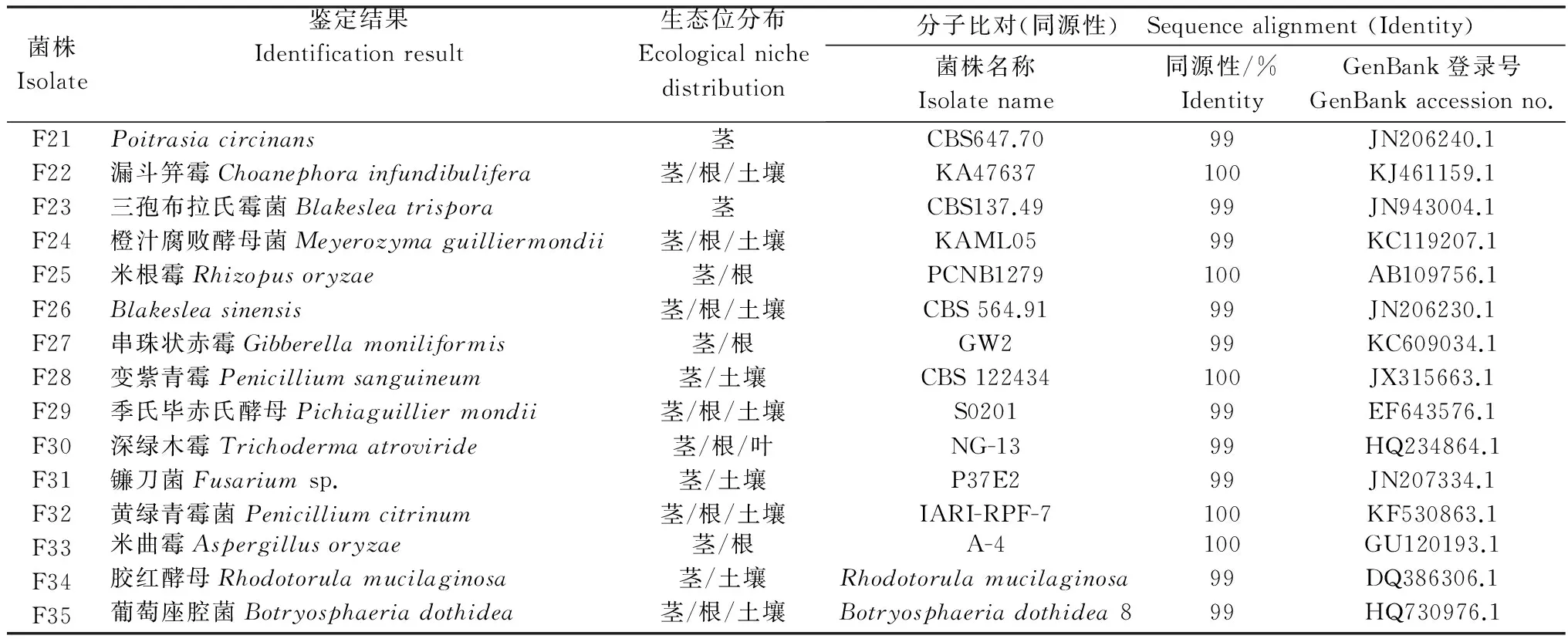
表2 真菌鉴定结果及其生态位分布

图1 细菌菌株16S rDNA序列的最大似然法系统发育树Fig.1 Maximum likelihood-based phylogenetic tree based on 16S rDNA sequences of the bacterial isolates

图2 真菌菌株ITS序列的最大似然法系统发育树Fig.2 Maximum likelihood-based phylogenetic tree based on ITS sequence of the fungal isolates
2.4 菌株F28的形态及分子鉴定
2.4.1 菌株F28的形态特征
在PDA培养基上,F28菌落呈绒状,表面为黄色,产孢时变为深绿色,背面红色或紫红色。在光学显微镜下,F28的菌丝、孢子透明,菌丝有横膈膜;扫描电镜下,可见分生孢子梗短而光滑,(100~150)μm×(2.5~3.5)μm;分生孢子梗顶端生帚状的间枝,分枝2次,间枝紧密,5~7个,(10~14)μm×(2.0~2.5)μm;以切离法生成分生孢子,分生孢子呈椭圆形至亚球形,表面极粗糙,大小(3.0~3.5)μm×(2.5~3.0)μm(图4)。
2.4.2 菌株F28的分子鉴定
菌株F28的ITS片段全长为594 bp。用NCBI的BLAST程序进行同源性比对发现,该菌株的ITS序列与一株Penicilliumsanguineum(JX315663.1)同源性达100%。根据GenBank中相关菌的ITS序列,利用MEGA6软件构建系统发育树(图5)。结合菌株F28的形态特征(帚状分枝孢子梗及分生孢子,而非Talaromyces属的子囊孢子)、ITS序列同源性及系统发育树的分析结果,根据真菌鉴定手册[5],将该株菌鉴定为变紫青霉Penicilliumsanguineum。

图3 黄葵茎腐病症状Fig.3 Stem rot of Abelmoschus manihot

图4 菌株F28的形态Fig.4 Morphology of isolate F28
3 讨论
通过对感病黄葵及根围土壤中微生物的分离,共得到13株细菌和15株真菌,采用形态学结合分子进化分析方法对其做了鉴定。在分离到的细菌和真菌当中,有一些是已经报道的植物致病菌,如细菌中的成团泛菌P.agglomerans是玉米细菌茎腐病和稻谷变色的致病菌[6]。真菌中串珠状赤霉G.moniliformis是导致玉米世界性病害的病原菌,深绿木霉T.aureoviride是某些食用菌的致病菌,葡萄座腔菌B.dothidea能导致树木溃疡病,也可引起蓝莓枯萎[7]。而镰刀菌Fusariumsp.可侵染粮食作物、经济作物、药用植物及观赏植物等100余种植物,引起植物的根腐、茎腐、茎基腐、花腐和穗腐等诸多病害[8-10]。此外,占分离到细菌总数60%以上的芽胞杆菌属Bacillussp.则是一类常见的具有生防作用的细菌,能在植物根际及植物体定殖,促进植物生长,引起植物系统诱导抗性,直接抑制植物病原菌生长等[11]。

图5 基于菌株F28 ITS序列及相关菌株的最大似然法系统发育树Fig.5 Maximum likelihood-based phylogenetic tree based on ITS sequence of isolate F28 and related isolates
植物茎腐病病原菌种类较多,一般主要为镰刀属Fusariumsp.和腐霉属Pythiumsp.等。本研究采用柯赫氏法则确定了黄葵茎腐病病原菌为变紫青霉P.sanguineum,而青霉属引起的植物茎腐病还不多见。此外,植物茎腐病的发病原因复杂[12],可由单一病原菌侵染所致,也可由多种病原菌复合侵染造成植物根系或茎基部腐烂。杨国慧等[13]报道了树莓茎腐病主要有两种:一种是真菌Didymellaapplanata引起的刺马钉状茎腐病,另一种是真菌Leptosphaeriaconiotltyrium引起的茎腐病,且这两种病害往往共同发生。然而,关于黄葵茎腐病病原菌分离鉴定的研究还未见报道。本研究结果显示,变紫青霉是引起黄葵茎腐病的主要致病菌,为黄葵茎腐病的防治研究提供了一定基础。
此外,胡江春等[14]通过对大豆茎腐病致病因子的研究表明,土壤紫青霉菌分泌的紫青霉菌毒素在大豆整个生育期内均能导致对大豆生长的毒害作用,包括影响种子发芽率和导致大豆共生固氮率下降等。本研究证明,F28菌株会导致黄葵茎腐病的发生,其致病因子及具体发病机制还有待进一步研究。
[1] 梁文波, 覃柳燕, 严方明.中药材黄蜀葵的研究现状及存在问题[J].农业研究与应用, 2012(5): 48-51.
[2] 史刚荣.黄蜀葵的研究进展[J].中国野生植物资源,2003,22(6):5-6.
[3] 晋齐鸣, 卢宗志, 潘顺法, 等. 玉米茎腐病病原对玉米苗期致病性研究[J]. 玉米科学,1994, 15(2): 103-108.
[4] 黄福新, 林明生, 黄思良. 25%培福朗对香蕉、芒果炭疽病菌的室内毒力测定[J]. 广西植保, 1991 (1):20-21.
[5] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[6] Wang X. First report of maize bacterial stalk dry rot in China[J]. Phytopathology, 2008, 98(6): 166.
[7] 吴小芹, 何月秋, 刘忠华. 葡萄座腔菌属所致树木溃疡病发生与研究进展[J]. 南京林业大学学报, 2001, 25(1): 61-66.
[8] 孙正祥,王丰,黄玲,等.西瓜枯萎病生防菌XG-1的筛选、鉴定及其抑菌作用[J].江西农业大学学报,2013,35(2):324-328.
[9] 陈健平, 梁月光, 张晚风. 国兰镰刀菌枯萎病的发生及防治[J]. 中国花卉园艺, 2007(18): 41-42.
[10]林兴祖, 陈腾. 海南香蕉镰刀菌枯萎病综合防治措施[J]. 现代农业科技, 2007(3): 46-48.
[11]彭研, 陈相艳, 裘纪莹, 等. 生防芽孢杆菌的研究进展[J]. 山东农业科学, 2013, 45(7): 138-140.
[12]陈润玲, 檀尊社, 赵保献, 等. 玉米茎腐病研究进展[J]. 西北农业学报, 2005, 14(6): 157-160.
[13]杨国慧. 树莓茎腐病的发生及防治[J]. 黑龙江农业科学, 2010(9): 188-189.
[14]胡江春. 重茬大豆土壤紫青霉菌毒素危害及其防治的生物技术研究[D]. 沈阳:中国科学院沈阳应用生态研究所, 1998.
(责任编辑:田 喆)
Isolation and identification of the pathogen ofAbelmoschusmanihotstem rot
Fang Yunbin, Liu Changhong
(School of Life Sciences, Nanjing University, Nanjing 210093, China)
Root rot is an important disease ofAbelmoschusmanihot. By phylogenetic and morphological analysis of the microorganisms isolated from roots, stems, leaves and soil, we investigated the species and distribution of the microorganisms in different parts ofA.manihotplant and rhizosphere soil from the mainA.manihot-producing area in Yixing, Jiangsu Province. Meanwhile, we tested the pathogenicity of all the microorganisms based on Koch’s postulates and determined that strain F28 could cause stem rot ofA.manihot. The strain F28 was identified asPenicilliumsanguineumaccording to its morphology and phylogenetic analysis of ITS.
Abelmoshcusmanihot; stem rot; isolation; pathogen identification;Penicilliumsanguineum
2016-06-08
2016-08-08
国家自然科学基金(31272081,31471810)
S 435.672
A
10.3969/j.issn.0529-1542.2017.03.017
* 通信作者 E-mail:chliu@nju.edu.cn
