从日本进境罗汉松中截获移去剑线虫
2017-06-05齐小峰谢泳桂李一农李芳荣
龙 海, 齐小峰, 谢泳桂, 李一农, 李芳荣*
(1. 深圳出入境检验检疫局, 深圳 518001; 2. 深圳市检验检疫科学研究院深圳市外来有害生物检测技术研发重点实验室, 深圳 518045)
有害生物动态
InformationofPests
从日本进境罗汉松中截获移去剑线虫
龙 海1,2, 齐小峰1, 谢泳桂1, 李一农1, 李芳荣1*
(1. 深圳出入境检验检疫局, 深圳 518001; 2. 深圳市检验检疫科学研究院深圳市外来有害生物检测技术研发重点实验室, 深圳 518045)
2016年11月,深圳口岸从日本进境罗汉松中截获一种剑线虫。采用贝曼漏斗法分离线虫,结合形态学、28S rRNA基因序列测定以及构建系统发育树,对分离的线虫进行鉴定。该线虫的28S rRNA基因序列和GenBank 数据库中的移去剑线虫Xiphinemaelongatum(登录号分别为EF140790、KF430803、KF430802和KF430801)的序列同源性高达99%;其形态特征和测计值与X.elongatum最为吻合;系统发育树表明该线虫和X.elongatum聚为一组。通过以上结果判定截获的线虫为移去剑线虫。剑线虫是一种重要的植物外寄生线虫,我国口岸曾经多次截获剑线虫,剑线虫入侵我国的风险较高。本文首次对日本罗汉松中的移去剑线虫进行了详细的描述,提供了该线虫新的地理分布信息。
移去剑线虫; 罗汉松; 形态学; 分子鉴定
剑线虫属Xiphinema线虫是一类重要的外寄生线虫,它们在植物根部取食,严重破坏根组织,影响根系生长。除取食危害以外,一些剑线虫作为植物病毒的传播介体对农林业生产造成严重的经济损失[1]。已报道的剑线虫属线虫有296种[2],其中剑线虫传毒种被列入我国检疫性有害生物名录。随着我国进口苗木种类和数量越来越多,剑线虫传入我国的风险日益加大。我国口岸曾多次从进境种苗中截获剑线虫,深圳口岸近年来从日本进境苗木中就曾截获过短颈剑线虫X.brevicollum、湖南剑线虫X.hunaniense、标明剑线虫X.insigne、美洲剑线虫X.americanum、太平洋剑线虫X.radicicola等。剑线虫入侵我国的风险可见一斑。
2016年11月深圳口岸从日本进境的罗汉松样品中分离到一种剑线虫。通过对其进行形态特征观察、测量,28S rRNA基因序列测定以及系统发育树分析,鉴定为移去剑线虫X.elongatum。本文对上述过程进行了详细描述,为口岸检疫提供参考。
1 材料与方法
1.1 样品采集
口岸现场取罗汉松的根和根际土壤约500 g,放入封口袋中,做好标签,送至实验室。
1.2 线虫分离
采用贝曼漏斗法分离线虫[3]。取约250 g样品,用双层纱布包好,置于漏斗中,25℃静置24~48 h。用凹面皿接取线虫悬浮液10 mL,在体式显微镜下镜检。
1.3 形态学鉴定
用挑针挑取线虫制成临时玻片[4],在Zeiss Zmager MI光学显微镜下对线虫的整体形态和内部结构进行观察。用显微镜自带的Zeiss AxioCam HRC数码相机对线虫进行拍照,并用Axio Vision 4.8.2自带的测量软件和de Man公式法[5]对线虫进行测计。
1.4 分子生物学检测
1.4.1 单条线虫DNA提取
参照Long等[6]的方法。取12 μL裂解缓冲液(1×ExTaqBuffer(Mg2+free),100 μg/mL蛋白酶K,2 mmol/L MgCl2)到洁净的载玻片上,将线虫挑到裂解缓冲液中并碾碎,把上述线虫悬液转移到PCR薄壁管中,-80℃放置30 min,再转移到PCR仪上,60℃加热1 h,95℃加热15 min,经上述步骤处理的线虫粗提液用于PCR扩增。
1.4.2 PCR扩增
28S rRNA基因序列扩增采用的引物对为:D2A(5′-ACAAGTACCGTGAGGGAAAGTTG-3′)和D3Br(5′-TCGGAAGGAACCAGCTACTA-3′)[7]。PCR反应体系为50 μL,包括10×ExTaqBuffer(Mg2+free)4 μL,25 mmol/L MgCl23.2 μL,2.5 mmol/L dNTP Mixture 4 μL,5 U/μLExTaq0.2 μL,10 μmol/L D2A/D3Br引物各4 μL,线虫粗提液10 μL,加灭菌水定容至50 μL。PCR反应程序参照de Ley 等[7]的方法,94 ℃预变性4 min;94℃ 30 s,55℃ 40 s,72℃ 1 min,40个循环;最后72℃保温10 min,使反应产物充分延伸。
1.4.3 PCR产物的检测、测序和序列分析
取5 μL PCR产物在1.5%的琼脂糖凝胶中电泳20 min,在凝胶成像系统下观察并拍照,如果出现目标条带,将余下的PCR产物送华大基因有限公司测序,用BioEdit 7.0[8]对序列进行编辑,在GenBank 数据库(www.ncbi.nlm.nih.gov)中进行BLAST分析,选取同源性较高的剑线虫的28S rRNA基因序列,用MEGA 4.0[9]构建系统发育树。
2 结果与分析
2.1 形态学鉴定
在光学显微镜下观察分离到的线虫形态(图1)。雌虫腹面弯曲,热杀死后呈“C”形,体环不明显。角质膜有两层,内层角质膜在尾端明显增厚。唇区微缢缩。口针和诱导环结构典型。食道球长圆柱状,长86 ~105 μm,宽21 ~25 μm。阴门位于虫体前约1/3处,双生殖腺,均发育完全,卵巢回折。尾圆锥形,腹面弯曲,长度约为肛门处体宽的2.5~3.5倍,每侧3个尾孔。雄虫未发现。
2.2 形态测量值
从日本进境罗汉松中分离的剑线虫,形态特征和测量值(表1)与文献报道的X.elongatum最为接近,故初步将其鉴定为X.elongatum。
2.3 分子生物学数据分析
经PCR扩增、测序(GenBank登录号KY348743),将序列与NCBI数据库中的序列进行BLAST分析,结果表明,剑线虫日本群体的28S rRNA基因序列与GenBank登录号分别为EF140790、KF430803、KF430802和KF430801的X.elongatum序列相似度高达99%。基于28S rRNA基因序列构建的系统发育树(图2)也显示该线虫与X.elongatum位于一个进化枝上,亲缘关系最近。综合上述形态学和分子生物学数据分析,判定截获的日本剑线虫为移去剑线虫。

图1 日本罗汉松中移去剑线虫的光学显微图片Fig.1 Photomicrographs of Xiphinema elongatum intercepted in Podocarpus macrophyllus from Japan

种群Population数量Number体长/mmLabcc'V日本Japan232.23±0.2(2.0~2.6)53.0±4.4(43.0~58.5)6.8±1.0(5.6~9.4)34.4±3.5(30.1~45.4)3.0±0.3(2.5~3.5)38.9±2.0(34.4~43.5)刚果[10](全模标本)Zaire(holotype)12.089496.1352.540埃塞俄比亚[11]Ethiopia42.38±0.71(2.33~2.43)69±7.0(64~74)7.2±0.5(6.9~7.6)33.2±5.8(29.1~37.3)2.7±0.1(2.6~2.8)41.3±0.3(41~41.7)泰国[12]Thailand52.30(2.15~2.45)51.3(47.9~55.7)—37.4(36.9~39.6)2.6(2.5~2.8)38.4(35.1~40.5)
续表1 Table 1(Continued)
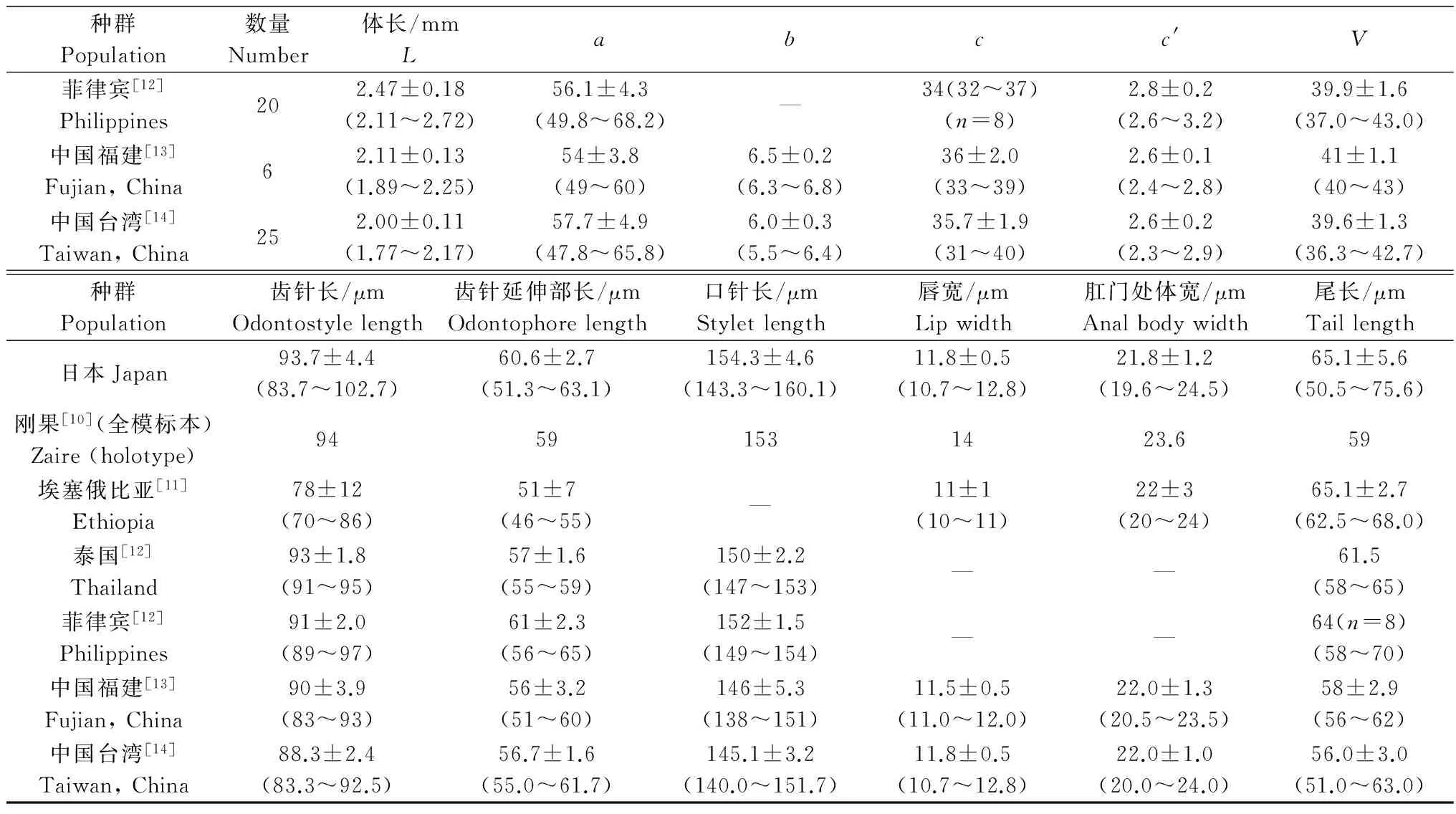
种群Population数量Number体长/mmLabcc'V菲律宾[12]Philippines202.47±0.18(2.11~2.72)56.1±4.3(49.8~68.2)—34(32~37)(n=8)2.8±0.2(2.6~3.2)39.9±1.6(37.0~43.0)中国福建[13]Fujian,China62.11±0.13(1.89~2.25)54±3.8(49~60)6.5±0.2(6.3~6.8)36±2.0(33~39)2.6±0.1(2.4~2.8)41±1.1(40~43)中国台湾[14]Taiwan,China252.00±0.11(1.77~2.17)57.7±4.9(47.8~65.8)6.0±0.3(5.5~6.4)35.7±1.9(31~40)2.6±0.2(2.3~2.9)39.6±1.3(36.3~42.7)种群Population齿针长/μmOdontostylelength齿针延伸部长/μmOdontophorelength口针长/μmStyletlength唇宽/μmLipwidth肛门处体宽/μmAnalbodywidth尾长/μmTaillength日本Japan93.7±4.4(83.7~102.7)60.6±2.7(51.3~63.1)154.3±4.6(143.3~160.1)11.8±0.5(10.7~12.8)21.8±1.2(19.6~24.5)65.1±5.6(50.5~75.6)刚果[10](全模标本)Zaire(holotype)94591531423.659埃塞俄比亚[11]Ethiopia78±12(70~86)51±7(46~55)—11±1(10~11)22±3(20~24)65.1±2.7(62.5~68.0)泰国[12]Thailand93±1.8(91~95)57±1.6(55~59)150±2.2(147~153)——61.5(58~65)菲律宾[12]Philippines91±2.0(89~97)61±2.3(56~65)152±1.5(149~154)——64(n=8)(58~70)中国福建[13]Fujian,China90±3.9(83~93)56±3.2(51~60)146±5.3(138~151)11.5±0.5(11.0~12.0)22.0±1.3(20.5~23.5)58±2.9(56~62)中国台湾[14]Taiwan,China88.3±2.4(83.3~92.5)56.7±1.6(55.0~61.7)145.1±3.2(140.0~151.7)11.8±0.5(10.7~12.8)22.0±1.0(20.0~24.0)56.0±3.0(51.0~63.0)
1)n=测计样本数;L=体长;a=体长/最大体宽;b=体长/体前端至食道与肠连接处的距离;c=体长/尾长;c′=尾长/肛门处体宽;V=体前端至阴门的距离×100/体长。“—”表示无数据。n=Number of measured samples;L=Body length;a=Body length/maximum body width;b=Body length/the distance from body front to esophagus and intestines junction;c=Body length/tail length;c′=Tail length/anal body width;V=The distance of body front to vulva×100/body length.‘—’ means no data.

图2 基于28S rRNA基因序列构建的部分剑线虫属种群系统发育树Fig.2 Phylogenetic tree based upon sequences of D2-D3 expansion region of the 28S rRNA gene of some Xiphinema spp.
3 讨论
移去剑线虫日本种群的形态特征和文献描述的形态特征[10-14]相符。日本种群的形态测量值和其他种群比较结果显示,和全模标本相比,c值、V值、齿针长、齿针延伸部长以及口针长非常吻合,其他测量值虽然存在一定差异,但是全模标本的各项单一测量值都在日本种群的范围内(表1)。日本种群的各测量值和菲律宾种群的一致性较高(表1)。和埃塞俄比亚种群相比,c值、c′值、V值、唇宽、肛门处体宽和尾长比较接近,其他各测量值存在差异,除了a值,埃塞俄比亚种群的测量值都在日本种群的范围之内,而埃塞俄比亚种群的a值大于其他种群,但与菲律宾和中国台湾种群没有重叠(表1)。日本种群的各测量值和泰国、中国的种群相比,虽然存在差异,但是测量范围都有重叠(表1)。Luc等[15]根据尾长和口针长度,将不同地理来源的移去剑线虫种群分成两类,第一类尾长48~54 μm,口针等于或大于164 μm,这一类源自西非;第二类尾长59~67 μm,口针等于或小于161 μm,此类主要来自东非、东南亚和太平洋地区。依据此二分法,日本群体属于第二类。
移去剑线虫起源于非洲刚果[10]。其后在夏威夷[16]、南非[17]、南美的苏里南[18]和巴西[19]等地均有报道,我国仅有零星分布[13-14]。不同地理来源的移去剑线虫在形态特征和测量值之间都存在差异,需要辅以分子生物学进行鉴定。本文通过28S rRNA基因序列扩增,测序,BLAST比对以及系统发育树分析,最终判定日本罗汉松中截获的剑线虫为移去剑线虫。本文首次对移去剑线虫的日本群体进行了详细描述。近年来,我国进口的苗木量不断攀升,危险性线虫入侵的风险也与日俱增,仅深圳口岸从日本和泰国进境的苗木中截获的线虫种类就有剑线虫、长针线虫、毛刺线虫、拟毛刺线虫、根结线虫、短体线虫、类短体线虫和隐皮孢囊线虫等。口岸检疫部门需加强对进口苗木的检疫监管,防止危险性线虫随苗木入侵我国,保护我国的农林业生产。
[1] Taylor C E, Brown D J F.Nematode vectors of plant viruses [M]. CAB International, Wallingford, 1997: 286.
[2] Coomans A, Huys R, Heyns J, et al. Character analysis phylogeny and biogeography of the genusXiphinemaCobb 1913 (Nematoda, Longidoridae) [M]. Royal Museum for Central Africa, 2001: 237.
[3] 谢辉. 植物线虫分类学[M]. 合肥: 安徽科学技术出版社, 2000.
[4] 刘维志. 植物线虫志[M]. 北京: 中国农业出版社, 2004.
[5] de Man J G. Di frei in der reinen Erde und im sussen Wasser lebenden Nematoden der Niederlandischen Fauna [M]. Brill, Leiden, 1884: 206.
[6] Long Hai, Liu Hao, Xu Jianhua. Development of a PCR diagnostic for the root-knot nematodeMeloidogyneenterolobii[J]. 植物病理学报, 2006, 36(2): 109-115.
[7] de Ley P, Felix M A, Frisse L M, et al. Molecular and morphological characterisation of two reproductively isolated species with mirror-image anatomy (Nematoda: Cephalobidae) [J]. Nematology, 1999, 1(6): 591-612.
[8] Hall T A. BioEdit: A user-friendly biological sequence alignment editor and analysis program for windows 95/98NT [J]. Nucleic Acids Symposium Series, 1999(41): 95-98.
[9] Tamura K, Dudley J, Nei Mand Kumar S. MEGA 4: Molecular evolutionary genetics analysis (MEGA) software version 4.0 [J]. Molecular Biology and Evolution, 2007, 24(8): 1596-1599.
[10]Tarjan A C, Luc M. Observations onXiphinemainsigneLoos, 1949 andXiphinemaelongatumSchuurrmans Stekhoven & Teunissen, 1938 (Nematoda: Dorylaimidae) [J]. Nematologica, 1963, 9(2): 163-172.
[11]Getaneh G, Bert W, Decraemer W. First report, morphological and molecular characterization ofXiphinemaelongatumandX.pachtaicum(Nematoda, Longidoridae) from Ethiopia [J]. Zookeys, 2015(489): 1-13.
[12]Alkemada J R M, Loof P A A. Observations on the ontogeny of some species ofXiphinema(Nematoda: Dorylaimida) [J]. Mededelingen van de Faculteit Landbouwwetenschappen / Rijksuniversiteit Gent, 1989, 54: 1177-1186.
[13]徐建华, 付鹏, 程瑚瑞. 中国七省(区)剑属线虫的分类学研究[J]. 南京农业大学学报, 1995, 18(1): 37-42.
[14]陈殿仪, 倪蕙芳, 颜志恒, 等. 台湾地区剑线虫Xiphinemaelongatum之变异性[J]. 植物病理学会刊, 2004, 13(1): 45-60.
[15]Luc M, Southey J F.Study of biometrical variability inXiphinemainsigneLoos, 1949, andX.elongatumSchuurmans Stekhoven & Teunissen 1938; description ofX.savanicolan. sp. (Nematoda: Longidoridae) and comments on thelytokous species [J]. Revue de Nématologie, 1980, 3(2): 243-269.
[16]Cohn E, Sher S A.A contribution to the taxonomy of the genusXiphinemaCobb,1913 [J].Journal of Nematology,1972,4(1):36-65.
[17]Heyns J. The genusXiphinemain South Africa Ⅱ.X.elongatum-group (Nematoda: Dorylaimida) [J]. Phytophylactica, 1974, 6(4): 249-260.
[18]Loof P A A, Maas P W T. The genusXiphinema(Dorylaimida) in Surinam [J]. Nematologica, 1972, 18(1): 92-119.
[19]Ferraz L C C B. Observations on someXiphinemaspecies found in Brazil (Nematoda: Dorylaimoidea) [J]. Nematologia Mediterranea, 1980, 8(2): 141-151.
(责任编辑:杨明丽)
Xiphinemaelongatumintercepted inPodocarpusmacrophyllusfrom Japan
Long Hai1,2, Qi Xiaofeng1, Xie Yonggui1, Li Yinong1, Li Fangrong1
(1. Shenzhen Entry-Exit Inspection and Quarantine Bureau, Shenzhen 518001, China;2. Shenzhen Key Laboratory of Inspection Research & Development of Alien Pests,Shenzhen Academy of Inspection and Quarantine, Shenzhen 518045, China)
In November 2016, oneXiphinemapopulation was detected in the roots ofPodocarpusmacrophyllusimported from Japan in Shenzhen port, China. The nematode was extracted using modified Baermann method and identified based on morphology, morphometrics, 28S rRNA gene sequencing and phylogenetic analysis. The 28S rRNA gene sequence of the nematode matched well (99% similarity) with that ofXiphinemaelongatumdeposited in GenBank (GenBank accession number EF140790, KF430803, KF430802 and KF430801). The morphological characteristics and morphometrics of the nematode were highly consistent with those ofX.elongatum. The phylogenetic analysis showed that the nematode andX.elongatumwere clustered into one group. It is concluded that the intercepted nematode isX.elongatum.Xiphinemaspp. are important ecto-parasitic nematodes, which have been repeatedly intercepted by Chinese ports, and the invasion risk of these nematodes to China is high. This paper first gives a detailed description ofX.elongatuminP.macrophyllusfrom Japan and provides new geographical distribution information of this nematode.
Xiphinemaelongatum;Podocarpusmacrophyllus; morphology; molecular identification
2017-02-09
2017-03-15
S 432.45
B
10.3969/j.issn.0529-1542.2017.03.040
* 通信作者 E-mail: lifangr@126.com
