进境高粱种子中葡萄茎枯病菌的检疫鉴定
2017-06-05许萍萍吴翠萍
张 宇, 许萍萍, 吴 晶, 杨 静, 李 彬, 吴翠萍*
(1. 江苏出入境检验检疫局, 南京 210001; 2. 江苏省南京出入境检验检疫局, 南京 210001)
进境高粱种子中葡萄茎枯病菌的检疫鉴定
张 宇1, 许萍萍2, 吴 晶2, 杨 静1, 李 彬1, 吴翠萍1*
(1. 江苏出入境检验检疫局, 南京 210001; 2. 江苏省南京出入境检验检疫局, 南京 210001)
从进境的美国高粱样品中分离到一株与葡萄茎枯病菌Didymellaglomerata相似的菌株4358-17。其菌落形态和显微特征均与葡萄茎枯病菌一致。多个位点(LSU、ITS、TUB2、ACT)序列比对显示菌株4358-17与GenBank登录号为KT389718、FJ427004、FJ427115、FJ426896的葡萄茎枯病菌相似性均达到100%。系统发育分析结果表明菌株4358-17与葡萄茎枯病菌株聚集在同一个分支上,支持率为99%。菌株4358-17接种高粱和小麦叶片,4 d后接种部位出现明显症状。根据上述试验结果,将进境美国高粱样品中分离的菌株4358-17鉴定为葡萄茎枯病菌。
葡萄茎枯病菌; 形态特征; 系统发育分析; 致病性测试
葡萄茎枯病菌Didymellaglomerata(Corda) Chen & Cai具有极强的生态适应性,能够在死亡植株、空气、海水和土壤等多种生境下存活。该菌曾经被认为是一种弱致病真菌[1],但近年来大量的研究发现它可导致严重的病害,给农作物和水果等造成巨大的经济损失。Milatovic[2]报道了葡萄茎枯病菌引起克罗地亚葡萄减产80%。Lahoz等[3]报道在2005年和2006年的秋季,由于葡萄茎枯病菌侵染,意大利南部数百万株的茴香严重倒伏,根部坏死,部分湿度较高的地区侵染率甚至达到100%。由于该病菌可以通过种子进行传播,因此是一种潜在的危险性病原菌[4-5]。该菌已被列入我国进境植物检疫性有害生物名录,是一种检疫性植物病原真菌。
葡萄茎枯病菌的寄主范围很广,目前为止已经从100多个属的植物上分离到了该菌,它通常出现于种子的表面[6]。葡萄茎枯病菌可引起葡萄枯萎病[7]、小麦和橡皮树叶斑病[8-9]、胡荽茎腐病[10]、茴香冠腐病[11]、花生芽枯病[12]、桃树溃疡病[13]等多种病害。该菌广泛分布于意大利、希腊、瑞典、印度、澳大利亚、以色列、秘鲁、匈牙利、美国等国家。目前为止在我国仅在五味子和牡丹上有两例报道[14-15]。
2016年3月,江苏出入境检验检疫局从一批美国进境的高粱样品中分离获得了一株疑似葡萄茎枯病菌株4358-17,并对其进行了形态观察、序列比对、多基因系统发育分析和致病性测试。
1 材料与方法
1.1 材料、试剂和仪器
材料:供试高粱样品为美国进境的高粱种子,进境时间为2016年3月19日,试验样品编号为201604358。致病性测定所用高粱、小麦、大麦为实验室保存的进境样品。
试剂:植物总DNA提取试剂盒(Tiangen),PCR反应试剂(TaKaRa),琼脂糖,PDA培养基,次氯酸钠消毒液。
仪器:低温破碎仪,振荡型恒温金属浴,离心机,体视显微镜,全自动万能显微镜,高清数字成像设备,生物安全柜,恒温培养箱,PCR仪,电泳仪,凝胶成像系统。
1.2 病变样品的选取
将口岸送检的原始高粱种子过铝制样品分样套筛,套筛的网孔直径从上到下依次是3.5、3.0、2.0、1.2 mm。分别收集2.0 mm孔径和1.2 mm孔径筛下物,置于直径9 cm的洁净培养皿中,在体视解剖镜下挑取皱缩、变色、表面有子实体的种子及碎屑。选取150~200粒(块)为一份样品,共选取了3份样品。
1.3 病原菌的分离与纯化
将样品用1%的次氯酸钠溶液消毒3 min,用无菌水漂洗3次,用无菌吸水纸吸干种子及碎屑表面的水分,置于加有抗生素的PDA平板上(青霉素和硫酸链霉素的添加浓度均为100 μg/mL)。每皿放置5块,于25℃下黑暗培养。观察病菌菌落生长情况,将长出的菌落及时转移到新的PDA平板上纯化培养,从形态不同的菌落边缘挑取菌丝块转移到新鲜PDA培养基上。纯化2~3次以保证所得菌落为纯培养。
1.4 病原菌形态鉴定
观察记录PDA平板上的病菌菌落形态、颜色变化和气生菌丝的疏密程度。测量菌落生长速度,并用高清数字成像设备拍摄菌落形态特征。在立体显微镜和显微镜下观察分生孢子器、分生孢子和厚垣孢子形态特征,进行拍照,并使用AxioVision Rel. 4.5软件记录其形态并测量大小,根据病菌的形态特征进行鉴定。
1.5 序列分析
1.5.1 菌丝DNA提取[16]
将获得的菌株接种于PDA平板上培养7 d,用解剖刀刮取适量菌丝于2 mL Eppendorf离心管内,加入40 μL 0.5 mol/L NaOH以及一颗直径3 mm的钢珠,在破碎仪上以30次/s研磨5 min,取下后12 000 r/min离心10 min,取5 μL上清液以100 mmol/L Tris (pH 8.0)进行10倍稀释。所提取的病菌DNA用于PCR扩增。
1.5.2 序列扩增
反应体系:DNA 1 μL,10×buffer 2.5 μL,dNTP Mix 2.5 μL,上、下游引物(10 μmol/L)各1 μL,rTaq0.2 μL,双蒸水补足25 μL。反应条件:94℃预变性3 min;94℃变性30 s,52℃复性30 s,72℃延伸1 min,35个循环;72℃延伸7 min后保存于4℃。
1) ITS: Internal transcribed spacer regions 1 & 2 including 5.8S rDNA gene; LSU: 28S large subunit of the nuclear rRNA gene; ACT: actin; TUB2:β-tubulin.
1.5.3 序列分析
将提取的菌株DNA的PCR产物进行双向序列测定,并将得到的序列在GenBank中进行BLAST比对。对获得的序列采用RAxML v. 7.2.6软件进行多基因系统发育分析[21]。
1.6 致病性测试
采用针刺法接种。取无病条件下在营养钵中栽培10 d,长出3~4片真叶的高粱、小麦和大麦幼苗作为接种材料。用解剖刀从培养2周的病菌培养基上刮取分生孢子,用无菌水配制成5×107cfu/mL菌悬液,用无菌接种针轻刺真叶形成伤口,将一小块脱脂棉蘸取菌悬液覆盖于伤口处,同时用脱脂棉蘸取无菌水覆盖于另一株植株的伤口处作为对照。接种后的幼苗用塑料薄膜保湿48 h后取出置于室温下培养,并观察记录发病情况。对发病幼苗的病健交界组织进行病菌的再分离。
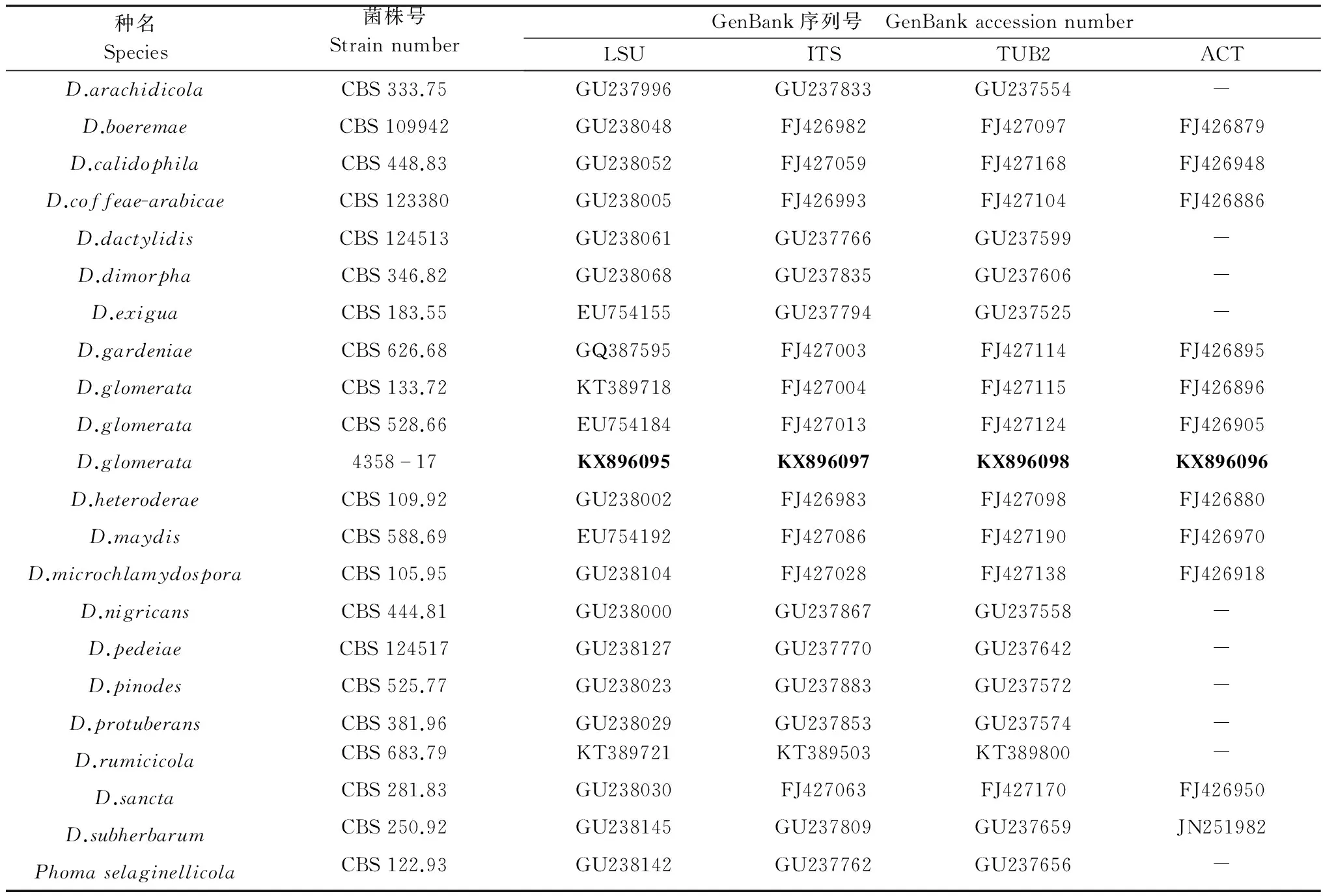
表2 本研究所用的菌株和序列号1)
1) 新测菌株序列用粗体表示。 Newly generated sequences are indicated in bold. CBS: Central Bureau of fungal cultures, Utrecht, The Netherlands.
2 结果与分析
2.1 病原菌形态特征
在25℃培养条件下病变种子(图1a)在PDA上所形成的疑似葡萄茎枯病菌菌落呈典型的圆形,气生菌丝极其稀疏,形成大量黑色分生孢子器,易破裂,从中溢出大量分生孢子而使菌落呈玫瑰红色或淡粉色,后期随着暗色厚垣孢子的产生,菌落颜色逐渐变为橄榄绿色。菌株转接以后仍呈规则圆形,产生大量气生菌丝,呈致密的羊毛状,也产生了极为丰富的分生孢子器及分生孢子,菌落颜色呈橄榄绿或灰绿色,背面呈深橄榄色或黑色,边缘呈暗灰色(图1c~e)。
将上述在PDA上分离获得的疑似葡萄茎枯病菌进行纯化和编号,编号为4358-17。该菌株在25℃条件下培养,早期易产生近球形或洋梨形分生孢子器,直径96~192 μm,多为单生,少数聚生。分生孢子从分生孢子器的孔口释放,初期形成浅红色黏孢团,逐渐变为橄榄棕色。分生孢子大小(5~9)μm×(1.8~3.6)μm,单胞,椭圆形至近圆柱形,有时略微弯曲,通常具两个油滴,无色透明。厚垣孢子形状和大小高度可变,砖格状,串生成链或单生,大多数位于菌丝的末端或中间,不易从菌丝上脱落,颜色为深棕色至黑色,大小(32.6~44.6)μm×(11.5~19.7)μm(图1f~m)。形态学研究表明分离菌株为葡萄茎枯病菌Didymellaglomerata。
2.2 序列分析
对菌株4358-17的DNA采用相应的引物分别扩增LSU、ITS、TUB2、ACT并进行测序,将得到的序列在GenBank中进行BLAST。结果表明,菌株4358-17的LSU、ITS、TUB2、ACT序列与葡萄茎枯病菌(登录号分别为KT389718、FJ427004、FJ427115、FJ426896)相似性均为100%。进一步通过多位点系统发育分析发现菌株4358-17与D.glomerata的代表菌株CBS 528.66聚集在一个分支上,支持率达到99%(图2)。其他相近种和该菌株在系统发育树上均能够明显区分开。
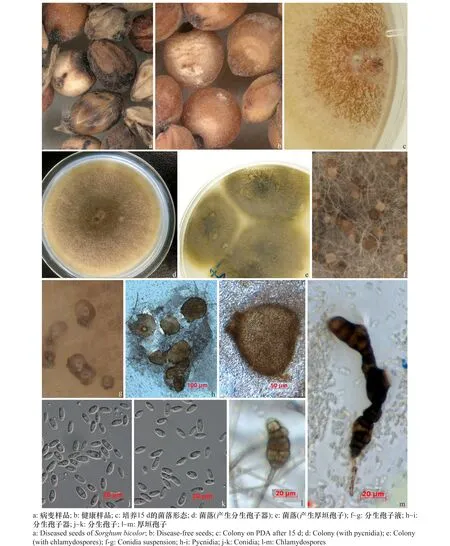
图1 高粱病变样品及菌株4358-17的形态特征Fig.1 Symptoms and morphological characteristics of strain 4358-17

图2 基于多位点(LSU、ITS、TUB2、ACT)系统发育分析构建的菌株4358-17和相近物种的最大似然树Fig.2 Phylogenetic tree inferred from a maximum likelihood analysis based on a concatenated alignment of LSU, ITS, TUB2 and ACT sequences of isolate 4358-17 and related Didymella spp.
2.3 致病性测定
运用柯赫氏法则对分离菌株进行致病性测定,结果表明,接种4358-17并在室温下培养4 d后,高粱幼苗叶片部位开始变色,逐步变为浅棕色,最后变为深褐色斑块,呈不规则形状,用无菌水接种的对照叶片未出现发病症状(图3a~b);小麦叶片在接种部位开始出现肉眼可见的浅黄色病斑,病斑逐渐扩大,萎蔫干枯,变为浅棕色。对照叶片无发病症状(图3c~d)。大麦叶片接种后经过连续10 d的观察,发现其和对照叶片无明显差异,因此本研究认为菌株4358-17不容易侵染大麦。
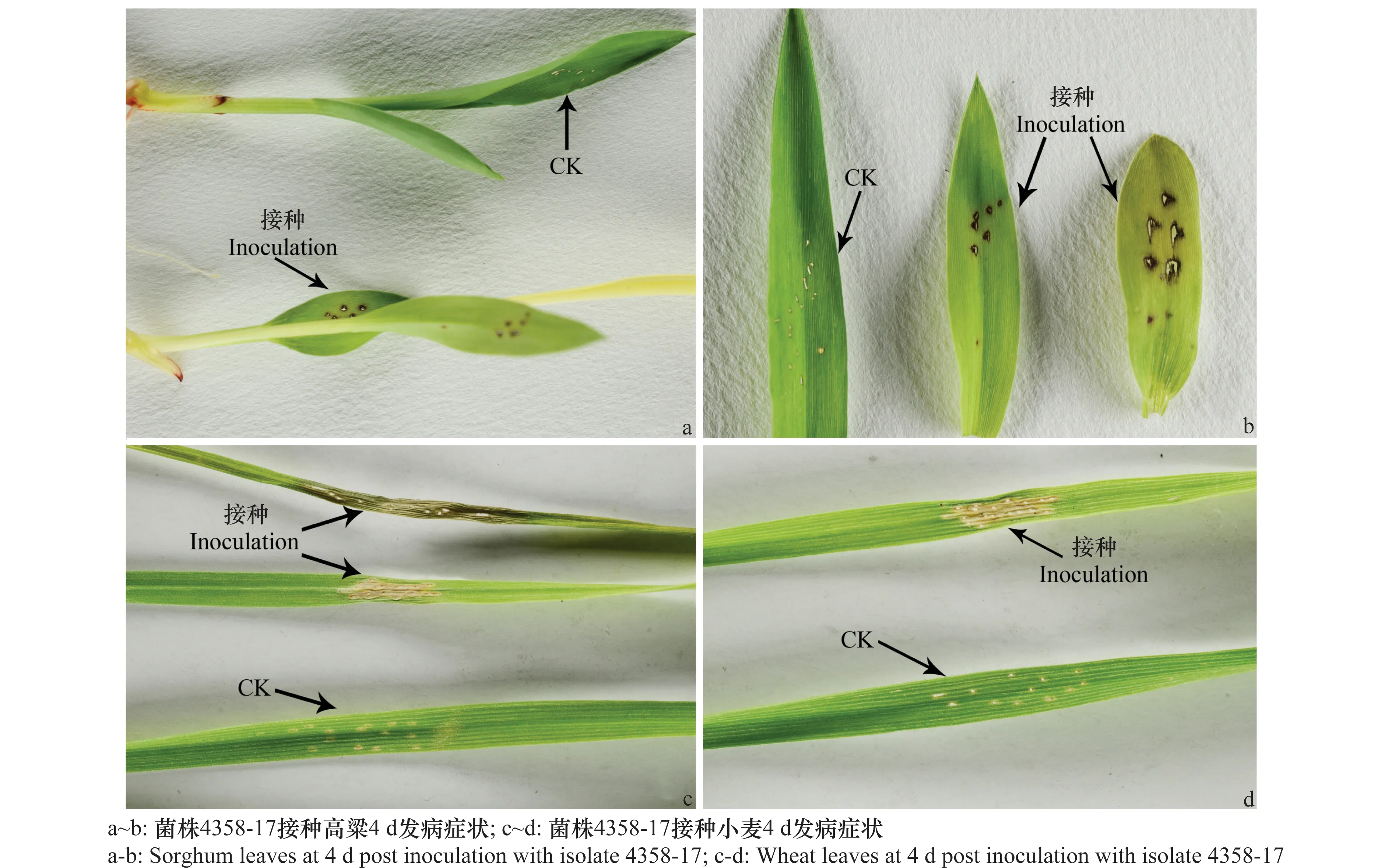
图3 菌株4358-17的致病性测试结果Fig.3 Pathogenicity test of strain 4358-17 inoculating sorghum and wheat
对上述接种植株的发病组织进行病原菌的再分离,所获得的菌株与原始菌株4358-17菌落形状、形态特征及序列分析结果均一致。
2.4 结论
通过对高粱分离菌株4358-17的培养性状和形态学观察、PCR产物序列比对、系统发育分析以及致病性测试,将菌株4358-17鉴定为葡萄茎枯病菌D.glomerata。
3 讨论
对高粱上分离的菌株4358-17的形态学观察和多位点(LSU、ITS、TUB2、ACT)序列分析均表明该菌为葡萄茎枯病菌,致病性测试结果表明该菌能够引起高粱和小麦的叶部感染。Corda[22]于1840年首次报道了葡萄茎枯病菌ConiothyriumglomeratumCorda。Wollenweber 和 Hochapfel[23]经过进一步深入的研究认为葡萄茎枯病菌属于茎点霉属Phoma,现在的文献报道多遵从该观点,采用Phomaglomerata(Corda) Wollenw. & Hochapfel作为葡萄茎枯病菌的种名。随着分子生物学的发展,对植物病原真菌的分类更趋于自然。Chen等[24]依据系统发育分析结果对茎点霉属和相关属的分类系统进行了大幅度的调整,其中葡萄茎枯病菌被划分到亚隔孢壳属Didymella。本研究遵从该新分类系统,采用更科学合理的种名Didymellaglomerata。
相对于检测,检疫强调的是针对性和有效性,因此对送检的样品必须事先挑选病变的样品进行病原菌的分离;而检测强调样品的代表性和普通性,对送检的样品保证其均匀性,往往借助多次混匀和等分选取试验样品。对于我国口岸进口的大宗粮谷,要保证检疫取样有效性和针对性,必须在大量样品中选取有典型症状的病变样品。对于大豆、玉米、大麦等种子较大的样品,病变样品容易识别,但对高粱这类种子较小的粮食样品,则肉眼不易辨别和选取。本研究经过探索,采用谷物套筛组合筛选,将病变的种子和病残体进行富集,然后在解剖镜下进行甄别挑选,大大提高了病变样品的筛选效率。目前,套筛组合筛选的方法已经成功应用于进口油菜籽样品中检疫性病原菌—油菜茎基溃疡病菌样品的挑选,进一步提高了其检出率。
葡萄茎枯病菌在全世界广泛分布,但是我国到目前为止只有两例报道,因此该菌在我国口岸检疫中具有重要意义。我国口岸多次从苹果、大豆、豌豆、油橄榄等进境农产品中截获该检疫性真菌[25-26]。由于葡萄茎枯病菌以前没有在高粱上引起田间发病的报道,因此该情况需要引起检疫和植保人员的重视。本研究过程中致病性测试结果显示该菌可侵染高粱,对高粱有潜在的危害性。中国已经成为全球第一粮食进口大国,高粱是其中主要的进口种类之一,其90%来自美国。高粱种子在装卸、运输过程中易洒漏,因此该菌伴随洒漏高粱种子传入我国的风险性极高。此次的葡萄茎枯病菌截获表明从美国进口高粱具有很大风险,需保持警惕性,对来自疫区的高粱进行严格的检疫监控,以保护我国的生物安全。
[1] Domsch K H, Gams W, Anderson T H. Compendium of soil fungi. Volume 2 [M]. London: Academic Press Ltd., 1980.
[2] Milatovic I. On the appearance of some diseases of grapevine in Croatia [J]. Review of Applied Mycology, 1968,48:3601.
[3] Lahoz E, Caiazzo R, Fanigliulo A, et al.Phomaglomerataas causal agent of crown rot disease of fennel in southern Italy[J]. Communications in Agricultural & Applied Biological Sciences, 2007, 72(4): 875-878.
[4] da Silva Barreto S, de Rezende D V, Blum L E B. Fungi on seeds of ornamentals [J]. Revista Brasileira de Sementes, 2011, 33(3): 561-573.
[5] Lahoz E, Caiazzo R, Fanigliulo A, et al. Seed transmission ofPhomaglomeratacausal agent of crown rot disease of fennel in Southern Italy [C]∥9th International Congress of Plant Pathology Turin, 2008.
[6] Aghapour B, Fotouhifar K B, Ahmadpour A, et al. First report of leaf spot disease onFicuselasticacaused byPhomaglomeratain Iran [J]. Australasian Plant Disease Notes, 2009, 4(1):82-83.
[7] Boerema G H, Gruyter J, Noordeloos M E, et al.Phomaidentification manual, differentiation of specific and infra-specific taxa in culture [M].Oxfordshire:CABI Publishing, 2004.
[8] Safaee D, Okhovvat M, Hedjaroude G A. The first report of existence ofPhomaglomerata(Cda) Woolen. & Hchaff from Iran [C]∥Proceeding of the 14th Iranian Plant Protection Congress.Isfahan: Isfahan University of Technology,2000:220.
[9] Hatami N, Zamanizadeh H, Aminaii M M. Collection and identification of plant pathogenic fungi in cucumber greenhouses [C]∥ Proceeding of the 18th Iranian Plant Protection Congress. Hamedan: University of Bu-Ali Sina, 2008:195.
[10]Rodeva R, Carrieri R, Stoyanova Z, et al. New report ofPhomaglomerataonCoriandrumsativumL.[J]. Communications in Agricultural & Applied Biological Sciences, 2013, 78(3): 617-620.
[11]Lahoz E, Caiazzo R, Fanigliulo, A, et al.Phomaglomerataas causal agent of crown rot disease of fennel in southern Italy[J]. Communications in Agricultural & Applied Biological Sciences, 2007, 72(72): 875-878.
[12]Dhanju A S, Chohan J S. A note onPhomaglomerata-in relation to bud-blight affected plants of groundnut (India)[J]. Indian Phytopathology, 1975, 27(4): 665-666.
[13]Thomidis T, Michailides T J, Exadaktylou E.Phomaglomerata(Corda) Wollenw. & Hochapfel a new threat causing cankers on shoots of peach trees in Greece [J]. European Journal of Plant Pathology, 2011, 131(2): 171-178.
[14]Wang X, Wang J, Gao J, et al. First report of leaf spot disease onSchisandrachinensiscaused byPhomaglomeratain China[J]. Plant Disease, 2012, 96(2): 289.
[15]Zhao D, Kang Y B. First report of branch blight of tree peony caused byPhomaglomeratain China [J]. Plant Disease, 2013, 97(8): 1114.
[16]吴翠萍, 李彬, 粟寒, 等. 进境美国苜蓿草中苜蓿黄萎病菌的检疫鉴定[J]. 植物检疫, 2011, 25(1): 42-46.
[17]White T J, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal rna genes for phylogenetics [M]∥Innis M A, Gelfand D H, Sninsky J J, et al. PCR protocols-a guide to methods and applications,1990: 315-322.
[18]Vilgalys R, Hester M. Rapid genetic identification and mapping of enzymatically amplified ribosomal DNA from severalCryptococcusspecies [J]. Journal of Bacteriology, 1990, 172: 4238-4246.
[19]Carbone I, Kohn L M. A method for designing primer sets for speciation studies in filamentous ascomycetes[J]. Mycologia, 1999, 91(3): 553-556.
[20]de Gruyter J D, Aveskamp M M, Woudenberg, J H C, et al. Molecular phylogeny ofPhomaand allied anamorph genera: towards a reclassification of thePhomacomplex [J]. Mycological Research, 2009, 113(4): 508-519.
[21]Stamatakis A, Alachiotis N. Time and memory efficient likelihood-based tree searched on phylogenomic alignments with missing data [J]. Bioinformatics, 2010, 26: 132-139.
[22]Corda A K J. Icones fungorum hucusque cognitorum. Volume 4 [M]. Prague: Apud J G Calve, 1840.
[23]Wollenweber H W; Hochapfel H. Beiträge zur Kenntnis parasitärer und saprophytischer Pilze I.Phomopsis,Dendrophoma,PhomaundAscochytaund ihre Beziehung zur Fruchtfäule [J]. Zeitschrift für Parasitenkunde, 1936, 8: 561-605.
[24]Chen Q, Jiang J R, Zhang G Z, et al. Resolving thePhomaenigma [J]. Studies in Mycology, 2015, 82: 137-217.
[25]段维军, 顾建锋, 张慧丽, 等. 进境意大利苹果苗上葡萄茎枯病菌的截获鉴定[J]. 植物病理学报, 2014, 44(5): 542-545.
[26]孙娟, 陈舜胜, 于子翔, 等. 美国进境大豆葡萄茎枯病菌的检疫鉴定[J]. 植物检疫, 2014, 28(1): 48-52.
(责任编辑:杨明丽)
Identification ofDidymellaglomerataon importedSorghumbicolor
Zhang Yu1, Xu Pingping2, Wu Jing2, Yang Jing1, Li Bin1, Wu Cuiping1
(1. Jiangsu Entry-Exit Inspection and Quarantine Bureau, Nanjing 210001, China;2. Nanjing Entry-Exit Inspection and Quarantine Bureau, Nanjing 210001, China)
The isolate 4358-17 was obtained from importedSorghumbicolorfrom America. It was similar toDidymellaglomeratain morphology. BLAST analysis indicated that LSU, ITS, TUB2 and ACT sequence showed 100% identity with the sequences with accession numbers of KT389718, FJ427004, FJ427115 and FJ426896, respectively. Phylogenetic analysis revealed that the isolate 4358-17 clustered withinD.glomeratastrains. Pathogenicity test showed that it could cause leaf spot on sorghum and wheat 4 d after inoculation. Based on all above results, the isolate 4358-17 was identified asD.glomerata.
Didymellaglomerata; morphological characters; phylogenetic analysis; pathogenicity test
2016-08-01
2016-09-27
国家质量监督检验检疫总局科技计划(2012IK278);“十二五”国家科技支撑计划(2012BAK11B03)
S 435.14
A
10.3969/j.issn.0529-1542.2017.03.033
* 通信作者 E-mail:wucp@jsciq.gov.cn
