广西三种甜瓜病毒分离物的分子检测与鉴定
2017-06-05杨世安李战彪秦碧霞谢慧婷崔丽贤邓铁军蔡健和
杨世安, 李战彪, 秦碧霞, 谢慧婷,崔丽贤, 苏 琴, 邓铁军, 蔡健和*
(1. 广西大学农学院, 南宁 530004; 2. 广西作物病虫害生物学重点实验室,广西农业科学院植物保护研究所, 南宁 530007)
广西三种甜瓜病毒分离物的分子检测与鉴定
杨世安1,2#, 李战彪2#, 秦碧霞2, 谢慧婷2,崔丽贤2, 苏 琴2, 邓铁军2, 蔡健和2*
(1. 广西大学农学院, 南宁 530004; 2. 广西作物病虫害生物学重点实验室,广西农业科学院植物保护研究所, 南宁 530007)
瓜类褪绿黄化病毒Cucurbitschloroticyellowsvirus(CCYV)、甜瓜黄化斑点病毒Melonyellowspotvirus(MYSV)及甜瓜坏死斑点病毒Melonnecroticspotvirus(MNSV)是近年来报道侵染瓜类作物的新病毒,在个别种植区大面积发生,对生产构成严重威胁。为了解3种病毒在广西的发生情况,先后到各西甜瓜种植区进行了调查,并采集疑似CCYV、MYSV及MNSV的甜瓜病叶样品,提取病叶总RNA,通过特异性引物分别进行一步法RT-PCR扩增,电泳结果显示RT-PCR产物与预期大小一致的序列条带;将扩增产物分别连接到pMD19-T克隆载体上,挑选阳性克隆子进行序列测定及比对分析。结果表明:CCYV、MYSV和MNSV广西分离物的CP基因序列与其他已报道核苷酸序列一致性分别达95.1%~100%、96.5%~99%和83.7%~92.5%。
广西; 瓜类褪绿黄化病毒; 甜瓜黄化斑点病毒; 甜瓜坏死斑点病毒; 一步法RT-PCR
甜瓜CucumismeloL.是世界上重要的葫芦科作物,起源于非洲、美洲和东南亚等热带地区,在热带地区、温带地区的温和气候季节广泛种植。在我国,甜瓜的种植几乎遍布大江南北。广西依其得天独厚的气候条件成为华南重要的甜瓜产区。甜瓜不仅种植面积广而且品种繁多,有包括‘广甜二号’、‘丰蜜三号’、‘金蜜宝’、‘翠蜜宝’、‘好运52’、‘广蜜1号’、‘好运11’、‘北甜1号’、‘京玉5号’、‘桂蜜12号’等在内的数十个品种[1-4]。近年来,各种病虫害,如细菌性果斑病、根结线虫病、蔓枯病和病毒病等,严重影响甜瓜的产量和品质,其中病毒病的危害尤为严重。瓜类褪绿黄化病毒、甜瓜黄斑病毒和甜瓜坏死斑点病毒是甜瓜上新发生的病毒病害,对甜瓜生产具有潜在的威胁。
瓜类褪绿黄化病毒Cucurbitchloroticyellowsvirus(CCYV)属于长线病毒科Closteroviridae毛形病毒属Crinivirus。病毒颗粒为长线形,基因组由双链RNA组成,即RNA1(8 607 nt)和RNA2(8 041 nt)。CCYV通过介体烟粉虱Bemisiatabaci(Gennadius)进行半持久性传播,主要危害西瓜、甜瓜、黄瓜等,以大面积侵染甜瓜最为常见。该病最早于2004年在日本观察到,直至2010年其病原才被鉴定出来[5]。我国古勤生等[6-7]于2011年在宁波、上海等地观察报道了CCYV。随后海南、河南、北京和山东等地均报道了该病害[8-10]。
甜瓜黄化斑点病毒Melonyellowspotvirus(MYSV),属于布尼亚病毒科Bunyaviridae番茄斑萎病毒属Tospovirus。病毒粒体为具有包膜的球体,基因组包括3个单链线性RNA片段,即L RNA、M RNA和S RNA。MYSV在植株间主要是通过节瓜蓟马Thripspalmi(又称棕榈蓟马)以持久增殖方式自然传播,也可通过汁液机械传播。MYSV主要危害甜瓜、西瓜、黄瓜和苦瓜等葫芦科作物,该病毒于2000年在日本首次发现并命名[11]。2008年发现我国台湾的西瓜受到该病毒侵染[12],2009年海南省发现三亚市大棚甜瓜受到该病毒侵染[13-14]。随后,在广东的西瓜和山东寿光的黄瓜上也发现了该病毒[15-16]。
甜瓜坏死斑点病毒Melonnecroticspotvirus(MNSV)属于番茄丛矮病毒科Tombusviridae香石竹斑驳病毒属Carmovirus,病毒粒体为球形,基因组为正义单链RNA,约4.3 kb。甜瓜坏死斑点病毒主要通过种子、土壤真菌瓜油壶菌Olpidiumradicale和黄瓜黑头叶甲Diabroticasp.进行自然传播,另外还可以通过机械摩擦传播。MNSV的寄主范围限于葫芦科植物西瓜、南瓜、葫芦、黄瓜、甜瓜等,其中甜瓜为系统侵染寄主。甜瓜坏死斑点病毒由日本最先报道,随后在美国、希腊、瑞典、意大利和突尼斯等国家出现[17]。我国于2007年在江苏省海门市温室甜瓜中发现该病毒[18],2015年山东寿光也报道了该病毒[10]。
CCYV、MYSV和MNSV自发现报道以来,其危害范围不断扩大。CCYV与MYSV在广西虽有分布[6,14],但未进行分子检测;MNSV在广西的研究更是空白。快速有效地检测、鉴定是病毒病防治的基础,本研究采用一步RT-PCR方法对具有典型CCYV、MYSV和MNSV症状的甜瓜病样进行检测,并对病毒的部分序列进行了测定与分析。研究结果对广西地区甜瓜上病毒的快速检测鉴定,综合防治措施拟定以及基因结构特征与变异、病害流行规律和抗病育种均具有重要的意义。
1 材料与方法
1.1 材料
1.1.1 样品来源
疑似CCYV、MYSV及MNSV病叶样品采集于广西甜瓜主产区南宁市和北海市,共采集37份样品,样品保存于-80℃待用。
1.1.2 试剂
植物总RNA提取试剂盒、一步法RT-PCR试剂盒和PCR产物回收试剂盒、pMD19-T连接载体和大肠杆菌DH5α感受态细胞以及质粒提取试剂盒等均购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 植物总RNA提取
称取甜瓜病叶、健叶各100 mg,参照植物RNA提取试剂盒说明书提取叶片组织总RNA。
1.2.2 引物合成
根据NCBI上已报道的病毒序列,经过比对分析,选择各病毒基因保守区分别设计CCYV、MYSV及MNSV特异性引物,引物由立菲生物技术有限公司合成。引物序列见表1。
1.2.3 RT-PCR扩增
RT-PCR反应体系:2.5 μL模板,2 μL PrimeScript 1 step Enzyme Mix,25 μL 2×1 step buffer,1 μL正/反向引物,18.5 μL RNase-free water,共50 μL。
RT-PCR一步法反应条件:50℃ 30 min;94℃预变性2 min;94℃变性30 s,58/58/50℃退火30 s,延伸45 s(30个循环);72℃延伸10 min,4℃保存。扩增产物用1%的琼脂糖凝胶进行电泳检测。
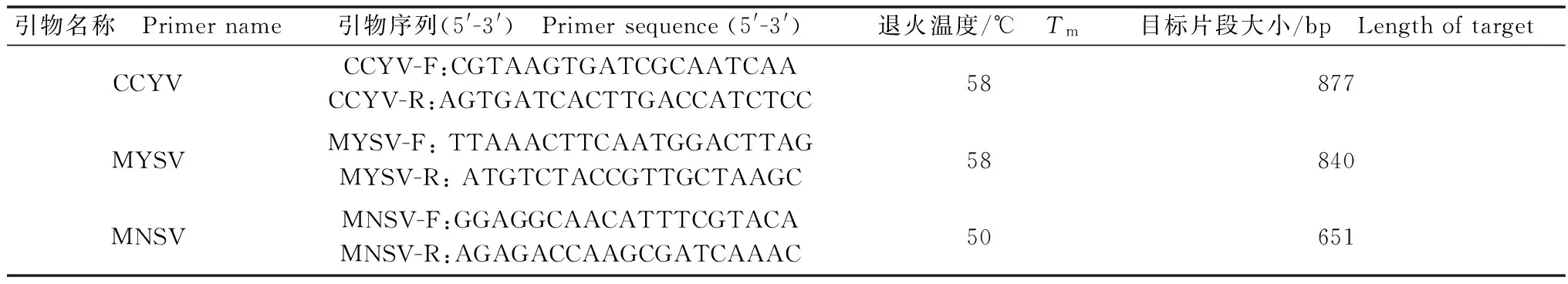
表1 用于检测3种病毒的引物序列
1.2.4 RT-PCR产物回收及克隆测序
根据PCR产物回收试剂盒说明,对PCR产物进行相应目的片段的快速回收,并将其分别与pMD19-T克隆载体连接,连接产物转入大肠杆菌感受态细胞中,经PCR鉴定的阳性菌落进行接种培养和质粒提取。测序由上海立菲生物科技有限公司完成。
1.2.5 序列分析
测序结果利用Vector NTI 11.5.1软件进行序列的拼接和比对分析;利用MEGA 6.0软件通过邻近相邻法(neighbour-joining)和最大似然组成模型法(maximum composite like-lihood method)构建系统发育树。构建系统发育树所用到的各病毒分离株信息(基因登录号、名称、寄主、其来源地及参考文献)见表2。
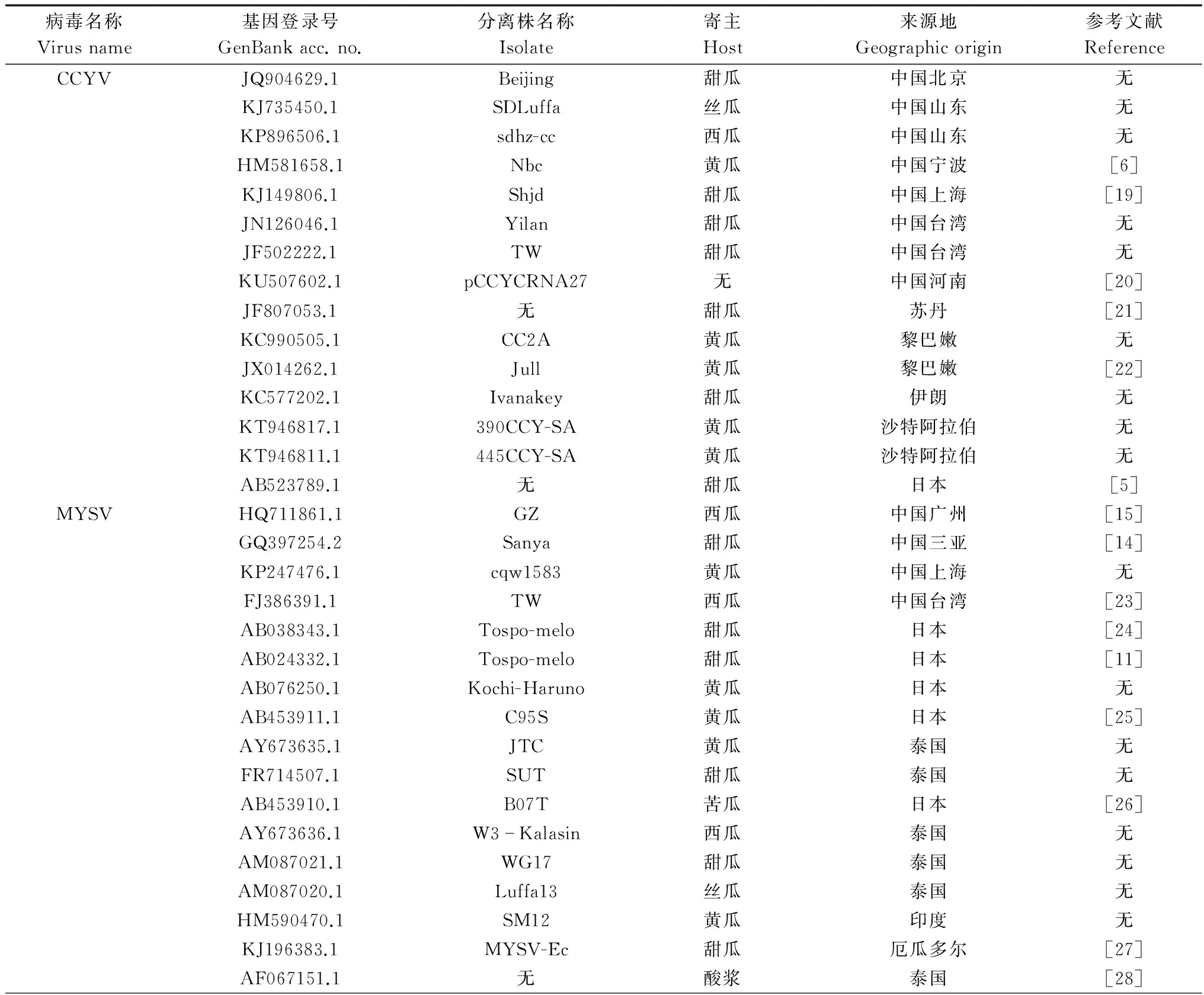
表2 用于CCYV、MYSV和MNSV广西分离物亲缘关系分析的国内外分离物
续表2 Table 2(Continued)
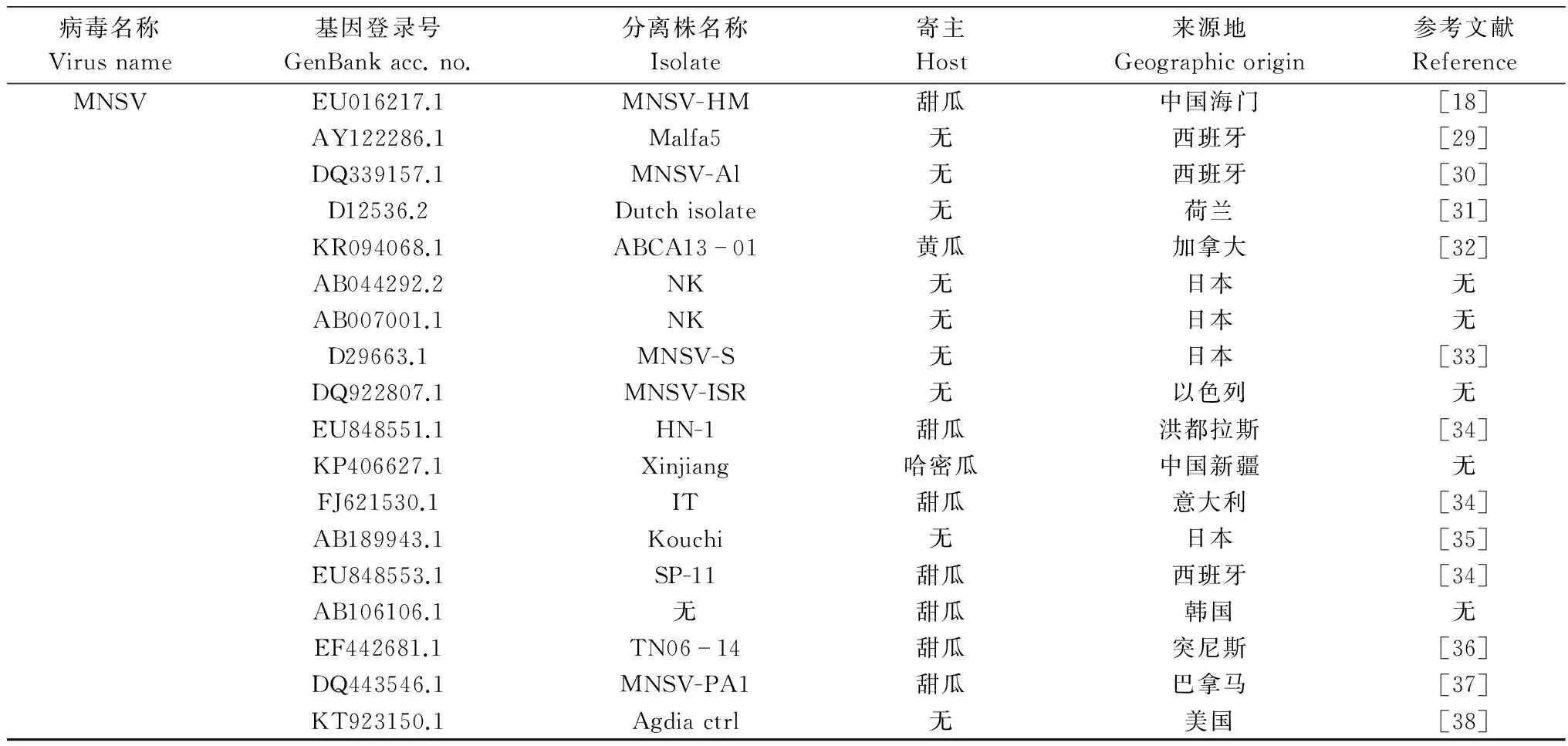
病毒名称Virusname基因登录号GenBankacc.no.分离株名称Isolate寄主Host来源地Geographicorigin参考文献ReferenceMNSVEU016217.1MNSV-HM甜瓜中国海门[18]AY122286.1Malfa5无西班牙[29]DQ339157.1MNSV-Al无西班牙[30]D12536.2Dutchisolate无荷兰[31]KR094068.1ABCA1301黄瓜加拿大[32]AB044292.2NK无日本无AB007001.1NK无日本无D29663.1MNSV-S无日本[33]DQ922807.1MNSV-ISR无以色列无EU848551.1HN-1甜瓜洪都拉斯[34]KP406627.1Xinjiang哈密瓜中国新疆无FJ621530.1IT甜瓜意大利[34]AB189943.1Kouchi无日本[35]EU848553.1SP-11甜瓜西班牙[34]AB106106.1无甜瓜韩国无EF442681.1TN0614甜瓜突尼斯[36]DQ443546.1MNSV-PA1甜瓜巴拿马[37]KT923150.1Agdiactrl无美国[38]
2 结果与分析
2.1 RT-PCR检测与鉴定
于广西壮族自治区南宁市和北海市的甜瓜种植区采集有褪绿黄化、黄色斑点和褪绿坏死斑症状的甜瓜病叶,进行分子检测。分别提取不同症状表现的甜瓜病叶样品总RNA作为RT-PCR的模板,用3种病毒的特异性引物进行RT-PCR扩增,PCR产物经1%的琼脂糖凝胶电泳检测,疑似感病样品扩增产物的电泳条带如图1~3,大小与所设计引物的目标片段大小(CCYV 877 bp、MYSV 840 bp和MNSV 651 bp)基本一致。由于缺少阳性对照,为了证实检测结果的可靠性,我们将RT-PCR产物纯化后进行直接测序,序列经NCBI的Blastn比对,结果显示,所扩增的产物序列与NCBI上CCYV、MYSV、MNSV的序列相似性分别达95%~100%、96~99%和85%~92%。经RT-PCR方法对样品进行检测,CCYV、MYSV和MNSV检出率分别为68.7%、72.7%和70%。
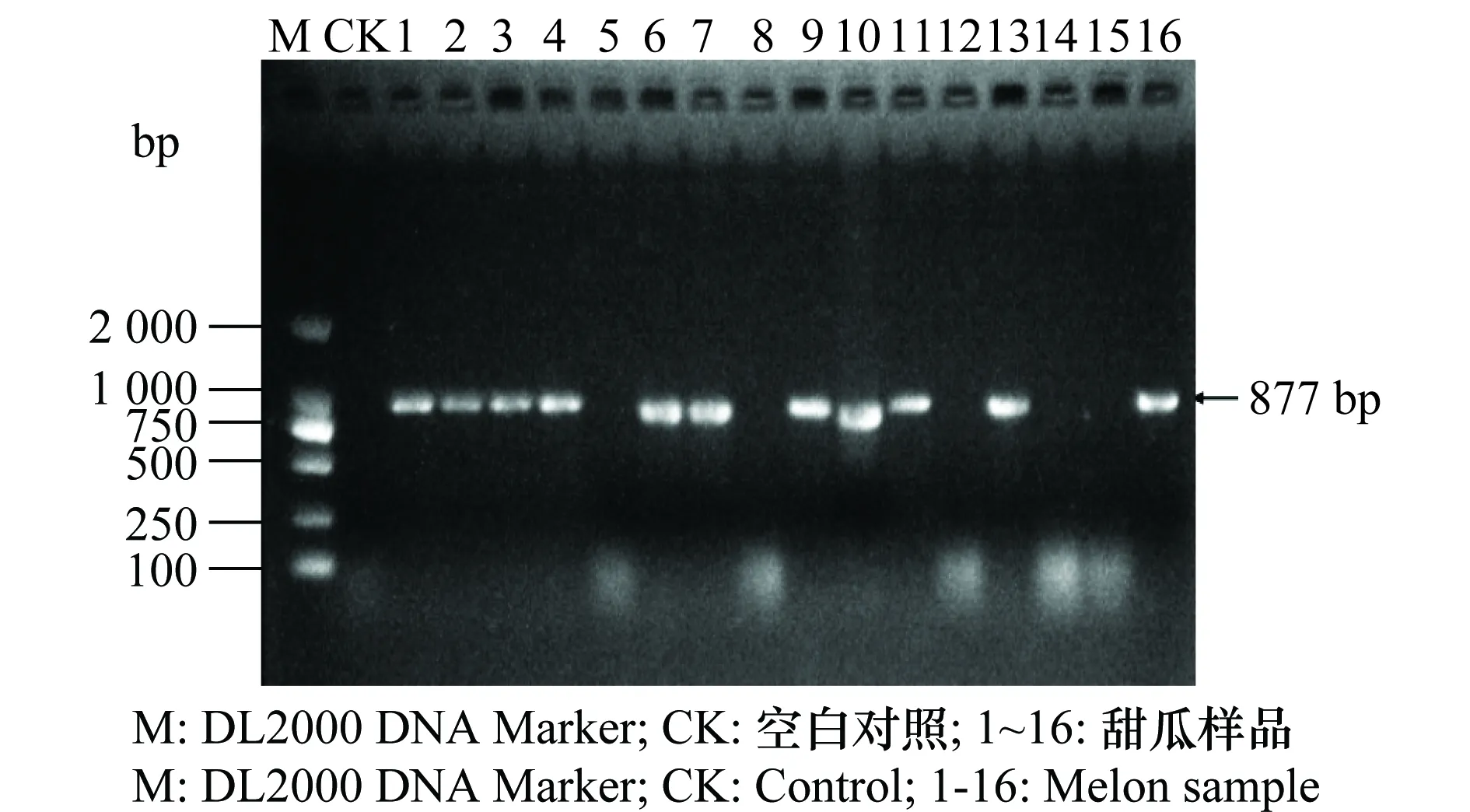
图1 CCYV的RT-PCR检测结果Fig.1 RT-PCR amplification of CCYV
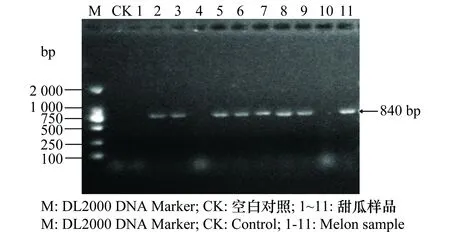
图2 MYSV的RT-PCR检测结果Fig.2 RT-PCR amplification of MYSV
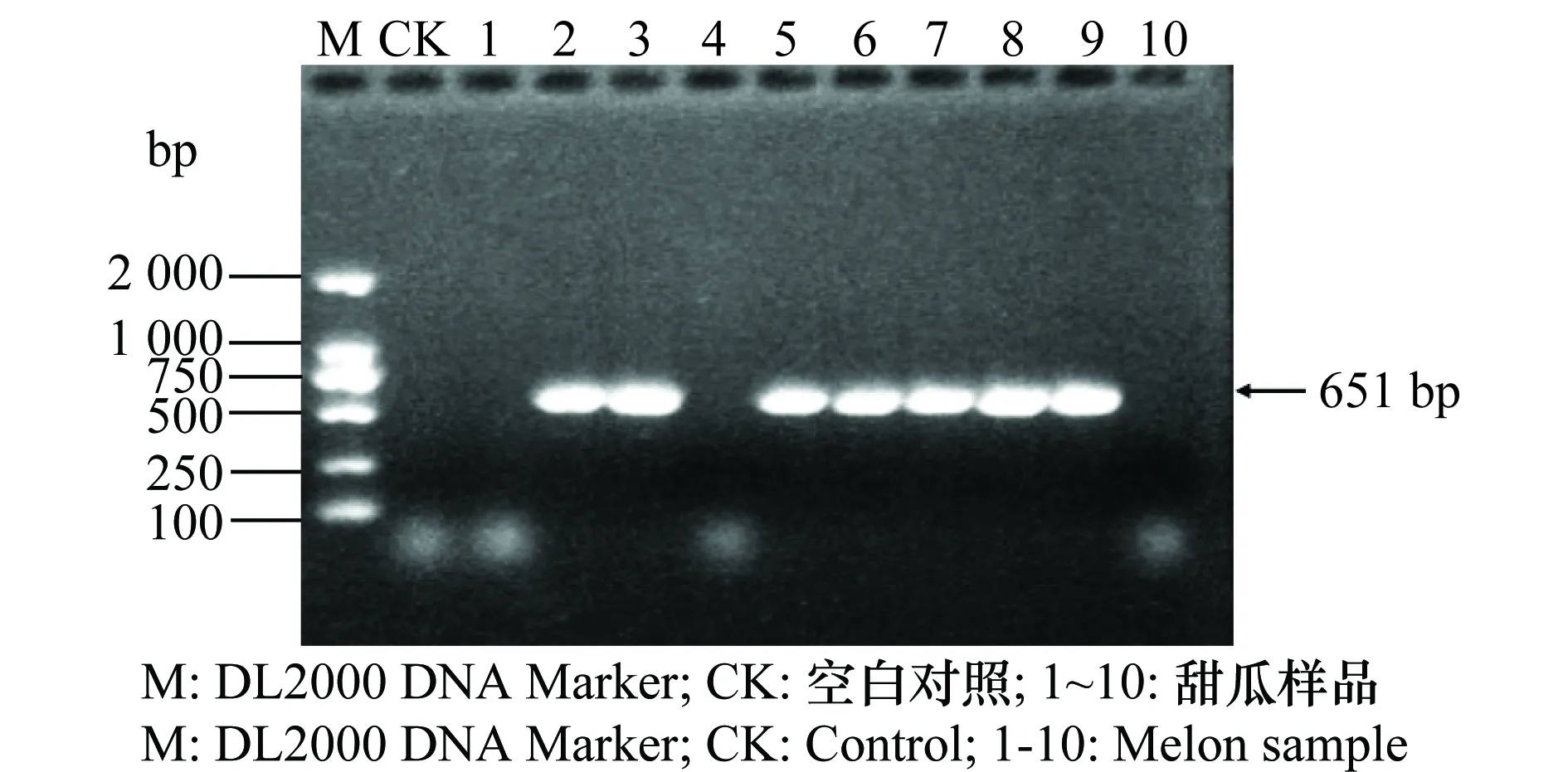
图3 MNSV的RT-PCR检测结果Fig.3 RT-PCR amplification of MNSV
2.2 CCYV、MYSV和MNSV广西分离物序列分析
将3种病毒的RT-PCR纯化产物克隆至pMD19-T载体,挑选阳性克隆进行测序,经Vector NTI 11.5.1拼接,CCYV、MYSV和MNSV广西分离物的CP基因特异性引物的扩增产物序列分别由877、840和651 bp核苷酸组成。分别通过NCBI Blastn和GenBank序列对比,下载我国其他省份以及世界其他国家和地区已上传的分离株序列进行分析。
通过Vector NTI 11.5.1的AlignX将所得的CCYV广西分离物(CCYV-GX)与我国及其他国家或地区分离物的核苷酸序列进行两两比对。结果发现:CCYV广西分离物(CCYV-GX)与中国大陆分离物(JQ904629.1、HM581658.1、KJ735450.1、KJ149806.1、KP896506.1和KU507602.1)、中国台湾分离物(JN126046.1、JF502222.1)等地区分离物的核苷酸相似性达99.6%~100%;与沙特阿拉伯分离物(KT946811.1)核苷酸相似性为98.0%;与伊朗分离物(KC577202.1)核苷酸相似性仅95.1%。利用MEGA 6.06软件对CCYV广西分离物(CCYV-GX)与我国及其他国家或地区相应分离物的核苷酸序列构建系统发育树(图4),结果表明:CCYV广西分离物(CCYV-GX)与沙特阿拉伯分离物(KT946811.1)和伊朗分离物(KC577202.1)在不同分支上,亲缘关系较远;与其他13个分离物,其中包括6个中国大陆分离物(JQ904629.1、HM581658.1、KJ735450.1、KJ149806.1、K和KP896506.1)和2个中国台湾分离物(JN126046.1、JF502222.1)在同一支上,亲缘关系最近。
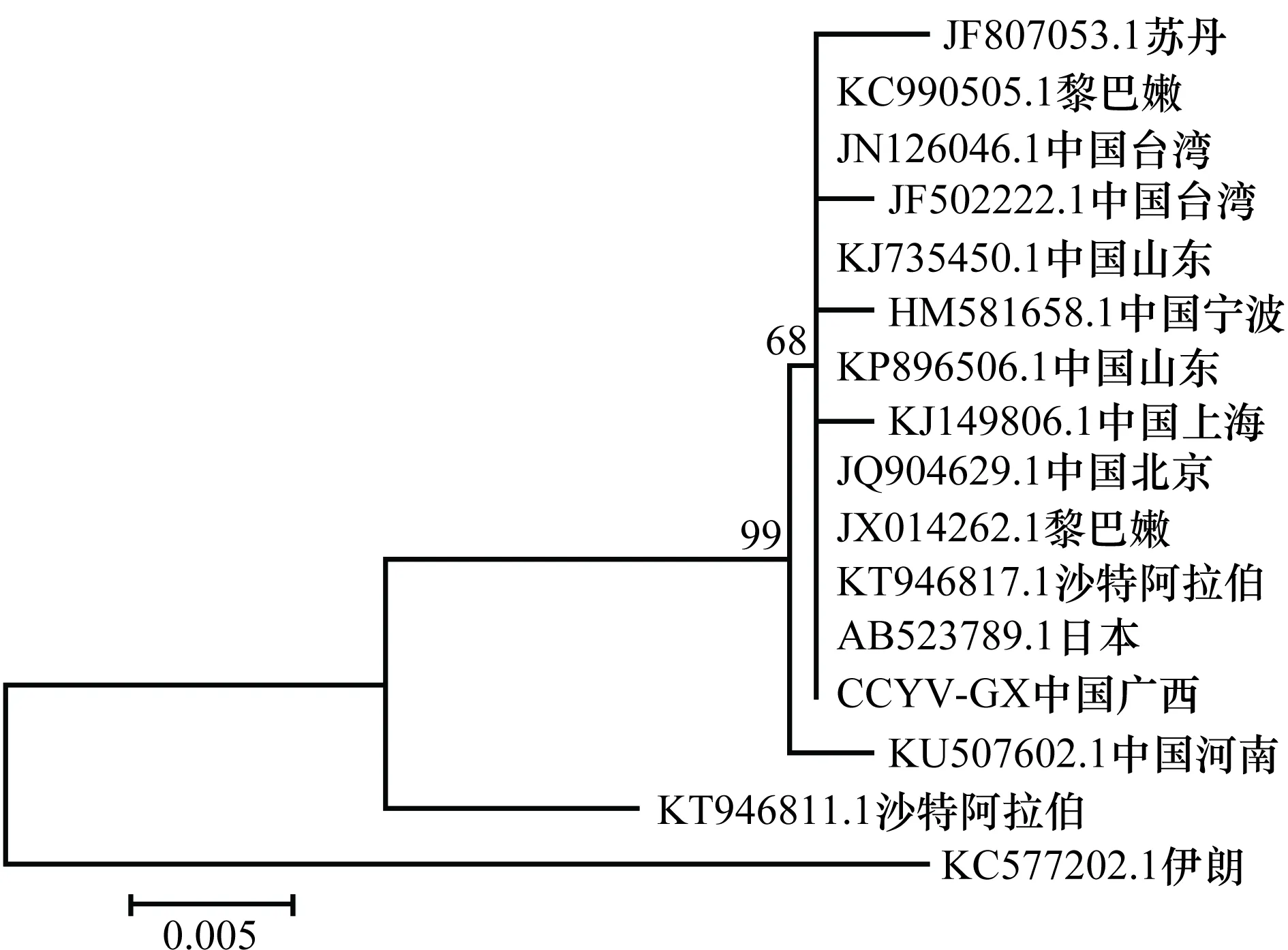
图4 CCYV广西分离物的核苷酸序列亲缘关系分析Fig.4 Phylogenetic relationship analysis between nucleotide sequences of Guangxi isolate and other 15 CCYV isolates reported previously
通过Vector NTI 11.5.1的AlignX将所得的MYSV广西分离物(MYSV-GX)与我国及其他国家或地区分离物核苷酸序列进行两两比对分析。结果发现:中国广西分离物(MYSV-GX)与中国三亚分离物(GQ397254.2)、中国上海分离物(KP247476.1)、中国广州分离物(HQ711861.1)核苷酸相似性达99.6%以上;与日本分离物(AB038343.1、AB024332.1)、泰国分离物(AF067151.1)、厄瓜多尔分离物(KJ196383.1)、中国台湾分离物(FJ386391.1)、印度分离物(HM590470.1)等14个分离物核苷酸相似性达96.5%~98.6%。利用MEGA 6.06软件对MYSV广西分离物(MYSV-GX)与我国及其他国家或地区相应分离物的核苷酸序列构建系统发育树(图5),结果表明:MYSV广西分离物(MYSV-GX)与中国三亚、上海、广州(GQ397254.2、KP247476.1、HQ711861.1)以及泰国分离物(AF067151.1)和厄瓜多尔分离物(KJ196383.1)在一个分支上,亲缘关系最近;与泰国分离物(AY673636.1、AY673635.1、FR714507.1、AM087021.1)、日本分离物(AB038343.1、AB024332.1)和中国台湾分离物(FJ386391.1)亲缘关系较近;与日本分离物(AB076250.1、AB453910.1和AB453911.1)、印度分离物(HM590470.1)、泰国分离物(AM087020.1)处于不同分支,亲缘关系较远。
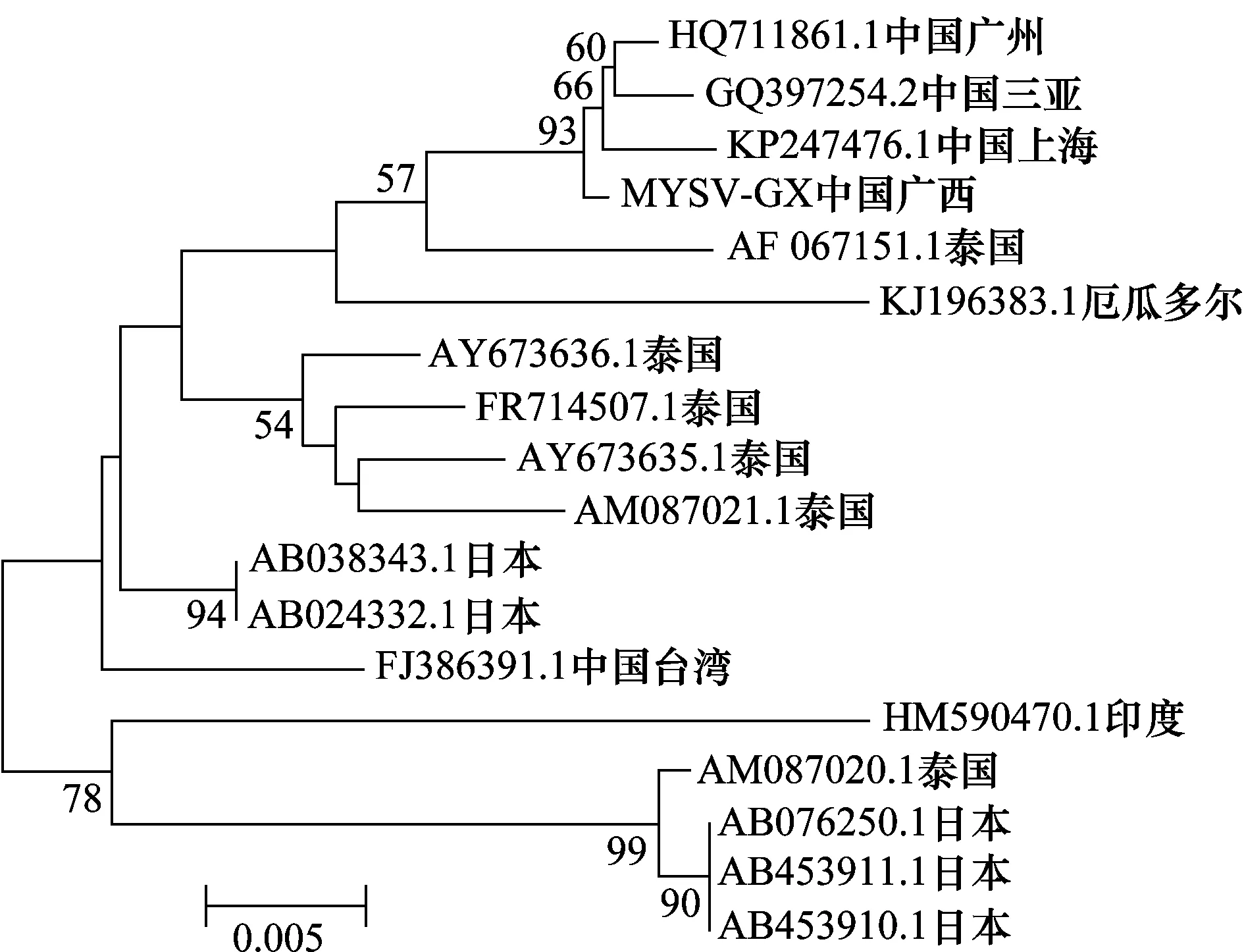
图5 MYSV广西分离物的核苷酸序列亲缘关系分析Fig.5 Phylogenetic relationship analysis between nucleotide sequences of Guangxi isolate and other 17 MYSV isolates reported previously
通过Vector NTI 11.5.1的AlignX将所得的MNSV广西分离物(MNSV-GX)与我国及其他国家或地区分离物核苷酸序列进行两两比对分析,结果发现:中国广西分离物(MNSV-GX)与中国海门分离物(GU480022.1)、中国新疆分离物(KP406627.1)等分离物的核苷酸序列相似性达91.4%~92.5%;与洪都拉斯分离物(EU848551.1)、美国分离物(KT923150.1)等分离物的核苷酸序列相似性达89.1%~90.8%;与日本分离物(D29663.1)和西班牙分离物(AY122286.1)核苷酸序列相似性仅为84.6%和83.7%。利用MEGA 6.06软件对MNSV广西分离物(MNSV-GX)与我国及其他国家或地区相应分离物的核苷酸序列构建系统发育树(图6),结果表明:MNSV广西分离物(MNSV-GX)处于一个小支上,但与中国新疆分离物(KP406627.1)、中国海门分离物(EU016217.1)、洪都拉斯分离物(EU848551.1)、巴拿马分离物(DQ443546.1)等处于一个大分支上,亲缘关系最近;其次是日本分离物(AB007001.1、AB044292.2、AB189943.1)及韩国分离物(AB106106.1);与日本分离物(D29663.1)和西班牙分离物(AY122286.1)亲缘关系相对较远。
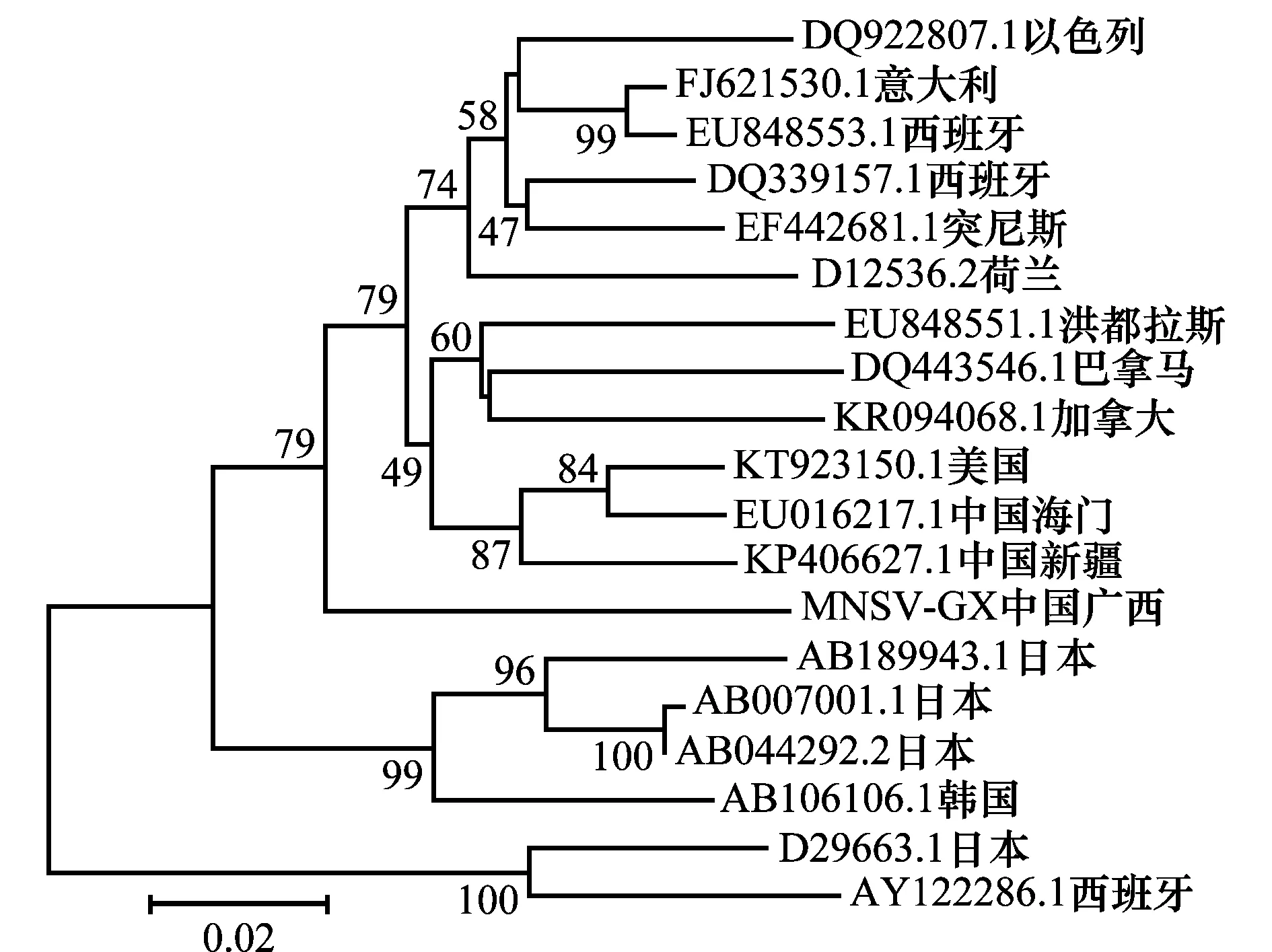
图6 MNSV广西分离物的核苷酸序列亲缘关系分析Fig.6 Phylogenetic relationship analysis between nucleotide sequences of Guangxi isolate and other 18 MNSV isolates reported previously
3 讨论与结论
瓜类褪绿黄化病毒、甜瓜黄斑病毒以及甜瓜坏死斑点病毒是近年来新发现的病毒,尽管没有在各省区大范围发生,但局部发生情况比较严重。据报道,2009年海南三亚保护地甜瓜上甜瓜黄斑病毒的发病率为30%~100%,给甜瓜生产造成了严重的经济损失[14]。据本课题组2014—2015年调查发现,这3种病毒在广西南宁市和北海市的甜瓜种植区有不同程度的发生,其中CCYV在北海、南宁的发病率在20%~70%。随着甜瓜栽培规模和范围的不断扩大,烟粉虱和蓟马等传播媒介种群暴发,这3种病毒病的发生范围将越来越广泛,危害程度日趋严重,及时有效的诊断方法对病害防治尤其重要。
本研究从疑似病毒病的样品中挑选不同症状的样本分别进行3种病毒检测,把检测结果对应其症状,瓜类褪绿黄化病毒(CCYV)引起的是褪绿黄化症状,但类似症状存在未检出现象,可能是缺素引起抑或是其他病毒比如瓜类黄矮失调病毒(CYSDV)[39]引起,有待于进一步研究;甜瓜黄斑病毒(MYSV)引起黄色不规则斑点症状,后期黄斑中间会形成枯死斑,与古勤生[13]等报道的症状表现基本一致;甜瓜坏死斑点病毒(MNSV)引起不规则白色坏死斑沿叶脉分布,叶片还有褪绿症状,与乔宁等[10]描述症状“叶片上产生许多‘米黄点’”相异,可能由于寄主和发病时期不同或其他因素所致。病毒在不同寄主以及寄主不同生长期所表现的症状有差别,同时,各个地域的气候条件和病原群落的构成差异也会影响病毒在寄主上的表征,所以在把握症状的同时需建立快速有效的检测技术,为有效的甜瓜病毒病防治打下基础。CCYV和MYSV分别通过烟粉虱和棕榈蓟马传播,加强栽培管理,治虫防病是防治病毒病的关键;MNSV不仅能通过土壤真菌瓜油壶菌Olpidiumradicale和黄瓜叶甲Diabroticasp.进行自然传播,而且能经种子及水体传播,防治更加困难。了解病害症状和明确病原、传播方式及寄主范围(特别是中间寄主)是防治甜瓜病毒病的关键,快速有效的检测鉴定方法是病毒病防治的基础。刘珊珊等[9]采用两步法RT-PCR对海南省和河南省瓜类褪绿黄化病病原进行分子鉴定,乔宁等[10,16]也运用两步法RT-PCR对山东寿光CCYV、MYSV和MNSV病毒分离物进行分子鉴定,刘勇等[15]运用一步法RT-PCR在广东西瓜上检测到MYSV。此外施艳等[40-41]还针对CCYV外壳蛋白基因和P22基因制备检测病毒的抗血清,曾蓉等[42]也针对CCYV上海分离物外壳蛋白制备检测病毒的抗血清。梁相志等[43]利用环介导等温扩增技术检测介体烟粉虱体内的瓜类褪绿黄化病毒。本研究采用一步RT-PCR方法对为害甜瓜的3种病毒进行检测鉴定,进一步提高了病毒病的检测效率。
通过序列比对和系统发育树分析,CCYV、MYSV和MNSV广西分离物核酸序列与已报道序列相似性达90%以上,属于同种病毒。CCYV广西分离物与伊朗分离物核苷酸相似性只有95.1%,与其他分离物序列相似性均达99%以上,系统发育树分析与乔宁等[10]的报道基本一致,说明CCYV来源基本相同,变异发生率较低。MYSV广西分离物与中国其他分离物核苷酸一致性高达99.5%以上,广西分离物与中国三亚、广州、上海分离物处于同一分支、与乔宁等[16]构建的系统发育树各分离物分布基本一致,说明中国分离物来源基本相同。MNSV广西分离物与其他分离物核苷酸序列一致性仅为83.7%~92.5%,差异稍大,系统发育树分析MNSV广西分离物单独处于一个分支上,与中国海门分离物、中国新疆分离物等处于一个大分支,亲缘关系最近;其次与日本分离物及韩国分离物亲缘关系较近,亲缘关系较远的是日本分离物(D29663.1)和西班牙分离物(AY122286.1),推测MNSV广西分离物可能与日本韩国分离物来源相同。温少华[44]对MNSV中国海门分离物(GU480022.1)的全基因组进行克隆测序与结构分析,MNSV在广西为首次报道,与其他分离物存在一定差异,有必要对MNSV广西分离物的全基因组进行序列结构分析,以便了解各个分离物分子结构特征及基因变异情况。
[1] 朱斌, 梁志妙, 赵秀河, 等. 北海春甜瓜比较试验[J]. 中国果菜, 2016,36(2): 57-58.
[2] 覃斯华, 洪日新, 黄金艳, 等. 广西大棚厚皮甜瓜品种比较试验[J]. 广西农业科学, 2010, 41(10): 1110-1112.
[3] 张曼, 刘文君, 何忠, 等. 广西厚皮甜瓜大棚与露地栽培农艺性状及效益比较[J]. 北方园艺, 2013(7): 25-28.
[4] 卢景润, 刘助生, 范大泳, 等. 桂北设施栽培厚皮甜瓜品种比较试验[J]. 南方园艺, 2012, 23(1): 3-6.
[5] Okuda M, Okazaki S, Yamasaki S, et al. Host range and complete genome sequence ofCucurbitchloroticyellowsvirus, a new member of the genusCrinivirus[J]. Phytopathology, 2010, 100(6): 560-566.
[6] Gu Q S, Liu Y H, Wang Y H, et al. First report ofCucurbitchloroticyellowsvirusin cucumber, melon, and watermelon in China [J]. Plant Disease, 2011, 95(1): 73.
[7] 古勤生, 彭斌, 刘珊珊, 等. 瓜类新病毒病害(一): 瓜类褪绿黄化病[J]. 中国瓜菜, 2011, 24(3): 32-33.
[8] 张汝楠, 李源源, 李大伟, 等. 瓜类褪绿黄化病毒(CCYV)北京分离物基因组序列分析[C]∥中国植物病理学会2012年学术会议论文集. 北京: 中国农业科学技术出版社.
[9] 刘珊珊, 彭斌, 吴会杰, 等. 海南省和河南省发生甜瓜褪绿黄化病的分子鉴定[J]. 果树学报, 2013, 30(2): 291-293.
[10]乔宁, 魏家鹏, 李美芹, 等. 两种甜瓜病毒寿光分离物的分子检测与鉴定[J]. 植物保护, 2015, 41(5): 130-133.
[11]Kato K, Hanada K, Kameya-Iwaki M.Melonyellowspotvirus: a distinct species of the genusTospovirusisolated from melon [J]. Phytopathology, 2000, 90(4): 422-426.
[12]Peng J C, Yeh S D, Huang L H, et al. Emerging threat of thrips-borneMelonyellowspotviruson melon and watermelon in Taiwan[J]. European Journal of Plant Pathology, 2011, 130(2): 205-214.
[13]古勤生, 吴会杰, 彭斌, 等. 瓜类新病毒病害(三): 甜瓜黄化斑点病[J]. 中国瓜菜, 2012, 25(1): 32-33.
[14]Gu Q S, Wu H J, Zhang X J, et al.Melonyellowspotvirusidentified in China for the first time [J].New Disease Reports,2012,25:7.
[15]刘勇, 吴竹妍, 黎园, 等. 广东西瓜上检测到甜瓜黄斑病毒[J]. 植物检疫, 2011, 25(6): 37-39.
[16]乔宁, 王兴翠, 田素波, 等. 黄瓜上甜瓜黄斑病毒寿光分离物的初步鉴定及序列分析[J]. 中国蔬菜, 2015(7): 25-28.
[17]古勤生, 吴会杰, 彭斌, 等. 瓜类新病毒病害(二): 甜瓜坏死斑点病[J]. 中国瓜菜, 2011, 24(5): 35-36.
[18]Gu Q S, Bao W H, Tian Y P, et al.Melonnecroticspotvirusnewly reported in China [J]. Plant Pathology, 2008, 57(4): 765.
[19]Zeng R, Dai F M, Chen W J, et al. First report ofCucurbitchloroticyellowsvirusinfecting melon in China [J]. Plant Disease, 2011, 95(3): 354.
[20]Shi Yan, Shi Yajuan, Gu Qinsheng, et al. Infectious clones of thecrinivirusCucurbitchloroticyellowsvirusare competent for plant systemic infection and vector transmission [J]. Journal of General Virology, 2016,97:1458-1461.
[21]Hamed K, Menzel W, Dafalla G, et al. First report ofCucurbitchloroticyellowsvirusinfecting muskmelon and cucumber in Sudan [J]. Plant Disease, 2011, 95(10): 1321.
[22]Abrahamian P E, Sobh H, Abou-Jawdah Y. First report ofCucurbitchloroticyellowsviruson cucumber in Lebanon [J]. Plant Disease, 2012, 96(11): 1704-1705.
[23]Chen T C, Lu Y Y, Cheng Y H, et al.Melonyellowspotvirusin watermelon: a first record from Taiwan [J]. Plant Pathology, 2008, 57(4): 765.
[24]Kato K, Hanada K. Characterization of the S RNA segment ofMelonyellowspotvirus[J]. Japanese Journal of Phytopathology, 2000, 66(3): 252-254.
[25]Takeuchi S, Okuda M, Hanada K, et al. Spotted wilt disease of cucumber (Cucumissativus) caused byMelonyellowspotvirus[J]. Japanese Journal of Phytopathology, 2001, 67(1): 46-51.
[26]Takeuchi S, Shimomoto Y, Ishikawa K. First report ofMelonyellowspotvirusinfecting balsam pear (MomordicacharantiaL.) in Japan [J]. Journal of General Plant Pathology, 2009, 75(2): 154-156.
[27]Quito-Avila D F, Peralta E L, Martin R R, et al. Detection and occurrence ofMelonyellowspotvirusin Ecuador: an emerging threat to cucurbit production in the region [J]. European Journal of Plant Pathology, 2014, 140(2): 193-197.
[28]Cortez I, Saaijer J, Wongjkaew K S, et al. Identification and characterization of a novel tospovirus species using a new RT-PCR approach [J]. Archive of Virology, 2001, 146(2): 265-278.
[29]Díaz J A, Bernal J J, Moriones E, et al. Nucleotide sequence and infectious transcripts from a full-length cDNA clone of the carmovirusMelonnecroticspotvirus[J]. Archive of Virology, 2003, 148(3): 599-607.
[30]Genoves A, Navarro J A, Pallas V. Functional analysis of the fiveMelonnecroticspotvirusgenome-encoded proteins[J]. Journal of General Virology, 2006,87(8): 2371-2380.
[31]Riviere C J, Rochon D M. Nucleotide sequence and genomic organization ofMelonnecroticspotvirus[J]. Journal of General Virology, 1990, 71(9): 1887-1896.
[32]Li Rugang, Zheng Yi, Fei Zhangjun, et al. Complete genome sequence of an emergingMelonnecroticspotvirusisolate infecting greenhouse cucumber in North America [J]. Genome Announcement, 2015, 3(4): e00775-15.
[33]Ohshima K, Matsuo K, Sako N. Nucleotide sequences and expression inEscherichiacoliof the coat protein genes from two strains ofMelonnecroticspotvirus[J]. Archive of Virology, 1994, 138(1/2): 149-160.
[34]Herrera-Vásquez J A, Córdoba-Sellés M C, Cebrián M C, et al. Genetic diversity ofMelonnecroticspotvirusandOlpidiumisolates from different origins [J]. Plant Pathology, 2010, 59(2): 240-251.
[35]Kubo C, Nakazono-Nagaoka E, Hagiwara K, et al. New severe strains ofMelonnecroticspotvirus: symptomatology and sequencing [J]. Plant Pathology, 2005, 54(5): 615-620.
[36]Yakoubi S, Desbiez C, Fakhfakh H, et al. First report ofMelonnecroticspotviruson melon in Tunisia [J]. Plant Pathology, 2008, 57(2): 386.
[37]Herrera J A, Cebrian M C, Jorda C.First report ofMelonnecroticspotvirusin Panama [J]. Plant Disease, 2006,90(9): 1261.
[38]De Sousa Geraldino Duarte P, Reis Figueira A D, Galvino-Costa S B F, et al. Establishment of a bank of positive controls for diagnosis of quarantine viruses and viroids in Brazil through PCR and RT-PCR [J]. Crop Protection, 2016,86: 31-41.
[39]Abrahamian P E, Seblani R, Sobh H, et al. Detection and quantitation of two cucurbit criniviruses in mixed infection by real-time RT-PCR [J]. Journal of Virological Methods, 2013, 193(2): 320-326.
[40]施艳, 王振跃, 袁媛, 等. 瓜类褪绿黄化病毒p22基因在大肠杆菌中的表达及抗血清的制备[J]. 园艺学报, 2013, 40(4): 762-766.
[41]施艳, 袁媛, 孙虎, 等. 瓜类褪绿黄化病毒外壳蛋白基因在大肠杆菌中的表达及抗血清的制备[J]. 植物病理学报, 2013, 43(5): 495-499.
[42]曾蓉, 徐丽慧, 顾海峰, 等. 瓜类褪绿黄化病毒上海分离物外壳蛋白的原核表达及其抗血清的制备[J]. 中国农学通报, 2014, 30(22): 276-281.
[43]梁相志, 施艳, 李静静, 等. 利用环介导等温扩增技术(LAMP)检测烟粉虱体内的瓜类褪绿黄化病毒(CCYV)[M]∥河南省昆虫学会编著.华中昆虫研究.北京: 中国农业科学技术出版社, 2012, 8: 372.
[44]温少华. 甜瓜坏死斑点病毒(MNSV)中国分离物全基因组序列的克隆和分析[D]. 武汉: 华中农业大学, 2009.
(责任编辑:田 喆)
Molecular detection and identification of three viruses isolatedfrom melons in Guangxi
Yang Shi’an1,2, Li Zhanbiao2, Qin Bixia2, Xie Huiting2,Cui Lixian2, Su Qin2, Deng Tiejun2, Cai Jianhe2
(1. College of Agriculture, Guangxi University, Nanning 530004, China; 2. Guangxi KeyLaboratory of Biology for Crop Diseases and Insect Pests, Plant Protection ResearchInstitute, Guangxi Academy of Agricultural Sciences, Nanning 530007, China)
Cucurbitchloroticyellowsvirus(CCYV),Melonyellowspotvirus(MYSV) andMelonnecroticspotvirus(MNSV), which were emerging threat to melon plantation, have recently been found infecting melons in some large melon-growing areas. In order to understand the incidences of these three viruses, a survey was conducted on these viruses on melons, and leaves infected by CCYV, MYSV and MNSV were collected from Nanning and Beihai, Guangxi. Total RNAs were extracted from these diseased samples and RT-PCR was performed by using specific primers. The PCR products were purified and inserted into pMD19-T cloning vector, and the expected DNA fragment were sequenced and analyzed by BLASTn in GenBank. The results showed that nucleocapsid protein gene sequences of CCYV, MYSV and MNSV isolates from Guangxi had 95.1%-100%, 96.5%-99% and 83.7%-92.5% identities with those of the isolates from other parts of China or some countries reported previously.
Guangxi;Cucurbitchloroticyellowsvirus(CCYV);Melonyellowspotvirus(MYSV);Melonnecroticspotvirus(MNSV); one-step RT-PCR
2016-07-07
2016-11-08
国家现代农业产业技术体系广西特色水果创新团队项目(nycytxgxcxtd-04-19-2);广西自然科学基金(2015GXNSFBA139075);广西农业科学院科技发展基金(2015JZ48);河南郑州果树瓜类重点实验室开放基金(HNS-201508-10)
S 436.5
A
10.3969/j.issn.0529-1542.2017.03.014
* 通信作者 E-mail:caijianhe@gxaas.net
#共同第一作者
