HCV多中和抗原表位嵌合病毒样颗粒免疫获得血清内中和抗体评价①
2017-06-05王晓岩雷迎峰张惠中韦三华
王晓岩 张 海 雷迎峰 林 芳 崔 颖 李 斌 张惠中 韦三华
(第四军医大学唐都医院临床实验与检验科,西安710038)
·免疫学技术与方法·
HCV多中和抗原表位嵌合病毒样颗粒免疫获得血清内中和抗体评价①
王晓岩 张 海②雷迎峰③林 芳 崔 颖 李 斌 张惠中 韦三华④
(第四军医大学唐都医院临床实验与检验科,西安710038)
目的:纯化的HCV多中和抗原表位及HCV包膜蛋白E2嵌合的HBV S抗原病毒样颗粒免疫新西兰兔,测定免疫血清内的中和抗体。分析中和抗体对HCVpp感染Huh7.5的中和作用。方法:纯化的HCV多中和抗原表位及包膜蛋白E2嵌合的HBV S抗原病毒样颗粒(VLPs-MEpS、VLPs-E2S)10 μg皮下接种新西兰兔,间隔2周共免疫3次,采集不同时间免疫兔血清,ELISA方法测定血清内的抗体,PBS组作为对照;制备1b型HCVpp,观察血清抗体对HCVpp感染Huh7.5的中和作用,对免疫血清保护性进行初步评价。结果:免疫后血清中产生一定水平的中和抗体,血清中和抗体测定VLPs-MEpS明显高于VLPs-E2S(P<0.05)。VLPs-MEpS与VLPs-E2S组均显著高于对照PBS组(P<0.01)。对HCVpp抑制作用,VLPs-MEpS高于VLPs-E2S组(P<0.05),最高中和率可达61.49%,二者均高于对照组(P<0.01)。结论:嵌合病毒样颗粒免疫新西兰兔后产生一定水平中和抗体,该中和抗体具有保护作用,为研发中和抗体表位疫苗奠定基础。
丙型肝炎病毒(HCV);表位;病毒样颗粒;中和抗体;免疫
丙型肝炎病毒(Hepatitis C virus,HCV)急性感染后仅20%~30%的感染者能够自发清除病毒,55%~85%感染者发展为慢性化持续感染[1,2],慢性感染者中约20%最终发展为肝硬化、肝细胞肿瘤或肝功能衰竭。全球估计有超过1.85亿人感染HCV,每年新增感染者300~400万人,因HCV感染导致的死亡人数达到35万[3,4]。一直以来丙型肝炎的疫苗研制受到包膜蛋白高度变异、缺乏细胞和小动物模型等多种原因的限制而进展缓慢。近年来以NS3/NS4A 蛋白酶抑制剂(Simeprevir等) 和 NS5B聚合酶抑制剂(Sofosbuvir等)为代表的治疗性药物的发展,为HCV感染治疗带来了突破性的进展,研究显示治疗组的持续病毒学应答(SVR)可达90%以上,因此WHO在2014年丙肝指南中指出丙肝是可以治愈的[5-7]。但是丙肝药物价格昂贵,副作用研究尚未深入,短期内难以广泛应用。因此HCV疫苗的研究仍是最经济的预防和缓解其全球化流行和感染的有效方式,疫苗研究的需求依然迫切。近年来,基于HCV假病毒颗粒(HCVpp)与HCV体外培养系统(HCVcc)的应用和建立,随着人们对中和抗体在机体适应性免疫中的作用,特别是交叉保护作用的认识逐步深入,使诱导产生中和抗体的预防性疫苗研究成为新的希望[8,9]。
我们前期将串联HCV多中和抗原表位嵌合于HBV S的氨基端胞外区,制备嵌合HCV多中和抗原表位的HBV S抗原病毒样颗粒(VLPs-MEpS);同时将HCV包膜蛋白E2嵌合于HBV S抗原氨基端,制备嵌合HCV包膜蛋白E2的HBV S抗原病毒样颗粒(VLPs-E2S);此外制备了嵌合完整HBV基因序列的病毒样颗粒(VLPs-HBS)。成功制备出三种嵌合病毒样颗粒,所得到的VLPs浓度最高可达3.0×104ng/ml,为后续的免疫动物提供了条件。本文中我们将纯化浓缩的嵌合VLPs分别免疫新西兰兔,观察免疫后诱导的中和抗体产生情况,并制备1b型HCVpp,HCVpp和免疫血清混合后感染Huh7.5细胞,通过免疫血清抑制HCVpp感染的作用评价中和抗体的活性,从而为HCV中和抗体疫苗的研究提供实验依据。
1 材料与方法
1.1 材料
1.1.1 试剂 VLPs-MEpS、VLPs-E2S及VLPs-HBS由本室制备保存。四种中和抗原表位多肽由北京Sunny公司合成。DMEM培养液、胎牛血清(FBS)购于Gibco。Lipofectamine 2000®转染试剂购于Invitr-ogen。重组乙型肝炎疫苗(酿酒酵母)安在时®购于GlaxoSmithKline Biologicals。佐剂AddaVaxTM购自美国Invivogen公司。Amicon® Ultracell-15 100K离心过滤器购于Millipore。Anti-Hepatitis C Virus E1、E2 antibody购自美国Abcam公司。HRP标记的羊抗兔购自美国Proteintech公司。HCV包膜质粒pVRC-E1E2(1b)、包装质粒pHR′CMVΔ8.2、转移质粒pCS-CG由第四军医大学微生物教研室雷迎峰博士惠赠。
1.1.2 实验动物 18只新西兰兔,雄性,年龄3个月左右,来自于第四军医大学实验动物中心。
1.2 方法
1.2.1 动物免疫 18只新西兰兔分为6组,每组3只,分别命名为VLPs-MEpS、VLPs-E2S、VLPs-HBS、Vaccine(乙肝疫苗组)、Adjuvant(佐剂组)、PBS组。分别取10 μg纯化的VLPs或10 μg Vaccine与同体积的MF59佐剂混合成油包水状后免疫新西兰兔, PBS补齐确保各个组免疫前体积相同。间隔2周免疫,共免疫3次。兔子背部局部皮下4~5个点注射,3次免疫前先采血。第0天开始耳缘静脉采血,每隔2周采血1次,即0、14、28、42、56和70 d分别采血1次。离心5 min留取血清,分装后-20℃保存备用。
1.2.2 免疫血清抗体测定 合成肽和BSA按照1个BSA 分子结合10个肽分子左右的比例混匀;加入新鲜配制的0.3%戊二醛溶液进行交联,室温作用2 h;用1 mol/L甘油封闭30 min;0.2 mol/L 硼酸缓冲液(pH8.5)透析,0.45 μm滤器过滤,BCA法定量。96孔板包被抗原交联肽(四种交联肽混合物),包被浓度为16 μg/ml,每孔100 μl,4℃过夜;同时包被HBS表面抗原阳性血清(1∶500稀释),PBST洗3遍;2%BSA封闭,37℃ 1 h,PBST洗3遍;加入兔免疫血清(1∶200稀释),37℃ 1 h,PBST洗3遍;加入HRP标记的羊抗兔二抗(1∶4 000稀释),37℃ 1 h,PBST洗3遍;加入TMB显色液100 μl,37℃显色5~10 min;加入终止液50 μl;30 min内450 nm测定OD值。
1.2.3 1b型HCVpp的制备 HEK293T细胞,培养传代至75 cm2培养瓶中培养,细胞密度达80%~90%时,HCV包膜质粒pVRC-E1E2(1b)、包装质粒pHR′CMVΔ8.2、转移质粒pCS-CG,按照比例为3 μg:6 μg:9 μg的量(每75 cm2培养瓶)进行转染,4~6 h后更换含10%胎牛血清的完全培养液。48~72 h间荧光显微镜下观察EGFP表达情况,并在48、72 h分别收获一次培养上清,4℃暂存。
1.2.4 1b型HCVpp的浓缩、鉴定 收获的培养上清,7 000 r/min,4℃离心10 min,弃去沉淀;0.45 μm滤器过滤除菌;Amicon Ultracell-15 100K离心过滤器浓缩上清,分装后-80℃保存;取20 μl浓缩后HCVpp,加入10 μl的5×SDS-PAGE Loading Buffer,煮沸5 min,12 000 r/min离心5 min;取50 μg的产物进行蛋白电泳(SDS-PAGE),电压80 V,20 min,电压120 V,1.5 h左右;转移至NC膜, 26 mA,3 h左右;5%脱脂奶粉封闭2 h;E1多克隆抗体(Anti-E1 pAb)1∶1 000 稀释,E2多克隆抗体(Anti-E2 pAb)1∶2 000稀释;4℃孵育过夜;TBST洗3次,10 min/次;HRP标记的羊抗兔二抗 1∶5 000稀释,室温振荡孵育1 h;TBST洗3次,10 min/次;ECL发光。
1.2.5 HCVpp的转导单位(TU) 的确定 1×105/孔的Huh7.5细胞接种到12孔板中。细胞密度达到80%~90%时,吸附病毒:将浓缩后的HCVpp培养上清用DMEM完全培养液按1∶1、1∶5、1∶10的比例稀释。每个孔加入1 ml的稀释液(每个稀释度两孔),37℃吸附12 h左右;更换为DMEM完全培养液,继续培养48 h。消化细胞,800 r/min离心5 min,PBS清洗2遍(800 r/min,5 min),流式细胞仪计数;取EGFP阳性率达到50%~80%的HCVpp稀释度。根据病毒合适稀释度下EGFP阳性细胞数来计算制备的HCVpp的转导单位。计算方法为:TU/ml=(初始靶细胞数/HCVpp ml体积)×(EGFP阳性细胞的百分率/100)。计算出EGFP阳性率达到50%~80%时所需HCVpp转导单位。
1.2.6 免疫血清对HCVpp感染Huh7.5细胞的抑制性分析 将2×104/孔的Huh7.5细胞接种于24孔板,37℃,5%CO2条件下过夜培养。细胞密度达70%~80%为最宜;将免疫血清(预先56℃、30 min灭活)1∶10(100 μl)稀释,与含有合适转导单位的HCVpp(1b型)等体积混合均匀,室温1 h;DMEM清洗24孔板,将HCVpp与血清混合物加到24 孔板中,每孔200 μl。37℃吸附12 h后,更换DMEM完全培养液;48 h后流式细胞仪计数表达EGFP的阳性细胞的比率。PBS组为非抑制对照。每组均做3个复孔。中和率(抑制率)计算:中和率=(%EGFP对照组-%EGFP实验组)/%EGFP对照组。
2 结果
2.1 免疫血清中抗体的ELISA测定 分别包被抗原交联肽和HBV表面抗原阳性血清,检测兔免疫血清中抗体产生情况。以收取血清的不同时间点为横坐标,ELISA检测结果OD值为纵坐标作图,分析不同组别中抗体的水平。ELISA检测结果可见VLPs-MEpS组和VLPs-E2S组抗体水平(OD值)随着免疫时间延长逐渐上升,42 d达到高峰。42 d时VLPs-MEpS组为1.15±0.02,VLPs-E2S组为0.97±0.07,对照PBS组为0.08±0.02。VLPs-MEpS组的血清抗体水平高于VLPs-E2S组(P<0.05);二者均明显高于对照PBS组(P<0.01)(图1A)。表明嵌合病毒样颗粒免疫兔后产生了一定水平的抗体。以HBV表面抗原阳性血清作为包被抗原,检测HBV S抗原载体的免疫原性,可见VLPs-MEpS、VLPs-E2S、VLPs-HBS、Vaccine均有较高的免疫反应,42 d时VLPs-MEpS组OD值为1.43±0.13,VLPs-E2S组为1.26±0.11,VLPs-HBS为1.30±0.16,Vaccine组为1.6±0.1,对照PBS组为0.13±0.02。各组抗体水平明显高于对照PBS组(P<0.01,图1B)。结果表明HCV多中和抗原表位嵌合病毒样颗粒具有良好的免疫原性。
2.2 HCVpp的制备及鉴定
2.2.1 1b型 HCVpp的包装 三种质粒共转染HEK293T细胞48、72 h后,荧光显微镜下观察,均可见约80%的细胞发出绿色荧光,表明HCVpp包装成功(图2)。
2.2.2 HCVpp表面包膜蛋白E1、E2的鉴定 20 μl 浓缩后HCVpp 进行Western blot分析,结果可见,用抗E1多抗作为一抗时,在约35 kD处检测到蛋白,即为糖基化的包膜蛋白E1(图3);用抗E2多抗作为一抗时,在约58 kD处检测到蛋白,即为糖基化的包膜蛋白E2(图4); 结果表明包膜蛋白E1E2成功嵌入到HCVpp表面。
2.3 免疫血清对HCVpp感染Huh7.5细胞的抑制性分析 免疫血清1∶10稀释后与等体积HCVpp混合,加入Huh7.5细胞,48 h后观察血清对HCVpp感染Huh7.5的中和作用。实验结果显示,42 d时VLPs-MEpS组中和率(%)为61.49±1.50,VLPs-E2S组为47.30±2.07,PBS组为-1.57±0.42。VLPs-MEpS组血清对1b型HCVpp感染Huh7.5的中和作用高于VLPs-E2S组(P<0.05)。VLPs-MEpS组和VLPs-E2S组显著高于对照PBS组(P<0.01),并且最高中和率可达61.49%(图5A);免疫后(42 d)与免疫前(0 d)比较VLPs-MEpS组和VLPs-E2S组中和率有显著差异(P<0.01,图5B)。

图1 免疫血清中抗体的测定Fig.1 Analysis level of antibody in rabbit serumNote: A.Coating with polypeptide;B.Coating with HBsAg.
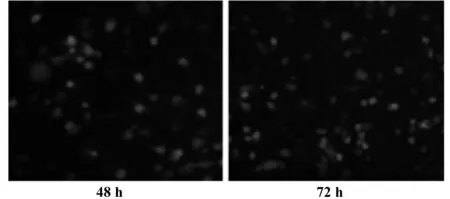
图2 三种包装质粒共转染后EGFP的表达(×40)Fig.2 EGFP expression after co-transfection of three plasmids(×40)
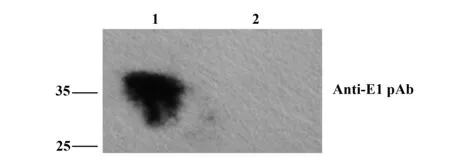
图3 Western blot检测1b型HCVpp表面包膜蛋白E1Fig.3 Western blot analysis of E1 on surface of 1b HCVppNote: 1.HCVpp of genotype 1b;2.Negative control.

图4 Western blot检测1b型HCVpp表面包膜蛋白E2Fig.4 Western blot analysis of E2 on surface of 1b HCVppNote: 1.Negative control;2.HCVpp of genotype 1b.

图5 兔免疫血清对HCVpp感染Huh7.5细胞的抑制性分析Fig.5 Inhibition analysis of rabbit serum to HCVpp infection to Huh7.5 cellsNote: 42 d vs 0 d,**.P<0.01.
3 讨论
HCV感染后,病毒中许多蛋白抗原(如核心蛋白、包膜蛋白和非结构蛋白)都可诱导抗体产生。但在这些抗体中,只有针对包膜糖蛋白E1/E2的中和抗体具有保护作用。近年来研究发现,HCV包膜糖蛋白E1/E2存在保守的中和性抗原表位,针对这些表位的单克隆抗体具有广谱的交叉中和活性[10-12]。以上研究结果为中和表位疫苗的研究提供了依据。寻求理想的载体,呈递和表达中和抗原表位,成为HCV中和表位疫苗研究的方法之一。
病毒样颗粒(Virus like particles,VLPs)是不含病毒颗粒,形态结构与天然病毒相似的能自我装配的病毒空壳。绝大多数的VLPs直径在20~100 nm之间,这使得其能够自由进入淋巴管到达被膜下淋巴结选择性的被抗原提呈细胞所摄取[13]。许多病毒结构蛋白都具有自主组装成VLPs的能力。由于VLPs不含病毒遗传物质,所以不具备感染性,而具有很强的免疫原性和生物学活性,广泛应用于疫苗研究领域[14,15]。VLPs在结构上允许外源基因或基因片段的插入而形成嵌合体VLPs并将外源性抗原展示在其表面,保留了天然病毒颗粒的空间构象和诱导中和抗体的抗原表位,比亚单位疫苗和重组的蛋白疫苗具有更强的免疫原性,能够激发机体体液免疫、细胞免疫及黏膜免疫。其机制可能为VLPs的大小适合被树突状细胞(DC)摄取,经加工处理后的抗原可通过MHCⅡ类分子提呈,促进树突状细胞的成熟和迁移。而外源性的VLPs能通过交叉提呈的方式通过MHCⅠ类分子提呈,从而活化CD8+T细胞,介导保护性免疫反应[16]。
HBV小包膜蛋白抗原(HBsAg-S)基因大小为681 bp,在无核心蛋白和基因组参与下有自我装配能力。其101~159位氨基酸区域为亲水区,形成的双环结构可表达外源性表位蛋白,在哺乳动物细胞中形成与野生型病毒相似的VLPs,可分泌至细胞外。国内外研究者以HBV S 为载体,对嵌合表达的病原体如A型流感病毒、HIV等保守的表位进行了研究[17,18],以及已完成临床3期试验的RTS,S/AS01疟疾疫苗(其中RTS代表环子孢子蛋白,S代表HBV S)[19]。
各国学者在HCV VLPs方面做出许多尝试。美国国立卫生院Liang等[20]用重组杆状病毒包装HCV结构蛋白core、E1、E2形成VLPs用于免疫狒狒,诱导出较强的细胞和体液免疫。法国科学家Huret等[21]用逆转录病毒MLV Gag和重组质粒为核心,1a型HCVE1、E2为包膜,包装重组HCV病毒样颗粒,在小鼠体内诱导出特异性的细胞免疫和体液免疫应答。澳大利亚学者以HBV S基因为载体,嵌合HCV E2高变区HVR1至亲水区,形成VLPs,在小鼠体内诱导出抗HCV活性的抗血清,可抑制HCVpp感染Huh7细胞[22]。Beaumont等[23]将HCV E1和E2分别嵌合在HBV S的氨基端,并用HCV E1和E2的TMD替换HBV S基因的第一个TMD,在BHK-21和CHO细胞系中成功包装出嵌合的VLPs,但该研究不足之处是用HCV TMD替换HBV S基因TMD后,只有野生型VLPs存在下才能分泌出嵌合的VLPs。
我们在前期研究中,将HBV S基因克隆至表达载体pCI-neo中,并将选择的4个已明确的HCV中和抗原表位分别嵌合于HBV S抗原亲水区,转染293T细胞,在培养上清中得到了嵌合HCV中和抗原表位的HBV S抗原病毒样颗粒(VLPs),纯化浓缩后免疫小鼠,结果小鼠血清检测到低水平的中和抗体,具有一定保护作用[24]。在此基础上,我们将表位串联,插入HBV S基因胞外区,制备嵌合多中和抗原表位的病毒样颗粒,并得到较高水平的嵌合病毒样颗粒。用纯化浓缩的VLPs免疫新西兰兔,收集免疫后的血清。以合成多肽为包被抗原,ELISA法检测兔免疫血清中抗体的水平,发现VLPs-MEpS组和VLPs-E2S组相比对照组明显检测到血清中的抗体,差异有统计学意义(P<0.01)。免疫后第42天,抗体量达到高峰。VLPs-MEpS组高于VLPs-E2S组,差异有统计学意义(P<0.05),结果显示了串联多中和抗原表位制备的VLPs具有较好的免疫性。同时我们制备了用于评价中和抗体水平及保护作用的HCVpp,以一定转导单位的1b型HCVpp与免疫血清混合后感染Huh7.5细胞,结果发现血清内的抗体对HCVpp感染Huh7.5有一定的抑制作用,抑制作用在42 d达到高峰,VLPs-MEpS组的抑制效果(中和率)高于VLPs-E2S免疫组,差异有统计学意义(P<0.05),两组均明显高于对照组,差异有统计学意义(P<0.01)。VLPs-MEpS组和VLPs-E2S组在免疫后(42 d)免疫血清抑制HCVpp感染Huh7.5作用明显高于免疫前(0 d),差异有统计学意义(P<0.01)。结果表明免疫血清中产生中和抗体,并且中和抗体具有一定的保护作用。下一步我们将用不同型别的HCVpp及HCVcc评价免疫血清中的中和抗体的保护作用。进一步证实嵌合多中和抗原表位病毒样颗粒疫苗的可行性。
[1] Santantonio T,Wiegand J,Gerlach JT.Acute hepatitis C:current status and remaining challenges[J].J Hepatol,2008,49(4):625-633.
[2] Webster DP,Klenerman P,Dusheiko GM.Hepatitis C[J].Lancet,2015,385(9973):1124-1135.
[3] Messina JP,Humphreys I,Flaxman A,etal.Global distribution and prevalence of hepatitis C virus genotypes[J].Hepatology,2015,61(1):77-87.
[4] El-Guindi MA.Hepatitis C viral infection in children:updated review[J].Pediatr Gastroenterol Hepatol Nutr,2016,19(2):83-95.
[5] Soriano V,Labarga P,Barreiro P,etal.Drug interactions with new hepatitis C oral drugs[J].Expert Opin Drug Metab Toxicol,2015,11(3):333-341.
[6] Lee R,Kottilil S,Wilson E.Sofosbuvir/velpatasvir:a pangenotypic drug to simplify HCV therapy[J].Hepatol Int,2016,11(2):161-170.
[7] Afdhal N,Zeuzem S,Kwo P,etal.Ledipasvir and sofosbuvir for untreated HCV genotype 1 infection[J].N Engl J Med,2014,370(20):1889-1898.
[8] Wakita T.Hepatitis C virus vaccine[J].Nihon Rinsho,2008,66(10):1961-1964.
[9] Catanese MT,Dorner M.Advances in experimental systems to study hepatitis C virus in vitro and in vivo[J].Virology,2015,479-480:221-233.
[10] Bose M,Mullick R,Das S,etal.Combination of neutralizing monoclonal antibodies against Hepatitis C virus E2 protein effectively blocks virus infection[J].Virus Res,2016,224:46-57.
[11] Johansson DX,Voisset C,Tarr AW,etal.Human combinatorial libraries yield rare antibodies that broadly neutralize hepatitis C virus[J].Proc Natl Acad Sci U S A,2007,104(41):16269-16274.
[12] Sandomenico A,Leonardi A,Berisio R,etal.Generation and characterization of monoclonal antibodies against a cyclic variant of hepatitis C virus E2 epitope 412-422[J].J Virol,2016,90(7):3745-3759.
[13] Frietze KM,Peabody DS,Chackerian B.Engineering virus-like particles as vaccine platforms[J].Curr Opin Virol,2016,18:44-49.
[14] Kushnir N,Streatfield SJ,Yusibov V.Virus-like particles as a highly efficient vaccine platform:diversity of targets and production systems and advances in clinical development[J].Vaccine,2012,31(1):58-83.
[15] Liu J,Dai S,Wang M,etal.Virus like particle-based vaccines against emerging infectious disease viruses[J].Virol Sin,2016,31(4):279-287.
[16] Warfield KL,Bosio CM,Welcher BC,etal.Ebola virus-like particles protect from lethal Ebola virus infection[J].Proc Natl Acad Sci U S A,2003,100(26):15889-15894.
[17] Cheong WS,Reiseger J,Turner SJ,etal.Chimeric virus-like particles for the delivery of an inserted conserved influenza A-specific CTL epitope[J].Antiviral Res,2009,81(2):113-122.
[18] 李学仁,陈 红,王 文,等.三个HIV-1广谱中和表位与HBV S抗原融合表达可诱导小鼠特异性抗体应答[J].病毒学报,2008,24(4):260-267.
[19] Neafsey DE,Juraska M,Bedford T,etal.Genetic diversity and protective efficacy of the RTS,S/AS01 malaria vaccine[J].N Engl J Med,2015,373(21):2025-2037.
[20] Jeong SH,Qiao M,Nascimbeni M,etal.Immunization with hepatitis C virus-like particles induces humoral and cellular immune responses in nonhuman primates[J].J Virol,2004,78(13):6995-7003.
[21] Huret C,Desjardins D,Miyalou M,etal.Recombinant retrovirus-derived virus-like particle-based vaccines induce hepatitis C virus-specific cellular and neutralizing immune responses in mice[J].Vaccine,2013,31(11):1540-1547.
[22] Netter HJ,Woo WP,Tindle R,etal.Immunogenicity of recombinant HBsAg/HCV particles in mice pre-immunised with hepatitis B virus-specific vaccine[J].Vaccine,2003,21(21-22):2692-2697.
[23] Beaumont E,Patient R,Hourioux C,etal.Chimeric hepatitis B virus/hepatitis C virus envelope proteins elicit broadly neutralizing antibodies and constitute a potential bivalent prophylactic vaccine[J].Hepatology,2013,57(4):1303-1313.
[24] 王晓岩,张 海,舒 放,等.HCV中和抗原表位与HBV S抗原嵌合病毒样颗粒诱导的中和抗体应答及保护评价[J].免疫学杂志,2015,31(11):945-950.
[收稿2016-11-25 修回2017-01-19]
(编辑 倪 鹏)
Evaluation of neutralizing antibodies in serum immunized with virus-like particle chimerized HCV series of neutralizing epitopes
WANGXiao-Yan,ZHANGHai,LEIYing-Feng,LINFang,CUIYing,LIBin,ZHANGHui-Zhong,WEISan-Hua.
DepartmentofClinicalLaboratoryMedicine,TangduHospital,FourthMilitaryMedicalUniversity,Xi′an710038,China
Objective:New Zealand rabbits were immunized with VLPs-MEpS,VLPs-E2S,and the levels of neutralizing antibodies in serum were determined.Methods: New Zealand rabbits were immunized with 10 μg VLPs-MEpS and VLPs-E2S,serum was collected at diffferent time with a two-weeks interval.The neutralizing antibodies were determined by ELISA.HCV(type 1b) had been prepared and mixed with serum from immunized rabbit before infected Huh7.5 cell.The protection of neutralizing antibodies in serum was assessed.Results: Neutralizing antibodies had been induced in rabbit after immunized with VLPs-MEpS and VLPs-E2S.VLPs-MEpS group had higher titer of antibodies than that of VLPs-E2S group(P<0.05),both group had higher titer of antibodies than that of control groups significantly(P<0.01).VLPs-MEpS group had higher neutralization than that of VLPs-E2S group(P<0.05),the highest neutralization rate was 61.49%.Both groups were higher than control group notably(P<0.01).Conclusion: Protective neutralizing antibodies have been induced in New Zealand rabbit after immunized with VLPs-MEpS and VLPs-E2S.It′s the basement for development of neutralizing antibodies vaccine.
Hepatitis C virus(HCV);Epitope;Virus-like particle;Neutralizing antibody;Immunization
10.3969/j.issn.1000-484X.2017.05.015
①本文为国家自然科学基金项目(No.31370924, 31570933 )。
王晓岩(1989年-),男,硕士,主要从事丙型肝炎病毒方面的研究,E-mail: wxywinter@163.com。
R373.21
A
1000-484X(2017)05-0707-06
②第四军医大学实验动物中心,西安710032。
③第四军医大学基础部微生物学教研室,西安710032。
④通讯作者,E-mail: sanhuawei3@163.com。
