青藤碱抗肝癌作用机制研究
2017-06-05王高峰张利娟
王高峰 张 强 张利娟
(黄河科技学院医学院实验中心,郑州450063)
青藤碱抗肝癌作用机制研究
王高峰 张 强 张利娟
(黄河科技学院医学院实验中心,郑州450063)
目的:探讨青藤碱对HepG2人肝癌细胞株的增生和转移能力的多靶向作用机制。方法:运用噻唑蓝还原法(MTT)来检测青藤碱对HepG2人肝癌细胞株的抗增殖作用,而同时运用Transwell 法来检测药物对于细胞转移能力的作用变化;间接荧光标记法测定经过不同浓度的青藤碱作用后,细胞内活性氧水平的变化;利用酶抑制动力学方法,研究青藤碱对逆转录酶的抑制作用;再通过逆转录聚合酶链式反应和蛋白质印迹的实验来检测HepG2细胞中凋亡蛋白水平的变化。结果:青藤碱对HepG2人肝癌细胞株具有抗侵袭及转移的治疗作用。MTT检测结果显示青藤碱对于HepG2人肝癌细胞抗增殖作用明显,半抑制浓度IC50为(15.35±2.43)μmol/L;而Transwell法的结果显示青藤碱对癌细胞有较好的抗转移能力;青藤碱是一种有效的逆转录酶抑制剂,IC50为(21.32±2.43)μmol/L;荧光标记法检测细胞内活性氧水平随青藤碱呈浓度依赖性升高;蛋白水平测定显示青藤碱上调HepG2人肝癌细胞CASP3、CASP9、CAV1和下调SOX2的表达。 结论:青藤碱可能是通过上调CASP3、CASP9、CAV1和下调SOX2的表达,进而抑制人肝癌细胞的增殖和转移,调节相关信号通路,最终在分子水平证明青藤碱对HepG2人肝癌细胞的抑制作用。
青藤碱;HepG2人肝癌细胞;活性氧水平;逆转录酶;CASP3;CASP9;CAV1;SOX2
青藤碱(Sinomenine)是从防已科植物青藤的根茎中提取出来的一种生物碱单体,结构类似吗啡,其药用形式多为盐酸盐。目前已有多篇文献报道青藤碱具有镇痛、抗炎、免疫抑制、心脑血管保护等药理作用,临床已有相关制剂用于治疗风湿性关节炎、心律失常等[1]。近年来,随着对青藤碱研究的深入,发现了一些新的药理作用及机制,尤其是抗肿瘤方面的作用愈来愈受到国内外学者的重视[2,3]。
传统意义上的化疗对肝癌的治疗,虽然取得了一定的疗效,但存在较大的毒副作用,特别是其潜在引起了肿瘤细胞的耐药性以及引发肿瘤细胞的扩散与转移[4]。因此寻找一种新型的毒副作用小,且能够防止肝癌细胞转移的药物,是一项重要的研究课题。本研究重点在于探讨青藤碱对于人肝癌细胞的增生和转移能力的抑制作用。选用HepG2人肝癌细胞株,检测青藤碱对人肝癌细胞株生长的抑制率以及抑制细胞的侵袭和转移能力的效果。再通过mRNA的分子水平来检测青藤碱对于凋亡相关基因以及转移侵袭相关基因的表达影响。本实验为肝癌的治疗提供了一种潜在的新药物即青藤碱,并且在细胞体外,以及分子水平检测其治疗效果,为后续的临床工作提供了可靠的实验数据。
1 材料与方法
1.1 材料
1.1.1 试验药物 青藤碱购买自美国Sigma公司,纯度大于98%,该冻干粉末已经通过HPLC与质谱检测(图1)。
1.1.2 细胞 HepG2人肝癌细胞株购自ATCC(中国科学院典型培养物种保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心),在本实验室进行培养。将细胞置于恒温37℃、5%CO2以及恒定湿度的培养箱中培养。当细胞生长到铺单层达80%,使用0.25%胰蛋白酶(美国,Gibco)消化传代至新的培养瓶中继续培养以备后续实验所需。
1.1.3 试剂 MTT试剂盒(美国Biosharp公司);Transwell(孔径为8.0 μm)小室滤膜(美国Corning公司);细胞外基质胶(美国,BD Bioscience);丙烯酰胺、甲叉双丙烯酰胺、四甲基乙二胺、十二烷基硫酸钠(美国Sigma公司);过硫酸铵(上海阿拉丁试剂公司);TritonX-100(上海时代生物科技有限公司);2-巯基乙醇(上海阿拉丁试剂公司);Tris base(国药集团化学试剂有限公司);RNA Mini试剂盒(美国 PureLink 公司);一步法RT-qPCR System试剂盒(美国Qiagen公司);β-actin鼠抗人单克隆抗体、CASP3、CASP9、CAV1;SOX2鼠抗人多克隆抗体;HRP标记羊抗兔的多克隆抗体(美国Santa Cruz公司);Bradford蛋白浓度测定试剂盒(美国Biorad公司)等。
1.1.4 仪器 pHS-3C型酸度计(上海雷磁仪器厂);NUAIR-NU-5510E细胞培养箱(美国Nuaire公司);酶标仪(美国PE公司);微量加样器(法国Gilson公司);RealPlex2 Thermal Cycler器 (美国Eppendorf公司); 高压电泳仪、VⅡ型垂直板电泳槽高压电泳仪(北京君意东方电泳设备有限公司);GWA-UN2超纯水仪(北京普析通用仪器有限责任公司)等。

图1 青藤碱的高效液相色谱图Fig.1 High performance liquid chromatography of sinomenine
1.2 方法
1.2.1 MTT实验测定细胞增殖[5]将细胞增殖处于对数生长期的HepG2人肝癌细胞,使用胰蛋白酶消化后,培养基清洗获得细胞悬浮液,接种于96孔培养板中。设空白对照组和青藤碱组。每组设4个重复实验孔。进行4次重复实验,在合适条件下进行24 h细胞培养,根据MTT试剂盒说明书以及酶标仪检测获得每孔OD值数据,计算细胞的生长抑制率,细胞生长抑制率(%)=(实验组OD值/对照组OD值)×100%。
1.2.2 Transwell 实验测定细胞侵袭与转移能力 准备Transwell小室的滤膜内表面涂细胞外基质胶(50 μg/室)。小室干燥后重新加入含有0.1%胎牛血清的细胞培养基水化(在进行细胞转移能力实验时无需进行外基质胶的涂层和水化)。在Transwell小室的下室中加入新鲜10%胎牛血清培养基,而在上室中加入0.1%胎牛血清的细胞培养基培养 24 h 的重悬浮细胞(浓度为4.0 × 105ml-1),每孔中加入100 μl细胞悬浮液。常规细胞培养16 h。取出小室后,使用PBS溶液冲洗滤膜,使用PBS棉棒吸除和擦除上室的细胞,再根据Transwell小室使用说明进行染色观察并计算穿膜的细胞数,从而反映各组细胞的侵袭和转移能力。实验进行4次重复实验。
1.2.3 流式细胞仪检测HepG2细胞内ROS[6]将对数生长期HepG2细胞以1×105/孔接种于96孔板中,置于恒温恒湿培养箱培养。培养24 h后,分别加入不同浓度的青藤碱培养基,同时设空白对照,每个药物4个平行孔。培养48 h后,收集细胞用PBS重新悬浮细胞,首先加入5 μl的FITC-Annexin V避光染色5 min,然后再加入10 μl的PI,在室温下避光孵育15 min。取样后,加入到流式细胞仪,进行荧光强度检测。
1.2.4 HepG2细胞逆转录酶活性检测 参照张晨等[7]方法,对HepG2细胞中的逆转录酶进行提取,将青藤碱100 μl加入到96 孔培养板中,并加入20 μl含逆转录酶的PBS溶液、70 μl的 RT Buffer,在37℃水浴1 h后,用洗液清洗3次,除去未结合的游离底物,再向每孔中加入100 μl BSA(1%)溶液,在室温下进行30 min的封闭,之后洗板,并再向每孔中加入50 μl的SA-ALP稀释液,在37℃水浴 1 h后洗板,最后向每孔中加入底物 PNPP(1 mg/ml)50 μl。在405 nm波长下,利用酶标仪测OD值,计算酶的抑制率,抑制率=(空白对照孔OD值-实验孔OD值)/空白对照孔OD值×100%。
1.2.5 Westren blot实验 首先将对数生长期的细胞加入到阳性组、空白对照组和青藤碱组培养基中,在37℃,5%CO2饱和湿度的环境下孵化24 h后弃培养基,加入1×SDS样品缓冲液,在冰上刮落细胞,并转移到Ep管中,煮沸样品5 min,12 000 r/min离心5 min,取上清液;应用RIPA裂解液裂解细胞,收集裂解液至离心管中,在振荡器上混匀4~15 min,14 000 r/min离心15 min(4℃),弃沉淀,用Bradford法或其他蛋白质测定方法测定上清中蛋白浓度以调整上样体积和上样量,以12%SD-聚丙烯酰胺凝胶进行电泳分离,电泳完毕后将胶浸于转移缓冲液中平衡10 min,三明治用海绵3层滤纸胶膜装配,每层放好后,用试管赶去气泡,将转移槽置于冰浴中,放入三明治,加入转移缓冲液,插上电极,100 V,1 h,转膜结束后,切断电源,取出杂交膜。之后用25 ml TBS洗膜5 min,置于25 ml封闭缓冲液1 h,加入合适稀释度的一抗[大鼠抗人GAPDH(1∶1 000),CASP3(1∶1 000),CASP9(1∶1 000),Caveolin-1(1∶1 000)和SOX2(1∶1 000)多克隆抗体],室温孵化2 h,缓慢摇动,TBS洗3次,加入碱性磷酸酶,室温孵育1 h,TBS洗3次,一抗孵育NC膜, 4℃过夜;缓慢摇动,TBS洗3次,加入碱性磷酸酶,室温孵育1 h,TBS洗3次;一抗结合后洗脱,再进行二抗孵育[HRP标记兔抗大鼠的多克隆抗体(1∶10 000)],以管家基因Bactin编码蛋白水平作为内对照;定量测定参照定量ELISA试剂盒说明,酶标仪进行定量检测。
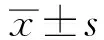
2 结果
2.1 青藤碱抑制HepG2细胞体外增殖 青藤碱(0~150 μmol/L)作用HepG2细胞后,随着青藤碱浓度的增加,青藤碱对肝癌HepG2细胞的生长抑制率在不断地增强,并且随着时间的增加,细胞的生长抑制率也在不断地增强,分别计算24、48和72 h 青藤碱对肝癌HepG2细胞生长的半抑制浓度IC50为(118.76±7.65)、(75.65±5.43)和(52.54±2.76)μmol/L,详见图2。
2.2 青藤碱对HepG2细胞内ROS的影响 图3显示,利用流式细胞免疫荧光术检测细胞内活性氧水平,结果如表1所示,经过不同浓度青藤碱作用HepG2细胞48 h后,细胞内活性氧水平随着青藤碱呈浓度依赖性升高,与空白对照组比较,差异具有统计学意义(P<0.05)。
2.3 青藤碱抑制HepG2细胞体外侵袭和转移 经过Transwell小室法发现随着青藤碱浓度的增加,处理后的人肝癌HepG2细胞的侵袭和转移能力呈现显著降低的趋势。不同浓度青藤碱组与空白对照组(生理盐水空白组)比较,差异具有统计学意义(P<0.05),见表2。
2.4 青藤碱对人肝癌HepG2细胞逆转录酶活性的抑制作用 图4显示了青藤碱对人肝癌HepG2细胞逆转录酶的抑制作用,随着青藤碱浓度的增加,逆转录酶的活性呈不断下降的趋势,直到青藤碱的浓度达到150 μmol/L后,逆转录酶的相对活性趋于平缓;解析IC50为(42.16±4.21)μmol/L,显示出青藤碱对人肝癌HepG2细胞逆转录酶有良好的抑制效果。

图2 青藤碱对肝癌HepG2细胞生长的抑制作用Fig.2 Inhibitory effect of sinomenine on growth of hepatocellular carcinoma HepG2 cells

图3 青藤碱诱导HepG2细胞ROS的产生Fig.3 Sinomenine induced HepG2 cells ROS


GroupsDose(μmol/L)Averagefluorescenceintensity(%)Controlgroup-1.12±0.17Sinomeninegroup106.67±0.511)2514.65±1.482)5027.59±2.662)7542.65±4.142)15065.34±5.762)
Note:Compared with the control group,1)P<0.05,2)P<0.01.


GroupsDose(μmol/L)Invasionexperiment(Numberoftransme-mbranecells,×103)Transferexperiment(Numberoftransme-mbranecells,×103)Controlgroup-25.17±2.3238.43±3.43Sinomeninegroup1017.54±1.761)29.17±1.891)2510.56±0.871)22.67±1.221)504.23±0.542)15.76±0.982)751.57±0.132)10.98±0.562)1500.73±0.062)7.54±0.482)
Note:Compared with the control group,1)P<0.05,2)P<0.01.


GroupsDose(μmol/L)Content(%)CASP3CASP9CAV1SOX2Controlgroup-1.02±0.041.01±0.051.04±0.050.99±0.07Sinomeninegroup101.43±0.171)1.26±0.141)1.22±0.121)0.91±0.041)251.76±0.211)1.45±0.151)1.32±0.191)0.84±0.031)502.02±0.251)1.76±0.211)1.46±0.151)0.75±0.041)752.35±0.271)1.94±0.331)1.61±0.161)0.62±0.071)1502.88±0.312)2.51±0.352)1.77±0.231)0.52±0.032)
Note:Compared with the control group,1)P<0.05,2)P<0.01.

图4 青藤碱对肝癌HepG2细胞逆转录酶的抑制作用Fig.4 Inhibitory effect of sinomenine on reverse transcriptase of hepatocellular carcinoma cells HepG2
2.5 青藤碱在蛋白水平对CASP3、CASP9、CAV1和SOX2的表达影响 使用Western blot检测青藤碱组和空白对照组CASP3、CASP9、CAV1和SOX2基因的蛋白表达水平(各组数据与内参GAPDH的比值)。结果显示青藤碱组中CASP3、CASP9和CAV1的蛋白表达量明显高于空白对照组的相应蛋白表达量(P<0.05),而对于SOX2蛋白的表达,青藤碱组的蛋白表达量显著降低(P<0.05)。
3 讨论
肝癌具有高复发率、高转移率且极容易产生对药物的耐药性,其常规治疗方法包括化学药物治疗与放射治疗结合,而化疗药物副作用极大,对于患者的免疫系统造成很大的损伤,特别是对脊髓的造血功能抑制,且易使癌细胞形成耐药性。所以迫切需要寻找一种更为长期有效以及副作用较小的药物,作为新药开发的方向。最近几年在中外各国对于肿瘤学的基础研究中,证实了青藤碱对多种肿瘤癌细胞具有显著的体外与体内治疗作用,其中不仅包括了对肿瘤的细胞增长抑制,诱导凋亡以及对肿瘤的血管生长抑制和肿瘤的转移,多方面的功效研究证明了青藤碱的广谱抗肿瘤效果[2,3,8-10]。
本实验在机理研究的过程中,体现了青藤碱的多靶点作用优势,本实验运用MTT法检测了青藤碱对人肝癌HepG2细胞的生长抑制作用,且存在浓度和时间依赖性;为其药效的持续作用提供了基础。ROS是由细胞内氧代谢过程中产生的具有很高生物活性的氧分子[11]。这些氧分子主要由超羟自由基(·OH)、氧阴离子自由基(O2-·)、过氧化氢(H2O2)和单线态氧(O2)等氧自由基组成[12]。在机体内,这些氧分子能够与自身的消化达到一种动态平衡,这种动态平衡一旦被打破,ROS则促进细胞的快速凋亡[13,14];多项研究表明CASP3与CASP9在肿瘤的凋亡通路中起到开关作用[15-17],而CAV1及SOX2则在人肝癌细胞的转移过程中占重要地位[18]。细胞凋亡相关蛋白CASP3、CASP9的上调,表明了青藤碱体外抑制人肝癌HepG2细胞的增殖是通过引发细胞凋亡而引起。蛋白CAV1的上调和SOX2的下调则表明了青藤碱能够在体外抑制人肝癌HepG2细胞的侵袭与转移的过程[19]。通过以上分子学水平的检测,青藤碱可能是通过上调CASP3、CASP9、CAV1和下调SOX2的表达,进而抑制人卵巢癌细胞的增殖和转移。从而调节相关信号通路,最终在分子水平证明青藤碱对HepG2人肝癌细胞的抑制作用。
众所周知,逆转录酶催化的反应也叫反转录(Reverse transcription)。在这个过程中,肝癌HepG2细胞的逆转录酶可以催化逆转录过程的发生,即催化脱氧核糖核苷酸以RNA为模板合成DNA,之后形成一代又一代的DNA,之后人肝癌HepG2细胞双链DNA进行环化,最终完成人肝癌HepG2细胞中DNA的复制[7],所以基于逆转录酶的作用机制,我们以逆转录酶为作用靶点,进行抗肝癌药物研发具有重要意义。本文研究发现,青藤碱对人肝癌HepG2细胞的逆转录酶活性有一定的抑制作用,这意味着青藤碱可能通过阻断肝癌HepG2细胞中DNA的复制,达到抑制HepG2细胞生长的目的,为青藤碱的多靶点性抗肝癌活性提供了理论基础,也为青藤碱应用于临床肝癌治疗提供了基础的实验数据,其将作为一种新型抗肝癌的化疗药物被进一步论证和研究。
[1] 路占忠, 李振彬, 马 旭, 等. 采用正交t值法优选治疗急性痛风性关节炎的中药有效成分复方配伍[J].解放军医药杂志,2016,28(11):33-36.
[2] Lv Y,Li C,Li S,etal.Sinomenine inhibits proliferation of SGC-7901 gastric adenocarcinoma cells via suppression of cyclooxygen-ase-2 expression[J].Oncol Lett,2011,2(4):741-745.
[3] Liao F,Yang Z,Lu X,etal.Sinomenine sensitizes gastric cancer cells to 5-fluorouracil in vitro and in vivo[J].Oncol Lett,2013,6(6):1604-1610.
[4] 刘永存,伍丽萍.STK Ⅱ在肝癌组织中的表达水平分析及临床意义[J].空军医学杂志,2016,32(5):319-322.
[5] Fabrizio A,Alice F.Liposomes and MTT cell viability assay:An incompatible affair[J].Toxicol Vitro,2015,29(2):314-319.
[6] 刘 欣,索智敏.苦参抗乙肝病毒的作用机制研究[J].中国生化药物杂志,2015,35(4):67-69.
[7] 张 晨.大黄酸联合贺普丁对乙肝病毒逆转录酶影响[J] 中国公共卫生,2015,31(6):781-783.
[8] Lu XL,Zeng J,Chen YL,etal.Sinomenine hydrochloride inhibits human hepatocellular carcinoma cell growth in vitro and in vivo:involvement of cell cycle arrest and apoptosis induction[J].Int J Oncol,2013,42(1):229-238.
[9] Jiang T,Zhou L,Zhang W,etal.Effects of sinomenine on proliferation and apoptosis in human lung cancer cell line NCI-H460 in vitro[J].Mol Med Rep,2010,3(1):51-56.
[10] Hong Y,Yang J,Shen X,etal.Sinomenine hydrochloride enhancement of the inhibitory effects of anti-transferrin receptor antibody-dependent on the COX-2 pathway in human hepatoma cells[J].Cancer Immunol Immunother,2013,62(3):447-454.
[11] 刘 仪,王 凯,王介非.氧化应激诱导细胞凋亡的机制[J].中华临床感染病杂志,2008,1(3):123-126.
[12] Shoeb M,Khan JA,Khan W,etal.ROS-dependent anticandidal activity of zinc oxide nanoparticles synthesized by using egg albumen as a biotemplate[J].ANSN,2013,4(3):35015-35026.
[13] Sepúlveda M,Gonano LA,Back TG,etal.Role of CaMKII and ROS in rapid pacing-induced apoptosis[J].J Mol Cell Card,2013,63(1):135-145.
[14] Pan X,Zhang X,Sun H,etal.Autophagy inhibition promotes 5-fluorouraci-induced apoptosis by stimulating ROS formation in human non-small cell lung cancer A549 cells[J].PLoS One,2013,8(2):55674-56679.
[15] Kuo CT,Hsu MJ,Chen BC,etal.Denbinobin induces apoptosis in human lung adenocarcinoma cells via Akt inactivation,Bad activation,and mitochondrial dysfunction[J].Toxicol Lett,2008,177(1):48-58
[16] Yang KC,Uen YH,Suk FM,etal.Molecular mechanisms of denbinobin-induced anti-tumorigenesis effect in colon cancer cells[J].World J Gastroenterol,2005,11(20):3040-3045.
[17] Song JI,Kang YJ,Yong HY,etal.Denbinobin,a phenanthrene from dendrobium nobile,inhibits invasion and induces apoptosis in SNU-484 human gastric cancer cells[J].Oncol Rep,2012,27(3):813-818.
[18] 胡 军,邵淑娟,董 岩,等.Caveolin-1与人卵巢癌转移的相关性及其机制的研究[J].解剖科学进展,2010,16(4):311-316.
[19] Belotte J,Fletcher NM,Alexis M,etal.Sox2 gene amplification significantly impacts overall survival in serous epithelial ovarian cancer[J].Reprod Sci,2015,22(1):38-46.
[收稿2016-09-28 修回2016-12-13]
(编辑 倪 鹏)
Study on anti-tumor mechanism of sinomenine
WANGGao-Feng,ZHANGQiang,ZHANGLi-Juan.
ExperimentalCenterofMedicalCollege,HuangheUniversityofScienceandTechnology,Zhengzhou450063,China
Objective:To investigate the anti-proliferation and anti-metastasis effects and study the molecular mechanism of sinomenine in cell line(HepG2).Methods: HepG2 cells were cultured together with different treatment concentrations of sinomen-ine.The effect of sinomenine on inhibition of growth of HepG2 cells were determined by methyl thiazolyl tetrazolium(MTT) assay.The effect of sinomenine on inhibiting metastasis of HepG2 cells were determined by Transwell assay.The inhibitory effect of sinomenine on reverse transcriptase(RT) was studied using inhibitory kinetic method,on the basis,the reactive oxygen species(ROS) of HepG2 cells was monitored by indirect fluorescent labeling.The protein expressions of CASP3,CASP9,CAV1 and SOX2 were analyzed by Western blot experiment.Results: Sinomenine inhibited the proliferation and metastasis of HepG2 cells significantly.Sinomenine had a good inhibitory effect on the growth of HepG2 cells,half inhibitory concentration(IC50) was (15.35±2.43)μmol/L.Sinomenine was RT inhibitor,IC50 was (21.32±2.43)μmol/L.The Western blot showed that CASP3,CASP9 and CAV1 were up-regulated and SOX2 was down-regulated by the sinomenine treatment in HepG2 cells.Conclusion: The potential molecular mechanism of sinomenine suppresses proliferation and metastasis of HepG2 cells by up-regulation of CASP3,CASP9,CAV1 and down-regulation of SOX2.
Sinomenine;HepG2 cells;Reactive oxygen species;Reverse transcriptase;CASP3;CASP9;CAV1;SOX2
10.3969/j.issn.1000-484X.2017.05.011
王高峰(1975年-),女,硕士,实验师,主要从事药学药剂学方面研究。
R453.9
A
1000-484X(2017)05-0688-05
