MICA 第5外显子微卫星多态性与食管癌相关性研究①
2017-06-05郑庆丰周智锋柳硕岩林万松陈赛云叶韵斌
郑庆丰 周智锋 柳硕岩 林万松 陈赛云 叶韵斌
(福建省肿瘤医院,福建医科大学附属肿瘤医院,福建省肿瘤转化医学重点实验室,福建省肿瘤医院胸外科,福州350014)
MICA 第5外显子微卫星多态性与食管癌相关性研究①
郑庆丰 周智锋②③柳硕岩 林万松②陈赛云 叶韵斌②
(福建省肿瘤医院,福建医科大学附属肿瘤医院,福建省肿瘤转化医学重点实验室,福建省肿瘤医院胸外科,福州350014)
目的:研究MICA第5外显子微卫星多态性与食管癌相关性。方法:采用PCR-STR 微卫星基因分型技术检测103 例食管癌患者和84 例正常对照MICA 基因5 外显子多态性。构建食管癌标本中高频率出现的MICA等位基因的真核表达载体,转染293T细胞株,LDH法检测NK细胞对不同MICA等位基因转染的293T细胞的杀伤作用,效靶比20∶1。ELISA法检测转染的293T细胞上清中sMICA含量。结果:食管癌患者第5 外显子检测到5种等位基因,频率分别为:MICA-A4(9.71%),MICA-A5(22.3%),MICA-A5.1(40.8%),MICA-A6(15.5%),MICA-A9(11.7%),其中MICA-A5.1 与对照组对比差异有统计学意义(P<0.05)。MICA等位基因转染293T细胞株后,相对于其他第5外显子A5.1组对NK杀伤的敏感性较低[(30.4±6.3)%,P<0.05],上清可溶性MICA分泌增加(135.7±6.2)pg/ml。结论:食管癌与MICA 第5外显子多态性A5.1 显著性相关,其危险性高于其他等位基因。
MICA 基因;微卫星多态性;食管癌;NK细胞
MICA基因包含6个外显子,外显子1编码L前导肽;外显子2~4分别编码细胞外α1、α2、α3结构域;外显子5编码跨膜(TM)区;外显子6编码胞质区。MICA基因具有高度多态性,目前已发现并命名的MICA等位基因多达70几个,编号为MICA*001-MICA*065。编码胞外区的外显子2、3、4是MICA等位基因多态性的集中区域,另外,跨膜区有一个三核苷酸重复序列的微卫星多肽位点(GCT)。根据GCT的差异分别命名为A4、A5、A5.1、A6、A7、A8和A9等[1],数字代表GCT的重复数目。A5.1是在A5基础上插入一个G,在2个GCT重复顺序后插入一个碱基G,导致在跨膜区提前出现终止密码子,编码产生可溶性蛋白[2]。 尽管已有研究证实MICA 第5外显子微卫星多态性与多种肿瘤有关[3],但与食管癌的关系尚不明确,本研究检测食管癌手术标本跨膜区微卫星多态性,分析MICA跨膜区多态性与食管癌的关系。并构建食管癌标本中高频率出现的MICA等位基因的真核表达载体,转染293T细胞株,通过体外验证MICA等位基因对NK细胞杀伤影响,探讨MICA跨膜区基因多态性与患食管癌风险的相关性。
1 资料与方法
1.1 资料
1.1.1 一般资料 选取福建省肿瘤医院2012 年4月至2015 年6月收治的食管癌患者103 例,其中男58例、女45例,平均年龄(49.69±8.28)岁;另选取同期食管正常者84例,其中男37例、女47例,平均年龄(42.81±9.13)岁,两组年龄、性别等一般资料比较差异均无统计学意义(P>0.05),具有可比性。
1.1.2 试剂 载体pcDNA3.1/myc-His(-)A及 Lipofectamine 2000购自上海Invitrogen公司;限制性内切酶XhoⅠ及KpnⅠ美国购自BioLab公司;质粒大量抽提纯化试剂盒购自德国Qiagen公司;DC蛋白定量试剂盒购自美国Bio-Rad公司;过硫酸铵、TEMED、SDS、甘氨酸、Tween-20、40%Acr-bis 及Tris-Base美国Amresco;LDH细胞毒性检测试剂盒购自美国Roche公司;可溶性MICA的ELISA检测试剂盒购自美国Abcam公司。
1.2 方法
1.2.1 MICA-STR 的PCR 扩增 采用primer 5 软件设计MICA 基因第5 外显子引物序列,由闽博生物公司合成。根据参考文献[4],设计MICA 基因组DNA 序列PCR 引物,其中,引物序列为:上游引物5′-CCAGAGTGAGGACAGACTTGC-3′,下游引物5′- CATGCCTATCTTTGCAGGAG-3′。PCR反应体系包括:2 μl 10 × PCR 缓冲液,0.25 mmol/L dNTPs,0.5 μmol/L 引物,100 ng 基因组DNA 和1 U Taq DNA 聚合酶。扩增产物通过ABI 3730 核酸分析仪检测,并经过ABI 3730 数据收集V3.0 和ABI 基因分型软件(Genemapper 4.0)分析得到PCR 产物片段大小信息。
1.2.2 MICA等位基因真核表达载体的构建及转染 TRIZOL法提取含高频率出现的MICA等位基因A4、A5、A5.1、A6和A9食管癌组织的总RNA,逆转录合成cDNA,PCR扩增MICA全长(MICA-myc-F:5′-CCGCTCGAGATGGGGCTGGGCCCGGTCT-3′,MICA-myc-R:5′-CGGGGTACCGGCGCCCTCAGTGG-AGCCA-3′), 以KpnⅠ及XhoⅠ酶切,酶切产物经琼脂糖凝胶电泳分离后进行胶回收,T4 连接酶16℃连接过夜,次日转化大肠杆菌,克隆入pcDNA3.1/myc-His(-)A载体,筛选重组克隆,经酶切鉴定及测序鉴定,选取鉴定正确的重组载体,命名为p293TA4、p293TA5、p293TA5.1、p293TA6及p293TA9,质粒大量抽提,以脂质体法转染293T细胞。
1.2.3 Western blot检测MICA等位基因转染后蛋白表达 Western blot检测带有myc标签的pcDNA3.1、p293TA4、p293TA5、p293TA5.1、p293TA6及p293TA9的MICA蛋白,制备SDS-PAGE凝胶,电泳,转膜,将膜置于脱脂牛奶室温封闭1~2 h或4℃过夜,摇床孵育。鼠抗人myc一抗室温孵育1~2 h,除去一抗,加入以封闭液稀释的二抗,室温1~2 h,摇床孵育。除去二抗,次日以TBST 洗膜10 min × 4 次,加入显色液,用化学发光成像系统扫描图像。
1.2.4 MICA基因多态性对NK杀伤的影响 NK细胞培养参考本科室常规方法[5]:LDH法检测NK细胞对不同MICA等位基因转染的293T细胞的杀伤作用,效靶比20∶1,以培养17~20 d的NK细胞为效应细胞,NK 细胞调密度至1×106ml-1,靶细胞分别为pcDNA3.1、p293TA4、p293TA5、p293TA5.1、p293TA6及p293TA9转染的293T细胞。终体积200 μl/孔,设3个复孔。根据说明书设立对照组,包括加入靶细胞的自发释放组(SR靶)、加入靶细胞并在检测前40 min 加入1% Triton-100的最大释放组(MR靶),只加入效应细胞的自发释放组(SR 效应),在37℃孵箱中培养4 h。1 000 r/min×10 min离心后,吸出50 μl/孔上清,转移至另一ELISA板,加入50 μl/孔LDH 反应液,室温避光放置30 min 后,测定492 nm 的吸光度(A)值,杀伤率(%)=[(实验孔D值-SR效应组D值-SR靶组D值)/(MR靶组D值-SR靶组D值)]×100%。
1.2.5 可溶性MICA的测定 取293T培养细胞上清-80℃冰箱保存, 根据试剂盒的操作说明书, 以双抗体夹心ELISA法检测上清中sMICA含量。先不稀释血清样本, 初步检测如果标本超过试剂盒的标准曲线范围, 将标本根据需要进行稀释重新检测。
1.3 统计学方法 等位基因频率通过计数法直接得出,对各等位基因的数据采用Genepop v3.4软件进行Hardy-Weinberg平衡检验;利用SPSS17.0进行χ2检验。
2 结果
2.1 食管癌患者和正常对照MICA-STR频率比较 结果如表1所示,食管癌患者MICA-A5.1 的频率40.8% 高于正常对照组19.0%(P<0.05),风险评估(OR)=2.926,95%CI为1.495~5.728。
2.2 重组质粒pcDNA3.1/myc-His(-)A-MICA的鉴定 将MICA基因分别克隆入pcDNA3.1/myc-His(-)A载体,构建MICA等位基因重组表达载体(p293TA4,p293TA5,p293TA5.1,p293TA6及p293TA9)。重组质粒经KpnⅠ和XhoⅠ双酶切,产物经1%琼脂糖凝胶电泳后可见两条带,其中5.5 kb为载体pcDNA3.1/myc-His(-)A条带,另外一条为MICA等位基因片段,其对应分子量为1 152、1 155、999、1 158及1 167 bp(图1)。
2.2 Western blot检测转染293T细胞后MICA蛋白的表达 转染pcDNA3.1的293T细胞为阴性对照,转染不同MICA等位基因的293T细胞作为实验组,Western blot检测MICA转染293T细胞后,实验组MICA蛋白水平表达变化。与空对照相比较,转染不同MICA等位基因的293T细胞均有抗myc标签的MICA蛋白表达,分子量除了p293TA5.1为37 kD外,其余p293TA4、p293TA5、p293TA6及p293TA9均为43 kD(图2)。
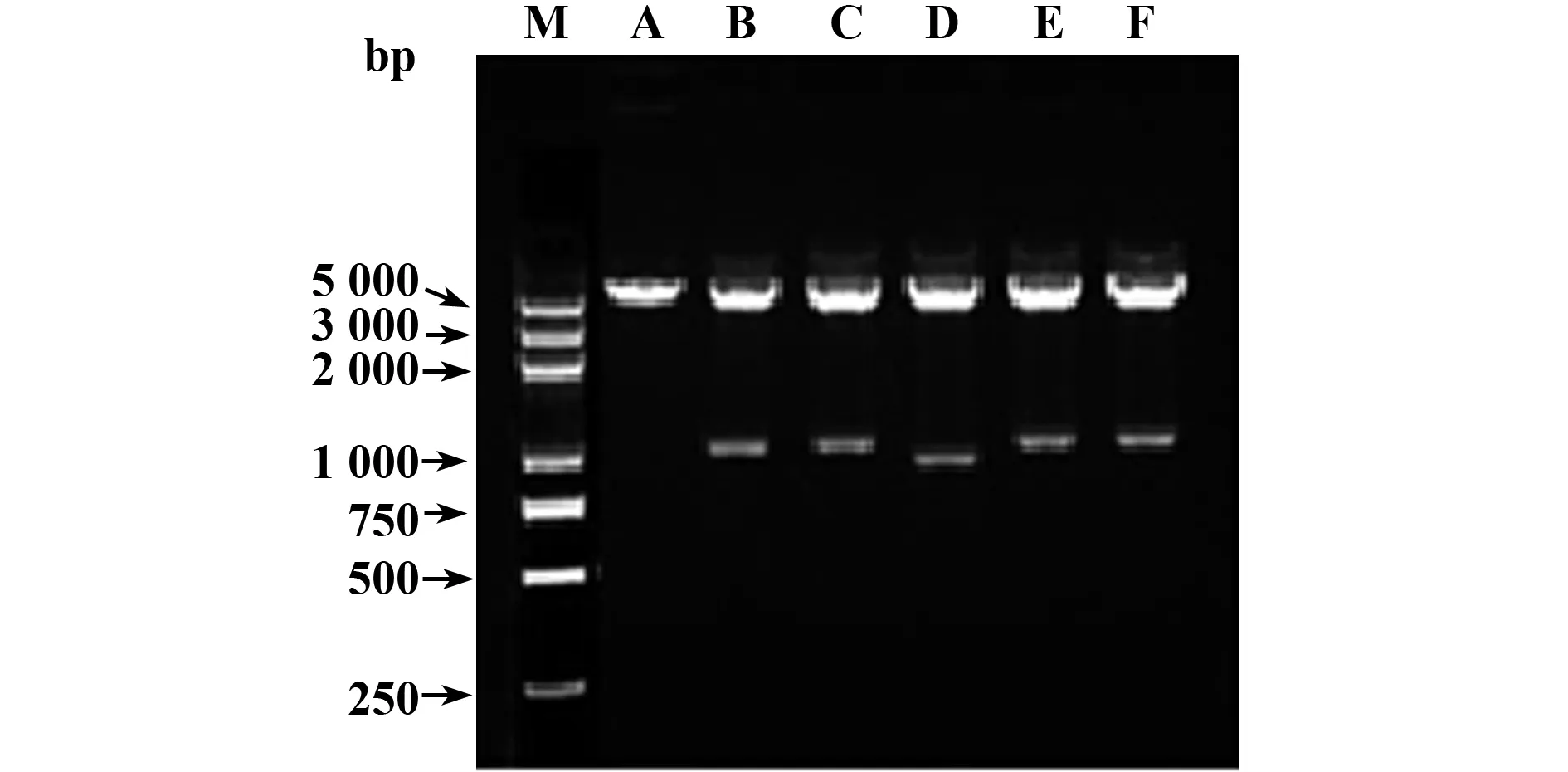
图1 MICA等位基因重组载体酶切鉴定Fig.1 MICA allele recombinant vector enzyme digestionNote: M.DNA ladder;A.pcDNA3.1/myc-His(-)A;B.p293TA4;C.p293TA5;D.p293TA5.1;E.p293TA6;F.p293TA9.
2.3 NK细胞对转染不同MICA基因的杀伤作用 与空转染pcDNA3.1相比,MICA基因转染后,靶细胞对NK细胞杀伤的敏感性均明显升高(P<0.05),但p293TA5.1组对NK杀伤的敏感性最低[(30.4±6.3)%,P<0.05];而其他组之间差异无统计学意义(P>0.05),见图3。
2.4 293T细胞上清可溶性MICA 以双抗体夹心法检测转染后293T细胞上清可溶性MICA,结果如图4所示,空转的pcDNA3.1组上清未检测到可溶性MICA,p293TA5.1组:(135.7±6.2) pg/ml;明显高于p293TA4、p293TA5、p293TA6及p293TA9组(P<0.05)。

图2 Western blot检测转染后293T细胞的MICA表达Fig.2 MICA expression in 293T cells after transfection was detected by Western blot
表1 实验组和对照组MICA 基因第5 外显子等位基因频率分布的比较
Tab.1 Comparison of allelic distributions of MICA gene polymorphism between patients and controls
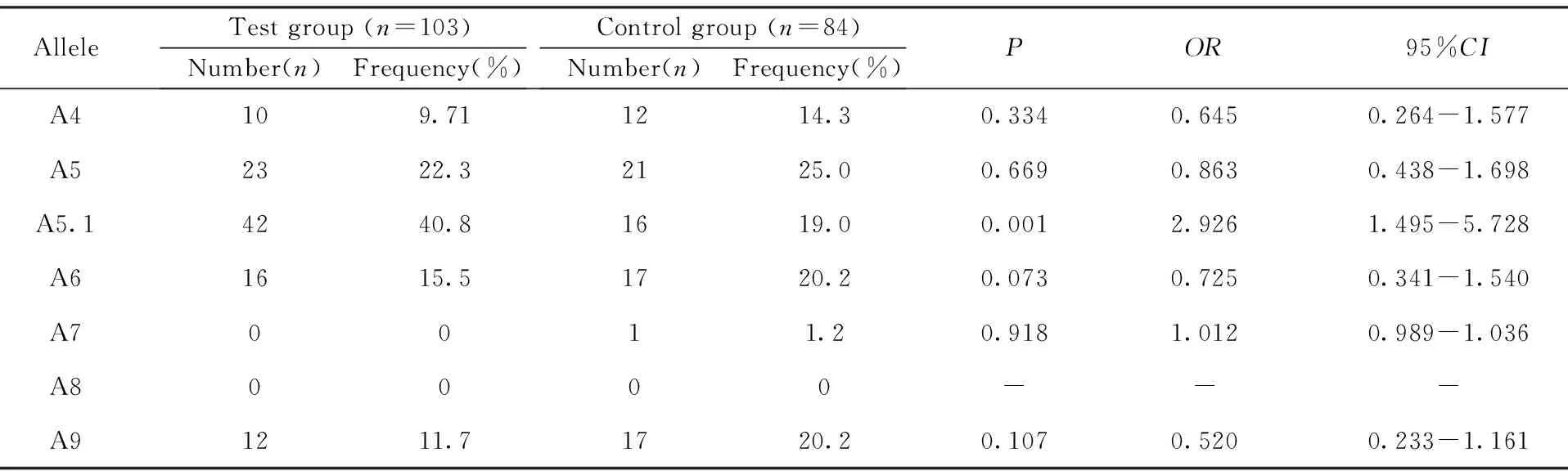
AlleleTestgroup(n=103)Number(n)Frequency(%)Controlgroup(n=84)Number(n)Frequency(%)POR95%CIA4109.711214.30.3340.6450.264-1.577A52322.32125.00.6690.8630.438-1.698A5.14240.81619.00.0012.9261.495-5.728A61615.51720.20.0730.7250.341-1.540A70011.20.9181.0120.989-1.036A80000---A91211.71720.20.1070.5200.233-1.161
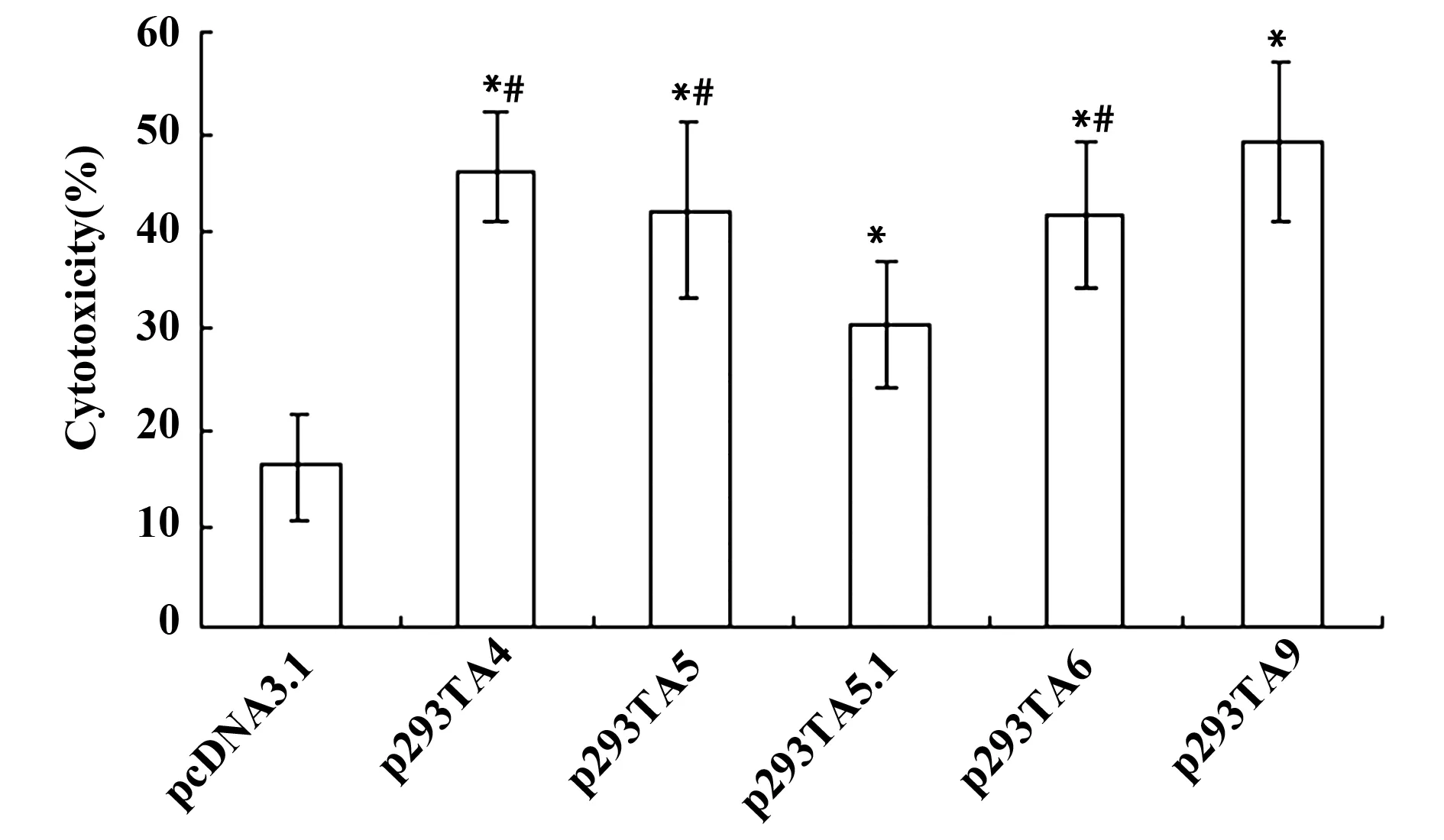
图3 NK细胞对MICA基因转染的293T细胞的杀伤活性Fig.3 Cytotoxicity of NK cells to MICA gene transfected 293T cellsNote: *.P<0.05,vs the group of untransfected pcDNA3.1;#.P<0.05,vs the group of p293TA5.1.

图4 转染后293T细胞上清可溶性MICAFig.4 Supernatants soluble MICA after transfected 293T cellNote: *.P<0.05,vs the group of p293TA5.1.
3 讨论
MICA 第5外显子微卫星多态性不仅与免疫性疾病,如系统性红斑狼疮、类风湿关节炎和强直性脊柱炎有关[6],更与多种肿瘤密切相关, Chung 等[7]证实A6 基因与口腔鳞状细胞癌有关联。Vallian 等[8]研究发现,50岁以上的妇女中,含A6、A9等位基因型的妇女,患乳腺癌的风险性明显高于对照组。本文发现食管癌组患者MICA 第5 外显子中A5.1 等位基因的频率相比正常人组明显增高,两组比较差异有统计学意义(P<0.05),提示MICA-A5.1 等位基因可能与食管癌的发生密切相关,是食管癌易感标记;其他基因表型频率等与食管癌无关联,未发现等位基因A7、A8。
NK细胞上NKG2D配体与MICA结合,在DAP10的介导下激活NK细胞的杀伤活性,且该活化效应能克服靶细胞上经典HLAⅠ类分子所诱导的抑制性效应,在NK细胞的活化中起着非常重要的作用[9]。NK细胞的杀伤敏感性与肿瘤细胞表面MICA/B的表达水平呈正相关,肿瘤细胞表面MICA/B的表达水平影响NK细胞的杀伤活性。提高肿瘤细胞表面MICA/B的表达水平,可使肿瘤细胞对NK细胞杀伤的敏感性明显增强[10]。为了研究MICA基因多态性对NK杀伤作用的影响,本研究RT-PCR 技术将食管癌组织来源的高频MICA等位基因,并将MICA基因连接到真核表达载体pcDNA3.1/myc-His(-)A上,通过酶切鉴定和质粒测序结果证明融合蛋白真核表达载体成功。再利用瞬时转染技术、免疫印迹的方法MICA在真核细胞293T中正确表达,来源pMCFA5.1总蛋白表达最低,可能是由于A5.1编码截短型蛋白,MICA的RNA翻译至跨膜区,提前终止。
本文通过LDH法检测NK细胞对MICA等位基因转染293T细胞的杀伤活性,与空转染相比,MICA等位基因转染后,靶细胞对NK细胞杀伤的敏感性均明显升高,这与转染后293T细胞MICA蛋白的增加有关。但相对于其他第5外显子p293TA5.1组对NK杀伤的敏感性仍低,其原因可能是293T细胞转染p293TA5.1后,虽然A5.1编码MICA截短型蛋白,容易脱落,产生可溶性MICA分泌至上清,仍有部分结构锚定在细胞膜上,固定在细胞膜上的MICA仍可与NKG2D结合,诱导NK细胞活化,促进NK对靶细胞的杀伤。
许多恶性肿瘤(如黑色素瘤、肺癌、胃肠癌、肝癌、前腺癌、多发性骨髓瘤等)可释放可溶性MICA抑制NK细胞的功能,造成肿瘤细胞的免疫逃逸[11]。本研结果转染p293TA5.1后293T细胞上清可溶性MICA明显增加。我们前期对食管癌患者血清中的可溶性MICA的研究发现,可溶性MICA通过下调NKG2D表达来抑制NK细胞的杀伤活性[12]。所以可溶性MICA在食管癌免疫逃逸中起重要作用,从免疫逃逸方面验证MICA等位基因A5.1 增加食管癌发病率。
[1] Barahmani N,de Andrade M,Slusser JP,etal.Major histocompatibility complex class I chain-related gene A polymorphisms and extended haplotypes are associated with familial alopecia areata.[J].J Invest Dermatol,2006,126(1):74-78.
[2] Cox ST,Madrigal JA,Saudemont A.Diversity and characterization of polymorphic 5′ promoter haplotypes of MICA and MICB genes[J].Tissue Antigens,2014,84(3):293-303.
[3] Laza-Briviesca R,Saudemont A,Madrigal JA,etal.Two novel 5′ promoter sequences of the MHC class I-related chain A gene[J].Int J Immunogenet,2015,42(3):226-227.
[4] Raache R,Belanteur K,Amroun H,etal.Association of major histocompatibility complex class 1 chain-related gene a dimorphism with type 1 diabetes and latent autoimmune diabetes in adults in the Algerian population[J].Clin Vaccine Immunol,2012,19(4):557-561.
[5] 周智锋,李洁羽,陈明水,等.细胞因子组合体外扩增人NK细胞的研究[J].中华肿瘤防治杂志,2014,21(3):193-197.
[6] Lee YH,Bae SC,Kim JH,etal.Meta-analysis of the association between functional MICA-TM polymorphisms and systemic lupus erythematosus,rheumatoid arthritis and ankylosing spondylitis[J].J Rheumatol,2015,74(2):146-152.
[7] Chung-Ji L,Yann-Jinn L,Hsin-Fu L,etal.The increase in the frequency of MICA gene A6 allele in oral squamous cell carcinoma[J].J Oral Pathol Med,2002,31(6):323-328.
[8] Vallian S,Rad MJ,Tavallaei M,etal.Correlation of major histocompatibility complex class I related A(MICA)polymorphism with the risk of developing breast cancer[J].Med Oncol,2012,29(1):5-9.
[9] Ribeiro CH,Kramm K,Galvez-Jiron F,etal.Clinical significance of tumor expression of major histocompatibility complex class I-related chains A and B(MICA/B)in gastric cancer patients[J].Oncol Rep,2016,35(3):1309-1317.
[10] Yamanegi K,Yamane J,Kobayashi K,etal.Sodium valproate,a histone deacetylase inhibitor,augments the expression of cell-surface NKG2D ligands,MICA/B,without increasing their soluble forms to enhance susceptibility of human osteosarcoma cells to NK cell-mediated cytotoxicity[J].Oncol Rep,2010,24(6):1621-1627.
[11] Koguchi Y,Hoen HM,Bambina SA,etal.Serum immunoregulatory proteins as predictors of overall survival of metastatic melanoma patients treated with ipilimumab[J].Cancer Res,2015,75(23):5084-5092.
[12] 柳硕岩,周智锋,郑庆丰,等.食管癌中MICA的表达及其意义[J].中国肿瘤临床,2013,40(3):148-152.
[收稿2016-08-01 修回2016-10-25]
(编辑 张晓舟)
Association of microsatellite polymorphism of MICA gene with susceptibility to esophageal cancer
ZHENGQing-Feng,ZHOUZhi-Feng,LIUShuo-Yan,LINWan-Song,CHENSai-Yun,YEYun-Bin.
FujianCancerHospital,FujianMedicalUniversity,CancerHospitalFujianKeyLaboratoryofTranslationalCancer,DepartmentofThoracicSurgery,Fuzhou350014,China
Objective:To explore the association of microsatellite polymorphism of MICA gene with susceptibility to esophageal cancer.Methods: PCR-STR microsatellite genotyped technique was used to detect the polymorphism of MICA in Exon 5 in 103 cases of esophageal cancer and 84 cases of normal controls.Constructed of eukaryotic expression vector in esophageal carcinoma with high frequency of occurrence of the MICA allele.NK cells killing effect to 293T cells after alleles MICA transfected were assayed by LDH and the effect on target was 20∶1.ELISA was used to test supernatants sMICA of 293T cell after transfected.Results: Identified five allelic genes in MICA Exon 5 with esophageal cancer.Each allele and its frequency respectively were:MICA-A4(9.71%),MICA-A5(22.3%),MICA-A5.1(40.8%),MICA-A6(15.5%),MICA-A9(11.7%).MICA-A5.1 showed significant difference comparison with the control group.After 293T cell line was transfected MICA allele,MICA-A5.1 group was less sensitive to NK cytotoxicity compared to other groups[(30.4±6.3)%,P<0.05].The secretion of soluble MICA increased(135.7±6.2)pg/ml.Conclusion: Esophageal cancer was relevent with the MICA-A5.1 polymorphism of MICA Exon 5 alleles.Its risk is higher than other alleles.
MICA gene;Microsatellite polymorphism;Esophageal;NK cells
10.3969/j.issn.1000-484X.2017.05.021
①本文受福建省卫生系统中青年骨干人才培养项目(No.2014-ZQN-JC-7)和福建省自然科学基金项目(2015J01378;2015J01433)资助。
郑庆丰(1975年-),男,博士,副主任医师,主要从事胸部肿瘤外科方面的研究,E-mail:zhqf@msn.com。
及指导教师:叶韵斌(1964年-),女,博士,教授,博士生导师,主要从事肿瘤免疫治疗研究,E-mail: zjyunbin@189.cn。
R735.1
A
1000-484X(2017)05-0738-05
②福建省肿瘤转化医学重点实验室,福建省肿瘤医院免疫学研究室,福州 350014。
③共同第一作者。
