通腑化痰法对急性脑出血肝损害大鼠Kupffer细胞NF-κB、TNF-α表达的影响*
2017-06-05赵海滨吴羿姗
李 蕊 王 威 赵海滨 王 昀 张 晗 吴羿姗
(北京中医药大学第三附属医院,北京 100029)
·研究报告·
通腑化痰法对急性脑出血肝损害大鼠Kupffer细胞NF-κB、TNF-α表达的影响*
李 蕊 王 威 赵海滨 王 昀 张 晗 吴羿姗
(北京中医药大学第三附属医院,北京 100029)
目的 观察星蒌承气汤对急性脑出血肝损害大鼠Kupffer细胞中核转录因子-κB(NF-κB)及肿瘤坏死因子-α(TNF-α)表达的影响。方法 大鼠尾状核注射胶原酶法建立脑出血模型,制备血清,提取SD大鼠Kupffer细胞,随机分为正常对照组、脑出血模型组、葡醛内酯组和通腑化痰组,每组分为6、12、24 h 3个时间亚组。EMSA检测NF-κB活性,Western blot检测NF-κB蛋白表达,ELISA法检测TNF-α水平。结果 与正常对照组相比,Kupffer细胞NF-κB、TNF-α表达在大鼠急性脑出血肝损害后6、12、24 h均明显升高(P<0.05);通腑化痰组和葡醛内酯组TNF-α、NF-κB表达均较脑出血模型组降低(P<0.05),但较正常对照组高,且通腑化痰组TNF-α、NF-κB较葡醛内酯组低(P<0.05)。结论 NF-κB、TNF-α在介导急性脑出血肝损害内毒素信号转导中起重要作用,是脑出血后继发肝损伤的重要因素,通腑化痰法能够抑制kupffer细胞中NF-κB的活化和TNF-α的释放,对脑出血肝损害具有一定的保护作用。
通腑化痰法 急性脑出血 Kupffer细胞 核转录因子κB 肿瘤坏死因子
急性脑出血(ACH)是临床的常见病和多发病,且其致死率、致残率居高不下[1]。脑出血肝损害具有高发性和隐蔽性的特点,是核心靶器官遭受严重应激损伤,引起和加重原发病并致死的关键性因素。其主要原因之一是肝细胞死亡受体通路紊乱,内毒素(LPS)诱导Kupffer细胞等过度激活,合成释放核转录因子(NF-κB)、肿瘤坏死因子-α(TNF-α)等炎性细胞因子,引发急、慢性肝损伤[2]。Kupffer细胞主要存在肝血窦中,占巨噬细胞细胞的80%~90%,具有启动免疫应答、吞噬清除病原、促进肝细胞再生等功能[3]。本课题在前期中医药干预脑出血肝损害研究基础上[4],已经证实通腑化痰法通过调控白细胞介素受体相关激酶(IRAKs)细胞因子的转录和表达,影响LPS信号转导,从而发挥急性脑出血继发肝损害的保护作用。本研究拟在体外培养肝Kupffer细胞中进一步研究NF-κB活性及TNF-α表达水平,并观察急性脑出血应激性肝损害发生发展和变化,探讨中医通腑化痰法对其的干预机理,揭示该法对脑出血肝损害的保护机制。
1 材料与方法
1.1 动物与分组 健康雄性成年SD大鼠96只,体质量(300±20)g,由北京中医药大学东直门医院实验动物中心提供,动物许可证号:SCXK(京)2012-0001。随机数字表法将大鼠分为正常对照组、脑出血模型组、葡醛内酯组和通腑化痰组,每组再分为6、12、24 h 3个时相亚组,每个时间点8只。分笼饲养,术前12 h禁食不禁水。
1.2 试剂与仪器 星蒌承气汤,药物组成:大黄6 g,芒硝6 g,胆南星12 g,瓜蒌12 g,枳实8 g,丹参18 g,配成复方颗粒剂,由北京康仁堂中药有限公司提供。Ⅶ型胶原酶(Sigma);RPMI-1640培养基(Gibco);20%胎牛血清(FBS,Hyclone);山羊抗兔 IgG(H+L),HRP(天德悦,S004);山羊抗小鼠IgG(H+L),HRP(天德悦,S001);蛋白抽提试剂(CWBIO);BCA蛋白定量试剂盒(CWBIO);引物合成(Invitrogen);NF-κB EMSA检测试剂盒(Thermo,89880);核蛋白提取试剂盒(凯基生物,KGP150);蛋白酶抑制剂(Roche,11697498001);TNF-α ELISA试剂盒(欣博盛,ERC102a.96);电泳仪(Bio-Rad);湿转电泳槽(Cavoy)。
1.3 造模及血清制备 参照文献[5],并根据实验要求做一定改进,本课题组在前期国家自然科学基金研究中[6-7],采用大鼠尾状核注射Ⅶ型胶原酶法成功建立脑出血模型。10%水合氯醛腹腔注射麻醉,头部丁字切口暴露颅骨,以前囟为原点,横坐标向右开4 mm,纵坐标向后1 mm,牙科钻钻颅约5 mm深度,注射0.5 UⅦ型胶原酶,缝合切口。通腑化痰组:复制脑出血模型,于脑出血造模手术前2 d开始灌胃给药,每天1次,手术前2 h加灌1次,手术后每天灌胃1次,各时相点处死前2 h加灌1次,给药量按《药理实验方法学》所示剂量换算法计算[8]:200 g大鼠计量(g/kg)=人的剂量[1 g/(kg·d)]×0.018。葡醛内酯组:复制脑出血模型,灌服葡醛内酯,灌胃方法及次数同通腑化痰组。正常对照组:不做造模处理。末次给药40 min后腹主动脉采血10 mL,收集血清于无菌离心管中,于-80℃冰箱备用。
1.4 Kupffer细胞的分离及培养 按文献[9]的改进方法采用酶消化法、密度梯度离心以及选择贴壁法提取Kupffer细胞。采用台盼蓝拒染实验测定细胞活性,计数显示活细胞数量在90%以上;吞噬墨汁实验测定细胞性质,显示绝大部分细胞内充斥有碳素颗粒,平均约为95%。将纯化后的Kupffer细胞接种于6孔板中(1× 106/L),用含20%胎牛血清的RPMI-1640培养基培养细胞。1)正常对照组:在培养基上清液中加入正常大鼠血清。2)脑出血模型组:上清液中加入正常血清和模型大鼠血清。3)葡醛内酯组:上清液中加入模型大鼠血清和葡醛内酯血清。4)通腑化痰组:上清液中加入模型大鼠血清和涤痰通瘀血清。置于CO2培养箱,分别培养6、12、24 h后,收集上清液,-70℃保存。
1.5 标本采集与检测
1.5.1 EMSA检测NF-κB活性 1)核蛋白抽提:按说明书操作,提取上清即为胞核蛋白。2)按照NF-κB EMSA试剂盒,配制6%的TBE胶,100V预电泳1 h。3)NF-κB探针与核蛋白结合反应:在反应体系中,依次加入2 μL 10×Binding Buffer,1 μL 1 μg/μL Poly(dI. dC),1 μL 50%Glycerol,1 μL 100 mmol/L MgCl2,1 μL 1%NP-40,5 μg Protein Extract及3 μL Biotin-DNA(30 fmol)。加超纯水至20 μL,混匀后,室温静置20 min。4)电泳、转膜及交联:新换缓冲液,20 μL/孔,100 V,直到溴酚蓝移至胶的2/3处停止;湿转法转膜;将膜至于254 nm的紫外交联仪下,交联15 min后封闭15 min。5)抗体孵育、曝光显影:Streptavidin-HRP以1∶300稀释,将膜完全浸没,室温轻摇,15 min,洗膜5次,每次5 min。ECL加到膜上后反应2 min,胶片曝光5 min,显影、定影。胶片在室温下干燥,扫描图像。
1.5.2 Western blot检测NF-κB蛋白水平 采用蛋白免疫印迹法(Western blot),提取不同组别Kupffer细胞胞浆和胞核蛋白,BCA法蛋白定量检测,加入样品缓冲液最终质量浓度为4 mg/mL,煮沸变性5 min。根据目的蛋白分子量,配制12%的分离胶,浓缩胶浓度为5%。取20 μg/孔蛋白样品凝胶电泳,湿转法转膜,封闭:将膜完全浸没3%BSA-TBST中室温轻摇30 min。一抗孵育:用3%BSA-TBST稀释一抗,室温孵育10 min,放4℃过夜。TBST洗膜5次,每次3 min。二抗孵育:用5%脱脂奶粉-TBST稀释二抗,山羊抗兔IgG(H+L)HRP,1∶20000,室温轻摇40 min。洗膜:TBST洗膜6次,每次3 min。ECL加到膜上后反应3~5 min,胶片曝光,显影2 min,定影。图像分析软件测定条带灰度值,以目的条带灰度值与GAPDH灰度值的比值反映胞核NF-κB蛋白表达情况。
1.5.3 Elisa法检测TNF-α水平 提取Kupffer细胞总蛋白,并进行定量检测,按照ELISA试剂盒说明书检测TNF-α含量。
1.6 统计学处理 应用SPSS20.0统计软件。结果以(±s)表示。组间比较方差齐采用方差分析,方差不齐采用非参,两两比较采用LSD检验。P<0.05为差异显著。
2 结 果
2.1 各组大鼠Kupffer细胞NF-κB DNA结合活性的检测 见图1。各组Kupffer细胞培养12 h后,检测到特异的蛋白和NF-κB DNA交联的滞后带,如图1所示,正常对照组蛋白滞后条带不明显,脑出血模型组细胞核蛋白组出现明显滞后条带,通腑化痰组及葡醛内酯组Kupffer细胞核内NF-κB DNA结合活性均较脑出血模型组低,且通腑化痰组Kupffer细胞核内NF-κB DNA结合活性低于于葡醛内酯组。

图1 各组Kupffer细胞NF-κB活性
2.2 各组大鼠Kupffer细胞NF-κB表达水平的比较
见表1。Western blot检测结果作灰度值分析显示,脑出血模型组NF-κB表达显著高于正常对照组、通腑化痰组和葡醛内酯组(P<0.05),通腑化痰组明显低于葡醛内酯组(P<0.05),但高于正常对照组,提示通腑化痰法可以降低NF-κB的活化,抑制炎症因子的表达。
2.3 各组大鼠Kupffer细胞TNF-α含量的比较 见表2。脑出血模型组Kupffe细胞上清TNF-α表达显著高于正常对照组(P<0.05),通腑化痰组和葡醛内酯组TNF-α显著低于脑出血模型组(P<0.05),但高于正常对照组,且通腑化痰组TNF-α显著低于葡醛内酯组(P<0.05)。
表1 各组大鼠Kupffer细胞NF-κB表达水平的比较(±s)

表1 各组大鼠Kupffer细胞NF-κB表达水平的比较(±s)
与同时间点对照组比较,*P<0.05;与同时间点模型组比较,#P<0.05;与同时间点葡醛内酯组比较,△P<0.05。下同。
组别6 h 12 h 24 h正常对照组 0.2750±0.0224脑出血模型组 1.9653±0.1680*葡醛内酯组 1.2783±0.0962#0.2817±0.0276 0.2863±0.0231 1.6580±0.1022*1.8325±0.1491*0.9733±0.0335#1.1452±0.1136#通腑化痰组 0.8219±0.0146#△0.6842±0.0285#△0.7184±0.0243#△
表2 各组大鼠Kupffer细胞TNF-α含量的比较(±s)
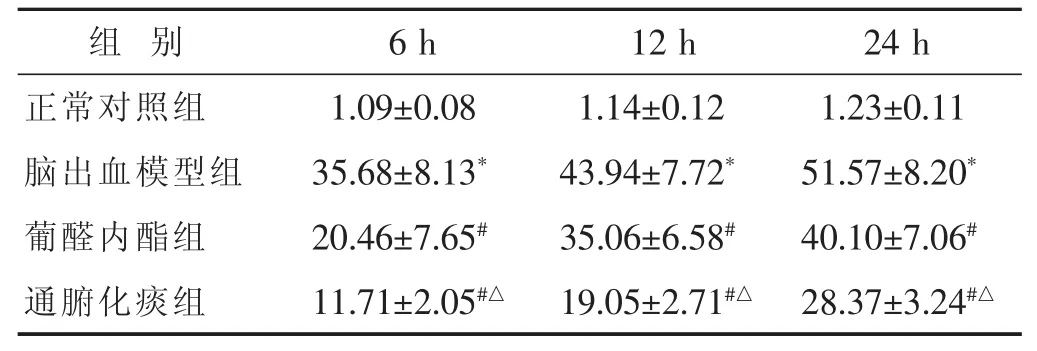
表2 各组大鼠Kupffer细胞TNF-α含量的比较(±s)
组别6 h 12 h 24 h正常对照组 1.23±0.11脑出血模型组 51.57±8.20*葡醛内酯组 40.10±7.06#1.09±0.08 1.14±0.12 35.68±8.13*43.94±7.72*20.46±7.65#35.06±6.58#通腑化痰组 28.37±3.24#△11.71±2.05#△19.05±2.71#△
3 讨 论
急性脑出血继发的肝损害,主要原因之一是机体在应激性内源或外源性损伤侵袭下,内毒素(LPS)促进合成分泌细胞因子及炎性介质,大量氧自由基、细菌等移位,可通过血运途径进入门脉系统,LPS激活肝内Kupffer细胞发生瀑布式连锁反应,活化核转录因子NF-κB,导致TNF-α等一系列炎症细胞因子基因的转录和表达[2],从而造成肝脏功能受损。肝脏是人体内各种营养代谢和储存的总枢纽,是机体调节应激反应的核心。一旦肝脏受损,Kupffer细胞等单核巨噬细胞系统功能减弱,引起细菌和LPS“逃逸”,发生内毒素血症,细菌移位加剧[10],从而进一步加重肝损伤,形成恶性循环。因此,如何在早期积极进行干预,抑制Kupffer细胞激活NF-κB,阻止TNF-α释放,保证机体对内毒素的清除功能,是阻止或延缓急性脑出血后肝损伤甚至多器官脏器功能衰竭(MODS)发展的重要环节。
Kupffer细胞来源于骨髓及血液中的单核细胞,是肝脏炎症反应的效应细胞,可产生多种细胞因子,如TNF-α、IL-1、IL-6等。其主要存在于肝窦内,具有吞噬清除病原、参与免疫反应、维持内外环境稳态的功能[3]。NF-κB是Rel家族的主要核转录因子,以非活化状态,存在于多种细胞类型中,参与调控机体应激、免疫、炎症等反应,其中最主要的功能是对编码炎性分子基因的转录[11-12]。TNF-α是机体创伤后较早释放的重要促炎细胞因子,具有广谱生理和病理效应,肝脏中的TNF-α主要由Kupffer细胞分泌[13]。NF-κB与TNF-α是Kupffer细胞中LPS介导的发生炎性级联反应的主要致病细胞因子,TNF-α是NF-κB的靶基因,可以通过激活NF-κB正反馈通路[14],致使炎症瀑布效应持续放大。且已有研究表明[15],TNF-α能够直接损害肝细胞引起肝损伤。任晓玲等[16]报道NF-κB与TNF-α呈直线相关。因此,以NF-κB、TNF-α为潜在靶点研究,可能是解决炎症反应失控的突破点之一。
本实验在前期研究基础上[4,6-7],建立了脑出血大鼠模型并体外培养Kupffer细胞,分别给予西药葡醛内酯及中药通腑化痰汤干预,EMSA结果表明,脑出血模型组出现明显滞后条带,说明Kupffer细胞核内NF-κB DNA结合活性最强,通腑化痰组及葡醛内酯组NF-κB DNA结合活性较脑出血模型组低,且以通腑化痰组更低,说明通腑化痰组可以抑制核转录因子活化,从而阻断 NF-κB DNA结合反应。Western blot及ELISA结果显示,脑出血模型组NF-κB及TNF-α表达在各个时间点均较正常对照组增高,葡醛内酯组及通腑化痰组均能够降低NF-κB及TNF-α表达,且以通腑化痰组作用最为明显。提示通腑化痰法能够发挥脑出血肝损害的保护作用,其机制可能与抑制Kupffer细胞炎症蛋白NF-κB活化,进而阻止下游炎症因子的合成与释放有关。
中风总属本虚标实,急性期标实为主,气血逆乱,风火相煽,痰热内阻,中焦气机紊乱,且火热内炽,消烁津液,而致痰热腑实。故可见神识昏蒙、鼻鼾痰鸣;邪毒横窜,诸脏受伐,变证诸起,终致脏腑衰竭。在治疗上,“急则治其标”,以祛邪为主。本研究以通腑化痰立法,立意于《中医内科学》中星蒌承气汤。方中大黄、芒硝通腑泻热,荡涤肠胃,借通降泻下之力,迅速有效排出肠道痰热毒邪;同时急下存阴,胆南星、瓜蒌清热涤痰、润燥滑肠;枳实破气除痞,化痰消积;丹参活血祛瘀,养血安神,药简力专。现代研究表明,通腑化痰法治疗急性期中风病可以通过脑肠轴机制抑制炎性反应,改善血液流变学,调节新陈代谢,从而保护机体在应激状态下免遭全身性炎性反应侵害及其他靶器官受损的作用[17]。本研究结果显示,通腑化痰组NF-κB及TNF-α的表达均较葡醛内酯组低,说明通腑化痰法可以通过抑制LPS诱导的Kupffer细胞活化核转录因子NF-κB,减少TNF-α炎性因子的合成释放,从而发挥对脑出血肝损害的保护作用。至于是否存在其他信号调控途径,尚有待于进一步研究。
[1] Van Asch C,Luitse M,Rinkel G.Incidence,case fatality and functional outcome of intracerebral haemorrhage over time,acording to age,sex,and ethnic origin:A systematic review and meta-analysis[J].Lancet Neurol,2010,9(2):167-176.
[2] Peizhi Li,Zhao Zhang,Jianping Gong,et al.S-Adenosylmethionine attenuates lipopolysaccharide-induced liver injury by downregulating the Toll-like receptor 4 signal in Kupffer cells[J].Hepatoloty International,2014,8(2):275-284.
[3] Chandrashekhar R.Gandhi.kupffer cells[J].Molecular Pathology of Liver Diseases,2010,15(5):81-95.
[4] 赵海滨,唐杰.星蒌承气汤对急性脑出血大鼠肝、肠系膜淋巴结IRAK-4mRNA表达的影响[J].山东中医药大学学报,2012,36(1):54-57.
[5] Chen Z,Gao C,Hua Y,et al.Role of iron in brain injury after intraventricularhemorrhage[J].Stroke,2011,42(2):465-470.
[6] 李东方,赵海滨,姜天元,等.采用Ⅶ型胶原酶制作大鼠脑出血模型的技巧[J].神经药理学报,2015,5(4):22-25.
[7] 王威,许晓英,马迪,等.涤痰通瘀方干预急性脑出血大鼠肝组织IRAK-M表达变化的影响[J].吉林中医药,2015,35(11):1155-1158.
[8] 魏伟,吴希美,李元建.药理实验方法学[M].4版.北京:人民卫生出版社,2010:38-41.
[9] Liu H,Cao H,Wu ZY.Isolation of kupffer cells and their suppressive effects on T lymphocyte growth in rat orthotopic liver transplantation[J].World,J Gastroenterol,2007,13(22):3133-3136.
[10]Zhong Z,Huang HF,Chen MQ,et al.Heme oxygenase-1 protects donor livers from ischemia/reperfusion injury:The role of Kupffer cells[J].World Journal of Gastroenterology,2010,16(10):1285-1292.
[11]Li R,Liang T,He Q,et al.Puerarin,isolated from Kudzu root(Willd.),attenuates hepatocellular cytotoxicity and regulates theGSK-3β/NF-κB pathway for exerting the hepatoprotection againstchronic alcohol-induced liver injury in rats[J].Int Immunop-harmacol,2013,17(1):71-78.
[12]Niederberger E,Geisslinger G.Proteomics and NF-[kappa]B:an update[J].Expert Review of Proteomics,2013,10(2):189-204.
[13]Z.Abrehdari,M.Pirestani,P.Allahdini,et al.Characterization of anti-inflammatory responses of norepinephrine in hepatitis induced by LPS:Effects on expression of IL-6,TNF-α and iNOS in liver of mice[J].Neurochemical Journal,2014,8(3):193-198.
[14]Ponnappa BC,Israel Y,Aini M,et al.Inhibition of tumor necrosis factor alpha secretion and prevention of liver injury in etha-nol-fed rats by antisense oligonucleotides[J].Biochem Pharma-col,2005,69(4):569-577.
[15]Liu LM,Liang DY,Ye CG,et al.The UII/UT System Mediates Upregulation of proinflammatory cytokines through p38 MAPK and NF-[kappa]B pathways in LPS-Stimulated kupffer cells[J].PLo S One,2015,10(3):e0121383.
[16]任晓玲,桂军云,李海波,等.大鼠颅脑损伤急性期脑组织NF-κB、TNF-α的表达及丙泊酚的干预效应[J].现代医药卫生,2011,27(9):1283-1284.
[17]王永炎,谢颖桢.化痰通腑法治疗中风病痰热腑实证的源流及发展 (四)——中风后脑肠轴改变及化痰通腑法治疗痰热腑实证的效应机理[J].北京中医药大学学报:中医临床版,2013,20(4):1-4.
Expression of TNF-αand NF-κB in Kupffer Cells caused by Hepatic StressInjury in Rats with Acute Cerebral Hemorrhage and Effects of Bowels-relaxing and Phlegm-resolving Method
LI Rui,WANGWei,ZHAO Hai-bin,WANG Yun,et al. The Third Affiliated Hospital of Beijing University of Traditional Chinese Medicine,Beijing 100029,China.
Objective:To investigate the changes of nuclear factor-κB(NF-κB)and tumor necrosis factor-α(TNF-α)in Kupffer cells(KCs)caused by hepatic stress injury in rats with acute cerebral hemorrhage and explore the protection mechanism of bowels-relaxing and phlegm-resolving method.Methods:Cerebral hemorrhage was induced by injecting collagenaseⅦinto the caudate nucleus of rats.With the serum was prepared well and healthy SD rats liver KCs were isolated,KCs were randomlly divided into 4 groups:blank control group,cerebral hemorrhage group,glucurolactone group and Tongfuhuatan group.Each group was further divided into 3 time-point sub-groups of 6,12,and 24 h.The activation of NF-κB in KCs was detected by electrophoresis mobility shift assays(EMSA),the protein of NF-κB was observed by Western blot,the expressions of TNF-α were determined by Enzyme-linked immunosorbent assay(ELISA)after drug administration.Results:The levels of NF-κB and TNF-α in KCs in cerebral hemorrhage group were more than that of blank control group at each time-point(P<0.05). Compared with cerebral hemorrhage group,it was increased significantly in both glucurolactone group and Tongfuhuatan group(P<0.05),but it higher than blank control group.Further more,Tongfuhuatan group had markedly reduced(P<0.05).Conclusion:The expression of NF-κB and TNF-αplay important roles in the signal transduction induced by Lipopolysaccharide in KCs caused by hepatic injury with acute cerebral hemorrhage.Bowelsrelaxing and phlegm-resolving method could enhance the activity of NF-κB and release of TNF-α availably,which is an important way to exert its protective effects on treating hepatic stress injury caused by acute cerebral hemorrhage.
bowels-relaxing and phlegm-resolving method;Accused cerebral hemorrhage(ACH);Kupffer cells;nuclear factor-κB(NF-κB);tumor necrosis factor-α(TNF-α)
R285.5
A
1004-745X(2017)04-0604-04
10.3969/j.issn.1004-745X.2017.04.012
2016-11-25)
北京中医药大学优秀青年骨干教师专项计划(2015-JYB-QNJSZX010)
