15种维药医院制剂微生物限度检查方法验证
2017-06-05郝娟常婧王毅
郝 娟 常 婧 王 毅
(新疆喀什地区食品药品检验所,新疆 喀什 844000)
15种维药医院制剂微生物限度检查方法验证
郝 娟 常 婧 王 毅
(新疆喀什地区食品药品检验所,新疆 喀什 844000)
目的:建立15种维药医院制剂的微生物限度检查方法。方法:按《中国药典》2010年版附录微生物限度检查法中细菌、霉菌及酵母菌计数方法和控制菌检查法进行验证。结果:供试品5种试验菌回收率菌均高于70%,控制菌均能正常检出。结论:维药医院制剂必须进行微生物限度检查方法验证,才能保证检验结果的正确性。
维药医院制剂;微生物限度;方法学验证;回收率
新疆维药居多,主要以医院制剂的形式发展。目前医院制剂普遍存在的质量标准检测方法落后、质量标准缺项严重的问题[1]。药品微生物检验主要是根据药品质量标准所规定的相关指标对药品在研制、生产、保存等过程中是否受到微生物污染来进行药品质量以及安全性的综合评定。[2]按《中国药典》2010年版规定[3],药品进行微生物限度检查时必须对方法学进行验证,本文参考相关文献[4-7],根据制剂中成分的抑菌作用强度不同,采用了常规法、培养基稀释法、薄膜过滤法制备供试品溶液,建立了15种医院制剂相应的微生物限度检测方法,经方法验证试验证实该方法简便易行,消除抑菌作用有效。
1 仪器与材料
1.1 仪器:高压蒸汽灭菌器,LDZH-150KBS,上海申安医疗器械厂;超净工作台,SW-CJ-2D,苏州净化设备有限公司;生物安全柜,BH3-1300,苏州安泰空气技术有限公司;HTY-III型集菌仪,杭州泰林医疗器械厂;一次性薄膜过滤器(规格FC502;批号20150814),杭州泰林生物技术设备有限公司。
1.2 样品:复方比黑马尔江胶囊(批号:20141201,20141202);艾合米尔散(批号:20150101,20150102);黑种草子油(批号:20141201,20141202);依提尔菲力开西尼孜丸(批号:20150201,20150202);小茴香露剂(批号:20141201,20141202)均有新疆喀什地区叶城县维吾尔医医院提供.加瓦日西库木尼蜜膏(批号:20141101,20141201);驱白马日白热斯丸(批号:20140601,20140801);复方安吉杷尔糖浆(批号:20140901,20141101);玛里抗瘤丸(批号:20140701,20141101);加瓦日西昆都尔蜜膏(批号:20141101,20141201)均有新疆喀什地区莎车县维吾尔医医院提供。止痛苏润江片(批号:20150101,20150102);复方合牙日仙拜尔片(批号:20150101,20150202);止咳祖帕片(批号:20150101,20150102);那尼花米西克片(批号:20150101,20150102);清血吾血白片(批号:20150101,20150102)均有新疆和田地区维吾尔医医院提供
1.3 培养基:营养琼脂培养基(批号:110105)、玫瑰红钠琼脂培养基(批号:1012152)、营养肉汤培养基(批号:101213)、胆盐乳糖增菌液批号:(1211222)、pH7.0氯化钠-蛋白胨缓冲液(批号:1404242)、乳糖胆盐发酵培养基(批号:101108),营养肉汤培养基(批号:141103)均由北京三药科技开发公司
1.4 菌株:金黄色葡萄球菌,大肠埃希菌,枯草芽孢杆菌,铜绿假单孢菌,白色念珠菌,黑曲霉,乙型副伤寒沙门菌均由中国食品药品检定研究院提供。
2 方法与结果
2.1 菌液的制备
2.1.1 取经35℃培养18~24h的金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌肉汤培养物1mL,加入9mL0.9%氯化钠溶液中,10倍稀释制成50~100cfu/mL,备用。
2.1.2 取经25℃培养24~48h的白色念珠菌改良马丁液体培养物1mL,加入9mL0.9%氯化钠溶液中,10倍稀释为50~100cfu/mL,备用。
2.1.3 取经25℃培养1周的黑曲霉斜面培养物,加3mL0.9%灭菌氯化钠洗下霉菌孢子,用带有棉花的吸管取出菌液,用0.9%灭菌氯化钠溶液10倍稀释制成50~100cfu/mL,备用。
2.2 供试品溶液的制备
2.2.1 口服液体供试品:取样品10mL,加pH7.0无菌氯化钠-蛋白胨缓冲液至100mL,混匀,制成1:10的供试液。
2.2.2 口服固体供试品:取样品10g,加pH7.0无菌氯化钠-蛋白胨缓冲液至100mL,混匀,制成1:10的供试液。
2.2.3 外用液体供试品:取样品10mL,加含2%吐温-80的pH7.0无菌氯化钠-蛋白胨缓冲液至100mL,混匀,制成1:10的供试液。
2.2.4 外用固体供试品:取样品10g,加含2%吐温-80的pH7.0无菌氯化钠-蛋白胨缓冲液至100mL,混匀,制成1:10的供试液。
2.3 验证方法
2.3.1 细菌、霉菌和酵母菌计数法回收率的测定。
2.3.1.1 试验组:平皿法:取1mL1:10供试品溶液和50~100cfu菌液注入1个平皿中,迅速倒入15~20mL45℃左右的琼脂培养基,每个菌株制备2个平皿。细菌在35℃培养箱中培养3d,霉菌在25℃培养箱中培养5d,计数,取平均值。
培养基稀释法:取0.2mL/皿1:10供试品溶液和50~100cfu菌液注入1个平皿中,照常规法进行试验。
薄膜过滤法:取1:10供试液1mL加入薄膜过滤器中,冲洗液100mL/膜,在最后一次冲洗液中加入50~100cfu试验菌,后取膜贴于琼脂平板,按薄膜过滤法测定其菌数。
2.3.1.2 菌液组:测定所加的试验菌数。
2.3.1.3 供试品对照组:取规定量供试品溶液,按菌落计数方法测定供试品本底菌数。
2.3.1.4 稀释剂对照组:取相应的稀释液代替供试品溶液,加入试验菌,按试验组方法测定其菌落数。
回收率(%)=(试验组菌数-供试品组菌数)/菌液组菌数×100%
2.3.2 控制菌检验方法验证
2.3.2.1 大肠埃希菌:取供试液10mL及10~100cfu大肠埃希菌加至100mL胆盐乳糖增菌液中,培养18~24h后,按《中国药典》2010年版控制菌检验方法检查。
2.3.2.2 大肠菌群:取供试液1.0mL及10~100cfu大肠埃希菌加至10mL胆盐乳糖发酵培养基中,培养18~24h后,按《中国药典》2010年版控制菌检验方法检查。
2.3.2.3 沙门菌:取供试液10mL及10~100cfu金黄色葡萄球菌加至200mL营养肉汤培养基中,培养18~24h后,按《中国药典》2010年版控制菌检验方法检查。
2.3.2.4 金黄色葡萄球菌:取供试液10mL及10~100cfu金黄色葡萄球菌加至100mL营养肉汤培养基中,培养18~24h后,按《中国药典》2010年版控制菌检验方法检查。
2.3.2.5 铜绿假单孢菌:取供试液10mL及10~100cfu铜绿假单孢菌加至100mL胆盐乳糖增菌液培养基中,培养18~24h后,按《中国药典》2010年版控制菌检验方法检查。
2.4 结果
2.4.1 常规法测定3家医院15种供试品的回收率,进行3次独立平行试验,稀释剂对照组回收率均高于70%,试验组结果见表1。复方比黑马尔江胶囊、黑种草子油、依提尔菲力开西尼孜丸、小茴香露剂、复方安吉杷尔糖浆、止咳祖帕片、清血吾血白片采用常规法5种试验菌的回收率均高于70%,证明无抑菌现象。加瓦日西库木尼蜜膏、驱白马日白热斯丸、玛里抗瘤丸、加瓦日西昆都尔蜜膏、止痛苏润江片等5种对枯草芽孢杆菌有明显抑制作用,其中加瓦日西昆都尔蜜膏采用薄膜过滤法(100mL/膜)可消除其抑菌作用,其他4种采用培养基稀释法(0.2mL/皿)可消除其抑菌作用。艾合米尔散、复方合牙日仙拜尔片、那尼花米西克片对金黄色葡萄球菌、枯草芽孢杆菌均有明显抑制作用,采用培养基稀释法(0.2mL/皿)可消除其抑菌作用。
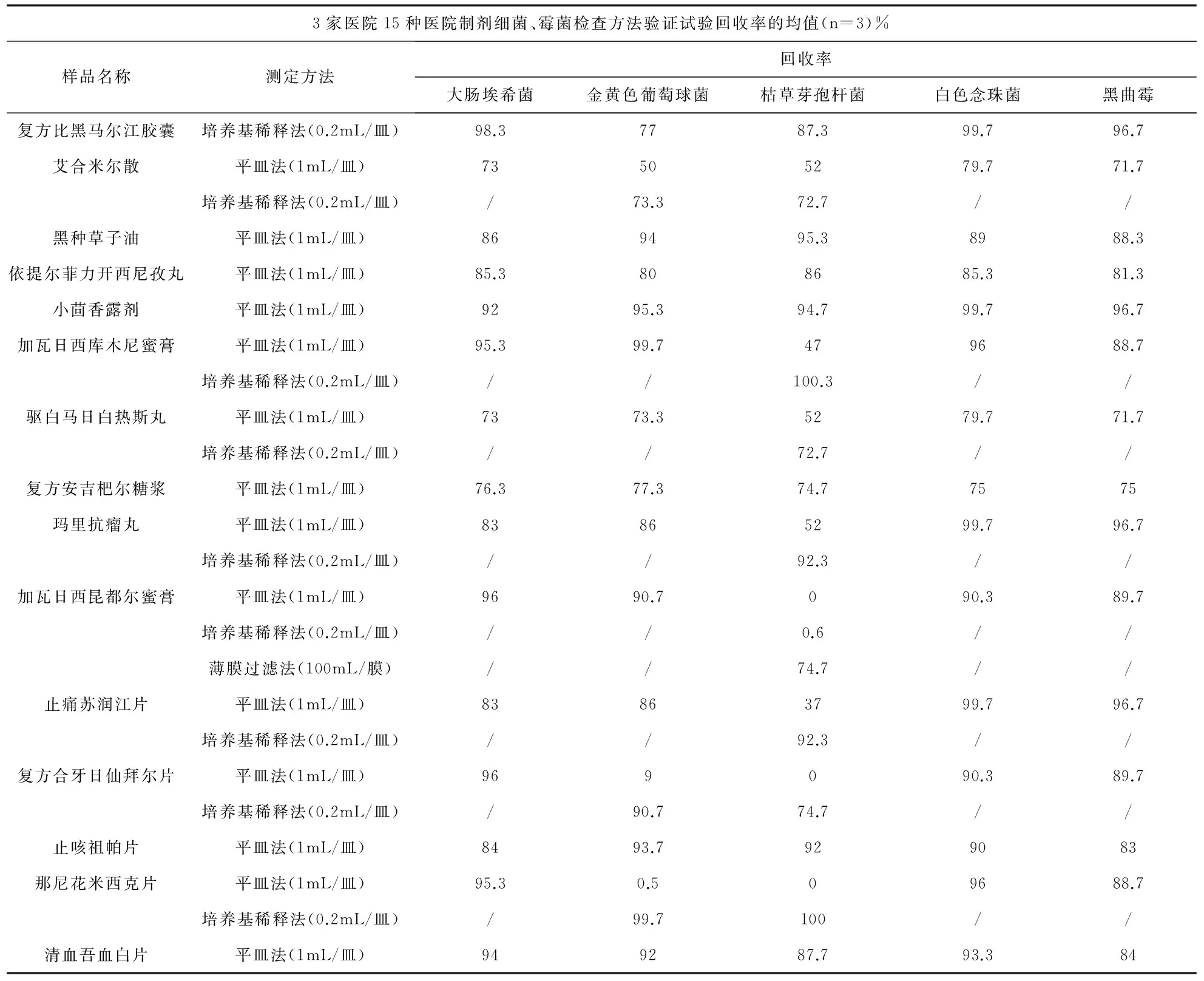
表1 15种维药医院制剂微生物限度检查方法验证结果
2.4.2 15种样品控制菌检查均可采用常规法进行检验,说明对各类控制菌均无抑制作用。

表2 控制菌检查方法验证结果
3 讨论
3.1 细菌、霉菌及酵母菌及控制菌检查方法的确立:通过对15种维药医院制剂微生物限度检查法的建立研究,表明对于细菌、霉菌及酵母菌的检验,复方比黑马尔江胶囊、黑种草子油、依提尔菲力开西尼孜丸、小茴香露剂、复方安吉杷尔糖浆、止咳祖帕片、清血吾血白片可采用平皿法(1mL/皿),加瓦日西库木尼蜜膏、驱白马日白热斯丸、玛里抗瘤丸、止痛苏润江片、艾合米尔散、复方合牙日仙拜尔片、那尼花米西克片可采用培养基稀释法(0.2mL/皿),加瓦日西昆都尔蜜膏采用薄膜过滤法(100mL/膜)进行检验。15种维药医院制剂控制菌检查均采用常规法。
3.2 方法确立结果的讨论:通过方法学验证试验,能有效地消除或减弱制剂中抑菌成分的影响,增加了实际用药检测的方法借鉴和数据支持,使检测结果与实际更接近,进一步说明了维药医院制剂微生物检查方法验证的必要性和重要性。
3.3 小结:本研究采用中国药典规定的药品微生物限度检查方法对15种维药医院制剂微生物限度检查方法进行验证,药品微生物限度检测是反映药品质量的重要依据。药品出现微生物污染会导致患者出现严重的肠道反应、甚至引发失明、败血症等严重后果[8]。目前,新疆维吾尔自治区共有民族医医疗机构48家,民族医医疗机构制剂室22个,可配制制剂品种1545个,新疆民族药事业发展步入了标准化、规范化轨道。民族药标准化带来的是人们群众的用药安全,是市场对民族药产品的认可,科学合理地制定民族药质量标准,将对推进民族药及其生产的规范化、标准化、现代化产生积极而深远的影响[9]。开展民族药研究,对于保证和提高民族药用药安全,促进各民族间文化交流和地区经济发展,将发挥极大作用[10]。药品安全性是临床应用的重要前提以及必要保证,其对于避免将受到微生物污染的制剂应用于人体,危害患者生命安全具有重要意义。因此,依据相关规定对药品进行无菌检测是保证患者用药安全的必要环节[11]。
[1]马佩杰,沈伟,张妍,赵婷,等.医院制剂质量标准存在的问题分析及对策探讨[J].中国医学伦理学,2015,28(3):353-355.
[2]Yang J.Analysis of factors influencing the results of the microbial limit test of drugs[J].Chin Pharm Affairs,2012,22(12):1095-1096.
[3]国家药典委员会.中国药典[S].一部.中医药科技出版社,2010:附录79-88.
[4]孙莹,郭朝晖,宋京都.8种医院制剂微生物限度检查方法验证[J].中国药事,2014,28(8):839-842.
[5]曹晓云,郭艳娟.药品微生物限度检查方法学验证试验及其相关的技术问题[J].d津药学,2006,13(6):12-13.
[6]韦曦,邱双成,王翠荣.29种医院制剂微生物限度检查方法学验证[J].中国药房,2008,19(1):52-54.
[7]吴晓敏,王燕燕.8种医院制剂微生物限度检查方法验证[J].中国医院药学杂志,2007,27(1):93-94.
[8]严佳,钟桂香,贺全山,等.我国药品微生物限度检查的发展历程[J].药学实践杂志,2012,23(03):26-27.
[9]杨洋,张艺,黄宇,赖先荣,等.民族药质量标准研究现状及思考[J].中国中药杂志,2013,38(17):2878-2881.
[10]陈佳,金红宇,田金改,林瑞超.民族药质量标准现状概述[J].中国药事,2012,26(2):191-194.
[11]林晓晖,宋菁景.浅谈我国药品微生物检验中的问题及发展[J].中国民康医学,2015,27(10):78-79.
2016年11月29日收稿
The microbial limit test of 15 Uighur medicine hospital preparations.
HAO Juan CHANG Jin WANG Yi
(Kashi district institute for food and drug control in Xinjiang)
Objective To establish a method for the microbial limit test of 15 Uighur medicine hospital preparations.Methods A validation on the microbial limit test method was conducted in accordance with the counting method of bacteria,mycetes and yeasts and the control bacteria test method stated in the Appendix of China Pharmacopoeia (2010 edition).Results The recoveries of five test organisms were higher than 70%,the control microorganisms were properly detected .Conclusion Uighur medicine hospital preparations should undergo validation with the microbial limit test method to ensure the correctness of test results.
Uighur medicine hospital preparations;microbiallimit;validation of method;recovery rate
R291.5
B
1006-6810(2017)04-0039-04
