乳酸不依赖于丙酮酸参与调节C2C12细胞线粒体功能维持的研究
2017-06-05孙景权叶建平谢敏豪
孙景权,叶建平,谢敏豪
缺氧情况下,细胞通过糖酵解途径产生乳酸,在大多数情况下乳酸以乳酸盐(如乳酸钠)形式存在于机体中。糖经过糖酵解产生丙酮酸,然后丙酮酸在乳酸脱氢酶(Lactate dehydrogenase,LDH)的作用下产生乳酸。安静状态下血浆中乳酸浓度是0.5~2 mmol/L,骨骼肌和红细胞被认为是产生乳酸的主要位点。尽管骨骼肌在安静状态下不停地生成和利用乳酸,但是剧烈运动引起乳酸生成量增加,能够达到10~20 mmol/L[1-4]。人体一次高强度无氧运动后骨骼肌中乳酸浓度甚至达到40 mmol/L[5]。另外,脂肪组织也是乳酸的重要来源[6-7]。当葡萄糖含量丰富的情况下,在胰岛素作用下脂肪组织能够将50%以上的糖转化成乳酸[8-9]。
乳酸通过其质子串联(Proton-linked)的单羧酸转运体(Monocarboxylate Transporters,MCTs)进出细胞[10]。传统生物化学理论认为,乳酸是缺氧条件下葡萄糖的一个中间代谢产物,在氧气充足情况下,乳酸进入细胞后,主要在LDH作用下转化为丙酮酸,丙酮酸在丙酮酸脱氢酶(Pyruvate Dehydrogenase,PDH)作用下生成乙酰辅酶A,进而进入糖异生途径生成葡萄糖或是三酸羧循环途径生成ATP[11]。这条途径称之为乳酸转化为丙酮酸途径。但是近年来研究发现,乳酸是机体一个重要信号物质,乳酸在细胞中发挥信号分子作用。研究发现:乳酸能够结合其受体G蛋白偶联受体81(G Protein-Coupled Receptors 81,GPR81)发挥自分泌和旁分泌作用,从而抑制小鼠及大鼠脂肪组织和脂肪细胞的脂解作用[12]。因此目前学者们认为,代谢物乳酸可能直接作为信号分子物质影响细胞功能。
线粒体功能的维持需要线粒体各种酶的作用,而这些功能酶会受到许多小分子物质调节。α-硫辛酸是一种重要的小分子物质,它的作用是脂化修饰某些蛋白。脂化修饰是线粒体存在的一种蛋白转录后修饰,这种修饰作用是PDH和其他酶类(如α-酮戊二酸脱氢酶)功能维持所必需的。在线粒体中,α-硫辛酸是通过脂肪酸合成酶II系统(FattyAcid Synthase II system,FAS II)由乙酰辅酶A合成,这也是线粒体具有合成内源性脂肪酸功能的体现[13]。丙二酸单酰辅酶A酰基载体蛋白酰基转移酶(malonyl CoA-acyl carrier protein(ACP)transacylase,MCAT)是FASII复合物中一个主要组成成分,它是维持线粒体功能所必需的[14-15]。运动训练能够增加线粒体功能,但是MCAT在其中所起的作用还未知。
乳酸作为运动性代谢产物,其是否影响骨骼肌细胞线粒体功能目前鲜见报道。本研究采用C2C12肌管细胞模拟骨骼肌细胞,假设乳酸参与调节C2C12肌管细胞中线粒体功能的维持,即乳酸调节MCAT蛋白表达量。另外,常规认为乳酸通过转化为丙酮酸发挥作用,那么乳酸发挥调节C2C12肌管细胞中线粒体功能作用是否依赖于丙酮酸途径目前尚未见报道。本研究通过采用乳酸和丙酮酸等化学药物处理C2C12肌管细胞后,观察细胞内MCAT蛋白含量及PDH脂化状态的变化情况,进而研究乳酸是否参与调节C2C12肌管细胞线粒体功能维持以及这一作用是否依赖于丙酮酸途径,为深入开展运动锻炼增加骨骼肌线粒体功能的机制研究奠定基础。
1 研究对象和方法
1.1 细胞培养
小鼠成肌细胞细胞株C2C12(CRL-1772)购买于美国菌种保藏中心(American Type Culture Collection)(马纳萨斯,维吉尼亚州)。首先将细胞接种于100 mm培养皿中,每皿加10 mL培养基(高糖DMEM,10%胎牛血清/FBS,1%庆大霉素),在37°C、5%CO2恒温培养箱中培养,定期检查是否出现支原体污染现象。当培养皿中细胞汇合约80%时,加入1 mL的0.25%胰酶37℃消化细胞,加新培养基吹悬细胞并调整细胞浓度至5×104/mL,铺入6孔板。当6孔板中细胞融合到90%~95%时,将C2C12细胞培养基更换为分化培养基(高糖DMEM,2%马血清,1%庆大霉素)。当用乳酸或是丙酮酸等化学药物处理细胞时,培养基换成含0.25%牛血清白蛋白(Bovine Serum Albumin,BSA)的高糖DMEM(GIBCO 11960)过夜,与次日进行药物处理。
1.2 细胞处理
C2C12细胞分化5天后,肌管细胞使用血清-饥饿培养基(高糖DMEM,不含丙酮酸,0.25%BSA,GIBCO,货号:11960)过夜。次日,使用乳酸钠(Sigma L7022)、丙酮酸钠(Sigma-Aldrich P2256)进行处理。乳酸钠和丙酮酸钠溶解在H2O中待用,4℃保存,储存浓度为1 mol/L。
1.3 蛋白质提取及浓度测定
用细胞裂解液(50 mmol/L KCl,1%NP-40,25 mmol/L HEPES pH7.8,10 μg/mL leupeptin,20 μg/mL aprotinin,125 μmol/L DTT,1 mmol/L PMSF,1 mmol/L Na3VO4)裂解细胞,收集在1.5 mL离心管裂解液中。用超声仪对细胞裂解液进行超声,此操作在冰上完成。4°C、12 000 g离心15 min。将上清液作为细胞蛋白提取液分装至预冷离心管中。总蛋白浓度测定采用Thermo Scientific公司的BCA蛋白定量分析试剂盒(Life technologies,Eugene,Oregon,Prod#23225),采用BSA作为标准液制作标准曲线,测试方法依照说明书进行。
1.4 Western blot检测蛋白表达量
按照实验室以前方案进行[16],每样品孔加50~100µg细胞总蛋白量。简单概括如下,按照样品:4×样品缓冲液=50µL:15µL比例混合在一起,100℃煮沸5 min,冰上放置5 min,800 g离心2 min,用移液枪抽取适量样品加入自制8%SDS-PAGE胶(见表1)的样品槽内,电压50~100 V;转膜,电压为50 V,时间2 h;转膜后1×PBS冲洗1次,共10 min;5%脱脂牛奶缓冲液封闭1 h;用1×PBS冲洗3次,每次10 min;然后加一抗4℃过夜;次日取出,1×PBS冲洗3次,每次10 min;鼠或是兔抗二抗孵育1 h;1×PBS冲洗3~5次,每次10 min;加底物显影液后进行曝光。蛋白名称及试剂提供公司如下:主要抗脂化的抗体lipoylation(437695)购买于Calbiochem®(Darmstadt,Germany);抗体 PDHE2(ab66511)购买于Abcam(Cambridge,MA,USA);β-actin(C4,sc-47778),抗体MCAT(H-146,sc-366137)购买于Santa Cruz Biotechnology(Dallas,TX)。β-actin作为内参蛋白。用化学发光方法将蛋白信号曝光于胶片中,使用Image J来分析每个条带的光密度强度。

表1 8%SDS-PAGE胶配方Table1 8%SDS-PAGE Gel Formula
1.5 PDH活性测试
细胞裂解液中PDH活性测试采用PDH活性微板测定试剂盒(Abcam,ab109902),操作步骤依照试剂盒所提供说明书进行。最后,在室温条件下使用酶标仪进行吸光度检测,波长450 nm,检测方法使用动力学程序,每20 s读一次数,共检测60 min,读数过程中96孔板震动摇匀。将时间作为x轴,OD值作为y轴,绘制曲线,曲线的斜率作为PDH活性大小。
1.6 丙酮酸含量测试
细胞中丙酮酸含量测定使用丙酮酸比色法测定试剂盒(K609-100,BioVision,Milpitas CA,USA),测试方法依照说明书进行。最后,使用酶标仪(Benchmark Plus Microplate Spectrophotometer,BIO-RAD,California,USA)在波长570 nm下读取吸光度。根据标准曲线计算出样品中丙酮酸含量,根据公式:样品中丙酮酸浓度=根据标准曲线计算出样品中丙酮酸含量(nmol)/加入样品含量(µL)×样品稀释倍数。相对丙酮酸含量用样品中蛋白浓度校准。
1.7 数据统计方法
所有数据以平均数±标准差(Xˉ±SD)方式表示,用SPSS18.0统计软件进行处理。组间比较采用独立样本T检验,显著水平取P<0.05,非常显著水平P<0.01。作图软件采用Excel 2010和GraphPad Prism 5。
2 结 果
2.1 乳酸增加C2C12肌管细胞MCAT蛋白表达量
本研究通过观察肌管细胞中MCAT蛋白表达量研究乳酸对线粒体功能维持的影响。由图1可知,与对照组相比,16 mmol/L乳酸以时间效应方式显著增加细胞中MCAT的蛋白表达量(P<0.01),这种诱导作用在0.5 h出现,一直持续到8 h,而且存在时间依赖性现象(图1 A)。另外,在剂量相应上,处理后4 h,2~64 mmol/L乳酸均能够非常显著增加细胞中MCAT蛋白表达量(P<0.01),其中16 mmol/L乳酸效果最为明显(图1 B)。
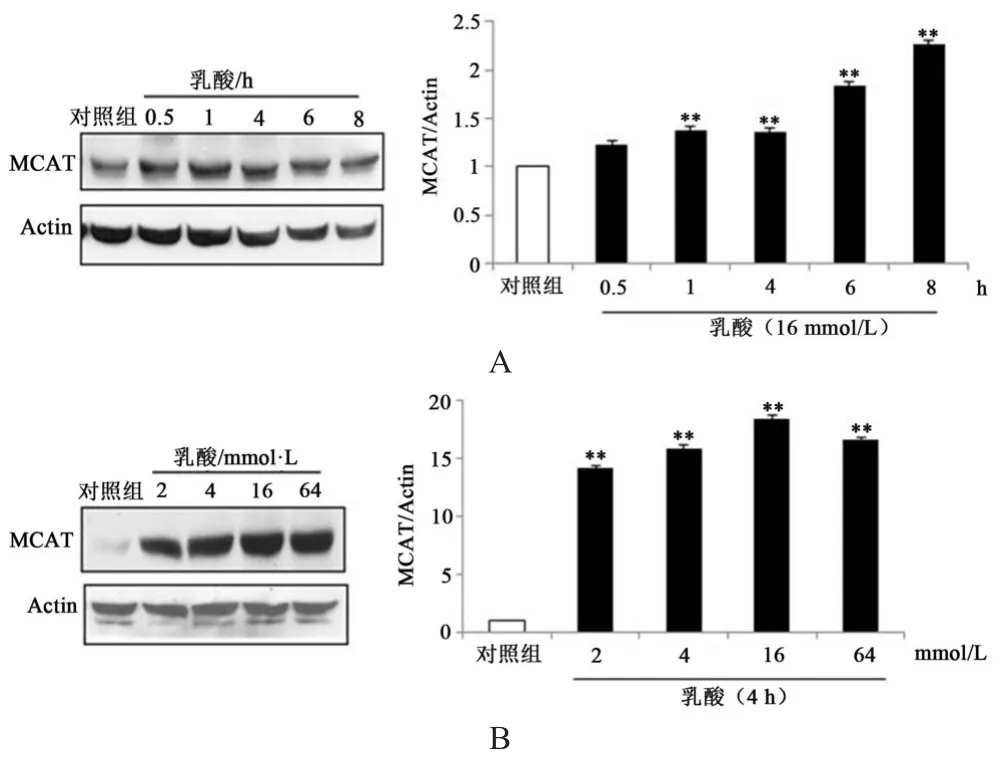
图1 乳酸对MCAT蛋白表达量的影响Figure1 The Effect of Lactate on Protein Expression of MCAT
2.2 乳酸增加C2C12肌管细胞中PDH脂化状态和活性
本研究通过观察肌管细胞中PDH脂化信号水平研究乳酸对线粒体功能的影响。由图2可知,与对照组相比,16 mmol/L乳酸以时间效应的方式非常显著增加C2C12肌管细胞中PDH脂化信号水平(P<0.01),这种诱导作用在0.5 h出现,一直持续到8 h(图2 A)。同时本研究观察乳酸对C2C12肌管细胞中PDH活性的影响。与对照组相比,8~16 mmol/L乳酸能够增加肌管细胞中PDH活性,并且16 mmol/L效果最显著(P<0.01)(图2 B)。这些数据证明乳酸处理增加了PDH脂化信号水平。
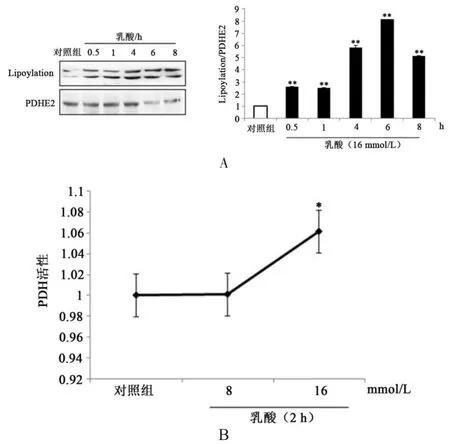
图2 乳酸对PDH脂化状态和活性的影响。Figure2 The Effect of Lactate on Lipoylation Level and Activity of PDH
2.3 丙酮酸对C2C12肌管细胞MCAT蛋白表达量和PDH脂化水平的影响
由图3可知,与对照组相比,16 mmol/L丙酮酸在时间效应上不能增加肌管细胞中MCAT蛋白表达量(P>0.05),甚至在8 h处理后显著降低细胞中MCAT蛋白表达量(P<0.05)(图3 A)。这表明丙酮酸不能影响MCAT蛋白表达量。同时,与对照组相比,16 mmol/L丙酮酸在时间效应上虽然有增加PDH脂化信号水平的趋势但无显著性(P>0.05),且在8 h处理后显著降低细胞中PDH脂化信号水平(P<0.05)(图3 B)。由此证明丙酮酸不影响线粒体功能酶MCAT蛋白表达量和PDH脂化信号水平。
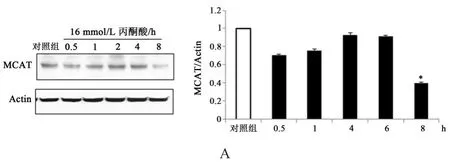
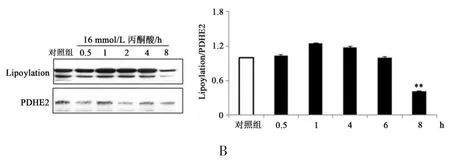
图3 丙酮酸对C2C12肌管细胞MCAT蛋白表达量和PDH脂化水平的影响。Figure 3 The Effect of Pyruvate on Protein Expression of MCAT and Lipoylation Level of PDH in C2C12 Myotube Cells
2.4 乳酸增加C2C12肌管细胞中丙酮酸含量和MCAT蛋白表达量不依赖于丙酮酸
由图4可知,与对照组相比,16 mmol/L乳酸处理肌管细胞后,C2C12肌管细胞中丙酮酸含量显著增高(P<0.05)(图4 A)。而且,当使用乳酸脱氢酶抑制剂棓黄素(Galloflavin)处理肌管细胞后,乳酸增加细胞内丙酮酸含量这一作用减弱(P<0.05)(图4 B)。这说明乳酸能够转化丙酮酸,丙酮酸可能介导了乳酸活性。为了验证这种可能性,本研究使用Galloflavin处理肌管细胞后,细胞中MCAT蛋白含量非常显著降低(P<0.01),但是Galloflavin处理并不能减弱乳酸增加MCAT蛋白表达量的作用(P<0.05)(图4 C)。这些数据表明,丙酮酸可能不参与介导乳酸增加MCAT蛋白表达量的作用。
3 分析与讨论
众所周知,运动训练能够增加骨骼肌细胞中线粒体氧化功能即ATP产生的能力[17-18]、琥珀酸脱氢酶含量、I型肌纤维数量比例[19]。但是运动诱导骨骼肌细胞线粒体功能增加的分子机制还不清楚。乳酸作为葡萄糖代谢物,长期以来被认为是葡萄糖无氧酵解的副产物或是废物,主要被用于作为能源物质进入三羧酸循环产生ATP或者是在肝脏中糖异生成葡萄糖[1,20-22]。近年来学者们注意到乳酸一个新的角色——分子信号物质[23-24],如乳酸通过结合其受体GPR81后能够通过降低腺苷酸环化酶活性进一步降低细胞内cAMP产量[25-26]。那么乳酸是否会影响骨骼肌细胞中线粒体功能维持蛋白MCAT蛋白表达量和PDH活性和表达量目前未见报道。本研究采用C2C12肌管细胞模拟研究乳酸对骨骼肌细胞线粒体功能蛋白MCAT和PDH的影响,为后续进行运动诱导骨骼肌线粒体功能增强的机制研究奠定基础。本研究结果表明,在细胞培养水平上,生理浓度范围内(4~64 mmol/L)的乳酸增加了C2C12肌管细胞中线粒体功能维持相关蛋白PDH和MCAT的蛋白含量及活性。

图4 乳酸增加C2C12肌管细胞中丙酮酸含量和MCAT蛋白表达量不依赖于丙酮酸。Figure 4 The Increases of Pyruvate Content and Protein Expression of MCAT by Lactate in C2C12 Myotube Cells Independently of Pyruvate
本研究观察乳酸是否影响MCAT蛋白表达量和PDH脂化水平。MCAT是一个线粒体蛋白,它是线粒体功能维持的必需物质。有机体细胞内存在两条脂肪酸合成途径,存在于胞浆内的是I型脂肪酸(Type I Fatty Acid Synthase,FAS I),存在于线粒体的是II型脂肪酸合成(Type II Fatty Acid Synthase,FAS II)[27]。FASII是线粒体功能维持所必需的[13,27]。硫辛酸是 FASII合成的其中产物之一[13,28]。硫辛酸是哺乳动物心肌细胞中蛋白质脂化修饰所必需物质[29-30]。在线粒体中,MCAT控制辛酸的合成,辛酸是硫辛酸的前体[27]。MCAT利用丙二酰辅酶A作为底物来合成硫辛酸。硫辛酸通过脂化来修饰线粒体功能酶[29]。脂化是一种动态的和可逆的转录后修饰。PDH是线粒体功能酶,它是通过脂化修饰来激活[29]。激活后的PDH促进丙酮酸转化为乙酰辅酶A,进而增强脂肪酸合成和ATP产生。因此MCAT通过合成α-硫辛酸使PDH和αKDH硫辛酸化[31]。因为MCAT是线粒体功能维持所必需的一个重要酶,MCAT失活将导致线粒体功能紊乱[13,31-32]。尽管线粒体中MCAT活性是已知的,但是细胞内调节MCAT蛋白表达量的因素还是未知的。本研究数据表明:乳酸诱导MCAT蛋白表达;同时发现,乳酸诱发PDH和αKDH硫辛酸化信号水平增加,这说明乳酸增强了MCAT酶活性。另外,Takeshi等研究发现:乳酸能够明显增加L6细胞线粒体功能相关蛋白Cyt c和PGC-1α表达量[33]。基于PDH、αKDH、Cyt c和PGC-1α是线粒体功能标志蛋白酶,本研究认为乳酸同时参与调节线粒体功能蛋白增加。因此,本研究提供了一个乳酸参与调节骨骼肌细胞线粒体功能维持的分子机制。
乳酸能够调节线粒体功能蛋白MCAT蛋白表达量和PDH活性,进而影响线粒体功能的维持。常规认为,乳酸常被认为是肝脏糖异生的底物或者在许多外周组织中经过三羧酸循环生成ATP而作为能源物质发挥作用[11,34]。在这一过程中需要LDH的帮助,它能将乳酸催化生成丙酮酸,进一步进行糖异生或者产生ATP。因此乳酸这一作用是否依赖于丙酮酸途径值得研究。本研究将研究重点集中于丙酮酸上。研究数据表明:乳酸发挥作用不依赖于丙酮酸。本研究通过检测丙酮酸对C2C12肌管细胞的作用发现,丙酮酸处理C2C12肌管细胞后并不能增加细胞中MCAT的蛋白表达量,这一结果与乳酸诱发肌管细胞MCAT蛋白表达是不一致的,这说明乳酸诱发MCAT表达不依赖于丙酮酸。FASII的重要作用是合成线粒体功能酶所需的α-硫辛酸,α-硫辛酸是PDH发挥功能所必需的小分子物质,在合成α-硫辛酸过程中MCAT是限速酶[14-15]。因此,检测PDH脂化信号水平可间接反映MCAT的活性。本研究检测丙酮酸处理后细胞中PDH脂化信号水平发现,丙酮酸不能明显增加PDH脂化信号水平,这一作用与乳酸显著增加PDH脂化信号水平是不一致的。因此,乳酸增加PDH脂化信号水平不依赖于丙酮酸。这些数据清楚的表明,乳酸参与调节肌管细胞线粒体功能不依赖于丙酮酸。另外,胞浆中丙酮酸通过线粒体丙酮酸转运体进入线粒体内[35,36]。在线粒体内,丙酮酸被PDH转化成乙酰辅酶A,然后进入三羧酸循环进行代谢[37]。尽管本研究研究发现丙酮酸与乳酸结果不同,但是乳酸处理C2C12肌管细胞后细胞内丙酮酸含量明显升高。而且当使用乳酸脱氢酶抑制剂Galloflavin(Galloflavin均能够抑制乳酸脱氢酶亚型A和B活性,它能够抑制细胞内乳酸和ATP的合成量[38])后,乳酸增加细胞中丙酮酸含量的作用减弱,因此这些结果均说明部分乳酸转化成了丙酮酸。另外,本研究发现当抑制LDH活性后,肌管细胞中MCAT蛋白表达量降低,然而却不能逆转乳酸增加MCAT蛋白表达量的作用。因此本研究认为丙酮酸不参与乳酸增加MCAT蛋白表达量作用。鉴于部分乳酸转化的丙酮酸不参与乳酸调节线粒体功能维持的作用,因此,这部分丙酮酸在C2C12细胞中所发挥的作用需要进一步研究。基于以上研究可以得出,丙酮酸可能不参与乳酸调节C2C12肌管细胞线粒体功能维持的作用。
本研究的结果将对研究乳酸是否参与调节体内骨骼肌组织中线粒体功能维持具有积极的意义,也为进一步研究运动代谢产物乳酸是否参与调节运动诱导线粒体功能增强提供新思路。然而,由于体外肌管细胞与体内骨骼肌组织整体系统存在差异和受限于本研究采用的乳酸浓度是否完全适用于体内骨骼肌组织中乳酸浓度等原因,因此,利用体外实验所得的实验结果并不一定能真实地反映体内骨骼肌组织中线粒体功能维持的确切机制,尚需更多在体研究数据进一步支持。
4 结论
乳酸影响C2C12细胞中线粒体功能维持并调节线粒体功能蛋白MCAT蛋白表达量,并且这一作用不依赖于丙酮酸途径。
[1]KAMIJO Y,TAKENO Y,SAKAI A,et al.Plasma lactate concentration and muscle blood flow during dynamic exercise with negative-pressure breathing[J].J Appl Physiol(1985),2000,89(6):2196-2205.
[2]HUGHSON R L,WEISIGER K H,SWANSON G D.Blood lactate concentration increases as a continuous function in progressive exercise[J].J Appl Physiol(1985),1987,62(5):1975-1981.
[3]OHKUWA T,KATO Y,KATSUMATA K,et al.Blood lactate and glycerol after 400-m and 3,000-m runs in sprint and long distance runners[J].Eur J Appl Physiol Occup Physiol,1984,53(3):213-218.
[4]CHEETHAM M E,BOOBIS L H,BROOKS S,et al.Human muscle metabolism during sprint running[J].J Appl Physiol(1985),1986,61(1):54-60.
[5]WALENTA S,SCHROEDER T,MUELLER-KLIESER W.Lactate in solid malignant tumors:potential basis of a metabolic classification in clinical oncology[J].Curr Med Chem,2004,11(16):2195-2204.
[6]CRANDALL D L,FRIED S K,FRANCENDESE A A,et al.Lactate release from isolated rat adipocytes:influence of cell size,glucose concentration,insulin and epinephrine[J].Horm Metab Res,1983,15(7):326-329.
[7]ELLMERER M,SCHAUPP L,SENDLHOFER G,et al.Lactate metabolism of subcutaneous adipose tissue studied by open flow microperfusion[J].J Clin Endocrinol Metab,1998,83(12):4394-4401.
[8]COPPACK S W,FRAYN K N,HUMPHREYS S M,et al.Effects of insulin on human adipose tissue metabolism in vivo[J].Clin Sci(Lond),1989,77(6):663-670.
[9]QVISTH V,HAGSTROM-TOFT E,MOBERG E,et al.Lactate release from adipose tissue and skeletal muscle in vivo:defective insulin regulation in insulin-resistant obese women[J].Am J Physiol Endocrinol Metab,2007,292(3):E709-E714.
[10]HALESTRAP A P.The SLC16 gene family-structure,role and regulation in health and disease[J].Mol Aspects Med,2013,34(2-3):337-349.
[11]BROOKS G A.Cell-cell and intracellular lactate shuttles[J].J Physiol,2009,587(Pt 23):5591-5600.
[12]AHMED K,TUNARU S,TANG C,et al.An autocrine lactate loop mediates insulin-dependent inhibition of lipolysis through GPR81[J].Cell Metab,2010,11(4):311-319.
[13]HILTUNEN J K,AUTIO K J,SCHONAUER M S,et al.Mitochondrial fatty acid synthesis and respiration[J].Biochim Biophys Acta,2010,1797(6-7):1195-1202.
[14]ZHANG L,JOSHI A K,SMITH S.Cloning,expression,characterization,and interaction of two components of a human mitochondrial fatty acid synthase.Malonyltransferase and acyl carrier protein[J].J Biol Chem,2003,278(41):40067-40074.
[15]SZAFRANSKA A E,HITCHMAN T S,COX R J,et al.Kinetic and mechanistic analysis of the malonyl CoA:ACP transacylase from Streptomyces coelicolor indicates a single catalytically competent serine nucleophile at the active site[J].Biochemistry,2002,41(5):1421-1427.
[16]KE B,ZHAO Z,YE X,et al.Inactivation of NF-kappaB p65(RelA)in Liver Improves Insulin Sensitivity and Inhibits cAMP/PKA Pathway[J].Diabetes,2015,64(10):3355-3362.
[17]GOODPASTER B H,HE J,WATKINS S,et al.Skeletal muscle lipid content and insulin resistance:evidence for a paradox in endurancetrained athletes[J].J Clin Endocrinol Metab,2001,86(12):5755-5761.[18]AMATI F,DUBE J J,ALVAREZ-CARNERO E,et al.Skeletal muscle triglycerides,diacylglycerols,and ceramides in insulin resistance:another paradox in endurance-trained athletes?[J].Diabetes,2011,60(10):2588-2597.
[19]PRUCHNIC R,KATSIARAS A,HE J,et al.Exercise training increases intramyocellular lipid and oxidative capacity in older adults[J].Am J Physiol Endocrinol Metab,2004,287(5):E857-E862.
[20]MILLER H I,ISSEKUTZ B J,RODAHL K,et al.EFFECT OF LACTIC ACID ON PLASMA FREE FATTY ACIDS IN PANCREATECTOMIZED DOGS[J].Am J Physiol,1964,207:1226-1230.
[21]ISSEKUTZ B J,MILLER H I,PAUL P,et al.Effect of lactic acid on free fatty acids and glucose oxidation in dogs[J].Am J Physiol,1965,209(6):1137-1144.
[22]CORI C F,SHINE W M.THE FORMATION OF CARBOHYDRATE FROM GLYCEROPHOSPHATE IN THE LIVER OF THE RAT[J].Science,1935,82(2119):134-135.
[23]LAM T K,GUTIERREZ-JUAREZ R,POCAI A,et al.Regulation of blood glucose by hypothalamic pyruvate metabolism[J].Science,2005,309(5736):943-947.
[24]KUEI C,YU J,ZHU J,et al.Study of GPR81,the lactate receptor,from distant species identifies residues and motifs critical for GPR81 functions[J].Mol Pharmacol,2011,80(5):848-858.
[25]LAURITZEN F,EID T,BERGERSEN L H.Monocarboxylate transporters in temporal lobe epilepsy:roles of lactate and ketogenic diet[J].Brain Struct Funct,2015,220(1):1-12.
[26]LAURITZEN K H,MORLAND C,PUCHADES M,et al.Lactate receptor sites link neurotransmission,neurovascular coupling,and brain energy metabolism[J].Cereb Cortex,2014,24(10):2784-2795.
[27]HILUNEN J K,SCHONAUER M S,AUTI K J,et al.Mitochondrial fatty acid synthesis type II:more than just fatty acids[J].J Biol Chem,2009,284(14):9011-9015.
[28]FUJIWARA K,OKAMURA-IKEDA K,MOTOKAWA Y.Expression of mature bovine H-protein of the glycine cleavage system in Escherichia coli and in vitro lipoylation of the apoform[J].J Biol Chem,1992,267(28):20011-20016.
[29]WITKOWSKI A,JOSHI A K,SMITH S.Coupling of the de novo fatty acid biosynthesis and lipoylation pathways in mammalian mitochondria[J].J Biol Chem,2007,282(19):14178-14185.
[30]FENG D,WITKOWSKI A,SMITH S.Down-regulation of mitochondrial acyl carrier protein in mammalian cells compromises protein lipoylation and respiratory complex I and results in cell death[J].J Biol Chem,2009,284(17):11436-11445.
[31]SMITH S,WITKOWSKI A,MOGHUL A,et al.Compromised mitochondrial fatty acid synthesis in transgenic mice results in defective protein lipoylation and energy disequilibrium[J].PLoS One,2012,7(10):e47196.
[32]YI X,MAEDA N.Endogenous production of lipoic acid is essential for mouse development[J].Mol Cell Biol,2005,25(18):8387-8392.
[33]HASHIMOTO T,HUSSIEN R,OOMMEN S,et al.Lactate sensitive transcription factor network in L6 cells:activation of MCT1 and mitochondrial biogenesis[J].The FASEB Journal,2007,21(10):2602-2612.
[34]BROOKS G A.Lactate shuttles in nature[J].Biochem Soc Trans,2002,30(2):258-264.
[35]BRICHER D K,TAYLOR E B,SCHELL J C,et al.A mitochondrial pyruvate carrier required for pyruvate uptake in yeast,Drosophila,and humans[J].Science,2012,337(6090):96-100.
[36]HERZIG S,RAEMY E,MONTESSUIT S,et al.Identification and functional expression of the mitochondrial pyruvate carrier[J].Science,2012,337(6090):93-96.
[37]BENDER T,PENA G,MARTINOU J C.Regulation of mitochondrial pyruvate uptake by alternative pyruvate carrier complexes[J].EMBO J,2015,34(7):911-924.
[38]MANERBA M,VETTRAINO M,FIUME L,et al.Galloflavin(CAS 568-80-9):a novel inhibitor of lactate dehydrogenase[J].ChemMed-Chem,2012,7(2):311-317.
