苄达赖氨酸脂质体的制备
2017-06-01段竣鹏王洪光
段竣鹏,王洪光
(青岛科技大学化工学院,山东 青岛 266042)
苄达赖氨酸脂质体的制备
段竣鹏,王洪光*
(青岛科技大学化工学院,山东 青岛 266042)
以苄达赖氨酸、大豆卵磷脂、胆固醇为原料制备了苄达赖氨酸脂质体。以包封率为主要指标,选取药脂比、超声时间、水相pH值和孵育温度4个因素进行正交实验优化制备工艺,用紫外分光光度计测定包封率,用粒度和Zeta电位分析仪测定所制备脂质体的粒径分布及Zeta电位。确定最佳制备工艺条件为:药脂比 1∶5(g∶g)、超声时间15 min、水相pH值5、孵育温度60 ℃,在该条件下所制得的3批苄达赖氨酸脂质体的平均包封率为81.54%,平均粒径为(99.85±9.60) nm,平均Zeta电位为(-30.6±1.8) mV,体外释放实验证明释放速度慢于市售制剂。表明所制备的苄达赖氨酸脂质体包封率高、稳定性好。
苄达赖氨酸;脂质体;包封率;粒径分布
药物脂质体(liposome)的基本结构是由磷脂包裹主药组成,该结构内部为被包封的药物,磷脂分子定向排列于四周。脂质体在药学领域应用广泛,被磷脂所包裹的特殊结构使其拥有靶向性和细胞相容性的优点。药物包裹于磷脂分子层之中,减少与介质的接触,因而增强了药物稳定性、降低了药物毒性并且带来了缓释效果[1]。
苄达赖氨酸(L-赖氨酸乙酸盐)是一种眼科常用药,能够预防和治疗早期老年性白内障等疾病。白内障是糖尿病患者最常见并发症,发病原因由于醛糖还原酶在晶状体中使葡萄糖转化。苄达赖氨酸可以抑制人体多个器官中醛糖还原酶的活性,从而达到治疗白内障的疗效。但市售的苄达赖氨酸滴眼液,在使用时对眼睛有强烈的刺激性并且需要一日3次,使用不便。将苄达赖氨酸制成脂质体,能降低其刺激性又带来适当的缓释效果,增加患者使用的依从性[2]。作者以包封率为指标,采用正交实验优化苄达赖氨酸脂质体的制备工艺条件,并对优化工艺条件下所制备的脂质体的平均粒径和Zeta电位进行测定,同时与市售滴眼液比较缓释效果,为下一步制备滴眼液打下基础。
1 实验
1.1 试剂与仪器
滴眼液,市售。
苄达赖氨酸(含量99%),武汉天盟化工有限责任公司;大豆卵磷脂(化学纯)、磷酸氢二钠(含量99%),天津博迪化工股份有限公司;胆固醇、磷酸二氢钾(分析纯),国药集团化学试剂有限公司;氯仿(分析纯),烟台三和化学试剂有限公司;甲醇(色谱纯),天津科密欧化学试剂有限公司;磷酸二氢钠(含量99%),天津登科化学试剂有限公司。
UV1000型紫外分光光度计,北京莱伯泰科有限公司;IT-09A5型恒温磁力搅拌器,上海一恒科学仪器有限公司;Zetasizer Nano ZS90型纳米粒度和Zeta电位及分子量分析仪,英国马尔文仪器有限公司;RE52CS型旋转蒸发器、S-220型恒温水浴锅,上海亚荣生化仪器厂;透析袋,国药集团化学试剂有限公司。
1.2 方法
1.2.1 苄达赖氨酸脂质体的制备
分别称取苄达赖氨酸、大豆卵磷脂、胆固醇于烧杯中,加氯仿,在磁力搅拌器上搅拌至溶液呈透明状态。将pH值 8.0的磷酸盐缓冲液缓慢加入到烧杯中,超声,溶液呈乳白色乳液。于旋转蒸发仪上旋蒸出现凝胶状薄膜,然后用磷酸盐缓冲液调节至适宜浓度,转移后在60 ℃水浴锅中孵育1 h,过0.22 μm滤膜3次得苄达赖氨酸脂质体[3]。
1.2.2 标准曲线的绘制
精密称定0.612 g苄达赖氨酸置于100 mL容量瓶中,加少量蒸馏水超声溶解,定容至100 mL。移取1 mL到25 mL容量瓶中,用蒸馏水稀释至刻度。分别取3 mL、4 mL、5 mL、6 mL、7 mL和8 mL稀释液置于50 mL容量瓶中,用蒸馏水定容、摇匀,于308 nm处测定吸光度(A)。以吸光度(A)对浓度(c)进行线性回归,拟合后得回归方程A=0.0117c+0.0312,R2=0.9994[4]。
1.2.3 正交实验设计
根据前期单因素实验结果,选取药脂比(A)、超声时间(B)、水相pH值(C)和孵育温度(D)为考察因素,每个因素取3个水平进行正交实验,其因素与水平见表1。
表1 正交实验的因素与水平
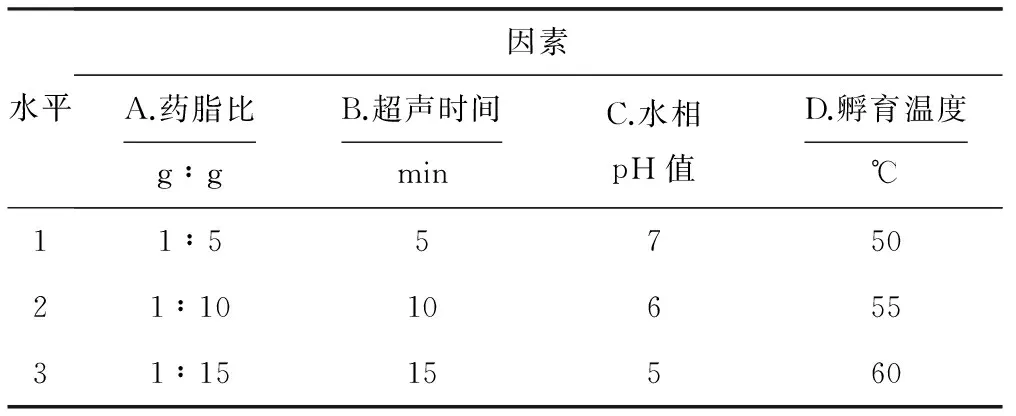
Tab.1 The factors and levels of orthogonal experiment
1.2.4 包封率测定
取适量新制苄达赖氨酸脂质体溶液置于离心管中,于12 000 r·min-1下离心10 min。 取适量上清液进行紫外测定,同时取沉淀物适量,加甲醇超声破乳,测其吸光度。其中上层是没有被包封的苄达赖氨酸,下层沉淀物为包封的苄达赖氨酸。包封率按下式计算[5]:

1.2.5 药物体外释放实验
取市售滴眼液和自制脂质体各7 mL,置于透析袋中,将两个透析袋分别放入装有500 mL蒸馏水的烧杯中,将烧杯放于磁力搅拌器上,以30 r·min-1的速度搅拌,分别在1 h、2 h、4 h、6 h、8 h和12 h时取样5 mL (每次取样后立即补充5 mL蒸馏水),用紫外分光光度计测定样品的吸光度,并计算累积药物释放度,以时间为横坐标、累积药物释放度为纵坐标绘制药物的体外释放曲线。
2 结果与讨论
2.1 回收率实验
精密称取处方量80%、100%、120%的苄达赖氨酸,向其中加入处方量空白脂质体溶液,混合均匀后,甲醇超声破乳,蒸馏水定容后,测定苄达赖氨酸量。经计算,3组实验的回收率分别为(99.3±1.4)%、(101.1±3.1)%、(100.3±2.5)%(n=3)。表明,所选膜材大豆卵磷脂、胆固醇等辅料对主药无影响,回收率符合实验要求。
2.2 正交实验结果与分析(表2)
由表2可知,各因素对包封率的影响顺序为:B>C>D>A,最优组合为A1B3C3D3,即药脂比1∶5(g∶g)、超声时间15 min、水相pH值5、孵育温度60 ℃。
表2 正交实验结果与分析
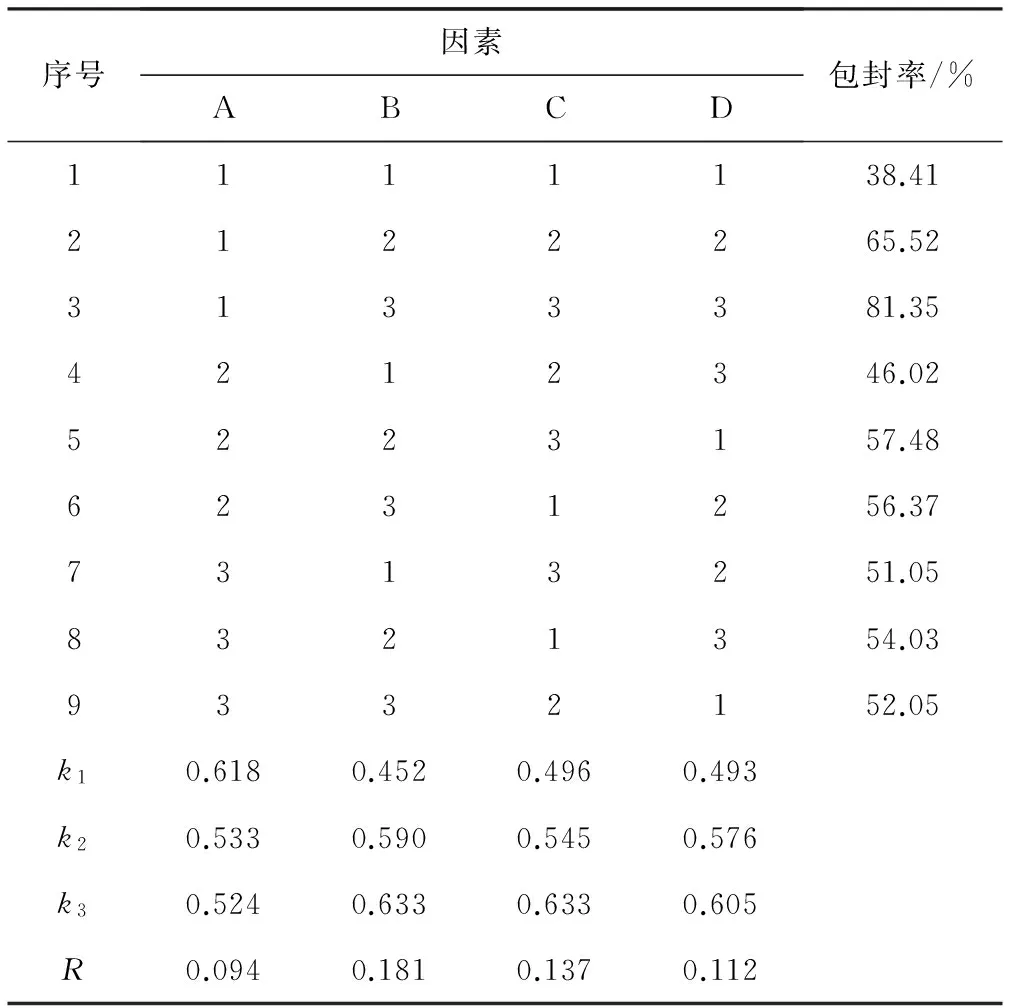
Tab.2 Results and analysis of orthogonal experiment
pH值梯度法制备脂质体是利用脂质体内外水相中H+梯度进行载药,合理pH值为5.0~7.0。按《中国药典》(2010版)中的方法测定苄达赖氨酸的pH值为6.0,呈弱酸性。因此,选择pH值梯度法制备脂质体[6]。
按最优工艺条件制备3批苄达赖氨酸脂质体样品,测试其包封率分别为80.25%、82.05%、82.33%,平均包封率为81.54%,达到脂质体的包封率标准[7]。
2.3 脂质体的测试
2.3.1 平均粒径
苄达赖氨酸脂质体的纳米粒径分布图如图1所示。
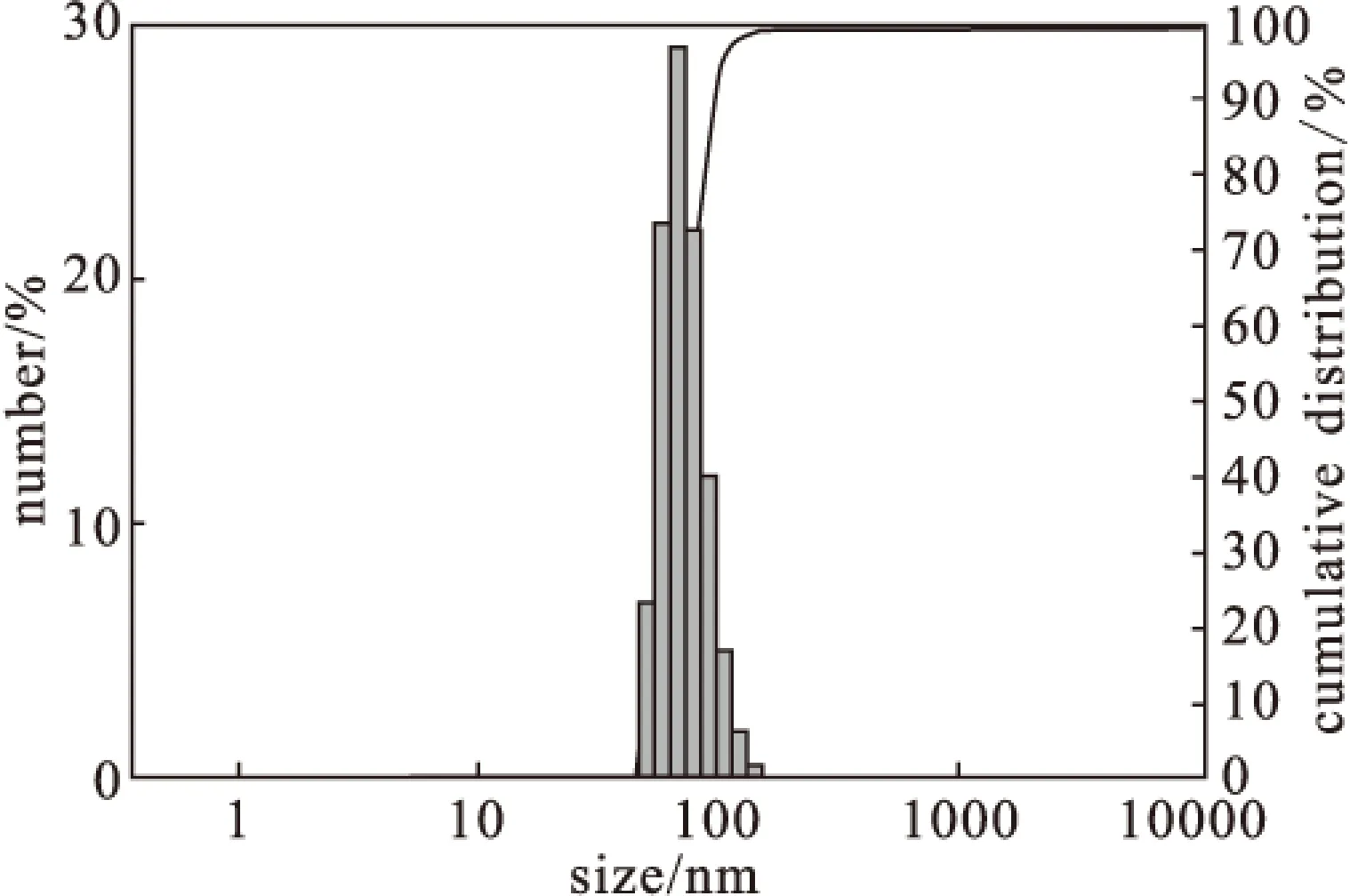
图1 纳米粒径分布图Fig.1 Nano particle size distribution
由图1可以看出,苄达赖氨酸脂质体的粒径分布符合正态分布,3批苄达赖氨酸脂质体样品的平均粒径为(99.85±9.60)nm。
2.3.2 Zeta 电位(图2)
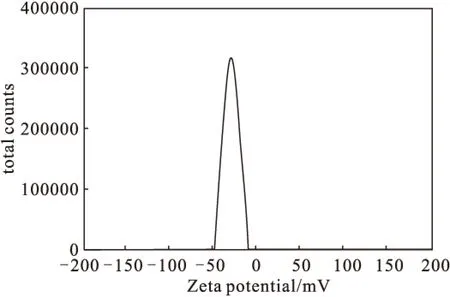
图2 Zeta 电位分布图Fig.2 Zeta potential distribution
Zeta电位常常用来衡量脂质体系统的稳定性,一般认为其数值介于-30~50 mV之间状态较稳定。由图2可以看出,所得的苄达赖氨酸脂质体的平均 Zeta电位为(-30.6±1.8) mV,符合稳定性标准[8]。
2.3.3 药物体外释放(图3)
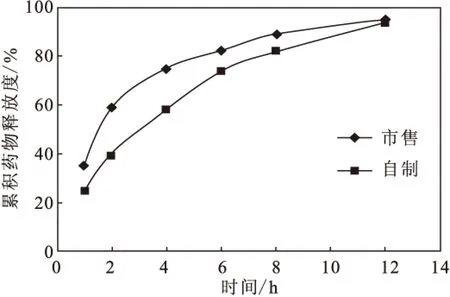
图3 体外释放曲线Fig.3 The release curves of bendazac lysine in vitro
由图3可以看出,市售滴眼液的体外释放速度要明显快于自制的脂质体,说明制备的苄达赖氨酸脂质体具有良好的缓释效果,从而可以减少滴眼液的使用次数,降低药物的刺激性。
3 结论
以苄达赖氨酸、大豆卵磷脂、胆固醇为原料制备了苄达赖氨酸脂质体。以包封率为主要指标,选取药脂比、超声时间、水相pH值和孵育温度4个因素进行正交实验优化制备工艺,用紫外分光光度计测定包封率,用粒度和Zeta电位分析仪测定所制备脂质体的粒径分布及Zeta电位。确定最佳制备工艺条件为:药脂比 1∶5(g∶g)、超声时间15 min、水相pH值5、孵育温度60 ℃,在该条件下所制得的3批苄达赖氨酸脂质体的平均包封率为81.54%,平均粒径为(99.85±9.60)nm,平均Zeta电位为(-30.6±1.8) mV,体外释放实验证明释放速度慢于市售制剂。表明所制备的苄达赖氨酸脂质体包封率高、稳定性好。
[1] 焦姣,蒋宫平,邓意辉,等.脂质体药物传递系统的50年发展历程概述[J].沈阳药科大学学报,2014,31(9):738-754.
[2] 严汉英.抗白内障新药苄达赖氨酸的研究进展[J].中国新药与临床杂志,1997,18(4):240-243.
[3] DESAIM P,LABHASETWAR V,AMIDONG L ,et al.Gastrointestinal of biodegradable micro particles[J].Pharm Res,1996,13(12):1838-1845.
[4] 刘力铭,顼兴敏.pH梯度法制备维生素C脂质体[J].发酵科技通讯,2015,44(2):17-19.
[5] 王萍,孔飞飞,谭兴起,等.苄达赖氨酸眼用凝胶的制备及质量控制[J].中国医药导报,2011,8(24):60-64.
[6] 刘瑞江,张业旺.正交试验设计和分析方法研究[J].实验技术与管理,2010,27(9):49-56.
[7] 陈召红,刘皈阳,魏亚超,等.脂质体包封率测定方法研究进展[J].解放军药学学报,2011,27(1):79-82.
[8] 胡朋毅,郑琴.pH梯度法制备澳洲茄边碱脂质体[J].中国新药杂志,2011,13(6):1103-1106.
Preparation of Bendazac Lysine Liposome
DUAN Jun-peng,WANG Hong-guang*
(CollegeofChemicalEngineering,QingdaoUniversityofScienceandTechnology,Qingdao266042,China)
Bendazac lysine liposome was prepared using bendazac lysine,soybean lecithin,and cholesterol as raw materials.With the encapsulation rate as the main index,the preparation process were optimized by an orthogonal experiment with four factors,i.e.,ratio of drug to lipid,ultrasonic time,pH value of water phase and incubation temperature.The encapsulation rate of the liposome was detected by UV spectrophotometry,and the particle size distribution and Zeta potential were determined by a particle size and Zeta potential analyzer.The optimal preparation conditions were as follows: ratio of drug to lipid of 1∶5(g∶g),ultrasonic time of 15 min,pH value of water phase of 5,and incubation temperature of 60 ℃.Under the optimal conditions,the average encapsulation rate of three batches bendazac lysine liposomes was 81.54%,the average particle size was (99.85±9.60) nm and the average Zeta potential was (-30.6±1.8) mV.Release experimentinvitroshowed the release rate was slower than that of commercial preparations.The liposome has high encapsulation rate and good stability.
bendazac lysine;liposome;encapsulation rate;particle size distribution
2016-11-19
段竣鹏(1992-),男,山东青岛人,硕士研究生,研究方向:缓控释制剂和新剂型研究,E-mail:13001662006@163.com;通讯作者:王洪光,教授,E-mail:whongg1@yeah.net。
10.3969/j.issn.1672-5425.2017.05.013
R988.1
A
1672-5425(2017)05-0058-03
段竣鹏,王洪光.苄达赖氨酸脂质体的制备[J].化学与生物工程,2017,34(5):58-60,70.
