深海独岛枝芽胞杆菌1A00493杀根结线虫活性物质研究
2017-06-01邵宗泽喻子牛张吉斌
郑 娜,黄 典,邵宗泽,喻子牛,张吉斌*
(1.农业微生物学国家重点实验室 华中农业大学生命科学技术学院 微生物农药国家工程研究中心,湖北 武汉430070;2.国家海洋局第三海洋研究所 海洋生物遗传资源重点实验室,福建 厦门 361005)
深海独岛枝芽胞杆菌1A00493杀根结线虫活性物质研究
郑 娜1,黄 典1,邵宗泽2,喻子牛1,张吉斌1*
(1.农业微生物学国家重点实验室 华中农业大学生命科学技术学院 微生物农药国家工程研究中心,湖北 武汉430070;2.国家海洋局第三海洋研究所 海洋生物遗传资源重点实验室,福建 厦门 361005)
以一株具有杀南方根结线虫(Meloidogyneincongnita)活性的深海独岛枝芽胞杆菌(Virgibacillusdokdonensis)1A00493为研究对象,对其发酵上清液的杀线虫活性进行测定,并对杀线虫活性物质进行理化分析。利用正相硅胶柱、反相硅胶柱、LH-20葡聚糖凝胶柱分离以及示差折光高效液相色谱(RID-HPLC)对活性物质进行分离纯化,将纯化的活性物质进行液相色谱-质谱联用分析。结果表明,杀线虫活性物质耐高温、对蛋白酶和酸碱不敏感、硫酸铵沉淀物无杀线虫活性、3 kDa超滤管滤过液有活性、易溶于甲醇和氯仿,推测活性物质是中强极性小分子物质。杀线虫活性物质主要有3种化合物,其中分子量为234 Da的新型化合物很有可能是主要的活性物质。
深海独岛枝芽胞杆菌;根结线虫;活性物质;分离纯化
植物寄生线虫主要生长在植物根际或者周围土壤中,能够和其它植物病原菌协同产生危害作用,其对农作物危害程度仅次于真菌,已超过细菌和病毒病害[1],对农业生产造成重大损失。根结线虫(Meloidogynespp.)是植物寄生线虫中分布广泛、种类较多、危害植物生长最为严重的种类之一[2-4]。在我国,对植物危害最大的是南方根结线虫(Meloidogyneincongnita),长期以来,我国对作物病原线虫的防治主要依靠化学药剂,但是,高毒性的化学药剂在使用过程中会造成农产品和环境污染问题。因此,杀线虫剂的应用应该向低毒、高效、低残留方向发展[5]。目前国内外研究线虫防治的主要趋势是利用真菌、细菌、放线菌等其它微生物开发微生物制剂,逐渐由化学药剂转向生物防治,从而达到防治线虫和消除化学药剂对人类及环境危害的双重作用[6]。
海洋环境独特,如高盐、高压、低温、少光、高pH值、寡营养等决定了海洋微生物独特的生活方式、代谢途径和防御系统,丰富的海洋微生物及其产生的代谢活性物质为开发海洋生物活性物质提供了丰富的资源[7]。从海洋微生物中筛选新型菌株,利用微生物菌剂或者提取的抗病害活性物质进行农业生物防治,能够逐渐减缓或消除化学防治给环境和人类健康带来的严重危害,这也是当前植物保护方向生物防治研究的重点与热点。作者对一株分离自深海的独岛枝芽胞杆菌(Virgibacillusdokdonensis)1A00493的发酵上清液的代谢活性物质进行理化分析与分离纯化,并进行活性物质结构鉴定与预测,为下一步开发菌株1A00493微生物制剂与微生物代谢物制作生物农药的研究奠定基础。
1 实验
1.1 菌种与线虫
独岛枝芽胞杆菌(Virgibacillusdokdonensis)1A00493,中国海洋微生物菌种保藏管理中心(CMCC)。
南方根结线虫(Meloidogyneincongnita)由南京农业大学李红梅教授提供。
1.2 仪器
真空旋转蒸发仪,恒温鼓风干燥箱,恒温摇床,高速离心机,光学显微镜,倒置显微镜,真空冷冻干燥机,pH计,NH2色谱柱(250 mm×4.6 mm),LC-20AT型液相色谱仪,RID-10A型示差折光检测仪,Agilent 6540型液相色谱-质谱联用仪。
1.3 培养基与人工海水配方
海洋细菌培养基(2216e):蛋白胨10 g、酵母粉5 g、牛肉浸粉1 g、乙酸钠1 g、硝酸铵0.2 g、柠檬酸钠0.5 g、柠檬酸铁0.1 g、人工海水1 000 mL,pH值7.6±0.2。
人工海水:氯化钠19.45 g、氯化镁0.75 g、硫酸镁0.75 g、氯化钙1 g、氯化钾0.55 g、碳酸氢钠0.16 g、溴化钾0.08 g、氯化锶34 mg、硼酸22 mg、硅酸钠4 mg、氟化钠2.4 mg、磷酸氢二钠8 mg、氯化锰0.5 mg、硫酸铜0.5 mg、硫酸锌10 mg、蒸馏水1 000 mL。
1.4 方法
1.4.1 菌种活化培养
用接种环从30%甘油保菌管中挑取少量菌液在2216e培养基上涂平板,置于28 ℃培养箱中培养72 h。挑取单菌落涂平板后置于28 ℃培养箱中培养48 h,按此方法活化3次后备用。
1.4.2 南方根结线虫培养
将番茄种子灭菌处理,用70%酒精消毒1 min,2%次氯酸钠消毒10 min,无菌水洗涤3次后置于吸满水的滤纸上萌发。将萌发的种子种植在湿热无菌的培养土(土∶沙=1∶1)中,每盆接种1颗番茄;长出4片子叶后再接种,接种时用玻璃棒在番茄苗的周围均匀插3个小孔,把南方根结线虫卵块放入小孔中,然后覆盖灭菌土。于温室(控制室温22 ℃左右)培养 45 d后小心拔出番茄植株,用清水将根部土壤洗净,挑取根部的卵块备用。每盆接种二龄线虫约1 000头。
1.4.3 杀线虫活性测定
(1)取菌株1A00493发酵液原液及稀释2倍、5倍的上清液用0.22μm滤膜过滤除菌2次,96孔平板中每孔加200μL上清液、约30条南方根结线虫、4μL 1 mg·mL-1氯霉素,每种待测液做3个平行。以不加发酵液为对照,于20 ℃下培养,分别在24 h、36 h、48 h时于倒置显微镜下观察,用针刺法判断线虫是否死亡,统计死亡线虫数量。按下式计算线虫死亡率、校正死亡率:

1.4.4 菌株发酵上清液杀线虫活性物质理化性质研究
1.4.4.1 发酵时间对活性物质杀线虫活性的影响
菌株的最适生长温度为28 ℃,以1%接种量接种于培养基中,分别取培养12 h、24 h、36 h、48 h、60 h和72 h发酵液各1 mL测定杀线虫活性,考察发酵时间对活性物质杀线虫活性的影响。1.4.4.2 紫外照射时间对活性物质杀线虫活性的影响将菌株1A00493发酵48 h,取无菌发酵上清液4份,每份10 mL盛入直径为10 cm的灭菌玻璃平板中,分别于室温25 ℃、254 nm紫外光下照射30 min、60 min、90 min和120 min,于室温25 ℃下测定杀线虫活性,以初始发酵上清液为对照,每个处理做3个平行,考察紫外照射时间对活性物质杀线虫活性的影响。
1.4.4.3 温度对活性物质杀线虫活性的影响
将菌株1A00493发酵48 h,取无菌发酵上清液分别置于20 ℃、40 ℃、60 ℃、80 ℃、100 ℃和121 ℃环境中,30 min后取出冷却,于室温25 ℃下测定杀线虫活性,以初始发酵上清液为对照,每个处理做3个平行,考察温度对活性物质杀线虫活性的影响。
1.4.4.4 pH值对活性物质杀线虫活性的影响
将菌株1A00493发酵48 h,取无菌发酵上清液,用HCl或NaOH调pH值分别为3、5、7、9和11,室温放置2 h,然后用HCl或NaOH调回到初始发酵上清液pH值(约为7.84),于室温25 ℃下测定杀线虫活性,以初始发酵上清液为对照,每个处理做3个平行,考察pH值对活性物质杀线虫活性的影响。
1.4.4.5 蛋白酶敏感性
将菌株1A00493发酵48 h,取无菌发酵上清液,用浓度为1 mg·mL-1的蛋白酶K、胰蛋白酶和胃蛋白酶分别处理发酵上清液3 h,于室温25 ℃下测定杀线虫活性。蛋白酶K在pH值8.0、40 ℃下处理;胰蛋白酶在pH值8.0、37 ℃下处理;胃蛋白酶在pH值4.5、37 ℃下处理。在室温25 ℃下,以初始发酵上清液和浓度为1 mg·mL-1的蛋白酶K、胰蛋白酶、胃蛋白酶为对照,考察活性物质对蛋白酶的敏感性。
1.4.4.6 硫酸铵沉淀处理
采用梯度盐析法,将菌株1A00493发酵上清液分别用0~20%、20%~40%、40%~60%、60%~80%和80%~100%硫酸铵浓度梯度以及用80%和100%硫酸铵沉淀蛋白,沉淀蛋白用PBS缓冲液溶解,于4 ℃透析24 h,过滤除菌,测定杀线虫活性。
1.4.4.7 活性物质分子量大小
将菌株1A00493发酵48 h,取无菌发酵上清液5 mL,分别经过100 kDa、50 kDa、10 kDa、3 kDa超滤管,取截留液及滤过液分别在室温25 ℃下测定杀线虫活性,以初始发酵上清液为对照,判断活性物质分子量范围。
1.4.4.8 活性物质有机溶剂萃取实验
将菌株1A00493发酵48 h,取无菌发酵上清液5份,每份50 mL,分别用等体积的石油醚、正丁醇、乙酸乙酯、氯仿和甲醇萃取过夜。取有机相用真空旋转蒸发仪于60 ℃蒸干,然后用水溶解,放置于冻干机冷冻干燥,再用10 mL水溶解,测定杀线虫活性。
1.4.5 菌株1A00493杀线虫活性物质的分离与鉴定
1.4.5.1 活性物质甲醇粗提物制备
取保存于30%甘油的菌株1A00493,平板划线活化,挑取单菌落接种于2216e 培养基中,于28 ℃、180 r·min-1培养12 h 作为种子液。按1%接种量将种子液接入摇瓶中,于28 ℃、180 r·min-1培养48 h。将发酵液于4 ℃、8 000 r·min-1离心30 min,弃沉淀,收集上清液。将等体积甲醇与上清液混合,4 ℃放置过夜,再8 000 r·min-1离心30 min 除去沉淀。所得混合溶液经过60 ℃真空旋转蒸干,析出的固体物质再用少量甲醇溶解,再离心,除去不溶于甲醇的高聚物和蛋白质等杂质。最后所得溶液即为杀线虫活性物质甲醇粗提物,于4 ℃保存。
1.4.5.2 正相硅胶柱层析分离
样品处理:将甲醇粗提物旋蒸浓缩,加入适量60~80目硅胶粉及二氯甲烷,充分混匀,然后旋蒸至硅胶颗粒干燥均一,使甲醇粗提物与硅胶结合。
硅胶柱装柱:柱内径6 cm,加入高约12 cm的200~300目硅胶粉和约2 L石油醚,使硅胶颗粒活化并平衡,再加入适量石英砂使柱面平整。
硅胶柱层析:硅胶柱内加入蒸干的结合甲醇粗提物的60~80目硅胶颗粒,再铺一层石英砂,先用石油醚-乙酸乙酯(1∶1,体积比,下同)的混合液洗掉小极性杂质,再用乙酸乙酯-甲醇(1∶1)的混合液洗脱中强极性分子,收集洗脱液,每管10 mL。直至强极性的色素分子被洗脱下来,然后用甲醇洗脱,收集洗脱液。
活性组分分离与鉴定:将每管洗脱液用毛细管点样TLC板,0.3%茚三酮显色。将收集的洗脱液分组,每5管设为一组,60 ℃旋蒸干,用4 mL甲醇溶解,冷冻干燥后用等体积水溶解,细菌过滤器除去硅胶颗粒备用,将样品做不同浓度稀释测定各组分杀线虫活性。
1.4.5.3 反相硅胶柱层析分离
湿法装柱:称取一定量硅胶,加甲醇搅拌呈匀浆状,装入抽滤瓶中于0.06 MPa真空脱气2 h,将填料加入层析柱中。
平衡活化:流动相甲醇和乙腈过有机相滤膜,先用甲醇冲洗2~3个柱体积,再用超声脱气的10%乙腈水溶液冲洗2~3个柱体积。
上样:将甲醇溶解的正相硅胶活性物质样品放入烘箱烘干,加入10%乙腈水溶液溶解,0.22μm滤膜过滤,加入柱内。
收样:控制恒流泵流速为1 mL·min-1,10%乙腈水溶液洗脱,按时间收集流出液,每管收集约4 mL,收集40管,试管按顺序编号1~40。
活性检测:TLC点板,0.3%茚三酮显色。根据显色结果,将显色的样品及其前后的样品分别合并成3组样品,真空旋转蒸发浓缩,进行杀线虫活性检测。
“斋,戒洁也”,指在敬神之前戒除不洁使自身清净,由此而引申为一种清幽净洁的建筑物,如书房称之书斋,学舍谓之东斋。“志归斋”是寓园最早的建筑物,“当开园之初,偶市得敞(敝)椽,移置于此”。其建筑格局是:“斋左右,贯以长廊,右达寓山草堂,左登笛亭。”[3]428
1.4.5.4 LH-20葡聚糖凝胶柱层析分离
依次用水、NaOH-NaCl水溶液(8 g NaOH,30 g NaCl,1 000 mL水)、水、甲醇清洗LH-20填料,新填料可直接用甲醇溶胀。0.06 MPa真空脱气2 h后装柱,使用甲醇-水洗脱剂进行洗脱,逐渐增加甲醇含量至50%,平衡使用1~2个柱体积。样品用50%甲醇溶解,上样。设置恒流泵流速为1.0 mL·min-1,每管收集约4 mL,收集30管,试管按顺序编号1~30。将每管收集液用0.3%茚三酮显色,初步检测活性组分;将显色部分做薄层层析。将显色点样品真空旋转蒸发浓缩,进行杀线虫活性检测。
1.4.5.5 示差折光高效液相色谱(RID-HPLC)分离纯化
用水和异丙醇冲洗管道,连接色谱柱,用异丙醇置换新色谱柱中的封存剂,最后用洗脱流动相冲洗色谱柱,将泵、进样器、色谱柱和检测器连接好。80%乙腈水溶液用0.22μm有机滤膜过滤,超声脱气30 min。在合适泵压下设定程序,放入样品,进行液相色谱分析。液相色谱条件:流动相为80%乙腈水溶液,单次样品时间为20 min,柱温为30 ℃,检测器为RID-10A。
分别收集各个液相峰的样品冷冻干燥,用水复溶,0.22μm滤膜过滤除菌后,进行杀线虫活性检测,实验重复3次。
1.4.5.6 Q-TOF液相色谱-质谱联用分析
回收液相色谱活性物质峰,采用液质联用(LC-MS)对活性物质进行鉴定。
色谱条件:采用梯度洗脱,0~2 min流动相为5%乙腈水溶液,2~10 min 5%~90%乙腈水溶液,10~12 min 90%乙腈水溶液平衡2 min,流速0.3 mL·min-1,进样量1μL。质谱条件:双源ESI,干燥温度350 ℃,干燥气流9 L·min-1,喷雾器压力40 psi。利用Agilent Mass Hunter Qualitative Analysis B.05.00软件分析和预测活性物质的分子量、分子式和物质的具体结构与特性。
2 结果与讨论
由表1可知,菌株1A00493发酵上清液原液及稀释2倍液在处理根结线虫48 h后,校正死亡率达到100%;稀释5倍液在处理根结线虫48 h后的校正死亡率为50.2%。表明菌株1A00493发酵上清液的活性物质对南方根结线虫有杀死作用。
表1 不同稀释倍数的发酵上清液杀线虫活性测定结果

Tab.1 The determination results of nematicidal activity of fermentation supernatant by diluting different multiple
2.2 发酵上清液杀线虫活性物质理化性质研究
2.2.1 发酵时间对活性物质杀线虫活性的影响(图1)

图1 发酵时间对活性物质杀线虫活性的影响Fig.1 Effect of fermentation time on nematicidal activity of active substance
由图1可以看出,在发酵12 h时,活性物质产量很低或没有产生,线虫校正死亡率最低;随着发酵时间的延长,48 h时的线虫校正死亡率达到最高;在60 h、72 h时菌株已经到生长后期,活性物质因次级代谢产物发生变化导致杀线虫活性降低。综合考虑,选择48 h为最适发酵时间。
2.2.2 紫外照射时间对活性物质杀线虫活性的影响(图2)

图2 紫外照射时间对活性物质杀线虫活性的影响
由图2可以看出,各个处理组的杀线虫活性相差不大,当紫外照射时间为120 min时,线虫校正死亡率与无紫外照射时的差别不大。表明菌株1A00493产杀线虫活性物质对紫外照射有耐受性。
2.2.3 温度对活性物质杀线虫活性的影响(图3)
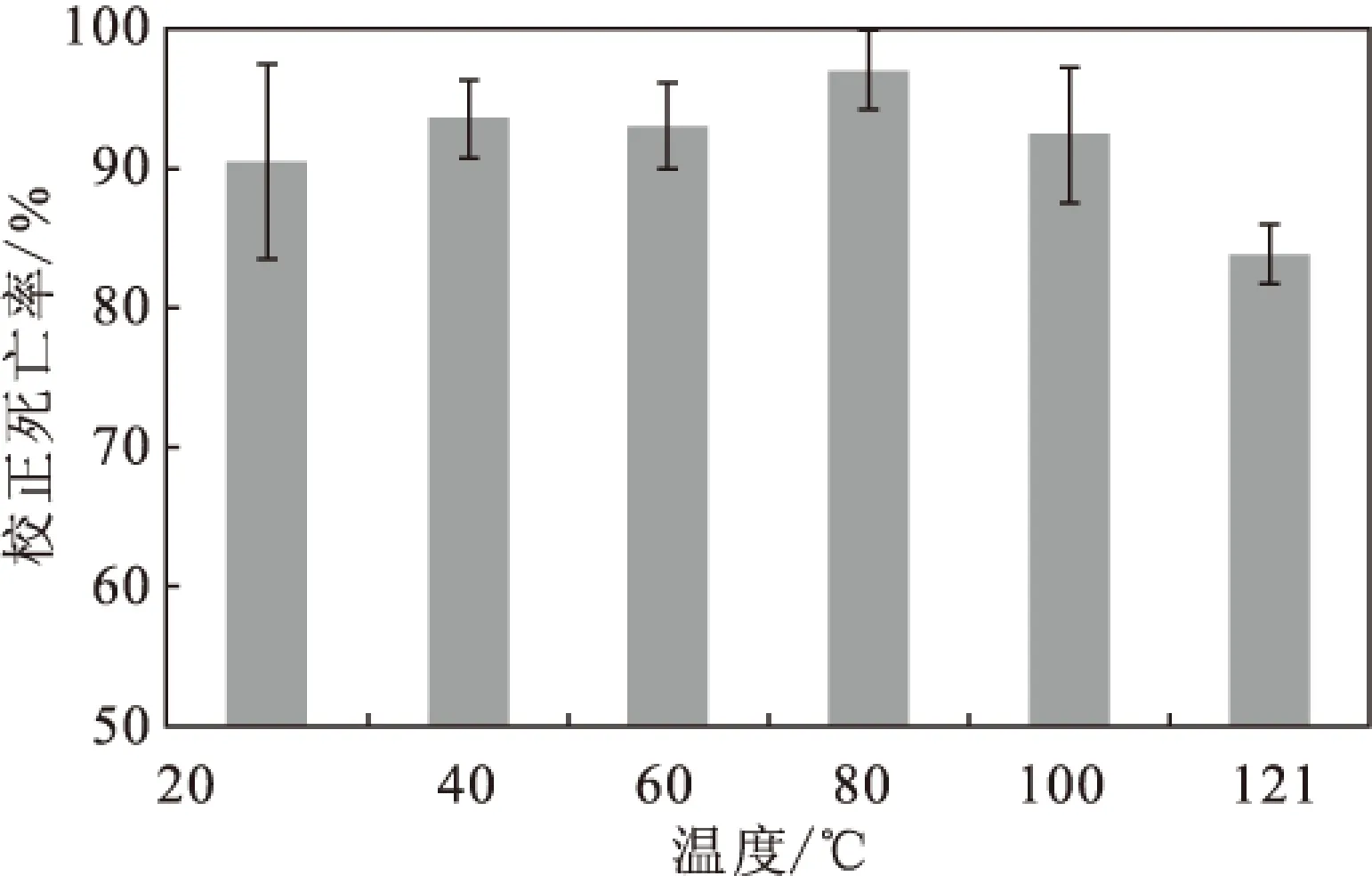
图3 温度对活性物质杀线虫活性的影响Fig.3 Effect of temperature on nematicidal activity of active substance
由图3可以看出,在温度低于100 ℃时,各个处理组的杀线虫活性相差不大,但在121 ℃处理后杀线虫活性稍微降低,但影响不显著。表明菌株1A00493产杀线虫活性物质的结构比较稳定,不易被高温破坏,具有一定的热稳定性。
2.2.4 pH值对活性物质杀线虫活性的影响(图4)

图4 pH值对活性物质杀线虫活性的影响Fig.4 Effect of pH value on nematicidal activity of active substance
由图4可以看出,pH值为11的处理组线虫校正死亡率降至80%,其它几个处理对活性物质杀线虫活性影响不大。表明菌株1A00493产杀线虫活性物质对酸碱有较好的耐受性。
2.2.5 杀线虫活性物质对蛋白酶的敏感性(表2)
由表2可以看出,各个酶处理对活性物质杀线虫活性基本没什么影响,表明菌株1A00493产杀线虫活性物质对这几种蛋白酶不敏感。
表2 活性物质对蛋白酶的敏感性

Tab.2 The sensitivity of active substance to protease
2.2.6 硫酸铵沉淀处理
各个处理所得蛋白的线虫校正死亡率基本为0,表明蛋白沉淀物没有杀线虫活性。
根据发酵上清液中活性物质可以耐高温,对蛋白酶K、胰蛋白酶、胃蛋白酶不敏感,以及硫酸铵沉淀的蛋白沉淀物无杀线虫活性,可以推断菌株1A00493产杀线虫活性物质不属于蛋白类物质。
2.2.7 活性物质分子量大小
实验发现,菌株1A00493发酵上清液滤过3 kDa超滤管的滤过液仍然有杀线虫活性,可以推测杀线虫活性物质为小分子类物质。
2.2.8 活性物质有机溶剂溶解性(表3)
表3 活性物质在有机溶剂中的杀线虫活性
Tab.3 Nematicial activity of active substance in organic solvent

发酵液处理方式水甲醇氯仿乙酸乙酯正丁醇石油醚上清液AABDDD沉淀AAAAA水(对照)D-----
注:A,死亡率≥90%;B,90%>死亡率≥70%;C,70%>死亡率≥10%;D,级死亡率<10%。
由表3可以看出,用甲醇和氯仿溶解的活性物质的杀线虫活性最高,活性物质在这2种有机溶剂中溶解性较好。由于氯仿的毒性相对较高,因此可以用甲醇来萃取活性物质进行下一步的分离纯化。
2.3 杀线虫活性物质的分离纯化
2.3.1 正相硅胶柱层析分离
利用正相硅胶柱分离甲醇粗提物,将收集的洗脱液分为20个组分(A1-A20)。发现用乙酸乙酯-甲醇洗脱的中强极性组分A9、A10、A11和A12有明显的杀线虫活性(表4),其它组分无杀线虫活性。将20个组分用0.3%茚三酮显色,结果显示杀线虫活性组分能够显色,非活性组分不显色或显色不明显,表明杀线虫活性物质可能含有氨基,能和茚三酮显色反应。因此,0.3%茚三酮可初步作为活性物质显色指示剂。
表4 正相硅胶柱层析分离各组分的杀线虫活性(24 h)

Tab.4 Nematicidal activities of different components separated from positive silica gel column chromatography (24 h)
2.3.2 反相硅胶柱层析分离
将正相硅胶柱层析分离的活性组分A9、A10、A11和A12合并,进行反相硅胶柱层析分离纯化。样品上柱后将收集的洗脱液分成40管。0.3%茚三酮显色结果显示,40管洗脱液中间部分样品显色,前后部分不显色或显色不明显,将所有样品合并成3个组分(B1、B2和B3),B2代表显色部分样品,B1和 B3分别是显色前、后两部分样品。将3个组分冷冻干燥,用水溶解后进行杀线虫活性检测,结果见表5。
表5 反相硅胶柱层析分离各个组分的杀线虫活性(24 h)

Tab.5 Nematicidal activities of different components separated from reverse silica gel column chromatography(24 h)
由表5可以看出,组分B2有明显的杀线虫活性。
2.3.3 LH-20葡聚糖凝胶柱层析分离
将收集的30管洗脱液,用0.3%茚三酮显色,结果和反相硅胶柱层析分离一样,中间部分有7管样品显色,前后部分不显色或显色不明显,将所有样品合并成3个组分(C1、C2和C3),C2代表显色部分样品,C1、C3分别是显色前、后两部分样品。将3个组分冷冻干燥,用水溶解后进行杀线虫活性检测。结果表明,组分C2有明显的杀线虫活性。
将组分C2硅胶板点样,用正丁醇∶冰醋酸∶水=4∶1∶2的溶剂系统薄层层析,然后用0.3% 茚三酮显色,结果显示有3条带,可能有3种或3种以上的物质。
2.3.4 RID-HPLC分离纯化
将LH-20葡聚糖凝胶柱层析分离的样品用80%乙腈水溶液溶解进行RID-HPLC分析,结果如图5所示。
按RID-HPLC图谱分为7个部分收集。将收集的各部分样品冷冻干燥,然后用水溶解,进行杀线虫活性检测。经验证,样品2和样品3有杀线虫活性,在处理线虫48 h后,线虫校正死亡率都达到100%。
2.3.5 Q-TOF液相色谱-质谱联用分析结果
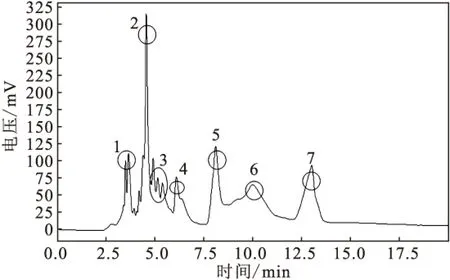
图5 杀线虫活性物质的RID-HPLC图谱Fig.5 RID-HPLC chromatogram of nematicidal active substance
LC-MS分析显示样品2的总离子流图谱有2个峰(图6),每个峰对应的一级质谱图见图7。

图6 样品2的总离子流图谱Fig.6 Total ion chromatogram of sample 2

图 7 样品2活性物质的一级质谱图Fig.7 First-order mass spectra of active substance of sample 2
由图7可以看出,样品2中响应度最高的主要有3种物质,分子量分别为234 Da、253 Da和120 Da,预测分析这3种物质都是未知的物质。
样品3的总离子流图谱有2个峰(图8),每个峰对应的一级质谱图见图9。

图8 样品3的总离子流图谱Fig.8 Total ion chromatogram of sample 3
由图9可以看出,样品3中响应度最高的主要有2种物质,分子量分别为234 Da和113 Da,其中分子量为113 Da的物质预测为已知化合物肌酸酐,肌酸酐是反应肾功能主要情况的指标,因此推测样品3中分子量为234 Da的物质可能起主要杀线虫作用。

图9 样品3活性物质一级质谱图Fig.9 First-order mass spectra of active substance of sample 3
样品2和样品3都有杀线虫活性,且都有分子量为234 Da的物质。分析分子量为234 Da的物质很有可能是杀线虫活性物质,也有可能分子量为253 Da和120 Da的物质起协同作用杀线虫。
3 结论
以一株深海独岛枝芽胞杆菌1A00493为研究对象,对其产生的杀南方根结线虫的代谢活性物质进行理化分析与分离纯化,并对活性物质进行结构鉴定与预测。结果表明:菌株1A00493发酵上清液对南方根结线虫有显著的杀虫作用,发酵上清液处理南方根结线虫48 h校正死亡率达到100%。该杀线虫活性物质稳定性强,不同浓度硫酸铵沉淀的蛋白沉淀物无杀线虫活性,发酵上清液滤过3 kDa超滤管仍然有活性,能溶解在甲醇和氯仿中,因此推测活性物质是中强极性小分子类物质。将发酵上清液用甲醇萃取,依次通过正相硅胶柱、反相硅胶柱、LH-20葡聚糖凝胶柱分离以及RID-HPLC对活性物质进行分离纯化,根据LC-MS分析推测活性物质极有可能是分子量为234 Da的未知化合物,也有可能分子量为253 Da和120 Da的物质起协同作用杀线虫。在此研究基础上,可对活性物质进行核磁共振结构鉴定,进一步深入研究其杀线虫作用机理,为菌株1A00493在农业生产上的应用提供理论基础和技术指导。
[1] WEI L,SHAO Y,WAN J,et al.Isolation and characterization of a rhizobacterial antagonist of root-knot nematodes[J].PLoS One,2014,9(1):1-5.
[2] 张博,王会利,慕立义.蔬菜根结线虫的发生与防治[J].农药,2002,43(9):4-5.
[3] NEIDIG N,PAUL R J,SCHEU S,et al.Secondary metabolites ofPseudomonasfluorescensCHA0 drive complex non-trophic interactions with bacterivorous nematodes[J].Microbial Ecology,2011,61(4):853-859.
[4] HUSSAIN M,MUKHTAR T,KAYANI M.Assessment of the damage caused byMeloidogyneincognitaon okra (Abelmoschusesculentus)[J].Journal of Animal and Plant Sciences,2011,21(4):857-861.
[5] 王新荣,马超,任路路,等.根结线虫引起的植物根结形态与形成机理研究进展[J].华中农业大学学报,2010,29(2):251-256.
[6] 丹阳,黄忠良,魏孝义,等.松材线虫的天然毒素研究进展[J].热带亚热带植物学报,2004,12(4):381-387.
[7] SALOMON C E,MAGARVEY N A,SHERMAN D H.Merging the potential of microbial genetics with biological and chemical diversity:an even brighter future for marine natural product drug discovery[J].Natural Product Reports,2004,21(1):105-121.
Nematicidal Active Substance Produced byDeep-SeaVirgibacillusdokdonensis1A00493
ZHENG Na1,HUANG Dian1,SHAO Zong-ze2,YU Zi-niu1,ZHANG Ji-bin1*
(1.StateKeyLaboratoryofAgriculturalMicrobiology,CollegeofLifeScienceandTechnology,HuazhongAgriculturalUniversity,NationalEngineeringResearchCenterforMicrobialPesticides,Wuhan430070,China;2.KeyLaboratoryofMarineBiogeneticResources,ThirdInstituteofOceanography,StateOceanicAdministration,Xiamen361005,China)
A deep-seaVirgibacillusdokdonensis1A00493,which had nematicidal activity againstMeloidogyneincongnita,was taken as the research object.The nematicidal activity of fermentation supernatant was determined,also the physical and chemical analyses on nematicidal active substance were carried out.The crude extracts of fermentation supernatant were isolated and purified by a positive silica gel column,followed by a reverse silica gel column,a Sephadex LH-20 gel column and RID-HPLC.Results showed that,nematicidal active substance was insensitive to high temperature,protease and pH value,ammonium sulfate precipitation had no nematicidal activity,the supernatant filtered through a 3 kDa ultrafiltration tube remained active,and it was easily soluble in methanol and chloroform.It is speculated that the active substance is a moderate polarity compound with small molecules.The results of LC-MS show that,the nematicidal active substance most likely contain three compounds,and the active substance molecular weight may be 234 Da.
deep-seaVirgibacillusdokdonensis;Meloidogynespp.;active substance;isolation and purification
国家重点基础研究发展计划项目(2013CB127504)
2016-12-19
郑娜(1988-),女,湖北武汉人,硕士研究生,研究方向:微生物工程及制剂;通讯作者:张吉斌,教授,E-mail:zhangjb@mail.hzau.edu.cn。
10.3969/j.issn.1672-5425.2017.05.005
S482.3
A
1672-5425(2017)05-0021-07
郑娜,黄典,邵宗泽,等.深海独岛枝芽胞杆菌1A00493杀根结线虫活性物质研究[J].化学与生物工程,2017,34(5):21-27.
