4种环境源性胁迫对异育银鲫血浆生化指标的影响
2017-06-01林听听来琦芳李功政厉成新仲启铖马庆男么宗利刘进红
单 娜, 林听听, 来琦芳, 李功政,周 凯,厉成新,仲启铖,马庆男,么宗利,刘进红
(1.中国水产科学研究院东海水产研究所,中国水产科学研究院盐碱水域渔业工程技术研究中心,上海 200090; 2.上海海洋大学水产与生命学院,上海 201306; 3.光明渔业有限公司,江苏大丰 224153)
4种环境源性胁迫对异育银鲫血浆生化指标的影响
单 娜1,2, 林听听1, 来琦芳1, 李功政3,周 凯1,厉成新3,仲启铖1,马庆男3,么宗利1,刘进红3
(1.中国水产科学研究院东海水产研究所,中国水产科学研究院盐碱水域渔业工程技术研究中心,上海 200090; 2.上海海洋大学水产与生命学院,上海 201306; 3.光明渔业有限公司,江苏大丰 224153)
以异育银鲫(Carassiusauratusgibelio)幼苗[(136.70 ± 7.98 )g]为实验对象,监测4种环境源性胁迫(高pH 9.2、低溶氧2 mg·L-1、高亚氮2 mg·L-1和高氨氮4 mg·L-1)下第3、7、10、15 天血浆内皮质醇(COR)、葡萄糖(GLU)、I型干扰素(IFN)、白细胞介素-2(IL-2)、超氧化物歧化酶(SOD)、免疫球蛋白M(Ig M)、补体3(C3)以及丙二醛(MDA)的变化规律。结果显示:COR经高pH、高亚氮和高氨氮胁迫时显著升高,而SOD显著降低,Ig M经高亚氮和高氨氮胁迫时亦显著升高,表明COR、SOD和Ig M可能是广源性的胁迫状态指示指标,COR和Ig M的升高以及SOD活力的降低指示异育银鲫可能处于被胁迫状态。GLU、IFN和C3只经高氨氮胁迫时显著升高,且响应幅度剧烈,表明GLU、IFN和C3可能是灵敏且狭源性的应激指示指标,高水平指示机体可能处于氨氮应激状态。IFN和MDA经高亚氮和高氨氮胁迫时,表现出不同的响应趋势:氨氮胁迫时IFN和MDA显著升高,但亚氮胁迫时则显著降低,表明IFN和MDA响应模式可能具有特异性,不适合指示综合应激状态。
异育银鲫; pH; 溶氧; 亚氮; 氨氮; 生化免疫指标
异育银鲫(Carassiusauratusgibelio)是一种改良的鲫鱼新品种,是我国淡水养殖的重要品种之一,有不易脱鳞、生长快、出肉率及成活率高等优点,市场需求旺盛、价格稳定、养殖效益明显,深受养殖户的喜爱,已成为我国鲫鱼养殖中的主要品系[1-2]。然而近些年,异育银鲫出现大规模病害如鳃出血、孢子虫病、大红鳃等[3-5]。究其原因是多方面的:一则是由于苗种质量参差不齐[6];二则是环境因素,如气候异常导致养殖水质环境恶化等[7];三则是不合理养殖如密度过高、过量投饵而致水质变坏、病原滋生等[8]。恶化水质的长时间刺激,会使得鱼体长期持续处于应激状态,势必削弱养殖鲫鱼的免疫力和抗逆力,从而导致鱼体出现生长缓慢、发病率高等问题[9]。因此,除了优化养殖技术、改善环境外,从源头上提高鱼体的质量,培育出高质量的幼苗,从而增强其对不良环境的适应性,也是解决目前鲫鱼养殖现状的一个良策[10]。而鲫鱼体质的提高,其前提就是建立一套鲫鱼体质评估方法或者筛选出几个可用于指示鲫鱼健康水平的指标。
鱼类属于低等脊椎动物,其免疫方式可以分为非特异性免疫和特异性免疫[11]。鱼类免疫防御过程主要由免疫组织细胞和体液活性免疫因子协同完成[12]。血细胞是鱼类主要的免疫细胞之一,是抵御病原性和非病原性刺激的最初防线和主要屏障。血细胞通过增生、凝集、吞噬、包囊、黑化、结节等方式,同时将活性物质释放至血液中来氧化杀伤病原和非病原,起到免疫防御的作用[13]。越来越多的研究表明:鱼体受到环境和病原刺激时,其血液中的生化免疫指标会发生显著变化;更有甚者,部分指标具有指示应激水平的效果[14]。因此,本研究选取4个在鲫鱼养殖过程中最常见的环境胁迫因子(高pH、低溶氧、高氨氮、高亚氮)作为刺激源,研究胁迫下血浆中生化免疫指标的变化,以期筛选出可用于指示鲫鱼应激水平的指标,为后续的鲫鱼体质评估打下基础。
1 材料与方法
1.1 实验用鱼
实验用鱼来自于光明食品集团上海市海丰标准化养殖池塘,暂养于体积200 L、直径2 m的圆形鱼缸,暂养期间水温为(24.8 ± 0.6)°C,氨氮浓度为(0.133 ± 0.017)mg·L-1,亚氮浓度为(0.163 ± 0.018)mg·L-1,水体pH值为8.14 ± 0.12。持续充气,保证水中溶氧高于5 mg·L-1,每天早上8点投喂复合饲料一次,投饵后3 h吸走残饵粪便,每天换水1/3。暂养一周后,选取健康的异育银鲫400 ind用于实验,实验用鱼平均体质量(136.70 ± 7.98 )g,平均体长(16.71 ± 0.49 )cm。
1.2 实验设计
选取pH、溶氧、氨氮和亚氮为胁迫因子,每个胁迫因子的胁迫强度均在参考、归纳和总结以往研究资料以及预实验的基础上设定[15-16],对异育银鲫具有明显的胁迫作用。具体强度值设定如下:pH 9.2、溶氧 2 mg·L-1、亚氮 2 mg·L-1、氨氮 4 mg·L-1。
将实验鱼分为5组,分别为对照组、pH组、溶氧组、亚氮组、氨氮组。其中高 pH、高亚氮、高氨氮分别是通过在养殖用水中添加一定量的氢氧化钠、亚硝酸钠、氯化铵配制而成,而溶氧组是通过调节充气筏控制而成。实验用水提前一天配好。每组设3个平行,每个平行20 ind鱼,每个平行在盛有200 L实验用水的养殖桶中进行。实验期间每天早上8点投喂一次,3 h吸走残饵粪便,取样前48 h停止投喂。实验期间每天换水1/3。实验周期为15 d(2015年6月15~29日),实验开始时第0、3、7、10、15天取样,每个时间点各取3 ind。
1.3 样品处理和测定
采集的鱼用肝素钠浸润的5 mL注射器尾静脉取血2~3 mL·ind-1,血液于4 ℃、3000 r·min-1条件离心10 min取上清, -80 °C冻存备用。皮质醇(COR)、葡萄糖(GLU)、I型干扰素(IFN)、白细胞介素-2(IL-2)、超氧化物歧化酶(SOD)、免疫球蛋白M(IgM)、补体3(C3)、丙二醛(MDA)和血浆总蛋白的测定均采用南京建成检测试剂盒。
1.4 数据处理
实验数据以平均值 ± 标准误(Mean ± SE)表示。胁迫实验组与对照组的差异性采用单因素方差分析,若有显著性差异,再做Duncan多重比较,所使用的统计软件为SPSS 19.0。
2 结果与分析
2.1 皮质醇(COR)
各环境胁迫下,COR呈现先升高后降低的变化趋势(图1)。前7 d,各胁迫组与对照组无显著差异(P>0.05)。之后pH、亚氮和氨氮对COR的胁迫作用开始显现,到第10天达到峰值,第15天恢复到对照值,其中氨氮的胁迫效果最为明显,其次是pH。溶氧胁迫在整个实验过程中都与对照组差异不显著(P>0.05)。
2.2 葡萄糖(GLU)
GLU在4种胁迫下,只对高氨氮胁迫有显著响应(P<0.05)(图2),该胁迫效果从第3 天开始显现,然后缓慢加强,于第10天以后维持在一个高的水平。其它3个胁迫组 基本与对照组无显著差异(P>0.05)。
2.3 白介素-2(IL-2)
与GLU变化趋势相似,氨氮胁迫后IL-2急剧升高,至第15天仍显著高于对照水平(P<0.05)。而其它3个胁迫组(除溶氧组第15天外)与对照组在整个实验期间基本无显著差异(P>0.05)(图3)。

图1 4种环境源性胁迫因子胁迫下异育银鲫血浆皮质醇的变化规律Fig.1 Variations of COR in the plasma of Carassius auratus gibelio under four environmental stresses

图2 4种环境源性胁迫因子胁迫下异育银鲫血浆葡萄糖的变化规律Fig.2 Variations of GLU in the plasma of Carassius auratus gibelio under four environmental stresses
2.4 补体3(C3)
C3的变化规律同GLU、IL-2类似,只对氨氮有明显的胁迫响应(P<0.05)(图4),该响应从第3 天开始显现,并一直维持在一个很高的水平。此外,C3在第7天对亚氮有响应,浓度水平显著高于对照组(P<0.05),剩余胁迫组在其它时间点与对照组均无显著差异(P>0.05)。
2.5 型干扰素(IFN)
随着时间的变化,4种环境胁迫下除pH组的血浆IFN水平与对照组无显著性差异外(P<0.05),其它3组都有显著性变化(P<0.05)。氨氮组先升高后降低再升高,其中在第3天和第15天时显著高于对照组(P<0.05);亚氮组先降低后升高,从第3 天到第15 天都显著低于对照组水平(P<0.05);而溶氧组的血浆IFN水平只有在第3天时显著高于对照组水平,之后缓慢降低(图5)。
2.6 免疫球蛋白M (Ig M)
pH组和溶氧组对Ig M的影响在整个实验周期内均无显著差异(P>0.05);而亚氮组则从第7 天开始一直显著高于对照组(P<0.05);与亚氮不同的是,氨氮组在第7 天则是显著低于对照组,在第10 天和第15 天 才开始高于对照组(P<0.05)(图6)。
2.7 丙二醛(MDA )
氨氮组和亚氮组MDA水平有显著性变化(P<0.05),其中氨氮胁迫下,MDA从第3 天开始显著升高,之后一直维持在一个高水平直至第15 天回落至对照组水平;而亚氮胁迫下,MDA 从第7 天到第15天均显著低于对照值。其它两胁迫组与对照组在整个实验周期内均无显著差异(P>0.05)(图7)。
2.8 超氧化物歧化酶(SOD)
pH胁迫组中SOD活力与对照组无显著差异(P<0.05);而其它3个胁迫组均能显著降低SOD活力,特别是氨氮组,SOD活力从第3 天开始显著降低,直至第15 天仍未恢复至对照水平;溶氧组这种降低效果只出现在第3 天,之后回升保持在对照组水平;而亚氮组则是在第3 天和第7 天降低,之后同样恢复至对照组水平(图8)。

图3 4种环境源性胁迫因子胁迫下异育银鲫血浆白介素-2的变化规律Fig.3 Variations of IL-2 in the plasma of Carassius auratus gibelio under four environmental stresses

图4 4种环境源性胁迫因子胁迫下异育银鲫血浆补体3内的变化规律Fig.4 Variations of C3 in the plasma of Carassius auratus gibelio under four environmental stresses
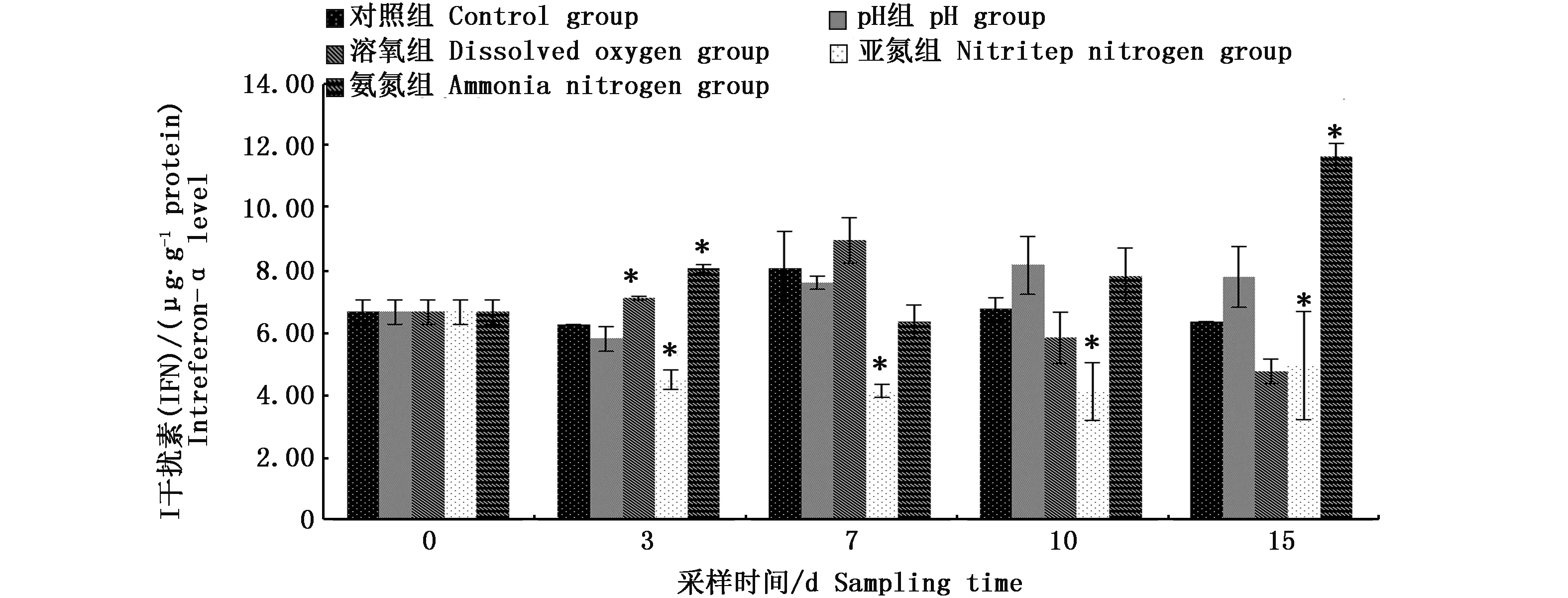
图5 4种环境源性胁迫因子胁迫下异育银鲫血浆I型干扰素内的变化规律Fig.5 Variations of IFN in the plasma of Carassius auratus gibelio under four environmental stresses

图6 4种环境源性胁迫因子胁迫下异育银鲫血浆IGM内的变化规律Fig.6 Variations of LGM in the plasma of Carassius auratus gibelio under four environmental stresses
3 讨论
关于鱼类应激指标方面,国内外做了大量的工作,筛选出的相关应激指标涉及多个方面:如行为方面的呼吸频率、游泳能力、应激状态恢复时间等;形态方面的体色、眼暗、肝体指数等;生理方面的皮质醇、葡萄糖、乳酸盐等[17-20]。然而,并非所有鱼受应激时会在形态外观上呈现出明显的差异,另外在行为上呈现出差异时可能表明鱼体已达严重应激状态[21]。因此,从生化免疫角度去筛选应激指标也是一种很有效的途径。鱼类是典型的变温和变渗型低等脊椎动物,极易受到各种环境源性和病原性的胁迫[22]。轻度应激会限制养殖鱼类生长、繁殖等,严重时则会导致其机体免疫力和抗逆性下降,从而诱发疾病甚至死亡[23]。研究发现,血清/血浆生化免疫指标可以反映出机体受环境胁迫后的代谢水平,进而被广泛用于判断鱼类的营养状况、疾病预警等方面[24]。目前,关于鱼类在应激状态下免疫指标的变化研究越来越多,但是大多数是某一单个刺激因子的不同梯度水平胁迫对血浆生化指标的影响[25],而本实验则采取了4种常见的异育银鲫幼鱼胁迫因子,研究胁迫下异育银鲫血浆生化免疫指标的变化趋势,旨在筛选出能够指示异育银鲫应激状态的指示性指标,为其体质评估和疾病的预防提供资料。
本研究发现COR经高pH、高亚氮和高氨氮胁迫时显著升高,而SOD显著降低,另外Ig M经高亚氮和高氨氮胁迫时亦显著升高,表明COR、SOD和Ig M可能是广源性的应激指示指标,高COR、高Ig M和低SOD指示机体可能处于应激状态。研究发现,应激状态下,众多血液指标会发生波动,其中以皮质醇最为灵敏[26-28]。众多研究也发现在各种不同胁迫情况下,各种鱼的COR均显著升高,如表1。

图7 4种环境源性胁迫因子胁迫下异育银鲫血浆MDA内的变化规律Fig.7 Variations of MDA in the plasma of Carassius auratus gibelio under four environmental stresses

图8 4种环境源性胁迫因子胁迫下异育银鲫血浆SOD内的变化规律Fig.8 Variations of SOD in the plasma of Carassius auratus gibelio under four environmental stresses

表1 血浆皮质醇相关研究Tab.1 Relevant studies of plasma COR
SOD是机体内重要的抗氧化酶,能够通过歧化反应清除机体细胞内所生成的氧自由基,降低其对细胞的损害,使受损细胞得到及时的修复,是抗氧化防御体系的第一道防线[37],其活性与水生生物的免疫水平密切相关[38]。所以,监测SOD活性的变化可反映出机体清除自由基的自我保护能力大小,对于增强吞噬细胞的防御能力以及整个机体的免疫功能具有重要作用[39]。因此,SOD经常被用作环境胁迫潜在指标[40]。田照辉等[41]发现西伯利亚鲟(Acipenserbaerii)遭受热应激时、王琨[30]发现鲤(Cyprinuscarpio)幼鱼在高氨氮胁迫下、韩春艳等[42]发现奥尼罗非鱼(Oreochromisniloticus×O.aureus)在氨氮胁迫下、叶俊[43]发现草鱼(Ctenopharyngodonidellus)在亚硝酸盐胁迫下、赵海涛[44]发现南方鲶(Silurusmeridionalis)幼鱼在高浓度氨氮长时间胁迫下、臧学磊[45]发现尼罗罗非鱼(OreochromisNiloticus)在高氨氮和高亚氮胁迫下,SOD均显著降低。
鱼类的免疫球蛋白M是一种特异性体液免疫因子,在体液免疫中发挥重要作用,可以中和毒素和病毒的毒性作用,是评价鱼体免疫应答反应的重要指标[46]。谢明媚等[47]发现银鲳(Peprilusmedius)幼鱼在急性温度胁迫时、杨启莲等[48]发现大黄鱼(Larimichthyscrocea)在温度胁迫时,Ig M均显著升高。
另外,本研究也发现GLU、IFN和C3只经高氨氮胁迫时显著升高,且响应幅度剧烈,表明GLU、IFN和C3可能是灵敏且狭源性的应激指示指标,高水平指示机体可能处于氨氮应激状态。氨氮对鱼体危害极大,它是诱发鱼病的主要环境因子[49]。胡毅等[50]发现青鱼(Mylopharyngodonpiceus)幼鱼在氨氮胁迫下,王琨[30]发现鲤在氨氮胁迫下血糖显著升高;此外,臧学磊[45]和陈家长等[49]都发现尼罗罗非鱼在氨氮胁迫下C3活性明显升高,但胁迫达到一定强度时C3则降低,而本实验中高氨氮胁迫下,异育银鲫C3活性一直处于高水平,这种差异可能由不同鱼类对氨氮耐受性的差异所致。
综上所述,在本实验条件下,血浆COR、SOD和Ig M可能是异育银鲫广源性的应激指示指标,GLU、IFN和C3可能是其灵敏的氨氮胁迫指示指标,但这些候选指标的进一步筛选还需深入研究。
[1] 段元慧, 朱晓鸣, 韩 冬, 等. 异育银鲫幼鱼对饲料中维生素K需求的研究[J]. 水生生物学报, 2013, 37(1): 8-15. DUAN Y H, ZHU X M, HAN D,etal. Dietary vitamin k requirement of juvenile gibel carp (Carassiusauratusgibelio) [J]. Acta Hydrobiologica Sinica, 2013, 37(1): 8-15.
[2] 王 健, 龚山明, 陈志刚. 异育银鲫“中科3号”与普通异育银鲫生长对比试验[J]. 科学养鱼, 2015(9): 21-22. WANG J, GONG S M, CHEN Z G. Comparative experiment on growth between different strains ofCarassiusauratusgibelioand “CAS III”Carassiusauratusgibelio[J]. Scientific Fish Farming, 2015(9): 21-22.
[3] 吴 霆, 朱春艳, 王 瑶, 等. 异育银鲫病毒性鳃出血病预防与控制技术[J]. 中国水产, 2015(10): 92-93. WU T, ZHU C Y, WANG Y,etal. Prevention and control of the gill hemorrhage viral syndrome inCarassiusauratusgibelio[J]. China Fisheries, 2015(10): 92-93.
[4] 秦 蕾, 张晓君, 毕可然. 一种新的异育银鲫病原: 腐败希瓦氏菌[J]. 微生物学报, 2012, 52(5): 558-565. QIN L, ZHANG X J, BI K R. A new pathogen of gibel carpCarassiusauratusgibelio-Shewanellaputrefaciens[J]. Acta Microbiologica Sinica, 2012, 52(5): 558-565.
[5] 夏 飞, 梁利国, 谢 骏. 异育银鲫病原维氏气单胞菌的分离鉴定及药敏实验[J]. 淡水渔业, 2012, 42(5): 22-26. XIA F, LIANG L G, XIE J. Isolation, identification and susceptibility test of the pathogenicAeromonasveroniifromCarassiusauratusgibelio[J]. Freshwater Fisheries, 2012, 42(5): 22-26.
[6] 王庆萍, 方春林, 芮学党. 鱼类的应激反应[J]. 江西水产科技, 2013(3): 36-39. WAGN Q P, FANG C L, RUI X D. Stress response in fish [J]. Jiangxi Fishery Sciences and Technology, 2013(3): 36-39.
[7] 陈 洁, 熊邦喜. 内源及外源因子对鱼类血液生理生化指标的影响[J]. 湖北农业科学, 2011, 50(9): 1861-1865. CHEN J, XIONG B X. The effect of endogenous and environment factors on hematology physiological and biochemical indices of fish [J]. Hubei Agricultural Sciences, 2011, 50(9): 1861-1865.
[8] 赵振新. 鱼类应激反应与饲料投喂[J]. 安徽农业科学, 2013, 41(20): 8560-8562. ZHAO Z X. Fish stress reaction and feeding management [J]. Journal of Anhui Agricultural Sciences, 2013, 41(20): 8560-8562.
[9] 王国强.应激反应对鱼类影响的研究进展[J]. 安徽农业科学, 2009, 37(24): 11579-11580. WANG G Q. Research progress on the effects of stress on fish [J]. Journal of Anhui Agricultural Sciences, 2009, 37(24): 11579-11580.
[10] 孔祥会, 张红绪, 杨太有. 鱼类特异性免疫受控多样性的研究进展[J]. 河南师范大学学报(自然科学版), 2001, 29(2): 57-61. KONG X H, ZHAGN H X, YANG T Y. Progress of research on various controlling factors of fish specific immunity [J]. Journal of Henan Normal University (Natural Science), 2001, 29(2): 57-61.
[11] 李 莉. 鱼类非特异性免疫研究进展[J]. 河南农业科学, 2012, 41(2): 26-32. LI L. Research progress of fish non-specific immunity [J]. Journal of Henan Agricultural Sciences, 2012, 41(2): 26-32.
[12] 蒋昕彧, 张 超, 李旭东,等. 鱼用疫苗免疫效果评价的研究进展[J]. 水产科学, 2015, 34(10): 662-666. JIANG X Y, ZHANG C, LI X D,etal. Research progress on assessment of immune effect of fish vaccines [J]. Fisheries Science, 2015, 34(10): 662-666.
[13] 周 玉, 郭广场, 杨振国, 等. 鱼类血液学指标研究的进展[J]. 上海水产大学学报, 2001, 10(2): 163-165. ZHOU Y, GUO G C, YANG Z G,etal. Advances in the study of haemotological indices of fish [J]. Journal of Shanghai Ocean University, 2001, 10(2): 163-165.
[14] 韩娜娜, 史成银. 血液学指标在鱼类学中的应用[J]. 安徽农业科学, 2010, 38(33): 18877-18878,18880. HAN N N, SHI C Y. The application of blood indexes in ichthyological research [J]. Journal of Anhui Agricultural Sciences, 2010, 38(33): 18877-18878,18880.
[15] 李文祥, 谢 骏, 宋 锐, 等. 水体pH胁迫对异育银鲫皮质醇激素和非特异性免疫的影响[J]. 水生生物学报, 2011, 35(2): 256-261. LI W X, XIE J, SONG R,etal. Effects of pH stress on cortisol and non-specific immunity ofCarassiusauratusgibelio[J]. Acta Hydrobiologica Sinica, 2011, 35(2): 256-261.
[16] 陈 惠, 王丽华, 刘 兰. 氨对鱼类毒性的研究[J]. 水产学杂志, 1994(2): 55-61. CHEN H, WANG L H, LIU L. Study on toxicity of ammonia to fish [J]. Chinese Journal of Fisheries, 1994(2): 55-61.
[17] MARTINS C I M, GALHARDO L, NOBLE C,etal. Behavioural indicators of welfare in farmed fish [J]. Fish Physiology Biochemistry, 2012(38): 17-41.
[18] FREITAS R H A, NEGRO C A, FELCIO A K C,etal. Eye darkening as a reliable, easy and inexpensive indicator of stress in fish [J]. Zoology, 2014(117): 179-184.
[19] ANDERSON P A, BERZINS I K, FOGARTY F,etal. Sound, stress, and seahorses: The consequences of a noisy environment to animal health [J]. Aquaculture, 2011(311): 129-138.
[20] SEGNER H, SUNDH H, BUCHMANN K,etal. Health of farmed fish: its relation to fish welfareand its utility as welfare indicator [J]. Fish Physiology Biochemistry, 2012(38): 85-105.
[21] 胡应高, 伍春艳. 鱼类的应激反应[J]. 铜仁职业技术学院学报, 2003(2): 54-57. HU Y G, WU C Y. Stress response in fish [J]. Journal of Tongren Polytechnic College, 2003(2): 54-57.
[22] 陈晓耘. 鱼类的血液[J]. 重庆师专学报, 2000, 19(3): 70-73. CHEN X Y. Fish blood [J]. Journal of Chongqing Teachers College, 2000, 19(3): 70-73.
[23] 朱红梅,周 宁. 应激反应对鱼类养殖的影响[J]. 科学养鱼, 2013(11): 90. ZHU H M, Zhou N. Effects of stress on fish culture [J]. Scientific Fish Farming, 2013(11): 90.
[24] 林光华. 鲫鱼血液的研究[J]. 动物学报, 1979, 25(3): 210-219. LIN G H. Hematological studies of the crucian carp [J]. Acta Zoologica Sinica, 1979, 25(3): 210-219.
[25] 施兆鸿, 张艳亮, 高权新, 等. 云纹石斑鱼幼鱼血清生化指标对低温胁迫的响应[J]. 生态学杂志, 2015, 34(8): 2222-2228. SHI Z H, ZHANG Y L, GAO Q X,etal. Effects of low-temperature stress on serum biochemical parameters and metabolic enzyme activity in juvenileEpinephelusmoara[J]. Chinese Journal of Ecology, 2015, 34(8): 2222-2228.
[26] STRANGE R J, SCHRECK C B. Anesthetic and handling stress on survival and cortisol concentration in yearling Chinook salmon (Oncorhynchustshawytscha) [J]. Journal of Fish Research, 1978, (35): 345-349.
[27] KLINGER H, DELVENTHAL H, HILGE V. Water quality and stocking density as stressors of channel catfish (IctaluruspunctatusRafinesque) [J]. Aquaculture, 1983(30): 263-272.
[28] ROBERTSON O H, HANE S, WEXLER D C,etal. The effect of hydrocortisone on immature rainbow trout (Salmogairdneri) [J]. Generaland Comparative Endocrinology, 1963(3): 422-436.
[29] 李 波, 樊启学, 杨 凯, 等. 慢性氨氮胁迫对黄颡鱼摄食、生长及血液指标的影响[J]. 应用与环境生物学报, 2011, 17(6): 824-828. LI B, FAN Q X, YANG K,etal. Effects of chronic ammonia stress on foraging, growth, and haematological parameters of yellow catfish (Pelteobagrusfulvidraco) juveniles [J]. Chinese Journal of Applied and Environmental Biology, 2011, 17(6): 824-828.
[30] 王 琨. 氨氮对鲤(CyprinuscarpioLinnaeus) 幼鱼部分组织及血液指标的影响[D]. 哈尔滨: 东北农业大学, 2007 WANG K. Effects of ammonia on tissue and haematological parameters of juvenile carp (CyprinuscarpioLinnaeus) [D]. Harbin: Northeast Agricultural University, 2007.
[31] PICKERING A D, POTTINGER T G, SUMPTER J P,etal. Effects of acute and chronic stress on the levels of circulating growth hormone in the rainbow trout,Oncorhynchusmykiss[J]. General and Comparative Endocrinology, 1991(83): 86-93.
[32] TOMASSO J R, DAVIS K B, PARKER N C. Plasma corticosteroid dynamics in channel catfish,Ictaluruspunctatus(Rafinesque), during and after oxygen depletion [J]. Journal of Fish Biology, 1981(18): 519-526.
[33] DAS P C, AYYAPPAN S, JENA J K,etal. Nitrite toxicity inCirrhinusmrigala(Ham.): Acute toxicity and sub-lethal effect on selected haematological parameters [J]. Aquaculture, 2004(235): 663-664.
[34] CIJI A, SAHU N P, PAL A K,etal. Alterations in serum electrolytes, antioxidative enzymes and haematological parameters ofLabeorohitaon short-term exposure to sublethal dose of nitrite [J]. Fish Physiology and Biochemistry, 2012(38): 1355-1365.
[35] 于 淼. 拥挤胁迫对鲤生长和生理指标的影响[D]. 武汉: 华中农业大学, 2005. YU M. Effects of crowding stress on growth and physiological parameters of common carp (CyprinuscarpioL.) [D]. Wuhan: Huazhong Agricultural University, 2005.
[36] 吴志昊, 尤 锋, 王英芳, 等. 低氧和高氧对大菱鲆幼鱼红细胞核异常及氧化抗氧化平衡的影响[J]. 上海海洋大学学报, 2011, 20(6): 808-813. WU Z H, YOU F, WANGY F,etal. The effects of hypoxia and hyperoxia on nucleus anomaly,SOD,CAT activities and MDA content in juvenile turbotScophthalmusmaximus[J]. Journal of Shanghai Ocean University, 2011, 20(6): 808-813.
[37] PANDEY S, PARVEZ S, SAYEED I,etal. Biomarkers of oxidative stress: a comparative study on river Yamuna fishWallagoattu(Bl and Schn.) [J]. Science of Total Environment, 2003(309): 105-115.
[38] 王文博, 汪建国, 李爱华, 等. 振荡胁迫后鲫血液皮质醇和溶菌酶水平的变化[J]. 水生生物学报, 2004, 28(6): 682-684. WAGN W B, WANG J G, LI A H,etal. Changes of cortisol and lysozyme levels inCarassiusauratusblood after handling stress [J]. Acta Hydrobiologica Sinica, 2004, 28(6): 682-684.
[39] 牟海津, 江晓路, 刘树青, 等. 免疫多糖对栉孔扇贝酸性磷酸酶, 碱性磷酸酶和超氧化物歧化酶活性的影响[J]. 青岛海洋大学学报(自然科学版), 1999, 29(3): 463-468. MOU H J, JIANG X L, LIU S Q,etal. Effects of immunopolysaccharide on the activities of acid phosphatase, alkaline phosphatase and superoxide dismutase inChlamysfarreri[J]. Journal of Qingdao Ocean University (Natural Science), 1999, 29(3): 463-468.
[40] ROCH H, BOGE G. Fish blood parameters as a potential tool for identification of stress caused by environmental factors and chemical intoxication [J]. Marine Environmental Research, 1996, 41(1): 27-43.
[41] 田照辉, 徐绍刚, 王 巍, 等. 急性热应激对西伯利亚鲟HSP70 mRNA表达、血清皮质醇和非特异性免疫的影响[J]. 水生生物学报, 2013(2): 344-350. TIAN Z H, XU S G, WANG W,etal. Effects of acute thermal stress on HSP 70 mRNA, phyiological and non-specific immunity in Siberian sturgeon (Acipenserbaerii) [J]. Acta Hydrobiologica Sinica, 2013(2): 344-350.
[42] 韩春艳, 郑清梅, 陈桂丹, 等. 氨氮胁迫对奥尼罗非鱼非特异性免疫的影响[J]. 南方水产科学, 2014, 10(3): 47-52. HAN C Y, ZHENG Q M, CHEN G D,etal. Effect of ammonia-N stress on non-specific immunity of tilapia (Oreochromisniloticus×O.areus) [J]. South China Fisheries Science, 2014, 10(3): 47-52.
[43] 叶 俊. 亚硝酸盐急性胁迫对草鱼血液生理生化指标和非特异性免疫性能的影响[D]. 武汉: 华中农业大学, 2013. YE J. The acute effect of nitrite on blood physiological and biochemical parameters and non-specific immunity in grass carpCtenopharyngodonidellus[D]. Wuhan: Huazhong Agricultural University, 2013.
[44] 赵海涛. 氨氮对南方鲶(SilurusmeridionalisChen)幼鱼血液生理、生化及非特异性免疫指标的影响[D]. 重庆: 西南大学, 2006. ZHAO H T. Effects of ammonia on haematological and immune parameters of juvenile Southern catfish (SilurusmeridionalisChen) [D]. Chongqing: Southwestern University, 2006.
[45] 藏学磊. 三种环境因子胁迫下罗非鱼(GIFTOreochromisniloticus)机体免疫力的变化及其对海豚链球菌易感性的影响[D]. 南京: 南京农业大学, 2010. ZANG X L. The immune response of tilapia (GIFTOreochromisniloticus) and its susceptibility toStreptococcusiniaeunder three environmental stresses [D]. Nanjing: Nanjing Agricultural University, 2010.
[46] 侯月娥, 冯 娟, 杨清华, 等. 鱼类免疫球蛋白的研究进展[J]. 黑龙江畜牧兽医, 2010(9): 37-39. HOU Y E, FENG J, YANG Q H,etal. Research progress of fish immunoglobulin [J]. Heilongjiang Animal Science and Veterinary Medicine, 2010(9): 37-39.
[47] 谢明媚, 彭士明, 张晨捷, 等. 急性温度胁迫对银鲳幼鱼抗氧化和免疫指标的影响[J]. 海洋渔业, 2015, 37(6): 541-549. XIE M M, PEGN S M, ZHAGN C J,etal. Effects of acute temperature stress on antioxidant enzyme activities and immune indexes of juvenilePampusargenteus[J]. Marine Fisheries, 2015, 37(6): 541-549.
[48] 杨启莲. 大黄鱼HSP及caspase家族部分基因对温度胁迫的响应[D]. 厦门: 集美大学, 2011. YANG Q L. Response characterization of some HSP and caspase genes of large yellow croaker to temperature stress [D]. Xiamen: Jimei University, 2011.
[49] 陈家长, 臧学磊, 胡庚东, 等. 氨氮胁迫下罗非鱼(GIFTOreochromisniloticus)机体免疫力的变化及其对海豚链球菌易感性的影响[J]. 生态环境学报, 2011, 20(4): 629-634. CHENG J Z, ZAGN X L, HU G D,etal. The immune response of tilapia (GIFTOreochromisniloticus) and its susceptibility to Streptococcus iniae under stress in different ammonia [J]. Ecology and Environmental Sciences, 2011, 20(4): 629-634.
[50] 胡 毅, 黄 云, 钟 蕾, 等. 氨氮胁迫对青鱼幼鱼鳃丝Na+/K+-ATP酶、组织结构及血清部分生理生化指标的影响[J]. 水产学报, 2012, 36(4): 538-545. HU Y, HUANG Y, ZHONG L,etal. Effects of ammonia stress on the gill Na+/K+-ATPase, microstructure and some serum physiological-biochemical indices of juvenile black carp (Mylopharyngodonpiceus) [J]. Journal of Fisheries of China, 2012, 36(4): 538-545.
Effects of four environmental stresses on biochemical indexes in the plasma of gibel carpCarassiusauratusgibelio
SHAN Na1,2, LIN Ting-ting1, LAI Qi-fang1, LI Gong-zheng3, ZHOU Kai1, LI Cheng-xin3, ZHONG Qi-cheng1, MA Qing-nan3, YAO Zong-li1, LIU Jin-hong3
(1EngineeringTechnologyResearchCenterforSaline-alkalineWaterFisheries,EastChinaSeaFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Shanghai200090,China;2CollegeofFisheriesandLifeScience,ShanghaiOceanUniversity,Shanghai201306,China;3BrightfisheriesCo.,Ltd.,DafengJiangsu224153,China)
In recent years, the problems such as uneven quality of juveniles, unstable production and large-scale disease occurence have been frequently emerged in the culture of gibel carpCarassiusauratusgibelioin our country. Establishment of the techniques for fish health evaluation or screening out several immune-related indexes for indicating the fish healthy status is useful to relieve these problems. In the present study, the effects of four environmental stresses (high pH of 9.2, low dissolved oxygen of 2 mg·L-1, high nitrite nitrogen of 2 mg·L-1and high ammonia nitrogen of 4 mg·L-1) on immune indexes (cortisol (COR), glucose (GLU), interferon (IFN), interleukin-2 (IL-2), superoxide dismutase (SOD), immunoglobulin M (Ig M), complement 3 (C3) and malondialdehyde (MDA)) in the plasma of theC.auratusgibeliojuveniles [(136.70 ± 7.98) g] were carried out. Stressed carps were sampled at the 0 d, 3 d, 7 d, 10 d and 15 d after stress. The results showed that COR significantly increased under pH, nitrite nitrogen and ammonia nitrogen stresses, while SOD significantly reduced under pH, nitrite nitrogen and ammonia nitrogen stresses, meanwhile, Ig M significantly increased under nitrite nitrogen and ammonia nitrogen stresses, indicating that these three immune indexes may be the broad-spectrum indicators for stressed status. High values of COR and Ig M, and low value of SOD may indicate fish under the stress condition. GLU, IFN and C3 strongly increased only under the ammonia nitrogen stress, indicating these three immune indexes may be the narrow-spectrum indicators for stressed status. High values of GLU, IFN and C3 may indicate fish under the stressed condition. Additionally, IFN and MDA increased under ammonia nitrogen stress, but decreased under nitrite nitrogen stress, indicating these two immune indexes may be not suitable for indicating the carp stressed status.
Carassiusauratusgibelio; pH; dissolved oxygen; nitrite nitrogen; ammonia nitrogen; biochemical and immune indicators
1004-2490(2017)02-0162-11
2016-04-19
上海市科技兴农重点攻关项目“海丰滨海盐碱池塘养殖关键技术研究与示范”;沪农科攻字(2015)第1-6号
单 娜(1991-),女,在读硕士研究生,主要从事水产养殖学研究。E-mail:danna_7047@hotmail.com
来琦芳,研究员。E-mail: laiqf@ecsf.ac.cn
S 964.3
A
