中国沿海鯻科鱼类DNA条形码研究及新记录种三线鯻分类地位探讨
2017-06-01黄伯炎吕金磊杨喜书
陈 璐,黄伯炎,薛 丹,吕金磊,杨喜书,章 群
(暨南大学生态系,热带亚热带水生态工程教育部工程研究中心,广州 510632)
中国沿海鯻科鱼类DNA条形码研究及新记录种三线鯻分类地位探讨
陈 璐,黄伯炎,薛 丹,吕金磊,杨喜书,章 群
(暨南大学生态系,热带亚热带水生态工程教育部工程研究中心,广州 510632)
鯻科鱼类是广泛分布于印度-西太平洋常见经济鱼类,由于不同物种间外部形态较为相似,且种内有一定变化,物种鉴定存在一定困难。为明确中国鯻科鱼类的分类地位,对中国鯻科鱼类进行了详细的形态计测,并测定了3属共62 ind鱼类COI基因5’端652 bpCOI序列,结合GenBank中三线鯻3个地点9条序列,发现我国除已报道的3属4种鯻科外,新发现目前仅见于广东的三线鯻,是中国鯻科鱼类的新纪录。在基于Kimura-2-paramter 的邻接树上,5种鯻科鱼类均独立成支。种间遗传距离18.34%(15.9%~20.1%)约为种内遗传距离0.72%(0.1%~2.7%)的24.93倍,形成较为明显的条码间隙。三线鯻可按地理来源分为西太平洋和印度洋-地中海2个谱系,具有明显的谱系结构和地理结构;谱系间遗传距离为5%(0.2%~5.6%)为谱系内遗传距离0.85%[谱系A为0.6%(0~1.7%),谱系B为1.1%(0.2%~5.6%)]的5.88倍, 谱系间与谱系内遗传距离倍数略低于大多数物种(种间是种内遗传距离10倍),但远高于其种内遗传距离一般小于2%的范围。同时,鯻科内种间在形态上存在诸如侧面体型细长扁平或肥厚、臀鳍是否带隐约散点斑纹、背鳍硬棘的Ⅲ-VI或Ⅶ-Ⅷ间是否有黑色斑点、头部至背鳍前端略带蓝灰或黄绿光泽、身体背部浅灰或浅棕色等区别。分子和形态差异表明,印度-西太平洋分布的三线鯻可能是2个亚种乃至2个种。由于本文分析的三线鯻的数量和地理范围有限,其准确的分类地位仍需要更多的形态计测和核基因数据等研究加以确定。
三线鯻; DNA条形码; 形态分类
鯻科(Terapontidae)鱼类隶属鲈形目(Perciformes),主要分布在东自萨摩亚、南至澳洲的印度-太平洋水域,西至红海,北至日本南部,在中国分布于东海和南海。鯻科鱼类是海洋生态系统的重要组成部分,也是颇受渔民喜爱的经济鱼类[1-2]。据NELSON[3]报道,全世界鯻科鱼类共有16属52种;根据现有资料记载,中国仅有细鳞鯻(Teraponjarbua)、鯻 (Terapontheraps)、尖吻鯻(Rhynchopelatesoxyrhynchus)及列牙鯻(Pelatesquadrilineatus) 3属4种,本文在研究中国鯻科鱼类时,发现目前仅见于广东的三线鯻(Teraponputa),是中国的新纪录。近年来随着海洋环境污染和过度捕捞的日益加剧,海洋鱼类资源急剧衰退[4-5],许多鱼类已因过度开发而种质资源濒临枯竭乃至灭绝[6],中国鯻科鱼类资源已出现衰退,鯻和细鳞鯻产量大不如从前[4-5, 7],尖吻鯻在中国南海属少有,三线鯻数量更为稀少。
准确的物种鉴定是深入开展种质资源保护与开发利用的基础。传统的形态分类因直观快速而一直作为物种分类法的主流,但单纯依赖外部形态,可能会因为一些物种在不同发育时期和不同的环境下出现的表型可塑性,而忽视物种在进化过程中因个体差异的积累而逐渐演变为潜在亚种乃至新种的可能性,导致错误的鉴定。因此有必要在传统形态鉴定的基础上寻求更为客观的方法。2003年HEBERT等[2]提出DNA条形码的概念,即通过一段易于扩增测序的标准基因序列进行物种鉴定。线粒体DNA具有进化速率快、几乎不重组的特点,其中细胞色素 C 氧化酶亚基Ⅰ(COI)基因5’端长652 bp左右的序列变异水平合适,种间最小遗传距离明显大于相应的种内最大遗传距离,可以用于鉴定大部分动物物种。2005年WARD等[8]发现澳洲207种鱼COI基因序列的种间种内遗传差异显著,可用作DNA条形码鉴定大部分鱼类物种;近年基于COI基因序列分析的研究发现了大量的隐存种或新种[9-11]。
鯻科鱼类鳍棘、体侧条纹及鳍条等外部形态较为相似,背鳍肛门附近的射线、黑色纵纹的条数和颜色深浅及断续程度因个体发育多有变异,导致部分种类的体侧条纹的位置和数量既有一定的过渡性,又有一定的种间差异,如三线鯻与鯻的躯体节点距离、背鳍及尾鳍斑纹位置、横纹或腹部的颜色等相近,与细鳞鯻、尖吻鯻及列牙鯻则均在背鳍起点前下方有明显大黑斑,导致准确的物种分类存在一定困难[1, 12]。国外关于三线鯻的研究主要集中在食性及其营养层级和重金属富集化等方面[13-15]。由于三线鯻是广泛分布于印度-西太平洋、南印度洋和印澳群岛等地的两侧洄游型鱼类,不同地理群体的外部形态存在一定差异,特别是在鳍棘、体侧条纹及鳍条等特征上变化较大,背鳍鳍膜的比例和弯曲度不一,体长与体高比变化较大(约为2.4~3.6倍),背部颜色深浅不定,体侧上纵纹条数、粗细及断续不定,背鳍硬棘上黑斑范围、背鳍前端蓝灰光泽深浅不一;腹部乳白色或灰白程度不同。虽然这些差异多被认为是个体间的差异,但并无客观的比较。为此本文测定了中国鯻科5种鱼类DNA条码区序列,结合GenBank (http://www.ncbi.nlm.nih.gov)和BOLD(http://www.barcodinglife.org)数据库中菲律宾、印度、以色列的三线鯻序列,共分析了5种71条序列;再结合形态计测,对比Fishbase(http://www.fishbase.org/)上已有的形态数据,以期明确中国鯻科特别是三线鯻2个分支的分类地位,为种质资源保护利用和海洋生态研究提供参考资料。
1 材料与方法
1.1 实验材料来源
本研究中,中国鯻科鱼类标本于2004年8月6日~2015年8月6日采集于福建平潭、福清,广东碣石、大亚湾、阳江、硇州岛、湛江、乌石,广西东兴,通过Fishbase、VARI[1]、《中国鱼类系统检索》[16]、《台湾鱼类检索》[17]等综合比较确定种名后,将标本放入95%乙醇中,保存于暨南大学生态系标本室。本研究所使用的鯻科鱼类经测定最终确认共有3属5种62 ind,其中三线鯻12 ind,目前仅见于湛江市乌石镇附近海域(表1)。
1.2 形态测量方法
参照BEDDOW等[18]方法计数侧线鳞、侧线上鳞、背鳍前鳞、侧线下鳞、围尾柄鳞、背鳍条、胸鳍、腹鳍条和臀鳍条;测量体长、体高、头长、头高、吻长、眼径、尾柄长、尾柄高、背鳍长、胸鳍长、腹鳍长、臀鳍基长、臀鳍长、眼间距等14个常规性状;通过9个解剖学坐标点:A吻端、B头背部末端、C胸鳍起点、D背鳍起点、E背鳍基部末端、F腹鳍起点、G臀鳍起点、H尾鳍背部起点、I尾鳍腹部起点构建框架结构,测量AB,AC, BC,BD,BF, CD,CF,DF,DE,DG, EF,FG,EG,EH,EI, GH,GI,HI等18个框架结构测量性状间距离,精确到0.1 mm(图1);通过SPSS软件对32个度量特征进行主成分分析、判别分析和聚类分析。摘录鱼体外观互相共有或特有的11个外表特征,作分类数据录入3D Chart Mobile Pro(http://www.advance-media.com),输出形态特征雷达图。
1.3 DNA提取及PCR扩增
取背部肌肉约100 mg,晾干后用酚/氯仿法[19]提取总DNA,使用本实验室自行设计引物COIF: 5’-TGTAAAACGACGGCCAGTCCTGTGGCAATYACDCGCTGAT-3’;COIR: 5’-CAGGAAACAGCTATGACNACYTCNGGRTGNCCRAAGAA-3’扩增线粒体COI基因5’端目标片断。PCR反应体系和反应时间参照薛丹等[20]的方法,将经过1%的琼脂糖凝胶电泳检测合格的扩增产物送往华大基因切胶纯化,经ABI-3730自动测序仪测序。
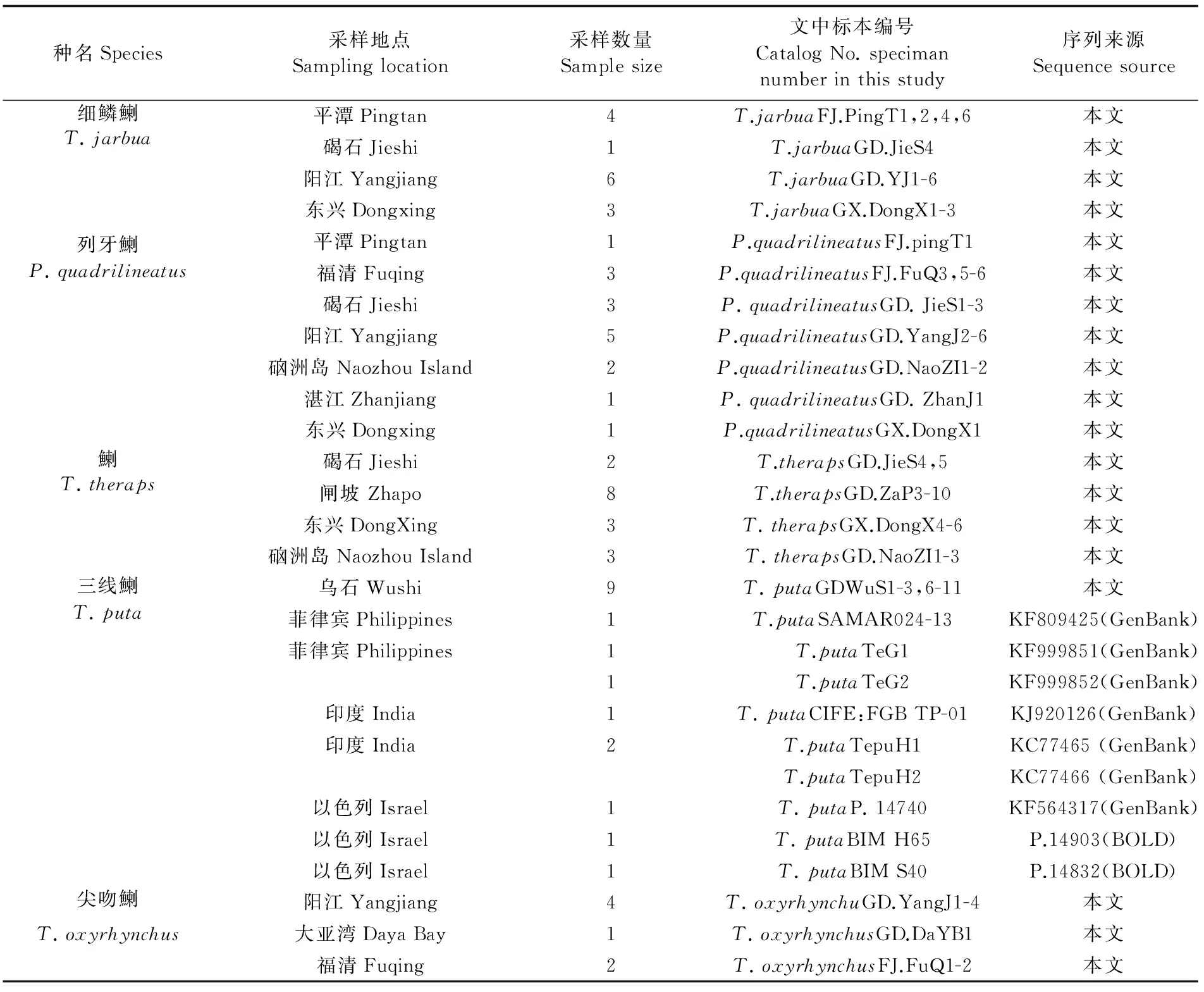
表1 样品相关信息Tab.1 Source of isolates and sequence of 72 individuals used in this study.

图1 鯻科鱼类的框架结构图[16] [参照T. theraps(Cuvier et Valenciennes)]Fig.1 Morphometrics measurement of Terapontidae [sensu T. theraps (Cuvier et Valenciennes) ]
1.4 数据分析方法
结合GenBank、BOLD下载的三线鯻序列,利用MEGA 6.0软件进行人工校对和序列比对,计算碱基组成、转换与颠换、简约位点及变异位点,以Kimura 2-parameter(K2P)模型计算种内和种间遗传距离,构建邻接(Neighbor-Joining)树,经1 000次重复抽样(Bootstraps)检测置信度。将序列数据上传到ABGD网站(http://wwwabi.snv.jussieu.fr/public /abgd /abgdweb. html),使用默认设置值进行ABGD法(automatic barcode gap discovery)[21]分类。
2 结果与分析
2.1 中国三线鯻的形态特征
本文所获的三线鯻形态特征如下(图2):头背平直,侧面体型呈细长梭形,体长与体高比约为3.2~3.6;唇部略钝,吻长等于眼径;吻微凸不带肉质;牙尖锥型,两颌牙多行,外行牙多为扩大;尾鳍略分叉。背鳍Ⅺ-10,背鳍硬棘部与软条部完全分离;胸鰭Ⅲ-10,腹鳍I-5,臀鳍III(8 - 9);体被细栉鳞,侧线完全,侧线上鳞70 - 85。液浸标本背部黑褐色,从眼上方至背鳍硬棘部下方的背部略带灰蓝光泽;体侧有3~4条细长黑色水平纵纹,第3条由眼前方起穿过鱼体腹部中央延续至尾柄侧面中央,与尾鳍中央带重叠,但第4条起始于吻部,在腹部断续隐约延至尾鳍。背鳍硬棘III -VI上有黑斑,软鳍部有竖纹黑带2~3条;臀鳍肛门附近具黑带;尾鳍上下叶有5条黑色纵纹,着色深浅不定,各鳍底色淡黃。

图2 采集于中国广东省乌石的三线鯻Fig.2 T.Puta collected from Wushi, Guangdong Province, China
2.2 鯻科形态测量多元分析
5种鱼类计数特征详见表 2。从11项主要形态特征雷达图上看(图3),三线鯻与鯻最为相像,仅前者体被栉鳞、而后者体被粗栉鳞有所不同。三线鯻与尖吻鯻共有5项相似特征,而与列牙鯻则仅有3项特征一致。在主成分散点图(图4)上,第一主成分(躯体节点距离特征)三线鯻除了与细鳞鯻重叠较多之外,与其余种类区分较好;第二主成分(头部特征)三线鯻与另外几种没

图3 基于形态特征构建的鯻科群体雷达图Fig.3 Radar chart based on the morphological features of Terapontid species

表2 鯻科5种间的分节特征比较Tab.2 Comparative summaries of meristic characters of populations in Teraponidae
注:框架内的数值为平均值
Note:Data in brackets are mean values
有明显区分,说明三线鯻与鯻科其余鱼类的最大区别是躯体节点距离特征。在判别函数图(图4)中,三线鯻、尖吻鯻100%被判别正确;列牙鯻的判别率达99%;鯻的判别率为93.5%,细鳞鯻判别率最低(89.5%)。因此,综合原始判别的正确率为95.7%。鯻与细鳞鯻在主成分分析、判别散点图中区域重叠严重,5种鱼类在躯体分节特征、头部特征上差异参差不齐,较难用单一计测特征来完全区分不同物种。
在5种鱼类的32个可量性状平均值(图5)聚类图上,鯻、细鳞鯻与尖吻鯻3者先聚类,说明在度量特征上最为相似;再与三线鯻聚类,说明三线鯻与上述3种鯻科鱼类的度量特征存在一定的差异;列牙鯻最后聚类加入,与鯻科其余4种最不相似。表明虽然三线鯻与鯻科其余鱼类在形态测量的多元分析下出现不同程度上的重叠,但仍可凭自己的特征被分出。
2.3 分子实验结果
2.3.1COI基因序列
在71条COI基因652 bp序列中, 没有插入和缺失,多态位点195个,简约信息位点190个;平均碱基组成为 T: 28.9%、C: 29.5%、A: 22.8%、G: 18.9%。A+T含量(51.7%)高于C+G含量(48.4%),呈现出明显的碱基组成偏向性,与WARD等[8]的硬骨鱼研究一致,颠换比(R)为2.64,表明COI基因序列的突变未达到饱和,适合系统发育分析[22]。
2.3.2 分子鉴定
在邻接树上(图5,右图),5种鱼类均独立成支,种间遗传距离18.34%(15.9%~20.1%)约为种内遗传距离0.72%(0.1%~2.7%)的 24.93倍。三线鯻进一步分为2个Clade,Clade间的遗传距离5%是Clade内平均遗传距离(0.85%)的5.88倍;排除三线鯻后,种间平均遗传距离为17.7%(16.1%~20.1%)为种内平均遗传距离0.23%(0.1%~0.5%)的77.09倍,表明存在明显的条码间隙[23-24]。详见表3。在通过ABGD软件的递归分析(图6)中,所有≤1.29%的先验距离(将鯻科数据分为了≥7个假设种)不仅小于一般种内距离(2%),且与本文所得的形态和分子结果不符。但当2.15%为先验遗传距离时, 鯻科数据被分成了5个假设种,与上述形态学与分子结果分析相对应,因此该假设比图中其余假设更为可信。

图4 主成分得分散点分布图(左)和鯻科内可量性状的判别函数得分(右)Fig.4 Scatter plot of component factor score(left)and discriminant scores(right) of measurement parameters among Terapontidae

图5 基于形态量度的聚类图(左)和COI序列K2P模型的鯻科NJ树(右)Fig.5 Dendrogram(left) and K2P-based NJ tree(right) of Terapontid species constructed by metrical characteristics and COI sequences respectively

表3 基于K2P模型的种间(对角线下)和种内(对角线)遗传距离Tab.3 Inter-specific(blow diagonal) versus intra-specific(diagonal) K2P genetic distances from individual species of the Teraponidae

图6 鯻科鱼类ABGD分析Fig.6 Automatic barcode gap discovery(ABGD) analyses for Terapontidae
3 讨论
3.1 DNA条形码研究辅助形态鉴定
在11项形态特征雷达图中,三线鯻与鯻仅前者被细栉鳞、而后者体被粗栉鳞不同;在可量特征聚类树上,三线鯻则与鯻-细鳞鯻-尖吻鯻3种聚成的一支距离较远;在主成分分析散点图上,三线鯻躯体节点距离特征与细鳞鯻重叠较多;表明鯻科种间可数和可量性状部分存在多方面的不同程度重叠,特别是三线鯻与细鳞鯻在主成分分析散点图、判别函数散点图上的可量性状比例重叠,三线鯻与鯻在形态特征雷达图上的相似,容易模糊种间关系,造成形态鉴定的误判。由于三线鯻在之前的国内检索文献内并没有被记录,且本实验室所获数量亦少,我们在最初分类时就曾将其误判为鯻。本研究的分子序列分析结果显示中国三线鯻与其它地区的三线鯻在邻接树上聚类成一支(bootstrap支持率100%),与鯻科其它鱼类差异显著,笔者仔细比对VARI等[1]的分类检索,并对鯻科鱼类进行了详细的形态测量后,发现形态描述与VARI等[1]描述较为一致,可见形态鉴定仍具有其实用性;同时说明DNA条形码对形态学鉴定有辅助作用,能校正或确定传统形态学结果,并阐释近缘物种间的亲缘关系。
3.2 中国三线鯻的分类地位
COI基因序列分析表明,鯻科5种鱼类各自独立成支,平均种间遗传距离(18.34%)是种内遗传距离(0.72%)的24.93倍;排除三线鯻后,种间平均遗传距离为17.73%(范围在16.1%~20.1%),种内平均遗传距离为0.23%(范围在0.1%~0.5%),种间可达种内的77.09倍;满足HERBERT等[23]提出的“10×规则”,确定了鯻科内各物种的有效性。值得注意的是,在邻接树上三线鯻分为中国-菲律宾、印度-以色列等2个分支,分支间遗传距离高达5%(1.4%~5.3%),是分支内遗传距离0.85%(0.6%~1.1%)的5.88倍。据HERBERT等[25]对13 320个物种的COI基因分析中的总结,多数物种种内遗传距离小于1%,少有大于2%;但三线鯻的种内遗传距离为2.7%(0~5.6%)。可见三线鯻分支间与分支内的遗传距离倍数小于HERBERT等[25]提出的“10×规则”,但三线鯻种内遗传距离大于指出的一般物种的种内遗传距离;推测2个分支的分类地位如下:
1)可能是同一种的不同亚种。首先,2个分支分别局限于西太平洋、印度洋-地中海域,这种异域分布(allopatric distribution)模式在沙重牙鲷(Diplodussargussargus)[26]、虹鳟(Onchorynchusmykiss)[27]中也有报道。印度洋与西太平洋之间存在的安曼达海和马六甲海峡在晚更新世内冰期-间冰期的海平面反复升降,可能导致栖息海域的片段化,成为不同地域间基因交流的地理隔离[28]。2个海域的三线鯻群体间形态差异已有一定程度的表现,如侧面体型细长扁平或肥厚;臀鳍是否有隐约散点斑纹;尾鳍边缘有凹缘或平截;背鳍硬棘部与软条部连续或分开;背鳍硬棘的III -VI或Ⅶ-Ⅷ间带黑色斑点;头部至背鳍前端略带蓝灰或黄绿光泽;身体背部浅灰或浅棕色。印度-西太平洋分布的多鳞鱚(Sillagosihama)[29]、南洋银汉鱼(Atherinomoruslacunosus)[30-31]及花斑蛇鲻(Sauridaundosquamis)[32]等外部形态上也出现相似程度的差异。由于隔离时间短,三线鯻不同海域间的分子差异[5%(1.4% ~5.3%)]不足以达到“10×规则”;且由于mtDNA属母系遗传,可能核基因仍未完成谱系拣选,冰期结束后仍可进行基因交流。本文三线鯻2个分支与斑带蝴蝶鱼(Chaetodonpunctatofasciatus)的复合种情况类似,平均种间差异只有1.62%(范围在0.78%~2.5%)[33]。这从分子和形态的层次都显示了存在两海域间的三线鯻个体差异可能已达亚种水平。
2)三线鯻的2个分支可能为近期分化的物种。宁平[34]发现日本金线鱼印度沿海组群和中国南海组群间的遗传距离为3.12%(>2%),认为有隐存种的存在;在沙丁鱼[9]、金枪鱼属[35]、石斑鱼属[36]中COI基因序列不仅种间差异低(如石斑鱼属在COI上的平均种间差异低至3.4%),且种内差异也非常小,但属内的每个种仍会聚类为一个独立分开的集合。这类种内种间较小的遗传差异一般被认为是同属内物种的特征而非同种内的种群分化[24]。这种在邻接树上按种独立分开且伴有较小的遗传距离的现象与本文结果类似。三线鯻分支间的遗传距离(5%)是分支内的平均遗传距离(0.85%)的5.88倍,虽然还没达到“10×规则”,但已远大于一般的种内遗传距离(2%)。由于不同物种生理生态习性和进化历史不同而呈现不同的种间遗传距离,并不是所有的物种都能满足“10×规则”,因此不能排除三线鯻2个分支是2个物种的可能性。
本研究表明,三线鯻的形态特征易于与鯻科其它鱼类混淆(特别是鯻和细鳞鯻),且本研究所获三线鯻数量较少,国内亦缺乏相关的资料,以致形态测量方法的多元性和鯻科形态特征上的相似性为实际的形态鉴定带来了不可避免的困难乃至错判。三线鯻的形态特征在DNA条形码辅助校对下能与鯻科其它物种分开,表明其为一有效物种。印度-西太平洋分布的三线鯻由2个分支组成,可能其由2个不同的亚种组成乃至近期分化为2个物种。基于种质资源保护、开发利用和海洋生态研究等需要,三线鯻应作为2个显著进化单位被加以保护。由于本文仅分析了母系遗传的线粒体基因,不能完整反映物种的遗传信息,在以后的研究中仍需更广泛的地理取样,并开展详细的形态测量,以明确三线鯻2个分支的分类地位。
[1] VARI R P. The terapon perches (Percoidei: Teraponidae): a cladistic analysis and taxonomic revision[J].Bulletin of the American Museum of Natural History, 1978(159):175-340.
[2] HEBERT P D, CYWINSKA A, BALL S L,etal. Biological identifications through DNA barcodes[J]. Proceedings Biological Sciences,2003,270(1512): 313-321.
[3] NELSON J S. Tetraodontidae. In:Fishes of the world[M].Newyork:John wiley & Sons Inc,1984:600.
[4] 黄良敏, 谢仰杰, 张雅芝,等.厦门海域渔业资源现存量评析[J]. 集美大学学报(自然科学版), 2010(2): 81-87. Huang L M, Xie Y J, Zhang Y Z,etal. Current fisheries resources assessment in Xiamen coastal waters[J].Journal of Jimei University(Natural Science), 2010(2): 81-87.
[5] 鞠海龙. 南海渔业资源衰减相关问题研究[J]. 东南亚研究, 2012(6): 51-55. JU H L. Studies on the decrement of fishery resource in the South China Sea[J].Southeast Asian Studies, 2012(6): 51-55.
[6] RADULOVICI A E, ARCHAMBAULT P, DUFRESNE F. DNA barcodes for marine biodiversity: Moving fast forward[J]. Diversity, 2010, 2(4): 450-472.
[7] 李忠炉. 北部湾口海域细鳞鯻渔业生物学特性及开发保护策略初步研究[D]. 湛江:广东海洋大学, 2008. LI Z L.Preliminary study on fishery biology and exploitation-protection strategies of Therapon jarbua in the mouth of Beibu Gulf[D]. Zhanjiang:Journal of Guangdong Ocean University, 2008.
[8] WARD R D, ZEMLAK T S, INNES B H,etal. DNA barcoding australia’s fish species[J]. Philosophical Transactions of the Royal Society of London Series B:Biological Science, 2005, 360(1462): 1847-1857.
[9] THOMAS JR.R C, WILLETTE.D A, CARPENTER K E,etal. Hidden diversity in sardines: Genetic and morphological evidence for cryptic species in the goldstripe sardinella, sardinella gibbosa (bleeker, 1849)[J]. PLoS One, 2014, 9(1): e84719.
[10] LARA A, PONCE DE LEON J L, RODRIGUEZ R,etal. DNA barcoding of cuban freshwater fishes: Evidence for cryptic species and taxonomic conflicts[J]. Molecular Ecological Resource, 2010, 10(3): 421-430.
[12] GOLANI D, APPELBAUM-GOLANI B. First record of the indo-pacific fish the jarbua terapon (terapon jarbua) (osteichthyes: Terapontidae) in the mediterranean with remarks on the wide geographical distribution of this species[J]. Scientia Marina, 2010, 74(4): 717-720.
[13] AHMED Q, BAT L, YOUSUF F. Heavy metals inTeraponPuta(cuvier, 1829) from karachi coasts, pakistan[J]. Journal of Marine Biology, 2015, 2015: 1-5.
[14] DAVIS A, PUSEY B. Trophic polymorphism and water clarity in northern Australian Scortum (pisces: Terapontidae)[J]. Ecology Freshwater Fish, 2010(19): 638-643.
[15] DAVIS A, PEARSON R, PUSEY B,etal. Trophic ecology of northern australia’s terapontids: Ontogenetic dietary shifts and feeding classification[J]. Journay of Fish Biology, 2011(78): 265-286.
[16] 成庆泰.中国鱼类系统检索[M].北京: 科学出版社, 1987. CHENG Q T. Systematic synopsis of Chinese fishes[M].Beijing: Science Press,1987.
[17] 沈世杰.台湾鱼类检索[M].北京: 南天书局, 1986. SHEN S J.Systematic Synopsis of Taiwanese Fishes. [M].Beijing: SMC Publishing, 1986.
[18] BEDDOW T A, ROSS L G. Predicting biomass of atlantic salmon from morphometric lateral measurements[J]. Journal of Fish Biology, 1996, 49(3): 469-482.
[19] 乐小亮, 章 群, 赵 爽,等. 一种高效快速的鱼类标本基因组DNA提取方法[J]. 生物技术通报, 2010(2): 202-204. LE X L, ZHANG Q,ZHAO S,etal.A fast efficient method for isolation of genomic DNA from fish specimens[J].Biotechnology Bulletin, 2010(2): 202-204.
[20] KUMAR S. Molecular clocks: Four decades of evolution[J]. Nature Reviews Genetics, 2005, 6(8): 654-662.
[21] 薛 丹, 章 群, 郜星晨,等.基于线粒体控制区序列的南海北部近岸鯻的遗传多样性[J]. 中国水产科学, 2015(4): 749-756. XUE D, ZHANG Q, GAO X Cetal. Genetic variation ofTherapontherapsin coastal waters of northern South China Sea based on mtDNA control region sequences[J]. Journal of Fishery Sciences of China, 2015(4): 749-756.
[22] PUILLANDRE N, LAMBERT A, BROUILLET S,etal. Abgd, automatic barcode gap discovery for primary species delimitation[J]. Molecular Ecology, 2012, 21(8): 1864-1877.
[23] HEBERT P D N, STOECKLE M Y, ZEMLAK T S,etal. Identification of birds through DNA barcodes[J]. Plos Biology, 2004, 2(10): 1657-1663.
[24] ZEMLAK T S, WARD R D, CONNELL A D,etal. DNA barcoding reveals overlooked marine fishes[J]. Molecular Ecological Resource, 2009(9): 237-242.
[25] HEBERT P D, RATNASINGHAM S, DEWAARD J R. Barcoding animal life: Cytochrome c oxidase subunit 1 divergences among closely related species[J]. Proceedings of the Royal Society of London Series B: Biological Sciences, 2003, 270 (1): 96-99.
[26] GONZ LEZ-WANG EMERT M, PÉREZ-RUZAFA, GARC A-CHARTON J A,etal. Genetic differentiation and gene flow of two sparidae subspecies,DiplodussargussargusandDiplodussarguscadenatiin Atlantic and south-west Mediterranean populations[J]. Biological Journal of the Linnean Society, 2006, 89(4): 705-717.
[27] HAIG S M, BEEVER E A, CHAMBERS S M,etal. Taxonomic considerations in listing subspecies under the U.S. Endangered species act[J]. Conservation Biology, 2006, 20(6): 1584-1594.
[28] MENEZES M R, AROLKAR U V. Genetic relationships among five nemipterid fish species from the indian coast using allozyme analysis[J]. Journal of Fish Biology, 2002, 60(5): 1326-1330.
[29] GOLANI D, FRICKE R, TIKOCHINSKI Y. Rehabilitation ofSillagoerythraeacuvier, and redescription ofSillagosihama(forsskål) (teleostei: Sillaginidae) from the red sea[J]. Stuttgarter Beiträge zur Naturkunde A,2011,30 (4): 465-471.
[30] KIMURA S, GOLANI D, IWATSUKI Y,etal. Redescriptions of the indo-pacific atherinid fishesAtherinomorusforskalii,Atherinomoruslacunosus, andAtherinomoruspinguis[J]. Ichthyological Research, 2007, 54(2): 145-159.
[31] BUCCIARELLI G, GOLANI D, BERNARDI G. Genetic cryptic species as biological invaders: The case of a lessepsian fish migrant, the hardyhead silversideAtherinomoruslacunosus[J]. Journal of Experimental Marine Biology & Ecology, 2002, 273(2): 143-149.
[32] GOLANI D. The biology of the red sea migrant, saurida undosquamis in the mediterranean and comparison with the indigenous confamilialSynodussaurus(teleostei: Synodontidae)[J]. Hydrobiologia, 1993, 271(2): 109-117.
[33] MCNAMARA M K, MILLER T L, CRIBB T H. Evidence for extensive cryptic speciation in trematodes of butterflyfishes (chaetodontidae) of the tropical Indo-West Pacific[J]. International Journal for Parasitology, 2014, 44(1): 37-48.
[34] 宁 平. 中国金线鱼科鱼类分类、系统发育及动物地理学研究[D]. 北京:中国科学院研究生院, 2012. Ning P.Taxonomy, molecular phylogeny and zoogeography of the family nemipteridae (Pisces: Perciformes) in China Seas[D].Beijing:Graduate University of Chinese Academy of Sciences, 2012.
[35] ELLIOTT N G, WARD R D. Genetic relationships of eight species of pacific tunas (teleostei: Scombridae) inferred from allozyme analysis[J]. Marine & Freshwater Research, 1995, 46(7): 1021-1032.
[36] STEINKE D, ZEMLAK T S, BOUTILLIER J A,etal. DNA barcoding of pacific canada’s fishes[J]. Marine Biology, 2009, 156(12): 2641-2647.
DNA barcoding of Terapontidae and taxonomic status of a new record ofTeraponputain costal waters of China
CHEN Lu, HUANG Bo-yan, XUE Dan, LV Jin-lei, YANG Xi-shu, ZHANG Qun
(InstituteofHydrobiology,JinanUniversity;EngineeringResearchCenterofTropicalandSubtropicalAquaticEngineering,MinistryofEducation;Guangzhou510632,China)
Terapontidae is a common economic fish,widely distributed in Indo-western Pacific.Due to the low interspecific variability and a degree of intraspecific differences, the accurate identification of Terapontidae is hardly achieved only by the external morphological charaters. To clarify the classification of Terapontid found in the coastal waters of China, all the putative species were subjected to the morphometric and molecular analysis. The 5' end ofCOI sequence(652 bp)from 62 terapontid individuals were sequenced, combined with 9Teraponputasequences from 3 sites in Indian Ocean and Mediterranean Sea downloaded from GenBank and BOLD as references. The results suggested thatT.putawas a new record in China, and the specimen was kept in the department of Ecology, Jinan University. The interspecific genetic distances [18.34%(15.9%-20.1%]) were 23.93 times greater than the intraspecific distances [0.72%(0.1%-2.7%)], indicating a clear barcoding gap between them. 5 terapontid species each could be independently divided into 5 monophyletic clades based on Kimura-2-parameters in the phylogenetic tree. Of whichT.putacould be further divided into 2 independent geographically-defined lineages: Western Pacific, and Indian-Mediterranean. As interlineage genetic distances [5%(0.2%-5.6%)] are 4.88 times greater than the intralineage distances {0. 85% [lineage A was 0.6% (0-1.7%)], lineage B was 1.1% (0.2%-5.6%)} inT.puta, which was slightly lower than the interspecific/intraspecific ratios, but a much higher than the intraspecific genetic distances (2%) for most species. Moreover, there are some visible morphological differences between the lineages ofT.putasuch as: body elongate and flat or thickening lateral, anal fin with faint scattered spots or not, dorsal fin with the black spots located between the third to the sixth or seventh to eighth spines or not, upper head to the front part of dorsal fin with or without bluish grey or yellowish-green lustre and the backside of body colored with light gray or brown. Overall, summaries of morphological measurements and molecular analyses suggested that the 2 lineages ofT.putamight belong to 2 subspecies or even 2 species. However, the insufficient sampling size, limited sampling area and the only maternal genetic data bring incomplete information in this study. So the species status identification work demands the further morphological and nuclear genetic studies based on more individual samplers from wider range of species.
Terapontidae;Teraponputa; DNA barcoding; morphomeristic taxonomy
1004-2490(2017)02-0121-10
2016-08-12
国家自然科学基金项目(41071034);中央高校基本科研业务费专项资金项目(21613105);欧盟 Erasmus Mundus TECHNOI博士后交流项目
陈 璐(1989-),女,广东湛江人,硕士研究生,从事生物化学与分子生物学研究。 E-mail:vic198987@gmail.com
章 群,副研究员。E-mail:tqzhang@jnu.edu.cn
Q 349
A
