优势醋酸菌株的筛选鉴定及乙醇脱氢酶活性研究
2017-06-01张霁红李明泽曾朝珍康三江张海燕张永茂
张霁红,李明泽,曾朝珍,康三江,张海燕,张永茂*
(甘肃省农业科学院农产品贮藏加工研究所,甘肃兰州730070)
优势醋酸菌株的筛选鉴定及乙醇脱氢酶活性研究
张霁红,李明泽,曾朝珍,康三江,张海燕,张永茂*
(甘肃省农业科学院农产品贮藏加工研究所,甘肃兰州730070)
为满足苹果醋液态深层发酵的需要,从果渣、泥土中选育出生长良好、遗传稳定的较优醋酸菌株,实现高效率、高产量的苹果醋中试生产。经初筛、复筛、产酸试验、遗传稳定性试验、生理生化试验和16S rDNA序列分析鉴定,优选菌株Y010鉴定为巴氏醋酸杆菌(Acetobacter pasteurianus)。进一步研究该菌株在苹果醋发酵过程中乙醇脱氢酶(ADH)活性与产酸量、产酸速率的关系。结果表明:该菌株在醋酸发酵48 h时酶活较高,达到4.62 U/mL,产酸速率最大达到0.51 g/(L·h),发酵120 h总酸含量最高达到53.12 g/L,其ADH酶活与产酸速率变化趋势一致。
醋酸菌属;筛选;16S rDNA;醇脱氢酶;产酸速率

ZHANG Jihong,LI Mingze,ZENG Chaozhen,KANG Sanjiang,ZHANG Haiyan,ZHANG Yongmao*
(Agricultural Product Storage and Processing Institute,Gansu Academy of Agricultural Sciences,Lanzhou 730070,China)
果醋发酵过程中菌种是影响品质的重要因素之一[1]。现代工业采用液态深层发酵,常用醋酸菌株为食醋菌种巴氏醋酸杆菌(Acetobacter pasteurianus)AS1.41和沪酿1.01巴氏醋酸杆菌(Acetobacterpasteurianus),不仅产酸能力低、酒精耐受力差,而且发酵果醋形成的风味不佳,同时,醋酸菌易变异、死亡,不易保存,优良的果醋发酵菌种很难实现工业化[2-3]。目前,醋酸菌的筛选、驯化多采用传统的分离培养和分子生物学重组技术,特别是在果醋专用醋酸菌种筛选方面,研究较多,但达到市场化、工业化的菌种却很少[4-5]。张蕾等[6]对处于对数期的醋酸菌株C1-0进行紫外线诱变,获得三株高产醋酸的醋酸菌株C1-11、C1-27、C1-30,比初始菌株C1-0产酸量分别提高4.5%、8.6%、2.6%,且遗传稳定性较好。邓洪钧等[7]从醋醅中筛选具有较好耐温特性的醋酸菌WL021-1,并且通过常温等离子体诱变,使得发酵周期缩短约7h,发酵效率提高约10%。TRECKJ等[8]研究表明,耐高酸醋酸菌的乙醇脱氢酶(alcohol dehydrogenase,ADH)活力远高于低浓度生长产酸的菌株。NAKANO S等[9]利用基因工程技术分离出醋酸菌中主要由乙酸诱导合成的AatA蛋白质,过量表达的AatA蛋白质使醋酸菌细胞内的醋酸浓度维持在较低水平,有效提高了菌株的耐酸性和产酸速率。
本研究从果园泥土、腐烂苹果中分离筛选优良醋酸菌株,在初筛、复筛等传统醋酸菌种筛选方法基础上,结合生理生化试验及16SrDNA鉴定确定优选菌株的种属。并进一步研究该菌株在苹果醋醋酸发酵过程中乙醇脱氢酶(ADH)活性以及其与醋酸菌株产酸能力的关系,希望得到酶活力较高、遗传稳定性好、产酸能力较高的菌株,为苹果醋工业化生产中优良醋酸菌株的选育提供理论依据[10]。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种来源及实验材料
醋酸菌株CICC20056、CICC 7009:中国微生物菌种保藏中心;沪酿1.01:上海市酿造科学研究所。土壤样品取自甘肃省庆阳市西峰区仕社村苹果园树冠下0~20 cm处,腐烂苹果随机取样于甘肃省庆阳市西峰区仕社村苹果园自然下落的腐烂苹果。
1.1.2 主要试剂
无水乙醇、碳酸钙、氯化铁、氢氧化钠、铁氰化钾、硫酸铁、十二烷基磺酸钠、葡萄糖、磷酸氢二钠、磷酸二氢钠、柠檬酸、磷酸等(均为分析纯):天津市光复科技发展有限公司;酵母膏、琼脂(均为生化试剂):北京奥博星生物技术有限公司;Triton X-100:北京拜尔迪生物技术公司。
1.1.3 培养基
基础培养基:葡萄糖10 g/L,酵母粉10 g/L,灭菌后冷却至50℃,加入体积分数为3%的无水乙醇。
分离培养基:葡萄糖10 g/L,酵母粉10 g/L,琼脂18 g/L,碳酸钙15 g/L,无水乙醇体积分数3%。
斜面保藏培养基:葡萄糖10 g/L,酵母粉10 g/L,琼脂18 g/L,碳酸钙10 g/L,无水乙醇体积分数3%。
种子培养基:葡萄糖10 g/L,酵母粉15 g/L,磷酸二氢钾0.5 g/L,硫酸镁0.5 g/L,pH 6.5。
产酸培养基:葡萄糖10 g/L,酵母粉15 g/L,经灭菌冷却后加入体积分数7%无水乙醇,分装至250 mL三角瓶,每瓶30mL。
分离培养基和斜面保藏培养基经过165℃、30 min干热灭菌,待温度降至70℃时加入碳酸钙和无水乙醇。其他培养基121℃,20 min高压灭菌,4℃保存备用。
1.2 仪器与设备
BSA224S-CW电子天平:赛多利斯科学仪器(北京)有限公司;ZHJH-C1112B超净工作台、ZWY-2102恒温培养振荡器:上海智城分析仪器制造有限公司;LRH-250生化培养箱:上海一恒科学仪器有限公司;TGL-16MC冷冻离心机:长沙维尔康湘鹰离心机有限公司;HH-S4电热恒温水浴锅:北京科伟永兴仪器有限公司;UV2400紫外可见分光光度计:上海舜宇恒平科学仪器有限公司。
1.3 实验方法
1.3.1 菌株筛选步骤[11]
(1)初筛
称取10.0 g土样或腐烂苹果样,置于90.0 mL带有玻璃珠的无菌水中,摇床振荡30 min,取1.0 mL菌液至基础培养基(装液量30 mL/250 mL),30℃、200 r/min条件下富集培养48h后,取出增值液用无菌水稀释至10-5、10-6、10-7浓度,取各浓度稀释液0.2mL,涂布法接种于分离培养基上,30℃恒温培养72 h后,挑选透明圈较大的菌落纯化后转接于斜面培养基上培养保存。对保存后的单菌落菌株在碳酸钙平板培养基上进一步分离,根据其透明圈直径与菌落直径之比的HC值(HC=透明圈直径/菌落直径)大小进行初筛。
(2)复筛
将初筛菌种分别接种于产酸培养基上,每株3次重复,在30℃静置恒温培养120 h后,测定总酸产量(以乙酸计)并比较。
(3)优选菌株驯化试验
将优选出的菌株分别接种于酒精含量为6%vol的苹果酒中进行醋酸发酵,发酵温度30℃、150 r/min,分别振荡培养1 d、2 d、3 d、4 d、5 d、6 d、7 d,每天取样检测其醋酸产量,从中筛选出产酸性能良好的醋酸菌。
(4)遗传稳定性试验
将筛选出的醋酸菌株进行传代培养(传4代),每一代活化后二级种子液接种于酒精含量为6%vol的苹果酒中进行醋酸发酵,30℃、150r/min振荡培养6d,测定醋酸产量,并观察每次传代后菌株的菌落特征、个体形态特征、以及在苹果酒中的产酸量和变化。
1.3.2 菌株鉴定
(1)生理生化鉴定:参见张纪忠的《微生物分类学》[12]和周德庆的《微生物学教程》[13]。
(2)16S rDNA鉴定[14]
纯种菌株Y010转接于斜面送工业微生物菌种保藏中心进行16SrDNA鉴定,检测方法参考“细菌16S rDNA检测方法”。鉴定用细菌基因组DNA抽提试剂盒提取目标菌株Y010的总DNA,然后用设计合成的通用引物和高保真DNA聚合酶进行聚合酶链式反应(polymerasechainreaction,PCR)扩增,扩增产物进行DNA测序,并与数据库中已知细菌比较获得样品种属信息,选取近似菌种序列,构建系统发育树。
1.3.3 乙醇脱氢酶活性研究
(1)粗酶液制备[15]
取相应时间的发酵液(100 mL),于4℃,8 000 r/min条件下离心10 min,用50 mmol/L(pH 5.8)的磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2次,然后重新悬浮于该缓冲液中(0.1 g湿菌体/3 mL PBS),在冰浴下进行超声破碎,超声功率240 W,破碎30 s暂停30 s,总时间10 min,破碎液作为粗酶液待用。
(2)乙醇脱氢酶(ADH)活性的测定[16]
ADH酶活的测定:参照WOOD氏法[11],取0.5 mL Mcllvaine缓冲液(pH 4.0),1.0 mol/L乙醇(乙醛)溶液0.1 mL,粗酶液0.1 mL,6%Triton X-100 0.1 mL于10 mL比色管中,25℃保温5 min后加入0.1 mol/L铁氰化钾溶液0.2 mL,在25℃条件下放置反应5 min(同时做空白对照),然后加入硫酸铁-Dupanol溶液0.5 mL终止反应,25℃下放置20 min,加入3.5 mL蒸馏水混合后,用紫外可见分光光度计测定波长660 nm条件下的光密度值。以25℃、pH 4.0条件下,1 min氧化1 μmol乙醇的酶量为1个酶活力单位;4.0光密度值等
于氧化1 μmol乙醇。
酶活性(U/mL)=A660nm×1/4 ×1/5 ×1/酶液(mL)×稀释倍数1.3.4指标测定及计算方法
总酸(以乙酸含量计)测定:采用酸碱滴定法;酒精含量测定:蒸馏瓶法。
醋酸产量(g/L)=[(CNaOH×V)/2] ×60
式中:CNaOH表示滴定的NaOH浓度,mol/L;V表示消耗NaOH的体积,mL;2表示取样量,mL;60为乙酸摩尔质量,g/mol。
产酸速率=Δ产酸量(g/L)/Δh

2 结果与分析
2.1 菌株分离纯化初筛结果
经过富集培养、分离纯化和产酸定性试验,共获得20个单菌株。从腐烂苹果中分离筛选出10个菌株编号为X001~X010,从苹果园泥土中分离筛选出10个菌株编号为Y001~Y010,其HC值如表1所示。
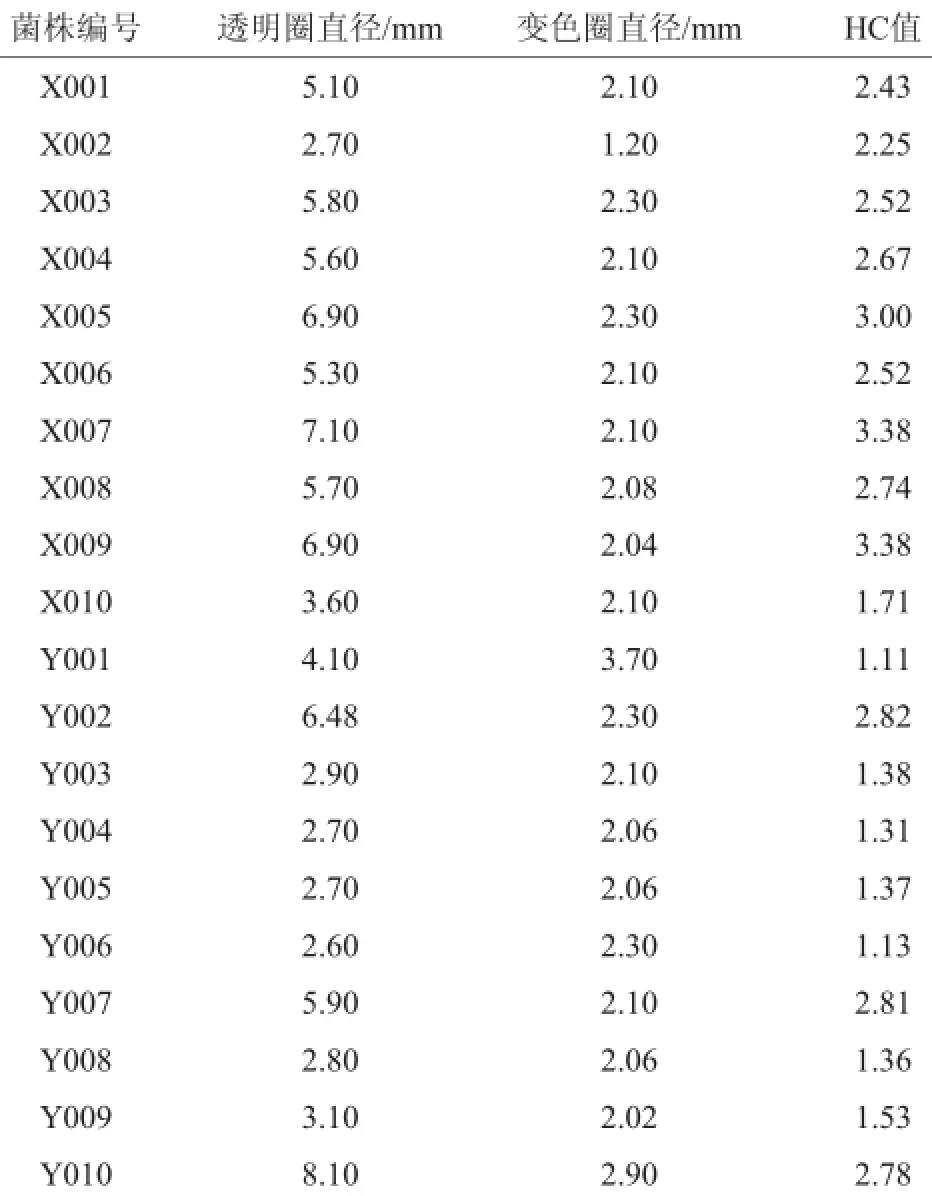
表1 菌株初筛结果Table 1 Preliminary screening results of strains
根据其变色圈直径与菌落直径之比的HC值大小,对形态一致的单菌落进行初筛,由表1中可知,菌株X004、X005、X007、X008、X009、Y010、Y002、Y004的HC值较大,其值范围在2.67~3.38。
2.2 复筛结果
对初筛出的菌株X004、X005、X007、X008、X009、Y010、Y002、Y004进一步进行产酸试验复筛,以菌株沪酿1.01、7009、20056为对照,其结果如图1所示。

图1 各菌株总酸产量Fig.1 Total acid production of different strains
由图1可知,菌株Y010、X004、X009的产酸量相对较高,其产酸量分别为40.12 g/L、35.48 g/L、35.02 g/L,其中菌株Y010的产酸量高于对照菌株(其中沪酿1.01为39.12 g/L,7009为38.26g/L,20056为35.56g/L)。因此菌株Y010、X004、X009为优选菌株。
2.3 优选菌株驯化试验结果
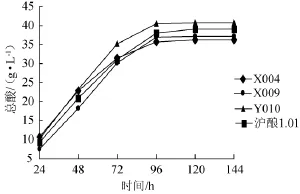
图2 优选菌株发酵过程中醋酸产量变化Fig.2 Acetic acid production change of the dominate strains in fermentation process
由图2可知,在整个发酵过程中,醋酸产量随时间延长呈增大趋势,发酵前96 h醋酸产量迅速增加,96 h后醋酸产量增长速度减慢,但总体酸含量增加。菌株Y010从发酵48 h后产酸速率和产酸量增加幅度大于菌株X004、X009和对照菌株沪酿1.01,故优选菌株在苹果醋发酵液中产酸量较高,可作为苹果醋发酵菌株进一步研究。
2.4 遗传稳定性试验结果
优选菌株Y010、X009、Y010以及对照菌株1.01在苹果醋醋酸发酵中连续培养4代后,产酸量结果如下(每代相同条件下培养第6天测总酸含量)。
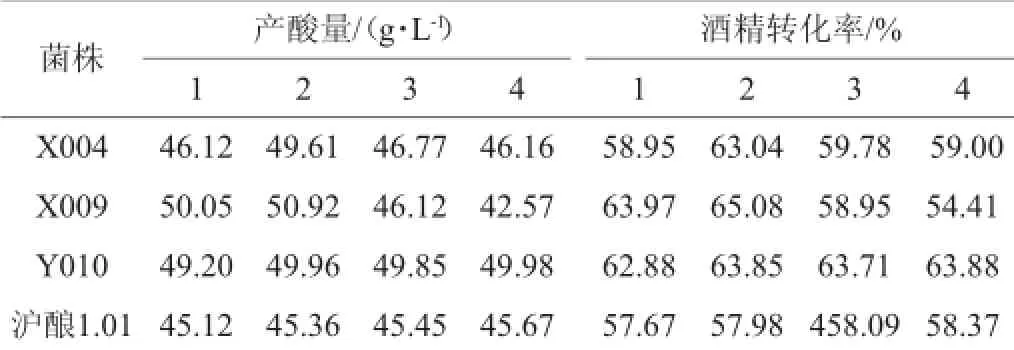
表2 连续培养4代后的稳定性Table 2 Stability of continuous culture of four generations
由表2可知,经4代遗传稳定性培养后,菌株X004、X009产酸量和酒精转化率都呈现先上升后下降的趋势,只有菌株Y010产酸量和酒精转化率随传代次数的递增呈微上升趋势,整个变幅在1%内,且产酸量和酒精转化率大于对照菌株,表明其遗传稳定性良好,产酸量较高。
2.5 菌种鉴定
2.5.1 细胞形态、菌落形态
优选菌株Y010的电镜扫描图及在平板上的钙溶圈分别见图3和图4。

图3 优选菌株Y010电镜扫描图Fig.3 Electron micrographs of the dominate strain Y010

图4 优选菌株Y010在平板上的钙溶圈Fig.4 Dissolved calcium circle of dominate strain Y010 on the tablet
由图3和图4可知,优选菌株Y010菌落圆形,表面湿润光滑、边缘整齐、小凸起、碳酸钙溶解圈明显,细胞形态G-,菌体呈短杆状,无芽孢,(0.8~1.0)μm×(1.5~2.5)μm,单个或成堆排列,有黏液物质分布。
2.5.2 生理生化特征
对菌株Y010进行生理生化试验,测定结果见表3。

表3 菌株Y010生理生化试验测定结果Table 3 Determination results of physiological and biochemical test of strain Y010
由表3可知,其生理生化试验结果与伯杰细菌手册中醋杆菌属中巴氏醋酸杆菌的生理生化特征相近[17]。
2.5.3 16S rDNA鉴定
所得16S rDNA序列在NGBI网站经序列对比,挑选与之有较高同源性的菌株16S rDNA序列,采用MEGA5.0软件,邻位连接法显示菌株产酸细菌与相关种的16S rDNA序列系统发育树,进行1 000次的相似度重复计算,图中发育树节点只显示Bootstrap值>50%,上标的“T”表示模式菌株,菌株的系统发育树结果见图5。

图5 细菌Y010的16S rDNA序列系统发育树Fig.5 Phylogenetic tree of strain Y010 based on 16S rDNA gene sequence
由图5可知,在系统发育树上产酸菌株Y010与醋酸杆菌(Acetobacter pasteurianussubsp.pasteurianusLMG 1262T(BACG01000075)非常接近,16S rDNA序列相似性高达100%。再结合菌落形态特征、个体形态特征、生理生化鉴定,参考《常见细菌系统鉴定手册》[18]及《伯杰细菌鉴定手册》鉴定菌株。确定出产酸菌株Y010为醋杆菌属(Acetobacter sp.)巴氏醋酸杆菌(Acetobacter pasteurianus),可作为苹果醋发酵专用菌种进一步研究。
2.6 醋酸发酵过程中乙醇脱氢酶酶活与产酸量、产酸速率之间的关系
2.6.1 乙醇脱氢酶酶活与产酸量的关系
优选菌株Y010在苹果醋发酵过程中ADH酶活和产酸量的关系,结果如图6所示。由图6可知,当菌液培养48 h时,ADH酶活和产酸总量均随着培养时间的延长而逐渐上升,即ADH酶活和产酸总量呈正相关;但是,当菌液培养48 h后,ADH酶活随着培养时间的延长却逐渐下降,而产酸总量随着培养时间的延长而逐渐上升,这是因为产酸量是一个逐步积累的过程,在整个发酵过程中产酸量逐渐增大,最大达到53.12 g/L。
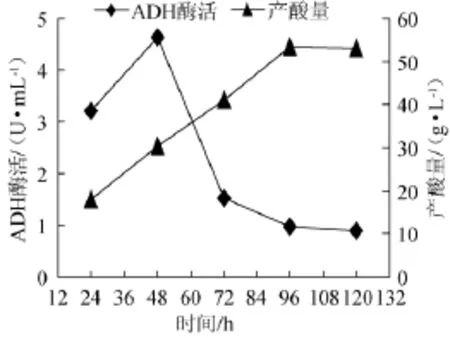
图6 优选菌株Y010醋酸发酵过程中ADH酶活、产酸量变化曲线Fig.6 Change curve of ADH activity and total acid production of the dominate strain Y010 in fermentation process
2.6.2 乙醇脱氢酶酶活与产酸速率的关系
乙醇脱氢酶是醋酸杆菌氧化产醋酸的关键酶,在醋酸发酵过程中ADH酶活和产酸速率如表4所示。由表4可知,乙醇脱氢酶ADH酶活与产酸速率变化趋势相一致,48h时,ADH酶活最大达到4.62 U/mL,此时,产酸速率也最大达到0.51 g/(L·h),故ADH酶活越高,产酸越快。故ADH酶活和产酸速率可作为优良醋酸菌选育的依据。

表4 优选菌株Y010醋酸发酵过程中ADH酶活和产酸速率Table 4 Relationship between ADH activity and acid yield of the dominate strain Y010 in fermentation process
3 结论
巴氏醋酸杆菌(Acetobacter pasteurianus)广泛存在于水果、蔬菜、醋和饮料中,具有醋杆菌属的特性,适于果醋发酵。本研究从腐烂苹果、果园泥土中分离、筛选适合苹果醋发酵的较优醋酸菌,采用传统的菌株筛选方法,经初筛、复筛、产酸实验、遗传稳定性实验、生理生化试验以及16S rDNA鉴定结果,初步确定出优选菌株Y010为巴氏醋酸杆菌(Acetobacter pasteurianus),为工业菌株的筛选和鉴别菌株性能优劣提供重要参考依据。
通过进一步研究优选菌株Y010在苹果醋发酵过程中,其ADH酶活与产酸速率、产酸浓度之间的关系,得到在醋酸发酵体系中ADH酶活和产酸速率呈现出较高的一致性,酶活越高产酸速率越大。发酵48 h时,菌体Y010生长活跃,ADH酶活最大,达到4.62 U/mL,产酸速率最快达到0.51 g/(L·h)。而产酸量随着发酵时间延长逐渐增大,120 h最大达到53.12 g/L。
[1]YAMADA Y,YUKPHAN P.Genera and species in acetic acid bacteria [J].Int J Food Microbiol,2008,125:15-24.
[2]陈伟.优质醋酸菌的选育、苹果醋酸发酵规律及酶活影响的研究[D].泰安:山东农业大学,2001.
[3]KANCHNARACH W,THEERAGOOL G,INOUE T,et al.Acetic acid fermentation ofAcetobacter pasteurianus:relationship between acetic acid resistance and pellicle polysaccharide formation[J].Biosci Biotech Biochem,2010,74(8):1591-1597.
[4]张忠明.高产醋酸菌的筛选及其形态生化特征研究[J].甘肃农业大学学报,2006,41(6):83-86.
[5]王金丹,张宝善,李亚武,等.醋酸菌耐酸机制的研究进展[J].中国酿造,2014,33(11):10-14.
[6]张蕾,郭龙,傅力.紫外线诱变选育高产醋酸的醋酸菌研究[J].新疆农业科学,2012,49(6):1120-1126.
[7]邓洪钧,白晓磊,方昕,等.常温等离子体诱变选育醋酸发酵菌株[J].安徽农业科学,2015,43(32):121-124.
[8]TRECK J,TOYAMA H,CZUBA J,et al.Correlation between acetic acid resistance and characteristics of PQQ-dependent ADH in acetic acid bacteria[J].Appl Microb Cell Physiol,2006,70(3):366-373.
[9]NAKANO S,FUKAYA M,HORINOUCHI S.Putative ABC transporter responsible for acetic acid resistance inAcetobacter aceti[J].Appl Environ Microbiol,2006,72(1):497-505.
[10]陈洋,高冰,汪超,等.巴氏醋酸杆菌AS1.41产醋酸关键酶研究[J].中国酿造,2016,35(1):38-42.
[11]刘绍军.食品微生物学实验技术[M].北京:中国农业科技出版社,2000:12-14.
[12]张纪忠.微生物分类学[M].上海:复旦大学出版社,1990:12.
[13]周德庆.微生物学教程[M].北京:高等教育出版社,1993:249.
[14]WILAWAN S.Characterization of acetic acid adapted strains and analysis of alcohol dehydrogenase genes from acetobacter syzy SKU19[D]. Bangkok:Kasetsart University,2008.
[15]宋娟,胡生海,李明泽,等.苹果醋优势醋酸菌株的诱变选育[J].中国酿造,2016,35(7):40-44.
[16]周秉辰.食醋生产中醋酸菌乙醇脱氢酶的活性与产酸速率关系的研究[J].中国酿造,2009,28(11):58-60.
[17]R.E,布坎南,N.E,吉本斯.伯杰细菌鉴定手册[M].北京:科学出版社,1984:362-365.
[18]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:21-32.
TS264.2
0254-5071(2017)05-0100-05
10.11882/j.issn.0254-5071.2017.05.021
2016-11-16
国家自然科学基金地区基金项目(31460449);甘肃省农牧厅生物技术专项(GNSW-2013-31);现代农业产业技术体系建设专项资金资助(CARS-28)
张霁红(1977-),女,副研究员,硕士,研究方向为食品微生物。
*通讯作者:张永茂(1957-),男,研究员,本科,研究方向为果蔬加工。
