笃斯越橘酰化花青素稳定性分析
2017-06-01朱良玉周丽萍王化李梦莎张悦沈光
朱良玉,周丽萍,王化,李梦莎,张悦,沈光*
(黑龙江省科学院自然与生态研究所,黑龙江哈尔滨150040)
笃斯越橘酰化花青素稳定性分析
朱良玉,周丽萍,王化,李梦莎,张悦,沈光*
(黑龙江省科学院自然与生态研究所,黑龙江哈尔滨150040)
采用分光光度法,通过多梯度、多组合系列试验,对光照、温度、金属离子、氧化剂、还原剂等因素下的笃斯越橘酰化花青素和笃斯越橘花青素的稳定性进行比较分析。研究表明,与未酰化的花青素相比,酰化花青素耐光性提高,各种环境里的抗色素分解能力增加。Fe2+、Fe3+、Cu2+对无论酰化与否的花青素都会产生不同程度的不利影响,在色素应用过程中(加工、保存及运输)应避免与其接触。结果证明,笃斯越橘酰化花青素稳定性优于未经修饰的花青素,有较高的开发应用和研究价值。
笃斯越橘;花青素;酰化修饰;稳定性

ZHU Liangyu,ZHOU Liping,WANG Hua,LI Mengsha,ZHANG Yue,SHEN Guang*
(Institute of Natural Resources and Ecology,Heilongjiang Academy of Sciences,Harbin 150040,China)
笃斯越橘(Vaccinium uliginosumLinn.)是我国野生蓝莓品种,其富含的花青素是一种天然食用色素,具有抗氧化活性,清除自由基,延缓衰老等功效,有极高的研究开发价值[1-3]。但是由于花青素自身的不稳定特性,限制了其应用范围,降低了花青素在加工和使用过程中的利用率[4-6]。
影响花青素稳定性的原因是花青素的化学结构和其高活性。一般情况下,甲基化程度提高可使其稳定性增加,羟基化程度提高会使其稳定性下降[7]。温度、pH、光、金属离子、抗坏血酸、糖及其降解产物等因素也会对其产生影响[8]。因此,贮藏加工方式不同对花青素稳定性产生不同影响。通常情况下,天然色素在低温或干燥状态时较稳定,加热或高温可加快变色反应[9-12]。金属离子也对花青素稳定性产生影响。杨万政等[13]研究玫瑰花红色素的稳定性时发现,Fe3+引起色素溶液变黑。杜连启等[14]研究紫甘薯色素稳定性的结果表明,Cu2+、Zn2+、Fe3+等离子在一定程度上影响色素的稳定性,放置时间越长,吸光度值越小。
已有研究表明,酰化花色苷相对来说具有较高的稳定性[15],GIUSTI M M等[16]用肉桂酸和丙二酸酰化的花色苷在常温下可保存6个月。酰化花色苷对pH值的改变、温度和光照等均表现出较强的稳定性。张智等[6]研究酸对蓝靛果花色苷稳定性的影响结果表明,对羟基苯甲酸能显著提高蓝靛果花色苷的稳定性。
在前期试验中采用Novozym435脂肪酶法辅助软脂酸对笃斯越橘花青素进行化学修饰,通过吸光度值的改变来计算保存率作为评价指标。利用紫外、红外图谱扫检测验证其酰化。最终测得其保存率为87.40%,紫外图谱中花色苷在波长300~330 nm左右有吸收峰且可见光区最大吸收峰有右移,红外图谱中,在波数为1 650~1 750 cm-1之间有较强的红外吸收峰,推测该羰基基团应当与共轭基团相连,得到酰化后的花青素。以此为原料,探讨不同温度、光照、金属离子、氧化剂对酰化后花青素稳定性的影响,为花青素的酰化研究提供数据参考及理论依据。
1 材料与方法
1.1 材料与试剂
笃斯越橘:大兴安岭市售。
无水乙醇(分析纯)、过氧化氢(分析纯)、氯化钾、氯化钠、氯化钙、氯化镁、硫酸亚铁、氯化铁、硫酸铜:天津市科密欧化学试剂有限公司;亚硫酸钠(分析纯):北京化工厂。
1.2 仪器与设备
DK-98-11A恒温水浴锅:天津市泰斯特仪器有限公司;LGJ-18冷冻干燥机:北京松源华兴科技发展有限公司;FA2004电子分析天平:上海天平仪器厂;DZF-6053真空干燥箱:上海恒科技有限公司;Re-52CS真空旋转蒸发仪:上海圣科仪器设备有限公司;PHS-3D精密pH计:上海精科仪器;ZD-85恒温震荡器:国华企业集团有限公司;UV-1700USA紫外分光光度计:天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 花青素的提取与酰化方法
笃斯越橘花青素的提取采用体积分数70%的乙醇,料液比1∶20(g∶mL),室温条件下浸提1 h后超声波提取30 min,超声温度35℃,超声功率100 W,过滤取上清液,在45℃条件下进行旋转蒸发浓缩,得到花青素的粗提液。大孔树脂X-5进行纯化,体积分数为70%乙醇洗脱,洗脱液旋转蒸发浓缩,冻干后得到酰化前的大兴安岭笃斯越橘花青素粉体。
选择软脂酸作为酰基供体,笃斯越橘花青素与软脂酸和Novozym435脂肪酶的质量比为1∶4∶1,反应pH4、时间4h、温度50℃,反应后冻干后得到酰化后的大兴安岭笃斯越橘花青素粉体。
分别量取1.00 g的酰化前后的大兴安岭笃斯越橘花青素粉体溶于1 000 mL的蒸馏水中,在紫外可见分光光度计下经250~700 nm全光谱扫描,确定未转化样品最大吸收波长531 nm为其检测波长。酰化后花青素检测波长为其最大吸收波长536 nm。调节酰化前后其吸光度值约为0.70,作为试验用样。
1.3.2 温度对花青素稳定性的影响
取酰化前用样和酰化后用样各300 mL,分装6份,每份50 mL,室内自然光照,分别置于50℃、60℃、70℃、80℃、90℃的恒温水浴锅中2h后于波长531nm和536nm处测量吸光度值,分析温度对花青素及其酰化后产物稳定性的影响。
1.3.3 光照对花青素稳定性的影响
采用的花青素材料同上,取样150 mL,分装3份,每份50mL,在室温条件下分别置于室内自然光照、日光灯(30W)照射和避光环境(实验台下背光柜橱中),每天定时测量各自最大吸收波长下的吸光度值,共观测49 d,分析光照对花青素及其酰化后产物稳定性的影响。
1.3.4 氧化剂和还原剂对花青素稳定性的影响
采用的花青素材料同上,取样100 mL,分装2份,每份50 mL,在室温自然光照条件下分别加入与样液1∶1体积的10%的过氧化氢溶液和亚硫酸钠溶液。分别隔1h、6h、12h、24h、48h测量各自最大吸收波长下的吸光度值,共测定5次,分析氧化剂和还原剂以及其浓度对花青素及其酰化后产物稳定性的影响。
1.3.5 金属离子对花青素稳定性的影响
采用的花青素材料同上,取样350 mL,分装7份,每份50 mL,在室温自然光照条件下分别加入与样液1∶1体积的0.10 mol/L的K+、Na+、Ca2+、Mg2+、Fe2+、Fe3+、Cu2+不同金属离子溶液。室温静置1 d,测量各自最大吸收波长下的吸光值,并观察溶液颜色变化,分析金属离子对花青素及其酰化后产物稳定性的影响。
以上实验均做3次平行,取其平均值做单因素分析。
2 结果与分析
2.1 温度因素下花青素酰化前后稳定性比较
温度对花青素酰化前后吸光度值的影响见图1。由图1可知,通过水浴锅加温实验,随着温度的升高,样品的吸光度值呈现降低的趋势,酰化花青素吸光度值整体上明显高于酰化前样品,尤其是当温度高于60℃以后,花青素样品的耐温性显著低于酰化物样品,说明酰化暂缓了花青素的降解,增强了花青素的稳定性,使其耐温性有所提高,仅从这一点上看,酰化花青素对于工业生产过程中的高温具有一定程度的耐受性。

图1 温度对花青素酰化前后吸光度值的影响Fig.1 Effect of temperature on the absorbance of anthocyanins before and after acylation
2.2 光照因素下花青素酰化前后稳定性比较
置于室内自然光照、日光灯直射和避光环境下的花青素在酰化前后的吸光度值随时间的变化见图2。
由图2可知,三种条件下都呈现随着时间的延长,吸光度值降低的趋势,即保存率逐渐降低。以上三种光环境下,3 d之内花青素酰化前后吸光值变化差别都不大,3 d之后两者吸光度值差别逐渐加大,且三种光环境条件下吸光度值差别显著,说明三种光环境对花青素吸光度的影响有明显区别。
三种光环境下处理84 d后花青素酰化前后吸光度值比较结果见表1。持续灯光和自然光照条件相比,持续灯光处理加速了花青素的降解,在84 d时酰化前后花青素的吸光度值分别是0.37和0.52,自然光条件84 d时,吸光度值分别是0.42和0.56,可见直射灯光比自然光更不利于花青素的保存;相比而言,避光环境有利于色素的稳定性,三种光环境下酰化物的光稳定性都优于未酰化产物,光照下从第14天开始,酰化产物的吸光度值明显高于未酰化物,说明酰化物光稳定性有了显著提高。避光保存下,1~14 d之间花青素吸光度值下降缓慢,酰化样略高于未酰化花青素,14 d后酰化样开始明显高于未酰化样。总体来看,酰化后花青素耐光性明显高于未酰化样品。
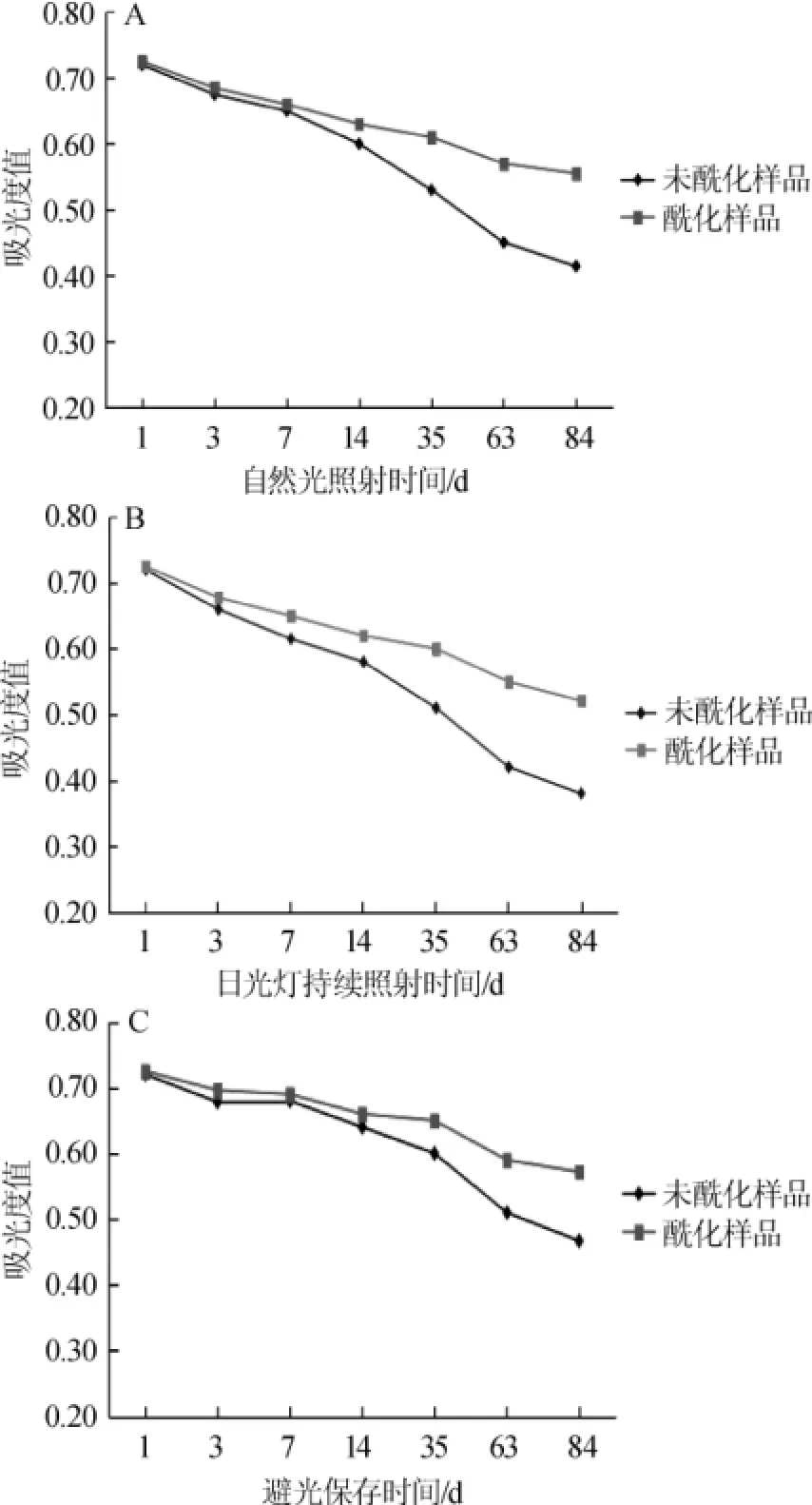
图2 自然光照(A)、日光灯(B)、避光环境(C)对花青素酰化前后吸光度值的影响Fig.2 Effects of natural light(A),fluorescent lamp(B)and dark environment(C)conditions on the absorbance value before and after anthocyanins acylation

表1 三种光环境下处理84 d对花青素酰化前后吸光度值的影响Table 1 Effect of three kinds of light treatments for 84 d on the absorbance value of anthocyanins before and after acylation
2.3 氧化剂和还原剂下花青素酰化前后稳定性比较
向体系中分别加入过氧化氢和亚硫酸钠,考察氧化剂和还原剂对花青素酰化前后吸光度值的影响,结果见图3。

图3 过氧化氢(A)和亚硫酸钠(B)对花青素酰化前后吸光度值的影响Fig.3 Effect of hydrogen peroxide(A)and sodium sulfite(B)on the absorbance value of anthocyanins before and after acylation
由图3A可知,酰化样品加入过氧化氢溶液在短时间内吸光度值增加,1 h后吸光度值随着时间的增加而逐渐减少;而未酰化样品在1 h内吸光度值快速下降至约0.20,然后随着时间的增加吸光度值减小速度过缓,直至48 h达到0.12左右。这说明就吸光度值而言酰化后花青素稳定性增加,适应性强,有着很好的抗氧化能力,对于提高花青素的稳定性有积极作用。
由图3B可知,花青素酰化吸光度值的变化趋势与加入过氧化氢一样,但变化幅度相对较小。不同的是未酰化样吸光度值在1 h时升高,随后急剧下降,酰化后花青素始终呈降低趋势。在48 h后,酰化前后花青素吸光度值逐渐趋于一致。原因可能是由于亚硫酸钠为强还原剂,具有漂白作用,与花青素反应生成络合物,降低了花青素溶液的吸光度值,酰化后的花青素对还原剂的耐性一般,并不高于未酰化后花青素。
2.4 金属离子因素下花青素酰化前后稳定性比较
七种金属离子的添加对花青素溶液吸光度值的影响见图4。酰化后花青素的吸光度相对于未酰化样品显著增加,但同时也产生了不同程度的絮状物,金属离子对花青素酰化前后颜色变化的影响结果见表2。

图4 金属离子对花青素酰化前后吸光度值的影响Fig.4 Effect of metal ions on the absorbance value of anthocyanins before and after acylation
由图4可知,加入金属离子后花青素酰化前后吸光度值明显增加,以加入Ca2+离子的溶液吸光度值增加的幅度最大,其次是Mg2+、K+、Na+、Fe2+。Fe3+和Cu2+的吸光度值相对增加较小。就吸光度值而言,酰化后花青素稳定性增加,对于提高花青素的稳定性有积极作用。但是添加金属离子使花青素稳定性产生影响还表现在花青素的颜色变化上,因此结合考察金属离子对花青素酰化前后颜色的影响。
由表2可知,加入金属离子后花青素酰化前后颜色变化比较,未酰化样品添加Fe2+溶液呈灰紫有黑色沉淀物,Fe3+添加溶液呈黄灰色有灰色沉淀物,添加Cu2+为无色,添加其他离子溶液澄清呈粉红色。酰化样品Fe2+添加后呈灰紫,Fe3+添加后呈金黄,Cu2+添加后呈浅粉,其他离子添加与未酰化样颜色一致。所有离子反应均产生絮状物,吸光度值明显高于未酰化样品。

表2 金属离子对花青素酰化前后溶液颜色的影响Table 2 Effect of metal ions on the solution color of anthocyanins before and after acylation
产生这样的原因是由于花青素本身含有多个酚羟基,易与金属离子络合,影响显色基团,产生不同程度的颜色变化。酰化后的花青素产生絮状物的原因,可能是因为酰化后与金属离子反应生成不溶性螯合物,这些螯合物或多或少影响了吸光度值的变化。总体来看花青素的稳定性都遭到了破坏。
Fe3+和Cu2+对无论酰化与否的花青素溶液结构状态都产生了不同程度的影响,但是对比反应后的颜色可知,酰化后的花青素颜色更深,特别是对于Cu2+的添加,反应物呈浅粉色,而未酰化产物为无色,这说明酰化花青素抗Cu2+能力增加,色素保存率提高,稳定性提高,这是酰化花青素优于未酰化花青素之处。
总的来看加入这7种金属离子,大部分未使花青素的颜色发生,最大波长下的吸光度值酰化后的花青素明显增加,但是有沉淀物生成,未酰化的花青素吸光度值减小,稳定性降低,因此对于K+、Na+、Ca2+、Mg2+、Fe2+、Fe3+、Cu2+这些金属离子,花青素在应用过程中(加工、保存及运输)应避免与其接触。对于Fe3+、Cu2+这2种金属离子,酰化花青素色素保存率相对提高,稳定性增加,如果解决反应物沉淀问题,将有更强的研究意义。
3 结论
试验采用分光光度法对笃斯越橘花青素的稳定性进行了分析研究。研究表明光照、温度、氧化剂和还原剂、金属离子等因素与花青素稳定性密切相关。
花青素的酰化提高了其耐温性、耐光性和各种环境里的抗色素分解能力。
花青素的稳定性在一定范围内与时间长短、温度高低呈反相关,酰化花青素在同样时间和同样温度下,稳定性高于未酰化花青素。当温度高于60℃以后,花青素吸光度值大幅度下降,与酰化样品吸光度值差别显著,即未酰化样品耐温性显著低于酰化样品,说明酰化使得其耐温性能有了很大的改良,对于工业生产过程中的高温具有一定程度的耐受性。
避光可以降低色素分解,持续灯光比自然光对花青素分解的影响较大,酰化花青素在同样光的环境中其稳定性高于未酰化花青素。
酰化花青素对氧化剂适应性强,有着很好的抗氧化能力,对于提高花青素的稳定性有积极作用,对还原剂的耐性一般,储存或应用应避免与还原剂接触。酰化后花青素与金属离子反应会生成絮状物或沉淀,其性质有待深入研究。
试验证明酰化提高了花青素的稳定性,其酰化物的稳定性比未酰化物明显优势;花青素物质应该低温避光保存;Fe2+、Fe3+和Cu2+对无论酰化与否的花青素都会产生不同程度的不利影响,在色素应用过程中(加工、保存及运输)应避免与其接触,其机理及其应用技术还需进一步研究。
[1]朱良玉,张悦.咖啡酸修饰笃斯越橘花色苷的实验分析[J].中国酿造,2015,34(3):130-132.
[2]胡济美,籍保平,周峰,等.大兴安岭笃斯越橘花色苷成分鉴定研究[J].食品科学,2009,30(10):239-241.
[3]WANG L,ALBERT N W,ZHANG H B.Temporal and spatial regulation of anthocyanin biosynthesis provide diverse flower colour intensities andpatterning inCymbidium orchid[J].Planta,2014,240(5):983-1002.
[4]周丽萍,朱良玉,张悦.北方主要越橘栽培品种果实品质及抗氧化能力比较[J].中国林副特产,2012,120(5):4-6.
[5]刘荣,冷梅,王振宇.三种浆果提取物体外抗氧化活性研究[J].食品工业科技,2012,33(11):71-75.
[6]张智,宋静,王振宇,等.辅色素对蓝靛果花色苷稳定性的影响[J].食品工业科技,2011,32(4):320-323.
[7]田小燕,邓洁红,位佳静,等.花色苷有机酸酰化及黄铜辅色研究进展[J].农产品加工,2012(11):126-130.
[8]MAZZA G,MINIATI E.Anthocyanins in fruits,vegetables and grains [M].London:CRC Press,1993:363.
[9]宋会歌,刘美艳,董楠,等.食品中花色苷降解机制研究进展[J].食品科学,2011,32(13):355-359.
[10]陆卿卿,张丽霞,刘小莉,等.温度、pH值和光照对蓝莓汁花色苷稳定性的影响[J].江西农业学报,2012,24(12):131-133
[11]王晓梅,徐为民,曹士锋,等.红心萝卜花色苷稳定性研究[J].食品科学,2008,29(7):98-100.
[12]任二芳,李昌宝,孙健,等.金属离子和食品添加剂对桑果花色苷稳定性的影响[J].南方农业学报,2014,45(1):98-103
[13]黄思梅,张镜,张京维.物理因子及无机盐对阴香花色苷稳定性的影响[J].食品科学,2010,31(13):69-73.
[14]邓洁红,谭兴和,王锋,等.金属离子及辅色剂对葡萄皮色素稳定性的影响[J].食品研究与开发,2009,30(11):48-53.
[15]李颖畅,李冰心,吕春茂,等.酰基化蓝莓花色苷的稳定性和对氧自由基清除能力[J].食品工业科技,2012(6):212-216.
[16]GIUSTI M M,WROLSTAD R E.Acylated anthocyanins from edible sources and their application in food systems[J].Biochem Eng J,2003, 14(3):217-255.
[17]BIKOWSKA-BARCZAK A.Acylated anthoeyanins as stable,natural food colorants-a review[J].Polish J Food Nutr Sci,2005,2(14/55): 107-116.
[18]孙婧超,刘玉田,赵玉平.示差法测定蓝莓果酒中的花色苷条件的优化[J].中国酿造,2011,30(11):171-174.
[19]李梦莎.响应面法优化超声提取黑果腺肋花楸花色苷工艺的研究[J].中国酿造,2014,33(9):129-133.
[20]刘敬华,王振宇.精制及高纯度蓝靛果花色苷的抗氧化性及稳定性[J].食品工业科技,2013,34(19):87-92.
[21]BUCKOW R,KASTELL A,TEREFE N S,et al.Pressure and temperature effects on degradation kinetics and storage stability of total anthocyanins in blueberry juice[J].J Agr Food Chem,2010,58(18):10076-10084.
[22]SYAMALADEVI R M,ANDREW P K,DAVIES N M,et al.Storage effects on anthocyanins,phenolics and antioxidant activity of thermally processed conventional and organic blueberries[J].J Sci Food Agr, 2012,92(4):916-924.
[23]KECHINSKI C P,GUIMARAES P V R,NORENA C P Z,et al.Degradation kinetics of anthocyanin in blueberry juice during thermal treatment[J].J Food Sci,2010,75(2):173-176.
[24]董楠,宋会歌,刘嘉,等.咖啡酸对胭脂萝卜红色素辅色作用及稳定性的影响[J].食品科学,2011,32(7):61-64.
[25]HOLZWARTH M,KORHUMMEL S.Impact of enzymatic mash maceration and storage on anthocyanin and color retention of pasteurized strawberry purées[J].Eur Food Res Technol,2012,234(2):207-222.
[26]SAKUTA M.Diversity in plant red pigments:anthocyanins and betacyanins[J].Plant Biotechnol Report,2014,8(1):37-48.
[27]BOLIVAR A,LUIS C Z.Stability of anthocyanin-based aqueous extracts of Andean purple corn and red-fleshed sweet potato compared to synthetic and natural colorants[J].Food Chem,2004,86(1):69-77.
[28]李卫,郑成,宁正祥,等.酯化修饰对二氢杨梅素性能的影响[J].食品科学,2011,32(1):66-69
[29]李金星,胡志和,马立志,等.蓝莓加工过程中出汁率及花青素的稳定性研究[J].食品科学,2014,35(2):120-125.
Q946.5
0254-5071(2017)05-0136-05
10.11882/j.issn.0254-5071.2017.05.029
2016-12-01
“十三五”国家重点研发项目(2016YFC0500300);黑龙江省科学院青年创新项目(ZLY2016-1)
朱良玉(1984-),女,助理研究员,博士研究生,研究方向为天然产物化学。
*通讯作者:沈光(1977-),男,副研究员,博士研究生,研究方向为经济植物。
