孕期咖啡因暴露导致子代成年雌性大鼠代谢综合征易感及发生机制
2017-06-01裴林国张郦鄢友娥夏利平徐丹汪晖
裴林国,张郦,鄢友娥,夏利平,徐丹,2,汪晖,2
(1.武汉大学基础医学院药理学系,湖北武汉430071;2.发育源性疾病湖北省重点实验室,湖北武汉430071;3.南阳医学高等专科学校基础医学部,河南南阳473061)
孕期咖啡因暴露导致子代成年雌性大鼠代谢综合征易感及发生机制
裴林国1,3,张郦1,鄢友娥1,夏利平1,徐丹1,2,汪晖1,2
(1.武汉大学基础医学院药理学系,湖北武汉430071;2.发育源性疾病湖北省重点实验室,湖北武汉430071;3.南阳医学高等专科学校基础医学部,河南南阳473061)
目的观察经历出生后早期追赶性生长和后期慢性应激的孕期咖啡因暴露(PCE)子代成年雌性大鼠代谢综合征(MS)的易感现象并探讨其发生机制。方法Wistar大鼠于孕11 d每天ig给予咖啡因120 mg·kg-1至分娩,子代雌性大鼠4周龄(PW4)~PW24给予高脂饮食,并于PW38~PW40给予2周不可预知性慢性应激,分别检测血糖及血清促肾上腺皮质激素释放激素、皮质酮、胰岛素、甘油三酯、总胆固醇、低密度脂蛋白(LDL-C)和高密度脂蛋白(HDL-C)水平。实时定量PCR技术检测肾上腺组织的甾体合成急性调节蛋白、P450侧链裂解酶、3β-羟类固醇脱氢酶、类固醇11β-羟化酶和类固醇21β-羟化酶,以及肝组织的胰岛素受体、胰岛素受体底物2和葡萄糖转运体2(GLUT2)mRNA表达。HE染色观察肾上腺、胰腺和肝组织形态。结果PCE子代雌性大鼠PW1时体质量为(10.5±1.0)g,显著低于对照组(13.9±2.8)g(P<0.01),这种低体质量持续至PW40(P<0.05,P<0.01),但体质量增长率在PW4~PW16处于高水平(P<0.05,P<0.01)。同时,血糖〔(5.9±0.3)mmol·L-1〕水平和血清胰岛素水平〔(100±31)mU·L-1〕、胰岛素抵抗指数(26.3±5.7)和血清LDL-C水平〔(0.55±0.05)mmol·L-1〕及LDL-C/HDL-C比值(0.87±0.11)分别高于对照组〔血糖:(4.3± 0.3)mmol·L-1;血胰岛素:(45±4)mU·L-1;胰岛素抵抗指数:8.3±0.9;LDL-C:(0.38±0.04)mmol·L-1;LDL-C/ HDL-C比值∶0.66±0.07〕(P<0.05,P<0.01)。PCE组肝组织GLUT2 mRNA表达低于对照组(P<0.05)。光镜下可见,PCE组肾上腺束状带变薄,胰腺胰岛面积变小,而肝组织形态无明显变化。结论PCE子代成年雌性大鼠MS易感性增加,主要表现为以高血糖和高胰岛素血症为特征的胰岛素抵抗、脂代谢紊乱、多脏器结构及功能异常,其发生与下丘脑-垂体-肾上腺轴相关的宫内神经内分泌代谢编程紊乱有关。
咖啡因;下丘脑-垂体-肾上腺轴;糖脂代谢;代谢综合征
咖啡因属黄嘌呤类生物碱,妊娠妇女摄入咖啡因的现象普遍存在。孕期咖啡因暴露(prenatal caffeine exposure,PCE)所致宫内发育迟缓(intra⁃uterine growth retardation,IUGR)的子代,其发生代谢综合征(metabolic syndrome,MS)的概率大大增加[1]。MS具有胎儿起源[2],其发生发展不仅与胎儿宫内生存环境有关,而且还受到出生后高脂饮食和各种慢性刺激的影响,并与年龄增长密切相关。下丘脑-垂体-肾上腺轴(hypothalamic-pitu⁃itary-adrenalaxis,HPAA)是机体神经内分泌系统的重要组成部分,参与调控应激反应,并调节多种机体活动。肾上腺如存在发育不良或者其他原因导致的结构或功能损伤,特别是甾体合成功能损伤时(主要表现为甾体合成酶表达异常),HPAA对机体的调节作用将会弱化。血清促肾上腺皮质激素释放激素(adrenocorticotropic-releasing hormone,ACTH)和糖皮质激素(glucocorticoid,GC)是评价HPAA功能活性最重要的指标,而肾上腺甾体合成酶的表达用于反映肾上腺GC合成功能[3-4]。本室前期研究发现,PCE所致IUGR子代成年后MS易感,与宫内母源性GC过暴露所致多种器官和组织如肝、胰腺和骨骼肌等糖脂代谢功能改变有关,并且这种改变能够延续到出生后甚至成年,表现为HPAA低基础活性和高应激敏感性,同时伴随循环GC水平依赖的外周糖脂代谢表型变化[5-7]。由此,我们提出PCE所致子代MS易感的宫内神经内分泌代谢编程机制[7]。然而,IUGR子代出生后如经历早期追赶性生长和后期高工作压力,其成年MS易感性是否增加,至今尚未见报道。本研究采用PCE所致子代成年雌性大鼠IUGR模型,出生后给予高脂饮食(模拟过营养状态)并在成年后给予慢性应激(模拟高工作压力),以期观察PCE子代成年雌性大鼠MS易感现象并探讨其发生机制,为解析MS的宫内起源和后天生活环境对其发生发展的影响,并探寻其早期防治措施提供理论和实验依据。
1 材料与方法
1.1 主要试剂
咖啡因(CAS#58-08-2,美国Sigma公司);大鼠ACTH试剂盒(北京北方生命科学技术研究所);大鼠皮质酮(corticosterone,CORT)ELISA检测试剂盒(美国R&D公司);胰岛素ELISA试剂盒(瑞典Mercodia公司);葡萄糖氧化酶法试剂盒(上海名典生物工程有限公司);相关引物及甘油三酯(triglyc⁃erides,TG)和总胆固醇(totalcholesterol,TCH)试剂盒(上海生工生物工程技术有限公司);高密度脂蛋白-胆固醇(high-density lipoprotein-cholesterol,HDL-C)和低密度脂蛋白-胆固醇(low-density lipo⁃protein-cholesterol,LDL-C)试剂盒(浙江创业生物有限公司)。逆转录PCR试剂(大连TaKaRa公司);Applied Biosystems Step One实时定量PCR试剂盒(美国Applied Biosystems公司);其他试剂均为国产分析纯。
1.2 动物分组及处理
未孕SPF级Wistar大鼠(雌性:180~220 g;雄性:260~300 g)购于湖北省预防医学科学院实验动物中心(合格证号No.2008-0005,中国湖北)。大鼠适应性饲养1周后,于每晚18∶00以雌雄2∶1合笼,次晨阴道分泌物涂片镜检见精子者记为孕0天(gestational day 0,GD0)。受孕大鼠随机分为对照组和PCE组(每组40只)。从GD11开始PCE组每天ig给予咖啡因120 mg·kg-1至分娩,对照组给予等体积蒸馏水。在GD11~GD20,胎鼠HPAA相关器官及肝、胰腺等代谢性器官发育基本成型并具备相应功能[8-10],此时给药不仅能有效避免早期流产发生,也可对各器官功能发育进行干预,为机制探讨提供依据。本室前期采用咖啡因暴露剂量为每天30,60和120 mg·kg-1,观察到多项指标异常以及良好的量-效关系[5,7]。为建立典型的IUGR动物模型,本室采用每天120 mg·kg-1的咖啡因暴露量,用于开展PCE所致成年MS及机制研究,尽管该剂量经外推后可能超过临床孕妇日常咖啡因摄入量的数倍[6,11]。
受孕大鼠产仔后1天,检查每窝胎仔,选胎仔数10~14只、雌雄胎仔数均>4只的8窝小鼠纳入实验,并将每窝仔鼠数量随机调整为8只(雌雄各半),以保证哺乳期均等营养。出生后4周(postnatal 4 weeks,PW4)断奶,对照组和PCE组仔鼠每窝随机取1只雌鼠,分别于PW4~PW24给予高脂饮食,PW38~PW40给予2周不可预测性慢性应激(unpredictable chronic stress,UCS)。每天8∶00 am随机给予1种应激刺激,包括禁食或禁水24 h、4℃冰水游泳、夹尾1 min、昼夜颠倒、50℃热应激5 min。末次应激后3 d,于8∶00 am-10∶00 am处死大鼠,取血并分离血清,迅速分离肾上腺、胰腺和肝组织,4%多聚甲醛溶液固定,其余置于-80℃的冰箱内保存备用(图1)。
1.3 体质量的测定
仔鼠体质量于PW1起每周测定1次,并计算PW1~PW16的体质量增长率。PWn体质量增长率(%)=(PWn体质量-PW1体质量)/PW1体质量× 100%,n=1~16。
1.4 血生化指标检测
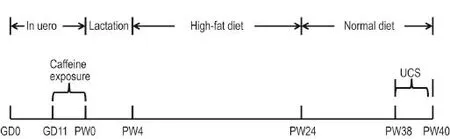
Fig.1 Time schedule of animal experiments from gestational day 0(GD0)to postnatal 40 weeks(PW40).From GD11,pregnant Wistar rats were ig given daily caffeine at a dose of 120 mg·kg-1untilthe day the rats went into labor.From PW4,the female offspring rats were fed a high-fat diet until PW24.The female offspring rats were then given a normaldiet and subjected to 2 weeks ofunpredictable chronic stress(UCS)between PW38 and PW40.At3 d after the finalexposure to stress,the rats were sacrificed.
采用试剂盒分别检测大鼠空腹血糖以及血清ACTH、CORT、胰岛素、TG、TCH、LDL-C和HDL-C水平。具体操作步骤见相应说明书。胰岛素抵抗指数(insulin resistance index,IRI)=空腹血清胰岛素浓度(mU·L-1)×空腹血糖浓度(mmol·L-1)÷22.5。
1.5 总RNA提取及实时定量PCR检测
取肾上腺和肝组织各30 mg,按RNA-Solv Reagent说明书提取总RNA。测A260nm和A280nm,计算总RNA浓度及纯度,调整总RNA浓度至1 g·L-1。cDNA合成和PCR扩增均按试剂盒说明书进行。分别检测肾上腺甾体合成急性调节蛋白(steroidogenic acute regulatory protein,StAR)、P450侧链裂解酶(P450 side-chain cleavage enzyme,P450scc)、3β-羟类固醇脱氢酶(3β-hydroxysteroid dehydrogenase,3β-HSD)、类固醇11β-羟化酶(steroid 11β-hydroxylase,P450c11)、类固醇21β-羟化酶(steroid 21β-hydroxylase,P450c21)、内参甘油醛-3-磷酸脱氢酶(glyceraldehydes3-phos⁃phate dehydrogenase,GAPDH)及肝组织胰岛素受体(insulin receptor,IR)、胰岛素受体底物2(insulin receptor substrate 2,IRS2)和葡萄糖转运体2(glucose transporter 2,GLUT2)mRNA表达。引物及扩增条件见表1。以标准品的相对浓度为横坐标,测得各自的Ct值为纵坐标得到标准曲线。以2-△△ct表示mRNA表达水平。
1.6 HE染色观察肾上腺、胰腺和肝组织形态变化
随机选取每组大鼠的右侧肾上腺、胰腺和肝组织(1 cm3),固定于4%多聚甲醛溶液,常规制作石蜡切片,经HE染色,并在光学显微镜下观察其形态变化。
1.7 统计学分析
实验结果数据以x±s表示,应用SPSS 13.0软件包进行统计学分析。分别采用双尾t检验分析数据,P<0.05为差异具有统计学意义。
2 结果
2.1 孕期咖啡因暴露对子代雌性大鼠出生体质量及其增长率的影响
图2A所示,PW1时,PCE组大鼠体质量低于对照组(P<0.01),这种低体质量水平持续至PW40。然而,在PW4~PW16时,PCE组体质量增长率高于对照组(P<0.01,图2B)。提示PCE组子代发生IUGR,并且出生后早期在高脂饮食下出现追赶性生长。
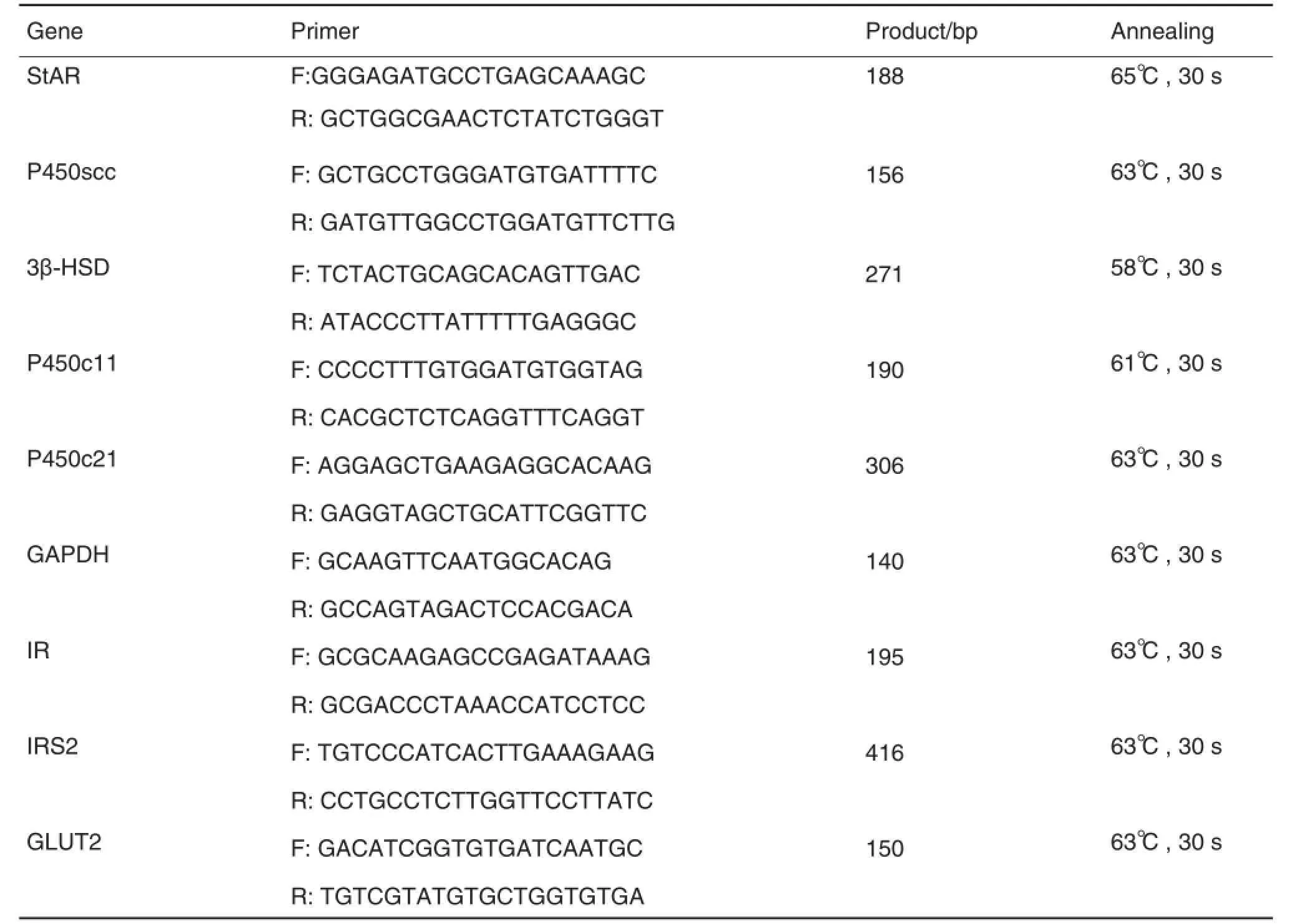
Tab.1 Primer sequences and optimal PCR conditions

Fig.2 Effect of prenatal caffeine exposure(PCE)on body mass(A)and gain rate(B)of female offspring rats on high-fat diet.See Fig.1 for the rat treatment.x±s,n=8.**P<0.01,compared with controlgroup.
2.2 孕期咖啡因暴露对子代成年雌性大鼠血糖以及血清ACTH、CORT、胰岛素、TG、TCH、LDL-C和HDL-C的影响
与对照组相比,PCE组血清ACTH和CORT浓度无明显变化(表2)。PCE组血糖、血清胰岛素浓度及IRI较对照组均升高(P<0.05,P<0.01,表3)。表4结果表明,与对照组相比,PCE组LDL-C浓度升高(P<0.01),但TG,TCH和HDL-C浓度无差异;LDL-C/HDL-C比值升高(P<0.05),但TG/HDL-C和TCH/HDL-C比值无明显变化。上述结果提示,PCE子代成年雌性大鼠经历早期追赶性生长和晚期慢性应激后,尽管HPAA活性无改变,但出现以高血糖和高胰岛素血症为特征的胰岛素抵抗,并伴有血脂代谢紊乱。
2.3 孕期咖啡因暴露对子代成年雌性大鼠肾上腺甾体合成酶和肝胰岛素通路相关mRNA表达的影响
如图3A所示,与对照组比,PCE组雌性子代大鼠肾上腺甾体合成酶(包括StAR,P450scc,3β-HSD,P450c11和P450c21)mRNA表达无变化。肝胰岛素通路相关基因IR和IRS2 mRNA表达亦无变化,但GLUT2表达降低(P<0.05,图3B)。

Tab.2 Effect of PCE on serum adrenocorticotropicreleasing hormone(ACTH)and corticosterone (CORT)concentrations in offspring adult female rats on high-fat diet

Tab.3 Effect of PCE on serum glucose,insulin con⁃centrations and insulin resistance index(IRI)in off⁃spring adult female rats on high-fat diet

Tab.4 Effect of PCE on serum triglycerides(TG),total cholesterol(TCH),high-density lipoprotein-cholesterol (HDL-C)and low-density lipoprotein-cholesterol(LDL-C) concentrations in offspring adult female rats on highfat diet
2.4 孕期咖啡因暴露对子代成年雌性大鼠肾上腺、胰腺和肝组织形态的影响
如图4所示,与对照组相比,PCE雌性成年子代大鼠的肾上腺束状带变薄,胰腺胰岛面积变小,但肝组织形态结构无明显变化。提示PCE组大鼠经历早期追赶性生长和晚期慢性应激后,肾上腺和胰腺组织结构出现异常。

Fig.3 Effect of PCE on mRNA expression of steroid synthesis genes and glucose metabolism related genes in livers of offspring adult female rats on highfat diet.See Fig.1 for the rat treatment.x±s,n=8.*P<0.05,compared with controlgroup.
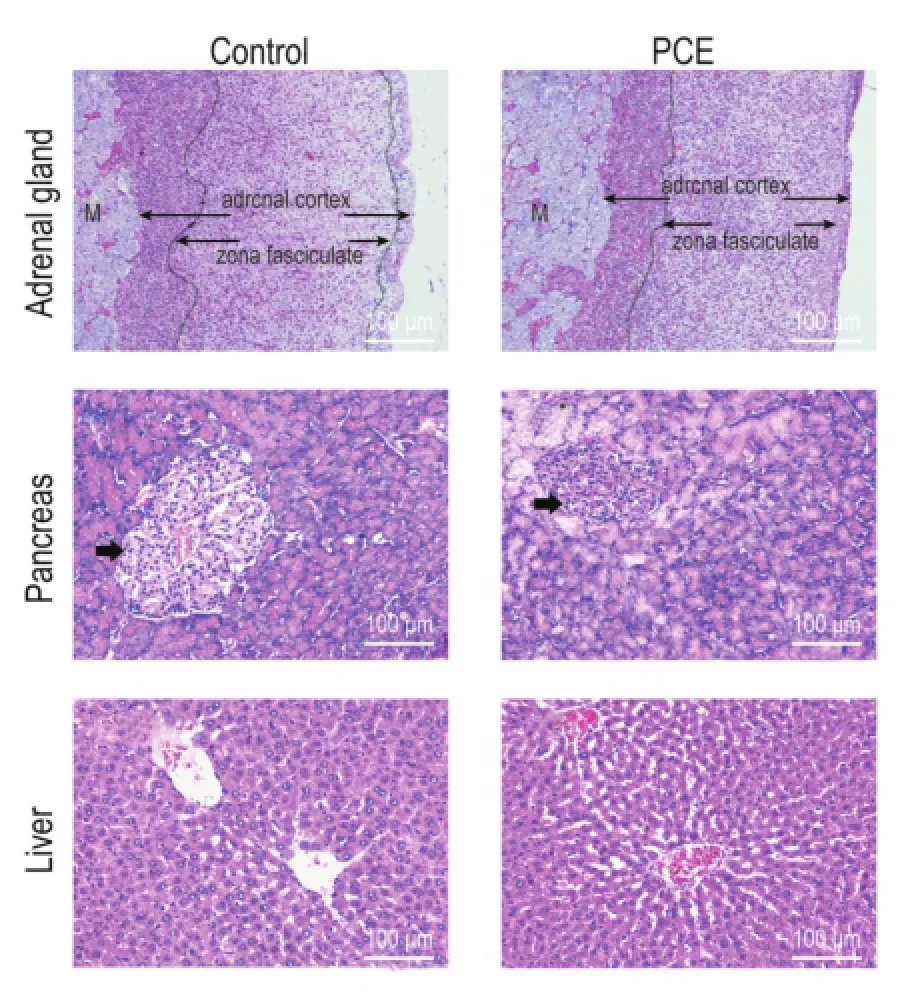
Fig.4 Effect of PCE on morphological changes in adrenal gland,pancreas and liver tissues of offspring adult female rats on high-fat diet(HE staining).See Fig.1 for the rattreatment.Arrows show pancreatic islands.
3 讨论
本研究发现,经历早期追赶性生长和后期慢性应激的PCE子代雌性成年大鼠MS易感性增加,表现为以高血糖和高胰岛素血症为特征的胰岛素抵抗,同时伴有脂代谢紊乱及多脏器(如肾上腺和胰腺)的结构与功能损伤。
MS的病理生理机制是胰岛素抵抗。研究表明,IUGR子代脂肪细胞膜胰岛素受体密度降低,胰岛素的抗脂解和脂肪合成能力减弱,易产生胰岛素抵抗并诱导MS发生[13]。而后天的慢性应激对高脂饮食引起的MS具有促进作用。本室前期研究发现,PCE雌性成年子代大鼠在正常饮食下,追赶性生长并不明显,4月龄出现了血TG和TCH水平升高[6]。本研究结果表明,出生后早期给予高脂饮食后雌性子代大鼠出现了明显的追赶性生长,并在10月龄出现以高胰岛素血症为特征的胰岛素抵抗现象并伴有糖脂代谢紊乱。上述结果均提示,PCE子代雌性成年大鼠MS相关疾病的易感性增加。
母源性GC过暴露可致宫内子代出生体质量下降、HPAA宫内发育不良及出生后功能异常[14],并遗传给后代[15]。本室前期研究表明,正常饮食下PCE可导致母源性GC过暴露,子代在出生后4月龄表现为HPAA低基础活性和高应激敏感性,同时伴随循环GC水平依赖性的糖、脂代谢功能变化。本研究结果表明,PW38时给予2周UCS后,尽管雌性成年子代大鼠HPAA活性无改变,但是肾上腺皮质部的束状带厚度减少。提示虽然宫内和出生后一系列不良事件造成了PCE子代成年雌性大鼠肾上腺结构损伤,但在10月龄时其HPAA功能依然能够代偿,其功能接近正常。
已有文献提示,出生前缓慢生长、出生后快速发育的生长模式,与其未来生活中的糖不耐受、胰岛素抵抗和肥胖等代谢性疾病的发生存在紧密的联系[16]。宫内GC过暴露的大鼠与其后天发生的高血糖和高胰岛素血症密切相关[17]。本室前期研究表明,PCE所致IUGR胎鼠出现了糖代谢减慢,给予正常饮食至4月龄后基础状态下血糖指标无变化,而给予应激后升高。本研究进一步发现,PCE雌性成年子代大鼠血糖和胰岛素基础分泌量均升高,并发生了高胰岛素血症。据报道,宫内高GC暴露损伤大鼠胰岛β细胞的发育[18],导致成年后胰岛素分泌不足和敏感性下降,从而引起后期的胰岛素抵抗,并造成了糖代谢能力异常[19]。Chang等[20]研究发现,胰岛素抵抗的发生与胰岛素信号通路的紊乱也有关系,其机制包括受体前、受体和受体后3个层面的改变[21]。已知IR,IRS2和GLUT2都是胰岛素信号通路中重要的基因。本研究结果表明,PCE雌性成年子代大鼠胰岛总面积减少,肝组织IR和IRS2表达虽无明显变化而GLUT2降低。提示PCE雌性成年子代大鼠出现的血糖升高及胰岛素抵抗的发生可能与胰腺发育不良和肝葡萄糖转运功能降低有关。
脂代谢紊乱是MS发生和发展的中心环节。研究报道,TG,TCH,LDL-C和HDL-C是心血管风险评估及急性冠心病事件预测的有效指标,HDL-C被誉为脂质代谢的“清道夫”,LDL-C/HDL-C比值也可作为判断脂代谢疾病发生和发展的重要指标[22]。本室前期研究表明,PCE所致IUGR胎鼠的脂代谢加快,给予正常饮食至4月龄后,其基础状态下血脂各指标均升高[4]。本研究发现,PCE雌性成年子代大鼠血LDL-C水平及LDL-C/HDL-C比值升高。提示PCE雌性成年子代大鼠的血脂代谢紊乱和代谢性疾病的风险增加。
综上所述,PCE所致的IUGR雌性子代大鼠在经历早期的追赶性生长和后期的慢性应激后,在10月龄时以高血糖和高胰岛素血症为特征的胰岛素抵抗并伴有糖脂代谢紊乱,提示MS及相关代谢性疾病的易感。其发生机制可能与HPAA相关的神经内分泌代谢编程紊乱有关。本研究结果为解释MS的宫内起源及后天生活环境对其易感的影响提供了理论和实验基础。
[1]Peck JD,Leviton A,Cowan LD.A review of the epidemiologic evidence concerning the reproduc⁃tive health effects of caffeine consumption:a 2000-2009 update[J].Food Chem Toxicol,2010,48(10):2549-2576.
[2]Alisi A,Panera N,Agostoni C,Nobili V.Intrauter⁃ine growth retardation and nonalcoholic fatty liver disease in children[J].Int J Endocrinol,2011,2011:269853.
[3]Goland RS,Tropper PJ,Warren WB,Stark RI,Jozak SM,Conwell IM.Concentrations of corticotrophin-releasing hormone in the umbilical-cord blood of pregnancies complicated by pre-eclampsia[J]. Reprod Fertil Dev,1995,7(5):1227-1230.
[4]de Vries A,Holmes MC,Heijnis A,Seier JV,Heerden J,Louw J,et al.Prenatal dexametha⁃sone exposure induces changes in nonhuman pri⁃mate offspring cardiometabolic and hypothalamicpituitary-adrenal axis function[J].J Clin Invest,2007,117(4):1058-1067.
[5]Xu D,Zhang B,Liang G,Ping J,Kou H,Li X, et al.Caffeine-induced activated glucocorticoid me⁃tabolism in the hippocampus causes hypothalamicpituitary-adrenal axis inhibition in fetal rats[J]. PLoS One,2012,7(9):e44497.
[6]Liu Y,Xu D,Feng J,Kou H,Liang G,Yu H,et al.Fetal rat metabonome alteration by prenatal caffeine ingestion probably due to the increased circulatory glucocorticoid level and altered peripheral glucose and lipid metabolic pathways[J].Toxicol ApplPharmacol,2012,262(2):205-216.
[7]Xu D,Wu Y,Liu F,Liu YS,Shen L,Lei YY,et al.A hypothalamic-pituitary-adrenalaxis-associ⁃ated neuroendocrine metabolic programmed alter⁃ation in offspring rats of IUGR induced by prenatal caffeine ingestion[J].Toxicol Appl Pharmacol,2012,264(3):395-403.
[8]Kapoor A,Dunn E,Kostaki A,Andrews MH,Matthews SG.Fetalprogramming of hypothalamopituitary-adrenal function:prenatal stress and gluco⁃corticoids[J].J Physiol,2006,572(Pt1):31-44.
[9]Keegan CE,Hammer GD.Recent insights into organogenesis of the adrenal cortex[J].Trends Endocrinol Metab,2002,13(5):200-208.
[10]Lemaigre FP.Mechanisms of liver development:concepts for understanding liver disorders and design of novel therapies[J].Gastroenterology,2009,137(1):62-79.
[11]Wang L,Shen L,Ping J,Zhang L,Liu Z,Wu Y,et al.Intrauterine metabolic programming alteration increased susceptibility to non-alcoholic adult fatty liver disease in prenatalcaffeine-exposed ratoffspring[J].ToxicolLett,2014,224(3):311-318.
[12]Hill MN,Hellemans KG,Verma P,Gorzalka BB,Weinberg J.Neurobiology of chronic mild stress:parallels to major depression[J].Neurosci Biobe⁃hav Rev,2012,36(9):2085-2117.
[13]Fagerberg B,Bondjers L,Nilsson P.Low birth weight in combination with catch-up growth predicts the occurrence of the metabolic syndrome in men at late middle age:the atherosclerosis and insulin resistance study[J].J Intern Med,2004,256(3):254-259.
[14]Davis EP,Glynn LM,Waffarn F,Sandman CA. Prenatal maternal stress programs infant stress regulation[J].J Child Psychol Psychiatry,2011,52(2):119-129.
[15]Reynolds RM.Programming effects ofglucocorticoids[J].Clin Obstet Gynecol,2013,56(3):602-609.
[16]Briana DD,Malamitsi-Puchner A.Intrauterine growthrestriction and adult disease:the role of adipocyto⁃kines[J].Eur J Endocrinol,2009,160(3):337-347.
[17]Lesage J,Del-Favero F,Leonhardt M,Louvart H,Maccari S,Vieau D,et al.Prenatalstress induces intrauterine growth restriction and programmes glucose intolerance and feeding behaviour distur⁃bances in the aged rat[J].J Endocrinol,2004,181(2):291-296.
[18]Blondeau B,Lesage J,Czernichow P,Dupouy JP,Bréant B.Glucocorticoids impair fetal beta-cell devel⁃opment in rats[J].Am J Physiol Endocrinol Metab,2001,281(3):E592-E599.
[19]Remacle C,Dumortier O,Bol V,Goosse K,Romanus P,Theys N,et al.Intrauterine program⁃ming of the endocrine pancreas[J].Diabetes Obes Metab,2007,9(Suppl2):196-209.
[20]Chang L,Chiang SH,Saltiel AR.Insulin signaling and the regulation of glucose transport[J].Mol Med,2004,10(7-12):65-71.
[21]Burén J,Liu HX,Lauritz J,Eriksson JW.High glucose and insulin in combination cause insulin receptor substrate-1 and-2 depletion and pro⁃tein kinase B desensitisation in primary cultured rat adipocytes:possible implications for insulin re⁃sistance in type 2 diabetes[J].Eur J Endocrinol,2003,148(1):157-167.
[22]Delgado Roche L,Acosta Medina E,Fraga Pérez A,Bécquer Viart MA,Soto López Y,Falcón Cama V,et al.Lipofundin-induced hyperlipidemia promotes oxidative stress and atherosclerotic lesions in New Zealand white rabbits[J].Int J Vasc Med,2012,2012:898769.
Prenatalcaffeine exposure induces high susceptibility to metabolic syndrome in offspring adult female rats and possible mechanism
PEILin-guo1,3,ZHANG Li1,YAN You-e1,XIA Li-ping1,XU Dan1,2,WANG Hui1,2
(1.Department of Pharmacology,Basic MedicalSchool,Wuhan University,Wuhan 430071,China; 2.HubeiProvincialKey Laboratory of Developmentally Originated Disease,Wuhan 430071,China; 3.Basic MedicalCollege of Nanyang MedicalUniversity,Nanyang 473061,China)
OBJECTIVETo observe the increased susceptibility to metabolic syndrome(MS)in offspring adult female rats which experienced prenatal caffeine exposure(PCE)and underwent early postnatalcatch-up growth and late chronic stress,and to explore the underlying mechanism.METHODSStarting from gestationalday 11,pregnant Wistar rats were intragastrically administered with caffeine atthe dose of120 mg·kg-1per day untildelivery.The female offspring rats were fed a high-fatdietfrom postnatal week 4(PW4)to PW24,and then exposed to two weeks of unpredictable chronic stress at PW38-PW40.Blood glucose and serum adrenocorticotropic hormone,corticosterone,insulin,triglycer⁃ides,totalcholesterol,low-density lipoprotein-cholesterol(LDL-C)and high-density lipoprotein-cholesterol (HDL-C)levels were detected.Meanwhile,the mRNA expression ofadrenalsteroidogenic acute regulatory protein,P450 side-chain cleavage enzyme,3β-hydroxysteroid dehydrogenase,steroid 11β-hydroxy⁃lase,steroid 21β-hydroxylase,hepatic insulin receptor,insulin receptor substrate 2 and glucose trans⁃porter 2(GLUT2)were examined by real-time quantitative PCR.The morphological changes of the adrenalgland,pancreas and liver were observed using hematoxylin-eosin staining.RESULTSCompared with controlgroup〔(13.9±2.8)g〕,the body mass of the PCE offspring female rats at PW1〔(10.5±1.0)g〕was significantly lower(P<0.01),which lasted until PW40(P<0.05,P<0.01).However,the gain rate of body mass was higher in the PCE group at PW4-PW16(P<0.05,P<0.01).Levels of blood glucose〔(5.9±0.3)mmol·L-1〕and serum insulin〔(100±31)mU·L-1〕,the insulin resistance index(26.3± 5.7),LDL-C〔(0.55±0.05)mmol·L-1〕level and LDL-C/HDL-C ratio(0.87±0.11)were increased compared with(4.3±0.3)mmol·L-1,(45±4)mU·L-1,8.3±0.9,(0.38±0.04)mmol·L-1and 0.66±0.07 in the controlgroup, respectively(P<0.05,P<0.01).The mRNA expression of hepatic GLUT2 in the PCE group was lowerthan in the controlgroup(P<0.05).Furthermore,the thicknesses of the adrenalzona fasciculata was re⁃duced and the area of pancreatic islets became smaller,but there was no significant change in liver morphology.CONCLUSIONPCE offspring adult female rats display high susceptibility to MS,which is mainly manifested as insulin resistance,characterized by hyperglycemia and hyperinsulinemia,lipid metabolism disorder and structural and functional abnormalities of multiple organs.The mechanism is possibly related to the disorder of hypothalamic-pituitary-adrenalaxis-associated neuroendocrine meta⁃bolic programming.
caffeine;hypothalamic-pituitary-adrenalaxis;glucose and lipid metabolism;metabolic syndrome
WANG Hui,E-mail:wanghui19@whu.edu.cn,Tel:13627232557
R996,R394.6
:A
:1000-3002-(2017)04-0332-08
10.3867/j.issn.1000-3002.2017.04.006
Foundation item:The project supported by National Natural Science Foundation of China(81220108026);and National Natural Science Foundation of China(81430089)
2016-06-22接受日期:2017-03-28)
(本文编辑:沈海南,乔虹)
国家自然科学基金(81220108026);国家自然科学基金(81430089)
裴林国,男,博士研究生,主要从事发育源性疾病研究;汪晖,女,教授,博士生导师,主要从事发育源性疾病研究。
汪晖,E-mail:wanghui19@whu.edu.cn,Tel:13627232557
