G蛋白偶联受体在肝细胞癌中调控作用研究进展
2017-06-01彭文婷孙妩弋厉歆然孙家昌魏伟
彭文婷,孙妩弋,厉歆然,孙家昌,魏伟
(安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,抗炎免疫药物安徽省协同创新中心,安徽合肥230032)
G蛋白偶联受体在肝细胞癌中调控作用研究进展
彭文婷,孙妩弋,厉歆然,孙家昌,魏伟
(安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,抗炎免疫药物安徽省协同创新中心,安徽合肥230032)
G蛋白偶联受体(GPCR),又称为7-α螺旋跨膜蛋白受体,是己知的3类涉及跨膜信号转导的膜受体之一。GPCR与G蛋白结合产生生物学效应,对机体生理功能和病理过程有广泛的调控作用。大量研究表明,GPCR通过调节下游某些信号的转导途径影响肝癌细胞的增殖、侵袭和转移过程,参与肝细胞癌(HCC)的发生和发展。本文就趋化因子受体、前列腺素受体、肾上腺素受体和血管紧张素受体等GPCR及其相关的信号通路在HCC发生发展进程中的作用进行综述,并对靶向GPCR的HCC治疗前景予以展望。
G蛋白偶联受体;肝细胞癌;趋化因子;溶血磷脂酸;肾上腺素受体;信号转导
肝细胞癌(hepatocellular carcinoma,HCC)是常见的肿瘤,每年全世界超过50万人被确诊为肝癌,其致死率在肿瘤相关死亡病例中位居第3,仅次于胃癌和食管癌,严重危害人类的生活质量和生命健康[1]。G蛋白偶联受体(G protein-coupled recep⁃tor,GPCR)是细胞外受体与细胞内效应分子的偶联体,与多种恶性肿瘤的发生发展密切相关。其通过介导下游多种信号通路,参与HCC的增殖、侵袭、转移和新生血管生成。因此,新的具有成药性的GPCR的开发对HCC的治疗具有很大的研究价值和市场潜力。本文就近年来GPCR在HCC中的研究现状进行综述。
1 GPCR的结构、功能及细胞内信号转导
1.1 GPCR的结构和分类
GPCR具有7段跨膜的α-螺旋结构,被称为7次跨膜受体。N端在细胞外,C端在细胞内,这2段肽链的氨基酸组成在不同受体中差异很大,与其识别不同配体及转导信号有关。针对GPCR超家族的成员有多种分类方法。根据配体结构的种类可分为生物胺类、肽类、脂类和蛋白酶类等,亦可依据序列的相似度分为5类:即谷氨酸(glutamate)受体、视紫红质(rhodopsin)受体、黏附素(adhesin)受体、卷曲蛋白(frizzled protein,FZD)受体和分泌素(secretin)受体,即GRAFS分类系统[2]。其中视紫红质受体包含了绝大多数的GPCR[3]。
1.2 GPCR的转导途径
GPCR能够转导神经递质、激素、生长因子、感觉刺激以及光线等物理、化学的细胞外信号。其信号途径主要包括G蛋白途径和β视紫红质抑制蛋白(β-arrestins)途径[4]。GPCR可能存在几种活性构象,不同的配体引发受体构象的改变不同。有些构象利于G蛋白结合,与G蛋白相互作用,使原先与GDP结合的G蛋白α亚基转而与GTP结合,并与βγ亚基解离,使之作用于腺苷酸环化酶(adenylate cyclase,AC)、磷脂酶、蛋白激酶和离子通道等效应器,通过产生第二信使或直接引起相应的生物效应。另一些构象更利于β视紫红质抑制蛋白(βarrestin)结合,β视紫红质抑制蛋白在GPCR激动剂刺激下,与磷酸化的GPCR结合后,改变受体构象,促进受体与G蛋白解偶联,即受体脱敏。活化的受体被定向降解或再循环到细胞表面,从而导致受体信号转导的减弱或终止。偏爱性配体则是其主要激活途径,以G蛋白非依赖的信号通路方式激活信号转导分子,如丝裂原活化的蛋白激酶(mitogen-activated protein kinase,MAPK)、Src蛋白酪氨酸激酶和蛋白激酶B(protein kinase B,PKB/Akt)等[5]。除上述2个途径,被激活的GPCR还能与GPCR激酶或其他受体相互作用,介导下游信号通路[6]。
1.3 GPCR的信号转导特征
GPCR的信号转导具有下列特征:①所有信号分子都能对其上、下游分子进行特异识别,精确地传递信号,并准确地“开启”或“关闭”信号传递道路。通过多分子转导,对外部信息进行精细加工、整合和放大。②信号分子在逐级有序传递的同时,对信号具有级联放大作用,形成级联反应。③各信号分子有活化和静息2种状态,适时地“开启”或“关闭”信号传递通路。④各信号分子可通过磷酸化和去磷酸化等作用可逆地共价修饰,实现对其功能的精细调控,这也是受体脱敏和超敏的机制之一[7]。例如,β视紫红质抑制蛋白在GPCR激动剂刺激下与磷酸化的GPCR结合后,改变受体构象,促进受体与G蛋白解偶联,即受体脱敏。脱敏后,尽管配体与受体仍然紧密连接,但受体处于非激活状态[6]。正常情况下,Gαi/o偶联受体抑制AC活性,使细胞内cAMP减少。然而,在长时程或慢性持续激活条件下,许多Gαi/o偶联受体能诱导细胞AC活性和cAMP“反跳性”或“代偿性”增加,通常将这种现象称作AC“超敏化”[8],是细胞的一种适应性反应机制和造成药物依赖性的原因。
2 参与HCC发生发展的GPCR
GPCR能激活多个下游信号通路,参与多种恶性肿瘤的病理进程。随着研究的深入,越来越多的研究提示,GPCR如趋化因子受体、前列腺素受体、溶血磷脂酸受体、血栓素受体、内皮素受体、肾上腺素能受体和血管紧张素受体等都在恶性肿瘤的生长、侵袭和转移中起着重要作用。这些GPCR可与多种因子发生相互作用而激活与HCC相关的信号通路,也可直接作用于突变基因,从而影响HCC的生长、转移、血管生成以及细胞的凋亡[9](图1)。
2.1 趋化因子受体
趋化因子受体主要表达于骨髓来源的各白细胞亚群,同时也表达于上皮细胞、血管内皮细胞和神经细胞等类型的细胞上。根据其结合的配体不同分为4个亚家族:CC趋化因子受体(CCR)、CXC趋化因子受体(CXCR)、CX3C趋化因子受体(CX3CR)和C趋化因子受体(XCR)。
2.1.1 CCR
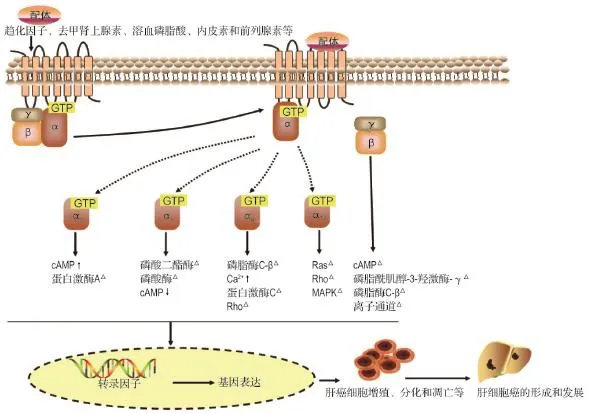
图1 G蛋白偶联受体(GPCR)在肝细胞癌(HCC)形成和发展中的信号通路.MAPK:丝裂原活化的蛋白激酶.↑:升高;↓:降低;△:升高或降低,
在二乙基亚硝胺诱导的C57BL/6小鼠肝癌模型和乙肝病毒表面抗原转基因小鼠肝癌模型中,CC趋化因子3(CCL3)/CCR1均异常高表达[10]。同时,CCL5也能激活CCR1,CCL5/CCR1在人肝癌细胞系HCCLM3中异常高表达,沉默肝癌细胞表面的CCR1能抑制肝癌细胞的侵袭转移[11]。若敲除小鼠CCR1或CCL3基因,肝癌发生率降低,瘤内枯否细胞、多种肿瘤生长因子、基质金属蛋白酶(matrix metalloproteinases,MMP)及肿瘤血管生成明显减少[10]。由此可见,不论是CCL3还是CCL5参与的致癌机制中,CCR1介导的下游信号通路都是至关重要的。另外,在小鼠结肠癌肝转移模型中发现,肿瘤细胞分泌的CCL2可以结合到骨髓来源且具有促进肝癌增殖的CD11b/Gr1mid细胞表面的CCR2受体,招募其进入肝癌组织内。并且,抑制CCL2分泌或沉默CD11b/Gr1mid细胞膜表面的CCR2均可抑制肿瘤增殖[12],这提示CCL2/CCR2轴在招募这类特殊的细胞进入肝癌组织内起到抑制肿瘤细胞增殖的重要作用。CCR5拮抗剂能缓解乙硫氨酸(ethionine)诱导的小鼠肝癌模型,抑制MAPK通路的激活,使肝癌细胞凋亡明显增多,而增殖减少,抑制肝癌[13]。Uchida等[14]研究显示,CCL20可促进CCR6高表达的人肝癌细胞系HepG2形成伪足,并且人肝癌组织中CCR6异常高表达与癌细胞肝内转移及预后差密切相关。以上研究提示,CCR1,CCR2,CCR5和CCR6等4种受体在肝癌中均表现为异常高表达,参与HCC增殖、凋亡、侵袭和转移的各个环节。然而,各受体间的相互作用及作用机制尚不明确,有待深入探索。
2.1.2 CXCR
在人的肝癌样本中检测到CXCL5/CXCR2的共表达水平升高,二者结合后通过激活磷脂酰肌醇-3激酶(phosphatidylinositol3-kinase,PI3K)/Akt/糖原合酶激酶3β(glycogen synthase kinase-3β,GSK-3β)/Snail信号通路促使肝癌细胞侵袭和转移[15]。在人原发性肝癌组织中,CXCR3蛋白水平明显上调。CXCL9/CXCR3能引起MAPK信号通路中细胞外信号调节激酶(extracellular signal regulated kinase,ERK)磷酸化水平升高,之后上调MMP-1和MMP-2,促进原发性肝细胞癌的侵袭和转移[16]。基质细胞衍生生长因子1(stromal cell derived growth factor-1,SDF-1),又名CXCL12,其受体为CXCR4,经实验验证,多种细胞都能够释放CXCL12,如受损的肝细胞、肝窦内皮细胞、与肿瘤相关的白细胞和肝癌细胞等。随后以自分泌或旁分泌方式激活多种表达CXCR4的细胞,如肝癌细胞、淋巴细胞和内皮细胞等,最终导致肝癌细胞生长、侵袭、转移和新生血管生成[17]。MMP-10参与肿瘤生长、侵袭和肿瘤血管生成,促进肝癌的形成。研究发现,在肝癌患者肿瘤组织中MMP-10和CXCR4同步高表达,但二者间具体的作用机制还不清楚,有待进一步研究[18]。在HCC患者组织标本中的CXCR6表达明显高于癌旁组织,而CXCR6缺失会抑制Gγ-1+中性粒细胞浸润和促炎因子白细胞介素(interleukin,IL)-1β、IL-6和IL-8产生,同时检测HCC患者标本中CXCR6与中性粒细胞的表达可以提高对生存和预后判断的准确性[19]。近年来发现,CXCL12除了可以与CXCR4结合外,亦可与CXCR7结合,且CXCL12与CXCR7的亲和性远高于CXCL12和CXCR4[20-21]。用CXCL12刺激人肝癌细胞SMMC-7721,发现血管内皮生长因子(vascular endothelial growth factor,VEGF)分泌增加,若沉默CXCR7,VEGF分泌会减少,且裸鼠皮下成瘤的瘤体明显缩小,血管指标CD31表达也减弱[22]。另外,CXCR7的表达与MAPK信号通路蛋白的磷酸化水平呈正相关,高表达的CXCR7还调控VEGF-A和半乳糖凝集素3,促进原发性肝癌细胞的生长和侵袭[23]。这些研究提示,CXCR2,CXCR3,CXCR6,CXCR4和CXCR7异常高表达促进肝癌细胞的侵袭和转移,而CXCR4和CXCR7还能促进肝癌细胞的增殖。
2.1.3 CX3CR
研究发现,肝癌组织CX3CL1/CX3CR1同时高表达的肝癌患者术后复发率低,增殖细胞核抗原标记指数也低,术后预后更好,且患者总体生存率有所提高[24]。若沉默CX3CL1的表达可以抑制人肝癌细胞系HepG2的血管生成[25]。这提示CX3CL1可以作为肿瘤免疫抑制和基因治疗的候选分子,也进一步说明了CX3CL1/CX3CR1轴在HCC中潜在的治疗价值,但具体作用机制仍需进一步深入调查研究。
2.2 前列腺素(prostaglandin,PG)受体
PG是机体内一类重要的活性脂类物质,其家族成员包括PGD2,PGE2,PGF2,PGI2和血栓素2,它们结构相近,但功能作用却各不相同。其中PGE2在机体中产量最高、分布最广,作为一种活性脂类物质,主要通过与细胞膜表面4种E族前列腺素(E-prostanoid,EP)(EP1,EP2,EP3和EP4)受体结合而激活下游信号转导通路,产生生物活性。通常,EP1受体与Gq蛋白结合,通过升高细胞内Ca2+浓度和激活磷脂酶A2而发挥作用。EP3受体与Gαi蛋白结合,通过抑制细胞内cAMP的活性而发挥作用。EP2和EP4受体都与Gs蛋白结合,通过激活AC促进cAMP生成,激活蛋白激酶A(protein kinase A,PKA)发挥作用。
EP1~EP4在多种肝癌细胞系及HCC患者癌组织中都表达。体外分别使用EP1~EP4拮抗剂观察其对肝癌细胞系的影响,发现EP1和EP3拮抗剂都能诱导肝癌细胞凋亡,抑制细胞活力,提示EP1和EP3可能作为治疗HCC的有效靶点[26]。在人肝癌细胞系Huh-7和Hep3B中,PGE2与EP1结合,激活PKC/NF-κB/FoxC2/β1整合素和PKC/c-Src/表皮生长因子受体(epidermal growth factor receptor,EGFR)/ERK/mTOR信号通路,上调Y盒结合蛋白1(Y-box binding protein 1),通过调控上皮间充质转化促进人肝癌细胞系Hep3B和Huh7的侵袭,促进了原发性HCC的转移[27-28]。当PGE2和EP2结合,通过Src/EGFR/Akt/mTOR通路上调Snail蛋白水平,促进HCC的侵袭和转移[29]。同时,过表达EP2能使下游Bcl-2异常高表达,下调Bax,促进肝癌细胞的增殖,抑制细胞凋亡,这可能与活化的胱天蛋白酶表达密切相关[30]。PEG2与EP4结合后,激活了Gs/AC/cAMP/PKA/CERB和EGFR/Akt/ NF-κB信号通路,上调肝癌细胞中原癌基因c-Myc的蛋白表达,使Snail蛋白水平升高,促进了肝癌细胞的生长和侵袭[31]。上述研究在细胞分子水平证实,过表达的EP2和EP4均能促进肝癌细胞的侵袭转移。然而,尚缺少动物整体实验验证,有待进一步深入研究。
2.3 溶血磷脂酸(lysophosphatidic acid,LPA)受体
LPA又名1-脂酰甘油酸-3-磷酸酯,是溶血磷脂(lysophospholipid,LP)的活性成分之一,也是一种重要的细胞外信号递质和细胞内第二信使。已知LPA至少有6个高亲和力、同源型视紫红质样GPCR(LPAR),可进一步将这些受体分为2个家族,LPAR1~3为内皮细胞分化基因家族成员,LPAR4~6为非内皮细胞分化基因家族成员。当LPA与相应LPAR结合后,通过调节效应器及信号分子,介导一系列细胞传导级联反应,从而发挥多种生物学效应[32]。
Sokolov等[33]观察LPAR1,LPAR3和LPAR6对人肝癌细胞系HuH7增殖和转移能力的影响,LPAR6促进人肝癌细胞系HuH7增殖和转移的作用更为明显。将31例HCC患者的癌组织与其癌旁组织及正常人的肝组织进行对比,发现肝癌组织中LPAR6异常高表达,而LPAR1和LPAR3在人肝癌组织和癌旁组织表达无明显差异。另有实验证明,LPA/LPAR能激活PI3K/Akt和PKCδ/P38MAPK通路,上调低氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)和MMP-9,进而促进肿瘤的生长、侵袭和转移[34]。
2.4 内皮素(endothelin,ET)受体
ET作为一种旁分泌或自分泌激素,其发挥生物学效应首先是与靶细胞上ET受体(EP receptor,ETR)结合,激活磷脂酰肌醇介导的钙信号系统,启动一系列细胞生物学效应。目前已明确的ETR有2种,即ETAR和ETBR[35]。Cong等[36]发现,ETAR在HCC患者癌组织和多种肝癌细胞系中表达异常增高,其激活了ERK1/2和Akt信号通路,上调MMP-3的表达,有利于肿瘤新生血管形成,促进肿瘤侵袭转移,并与肿瘤分期密切相关。当用小干扰RNA(siRNA)沉默ETAR或用拮抗剂BQ-123阻断ETAR时,会减弱由ET-1调节的细胞侵袭和转移能力。
2.5 肾上腺素能受体(adrenergic receptor,AR)
AR是能选择性地与去甲肾上腺素或肾上腺素结合的受体,分布于大部分交感神经节后纤维支配的效应器细胞膜上。依据受体对激动剂的敏感性不同,分为α-和β-AR。α-AR分α1-和α2-AR,其中α1-AR亚型包括α1A,α1B和α1D,α2-AR亚型包括α2A,α2B和α2C,β-AR分β1-,β2-和β3-AR。在人的肝中主要存在β2-,α1-和α2-AR。每种亚型结合不同的信号转导系统,β2-AR和Gs偶联,激活AC产生cAMP。α1-AR与Gq/11偶联,激活磷脂酶C,调节磷脂酰肌醇和Ca2+。α2-AR和Gi偶联,抑制细胞内cAMP所调节的信号通路[37]。
HCC患者肝癌组织标本中α1-AR蛋白表达与癌旁组织及正常肝组织相比明显下降,肿瘤诱导的应激反应通过慢性刺激交感神经,抑制α1-AR/Gq/11/ PLC通路[38]。然而,HCC患者的癌组织中β2-AR表达明显高于癌旁组织,这种高表达与癌组织中甲胎蛋白水平增高、肿瘤体积增大、肿瘤血管侵袭、微小卫星灶形成、分化不良、低存活率和高复发率密切相关[39]。这可能与β2-AR激活下游ERK1/2信号通路,促进肿瘤细胞增殖有关[40]。人肝癌细胞系SMMC-7721建立的裸鼠移植瘤模型和二乙基亚硝胺诱导的HCC模型中,预先注射β2-AR抑制剂ICI 118,551,能抵消肾上腺素异常升高引起的作用,减轻HCC性状,如肿瘤体积、数量和肝指数等[41]。选择性β2-AR激动剂福莫特罗(formoterol)通过Akt依赖途径扰乱Beclin1/VPS34/Atg14复合物形成,负性调节细胞自噬,抑制HIF-1α降解,使其处于稳定状态,改变肝癌细胞的糖代谢。另有研究发现,当交感神经过度兴奋时,肝内聚集大量去甲肾上腺素和肾上腺素,与α1-AR和β2-AR结合,反式激活EGFR,激活下游ERK1/2/MAPK通路,促进肝癌细胞SMMC-7721增殖,抑制其凋亡[42]。
2.6血管紧张素受体(angiotensin receptor,ATR)
ATR是以血管紧张素Ⅱ为配体的GPCR,是肾素-血管紧张素系统的重要组成部分,主要包括1型受体(AT1R)和2型受体(AT2R),此外还有3型和4型受体,但是对其了解十分匮乏。虽AT1R和AT2R仅有约30%的序列相同,但是血管紧张素Ⅱ却是二者的主要配体,与之有相近的亲和力。
在具有高转移潜能的肝癌细胞系MHCC97H中,血管紧张素Ⅱ诱导AT1R在癌细胞中高表达,通过激活酪氨酸激酶/信号转导及转录激活因子,引起细胞因子信号抑制分子3(suppressors of cyto⁃kine signaling 3)异常高表达,最终上调血管生成因子,如VEGF和血管生成素2等,促进肿瘤新生血管形成[43]。此外,AT1R在癌旁组织的肿瘤相关巨噬细胞中高表达,这提示AT1R可能在炎症相关肿瘤新生血管形成中发挥重要作用,作用于肿瘤微环境,促进肿瘤的生长、侵袭和转移[44]。
对人肝癌细胞系SMMC7721进行慢病毒转染,使细胞AT2R过表达,发现能降低周期蛋白细胞依赖性激酶4和细胞周期蛋白D1水平,使停留在S期的细胞明显减少,而处于G1期的细胞明显增多,最终促进肝癌细胞凋亡,抑制细胞生长。AT2R通过激活P38MAPK、胱天蛋白酶3和胱天蛋白酶8,降低ERK1/2表达,从而启动细胞死亡信号通路[45]。
2.7 孤儿受体
序列已知而配基未明的GPCR一般称为孤儿GPCR。近年研究发现,多种孤儿GPCR参与了HCC的形成与发展。
GPR49属于糖蛋白受体家族,是Wnt信号通路的目标基因。通过对HCC患者的癌组织及癌旁组织进行分析,发现与癌旁组织相比,GPR49在肝癌组织中异常高表达,并伴随着β连环蛋白(βcatenin)的外显子3发生突变[46]。GPR49+肝癌细胞的行为类似于肿瘤起始细胞,有较高的致瘤性及药物耐受性,并促进赖氨酸特异性组蛋白去甲基化酶1高表达,通过降低Prickle1和APC基因启动子周围H3K4mel/2水平,抑制Prickle1和APC的蛋白表达,激活WNT/β-连环蛋白信号通路,促进肿瘤细胞的生长[47]。
2.8 蛋白酶激活受体(protease-activated recep⁃tors,PAR)
PAR分4个亚型,即PAR1,PAR2,PAR3和PAR4。PAR3和PAR4主要表达于血小板,介导凝血酶反应,引起血小板活化、血液凝固等。PAR1和PAR2则表达于多种组织,包括肿瘤组织及细胞,参与人体多种肿瘤的发生、发展以及转移[48]。
在人肝癌细胞系Hep3B中,PAR1和PAR4可通过促进活性氧生成,使蛋白质酪氨酸磷酸酶1B失活,激活受体酪氨酸蛋白激酶Met和血小板衍生生长因子受体,最终促肿瘤生长和迁移[49]。同样,在Hep3B中,PAR2激活Ca2+/ERK1/2信号通路,促进肿瘤细胞的生长和转移[50]。
3 靶向GPCR的治疗前景
研究表明,HCC的发病机制与多种基因突变和细胞信号转导通路密切相关,包括异常的生长因子激活、细胞分裂信号途径持续活化、抗细胞凋亡信号失调和新生血管异常增生[51]。提示在肿瘤细胞增殖、侵袭和转移过程中可能存在多个潜在的治疗靶点,可通过阻断肿瘤细胞或激活相关细胞的信号转导,来控制细胞基因表达的改变,产生抑制或杀死肿瘤细胞的效应,而不损伤人体正常细胞[52]。
靶向药物治疗HCC已逐渐引起重视,成为新的研究热点。一些以GPCR为治疗靶点的药物存在潜在治疗效果,有待进一步挖掘发现。普乐沙福(plerixafor,AMD3100)用于非霍奇金淋巴瘤和多发性骨髓瘤的治疗。目前,它被广泛地应用于HCC的研究中[53]。马拉维罗(maraviroc)是一种CCR5拮抗剂,可抑制MAPK通路的激活,进而抑制乙硫氨酸(ethionine)诱导的小鼠肝癌细胞增殖,也使肝癌细胞的凋亡数量明显增多,缓解HCC症状[13]。若使用β2-AR阻断剂普萘洛尔(propranolol)与索拉非尼(sorafenib)协同用药,阻断β2-AR信号,促进HIF-1α的自噬降解,可增强索拉非尼的抗肿瘤效果[54]。实验表明,AT1R拮抗剂坎地沙坦(candesar⁃tan)不仅能抑制小鼠HCC移植瘤的生长,且显著降低组织中VEGF表达和微血管密度[55],提示坎地沙坦可通过抑制新生血管生成而抑制HCC生长。
4 结语
GPCR作为一种极广泛的跨膜受体蛋白,参与感知、生殖和发育等多种生命活动以及内分泌和代谢等多种生理过程,同时与代谢、肿瘤、免疫和感染等重要疾病的发生发展密切相关。近年研究发现,在HCC中多种GPCR存在异常表达,如趋化因子受体、EP受体、LPAR和AR等,参与调控肝癌细胞的增殖、凋亡、侵袭、转移及新生血管生成,影响HCC的发展和进程。提示GPCR及其下游激活效应器是HCC预防和治疗中重要的潜在药物靶点,为HCC的防治提供了新的思路与方向。然而,GPCR参与调控的生物通路和网络十分广泛而复杂,现有研究尚缺乏与临床研究、新药研发的结合。因此,在未来研究领域里,要加强对GPCR介导的信号通路与其他信号通路之间网络图的探究,全面认识GPCR的作用机制,早日研发出应用于临床的靶向GPCR的HCC治疗药物。
[1]El-Serag HB.Hepatocellular carcinoma[J].N Engl J Med,2011,365(12):1118-1127.
[2]Katritch V,Cherezov V,Stevens RC.Structurefunction of the G protein-coupled receptor super⁃family[J].Annu Rev Pharmacol Toxicol,2013,53:531-556.
[3]Lagerström MC,Schiöth HB.Structuraldiversity of G protein-coupled receptors and significance for drug discovery[J].Nat Rev Drug Discov,2008,7(4):339-357.
[4]Audet M,Bouvier M.Restructuring G-protein-cou⁃pled receptor activation[J].Cell,2012,151(1):14-23.
[5]Gomes I,Ayoub MA,Fujita W,Jaeger WC,Pfleger KD,Devi LA.G protein-coupled receptor heteromers[J].Annu Rev Pharmacol Toxicol,2016,56:403-425.
[6]Ritter SL,Hall RA.Fine-tuning of GPCR activity by receptor-interacting proteins[J].Nat Rev Mol Cell Biol,2009,10(12):819-830.
[7]Latorraca NR,Venkatakrishnan AJ,Dror RO.GPCR dynamics:structures in motion[J].Chem Rev,2017,117(1):139-155.
[8]Brust TF,Conley JM,Watts VJ.Gαi/o-coupled receptor-mediated sensitization of adenylyl cyclase:40 years later[J].Eur J Pharmacol,2015,763(Pt B):223-232.
[9]Lappano R,Maggiolini M.G protein-coupled recep⁃tors:noveltargets for drug discovery in cancer[J]. Nat Rev Drug Discov,2011,10(1):47-60.
[10]Yang X,Lu P,Fujii C,Nakamoto Y,Gao JL,Kaneko S,et al.Essentialcontribution of a chemo⁃kine,CCL3,and its receptor,CCR1,to hepato⁃cellular carcinoma progression[J].Int J Cancer,2006,118(8):1869-1876.
[11]Wu X,Fan J,Wang X,Zhou J,Qiu S,Yu Y,et al. Downregulation of CCR1 inhibits human hepatocellular carcinoma cell invasion[J].Biochem Biophys Res Commun,2007,355(4):866-871.
[12]Zhao L,Lim SY,Gordon-Weeks AN,Tapmeier TT,Im JH,Cao Y,et al.Recruitment of a myeloid cell subset(CD11b/Gr1 mid)via CCL2/CCR2 promotes the development ofcolorectalcancer liver metasta⁃sis[J].Hepatology,2013,57(2):829-839.
[13]Ochoa-Callejero L,Pérez-Martínez L,Rubio-Mediavilla S,Oteo JA,Martínez A,Blanco JR.Maraviroc,a CCR5 antagonist,prevents development of hepa⁃tocellular carcinoma in a mouse model[J].PLoS One,2013,8(1):e53992.
[14]Uchida H,Iwashita Y,Sasaki A,Shibata K,Matsumoto T,Ohta M,et al.Chemokine receptor CCR6 as a prognostic factor after hepatic resec⁃tion for hepatocellular carcinoma[J].J Gastroen⁃terolHepatol,2006,21(1 Pt 1):161-168.
[15]Zhou SL,Zhou ZJ,Hu ZQ,Li X,Huang XW,Wang Z,et al.CXCR2/CXCL5 axis contributes to epithelial-mesenchymaltransition of HCC cells through activating PI3K/Akt/GSK-3β/Snail signaling[J]. Cancer Lett,2015,358(2):124-135.
[16]Ding Q,Xia Y,Ding S,Lu P,Sun L,Liu M.An alternatively spliced variant of CXCR3 mediates the metastasis of CD133+liver cancer cells induced by CXCL9[J].Oncotarget,2016,7(12):14405-14414.
[17]Ghanem I,Riveiro ME,Paradis V,Faivre S,de Parga PM,Raymond E.Insights on the CXCL12-CXCR4 axis in hepatocellular carcinoma carcino⁃genesis[J].Am J TranslRes,2014,6(4):340-352.
[18]García-Irigoyen O,Latasa MU,Carotti S,Uriarte I,Elizalde M,Urtasun R,et al.Matrix metalloproteinase 10 contributes to hepatocarcinogenesis in a novel crosstalk with the stromal derived factor 1/C-X-C chemokine receptor 4 axis[J].Hepatology,2015,62(1):166-178.
[19]Gao Q,Zhao YJ,Wang XY,Qiu SJ,Shi YH,Sun J,et al.CXCR6 upregulation contributes to a proinflammatory tumor microenvironment that drives metastasis and poor patient outcomes in hepatocellular carcinoma[J].Cancer Res,2012,72(14):3546-3556.
[20]Burns JM,Summers BC,Wang Y,Melikian A,Berahovich R,Miao Z,et al.A novel chemokine receptor for SDF-1 and I-TAC involved in cellsurvival,cell adhesion,and tumor development[J].J Exp Med,2006,203(9):2201-2213.
[21]Balabanian K,Lagane B,Infantino S,Chow KY,Harriague J,Moepps B,et al.The chemokine SDF-1/CXCL12 binds to and signals through the orphan receptor RDC1 in T lymphocytes[J].J Biol Chem,2005,280(42):35760-35766.
[22]Xue TC,Chen RX,Han D,Chen J,Xue Q,Gao DM,et al.Down-regulation of CXCR7 inhibits the growth and lung metastasis of human hepato⁃cellular carcinoma cells with highly metastatic potential[J].Exp Ther Med,2012,3(1):117-123.
[23]Lin L,Han MM,Wang F,Xu LL,Yu HX,Yang PY. CXCR7 stimulates MAPK signaling to regulate hepatocellular carcinoma progression[J].Cell Death Dis,2014,5:e1488.
[24]Matsubara T,Ono T,Yamanoi A,Tachibana M,Nagasue N.Fractalkine-CX3CR1 axis regulates tumor cell cycle and deteriorates prognosis after radical resection for hepatocellular carcinoma[J].J Surg Oncol,2007,95(3):241-249.
[25]Li F,Wang Z,Liu Y,Li J.Down-regulation of frac⁃talkine inhibits the in vitro and in vivo angiogenesis of the hepatocellular carcinoma HepG2 cells[J]. OncolRep,2010,24(3):669-675.
[26]Breinig M,Rieker R,Eiteneuer E,Wertenbruch T,Haugg AM,Helmke BM,et al.Differential expres⁃sion of E-prostanoid receptors in human hepatocel⁃lular carcinoma[J].Int J Cancer,2008,122(3):547-557.
[27]Zhang H,Cheng S,Zhang M,Ma X,Zhang L,Wang Y,et al.Prostaglandin E2 promotes hepato⁃cellular carcinoma cell invasion through upregula⁃tion of YB-1 protein expression[J].Int J Oncol,2014,44(3):769-780.
[28]BaiX,Wang J,Guo Y,Pan J,Yang Q,Zhang M,et al.Prostaglandin E2 stimulatesβ1-integrin expression in hepatocellular carcinoma through the EP1 receptor/ PKC/NF-κB pathway[J].SciRep,2014,4:6538.
[29]Cheng SY,Zhang H,Zhang M,Xia SK,Bai XM,Zhang L,et al.Prostaglandin E2receptor EP2 medi⁃ates Snail expression in hepatocellular carcinoma cells[J].OncolRep,2014,31(5):2099-2106.
[30]Hu S,Sun W,Wei W,Wang D,Jin J,Wu J,et al. Involvement of the prostaglandin E receptor EP2 in paeoniflorin-induced human hepatoma cellapop⁃tosis[J].Anticancer Drugs,2013,24(2):140-149.
[31]Xia S,Ma J,Bai X,Zhang H,Cheng S,Zhang M,et al.Prostaglandin E2 promotes the cell growth and invasive ability of hepatocellular carcinoma cells by upregulating c-Myc expression via EP4 receptor and the PKA signaling pathway[J].Oncol Rep,2014,32(4):1521-1530.
[32]Yanagida K,Ishii S.Non-Edg family LPA recep⁃tors:the cutting edge of LPA research[J].J Bio⁃chem,2011,150(3):223-232.
[33]Sokolov E,Eheim AL,Ahrens WA,Walling TL,Swet JH,McMillan MT,et al.Lysophosphatidic acid receptor expression and function in human hepatocellular carcinoma[J].J Surg Res,2013,180(1):104-113.
[34]Park SY,Jeong KJ,Panupinthu N,Yu S,Lee J,Han JW,et al.Lysophosphatidic acid augments human hepatocellular carcinoma cell invasion through LPA1 receptor and MMP-9 expression[J]. Oncogene,2011,30(11):1351-1359.
[35]Cai L,Wang GJ,Mukherjee K,Xu ZL,Khalil M,Cherian MG,et al.Endothelins and their receptors in cirrhotic and neoplastic livers of Canadian and Chinese populations[J].Anticancer Res,1999,19(3B):2243-2247.
[36]Cong N,Li Z,Shao W,Li J,Yu S.Activation of ETA receptor by endothelin-1 Induces hepatocellular carcinoma cell migration and invasion via ERK1/2 and AKT signaling pathways[J].J Membr Biol,2016,249(1-2):119-128.
[37]Guellaen G,Yates-Aggerbeck M,Vauquelin G,Strosberg D,Hanoune J.Characterization with[3H]dihydroergocryptine of the alpha-adrenergic receptor of the hepatic plasma membrane.Comparison with the beta-adrenergic receptor in normal and adre⁃nalectomized rats[J].J Biol Chem,1978,253(4):1114-1120.
[38]Kassahun WT,Günl B,Jonas S,Ungemach FR,Abraham G.Altered liverα1-adrenoceptor density and phospholipase C activity in the human hepato⁃cellular carcinoma[J].Eur J Pharmacol,2011,670(1):92-95.
[39]Chen D,Xing W,Hong J,Wang M,Huang Y,Zhu C,et al.The beta2-adrenergic receptor is a potential prognostic biomarker for human hepato⁃cellular carcinoma after curative resection[J].Ann Surg Oncol,2012,19(11):3556-3565.
[40]Yuan A,Li Z,Li X,Yi S,Wang S,Cai Y,et al. The mitogenic effectors of isoproterenol in human hepatocellular carcinoma cells[J].Oncol Rep,2010,23(1):151-157.
[41]Wu FQ,Fang T,Yu LX,Lv GS,Lv HW,Liang D,et al.ADRB2 signaling promotes HCC progression and sorafenib resistance by inhibiting autophagic degradation of HIF1α[J].J Hepatol,2016,65(2):314-324.
[42]Li J,Yang XM,Wang YH,Feng MX,Liu XJ,Zhang YL,et al.Monoamine oxidase A suppresses hepatocellular carcinoma metastasis by inhibiting the adrenergic system and its transactivation of EGFR signaling[J].J Hepatol,2014,60(6):1225-1234.
[43]Ji Y,Wang Z,Li Z,Li K,Le X,Zhang T.Angio⁃tensinⅡinduces angiogenic factors production partly via AT1/JAK2/STAT3/SOCS3 signaling path⁃way in MHCC97H cells[J].Cell Physiol Biochem,2012,29(5-6):863-874.
[44]Deshayes F,Nahmias C.Angiotensin receptors:a new role in cancer?[J].Trends Endocrinol Metab,2005,16(7):293-299.
[45]Du H,Liang Z,Zhang Y,Jie F,Li J,Fei Y,et al. Effects of angiotensinⅡtype 2 receptor overex⁃pression on the growth of hepatocellular carcinoma cells in vitro and in vivo[J].PLoS One,2013,8(12):e83754.
[46]Yamamoto Y,Sakamoto M,Fujii G,Tsuiji H,Kenetaka K,Asaka M,et al.Overexpression of orphan G-protein-coupled receptor,Gpr49,in human hepatocellular carcinomas with beta-catenin muta⁃tions[J].Hepatology,2003,37(3):528-533.
[47]Lei ZJ,Wang J,Xiao HL,Guo Y,Wang T,Li Q,et al.Lysine-specific demethylase 1 promotes the stemness and chemoresistance of Lgr5+liver cancer initiating cells by suppressing negative regulators ofβ-catenin signaling[J].Oncogene,2015,34(24):3214.
[48]Fujimoto D,Hirono Y,GoiT,Katayama K,Matsu⁃kawa S,Yamaguchi A.The activation of protein⁃ase-activated receptor-1(PAR1)mediates gastric cancer cell proliferation and invasion[J].BMC Cancer,2010,10:443.
[49]Mußbach F,Henklein P,Westermann M,Settm⁃acher U,Böhmer FD,Kaufmann R.Proteinaseactivated receptor 1-and 4-promoted migration of Hep3B hepatocellular carcinoma cells depends on ROS formation and RTK transactivation[J].J Cancer Res Clin Oncol,2015,141(5):813-825.
[50]Kaufmann R,Mussbach F,Henklein P,Settmacher U. Proteinase-activated receptor 2-mediated calcium signaling in hepatocellular carcinoma cells[J].J Cancer Res Clin Oncol,2011,137(6):965-973.
[51]Villanueva A,Minguez B,Forner A,Reig M,Llovet JM.Hepatocellular carcinoma:novelmolecular approaches for diagnosis,prognosis,and therapy[J].Annu Rev Med,2010,61:317-328.
[52]TommasiS,Pinto R,Pilato B,Paradiso A.Molecular pathways and related target therapies in liver carci⁃noma[J].Curr Pharm Des,2007,13(32):3279-3287.
[53]Fontanella R,Pelagalli A,Nardelli A,D′Alterio C,IeranòC,Cerchia L,et al.A novel antagonist of CXCR4 prevents bone marrow-derived mesenchy⁃mal stem cell-mediated osteosarcoma and hepato⁃cellular carcinoma cell migration and invasion[J]. Cancer Lett,2016,370(1):100-107.
[54]Wu FQ,Fang T,Yu LX,Lv GS,Lv HW,Liang D,et al. ADRB2 signaling promotes HCC progression and sorafenib resistance by inhibiting autophagic degra⁃dation of HIF1α[J].J Hepatol,2016,65(2):314-324.
[55]Han Y,Jiang LY,Fu XX,Li H,Jing L,Zhao CX,et al.The inhibitory effect of candesartan on growth and angiogenesis of mice bearing hepato⁃cellular carcinoma xenograft[J].Chin Clin Oncol(临床肿瘤学杂志),2013,18(10):869-873.
Research progress in regulation roles of G protein-coupled receptors in hepatocellular carcinoma
PENG Wen-ting,SUN Wu-yi,LIXin-ran,SUN Jia-chang,WEIWei
(Institute of ClinicalPharmacology,AnhuiMedicalUniversity,Key Laboratory of Antiinflammatory and Immune Medicine,Ministry of Education,Collaborative Innovation Center of Anti-inflammatory and Immune Medicines,Hefei 230032,China)
G protein-coupled receptors(GPCRs),also known as seven-transmembrane domain receptors,constitute the largest superfamily of cellsurface receptors.By coupling to heterotrimeric G proteins,arrestins and other signaling molecules,GPCRs modulate diverse signal transduction pathways under physiologicaland pathologicalconditions.Recentstudies have revealed crucialroles of GPCRsin tumorigenesis and development of cancer metastasis.This review summarizes roles of GPCRs, particularly the roles ofthose coupled to chemokines,prostaglandin,lysophosphatidic acid,endothelin, catecholamine and angiotensin in proliferation,invasion,metastasis and angiogenesis of hepatoma cells and development of hepatocellular carcinoma.The potential of GPCRs-based therapeutics being used for hepatocellular carcinoma is also highlighted.
G protein coupled receptor;hepatocellular carcinoma;chemokines;lysophosphatidic acid;adrenergic receptor;signaltransduction
SUN Wu-yi,E-mail:sunwuyi51@aliyun.com,Tel:(0551)65161206;WEIWei,E-mail:wwei@ahmu. edu.cn,Tel:(0551)65161209
R730.23
:A
:1000-3002-(2016)11-0358-09
10.3867/j.issn.1000-3002.2017.04.010
Foundation item:The project supported by National Natural Science Foundation of China(81300332);National Natural Science Foundation of China(81330081);National Natural Science Foundation of China(81673444);and Natural Science Foundation ofthe Higher Education Institutions of AnhuiProvince(KJ2012A153)
2016-12-06接受日期:2017-04-12)
(本文编辑:齐春会)
国家自然科学基金(81300332);国家自然科学基金(813300810);国家自然科学基金(81673444);安徽省高等学校省级自然科学研究项目(KJ2012A153)
彭文婷,女,硕士研究生,主要从事肝脏药理学研究。
孙妩弋,E-mail:sunwuyi51@aliyun.com,Tel:(0551)65161206;魏伟,E-mail:wwei@ahmu.edu.cn,Tel:(0551)65161209
