丁氟螨酯对SH-SY5Y细胞的毒性作用及其机制
2017-06-01赵海洲陈永星李楠杨旭李赛男刘文华
赵海洲,陈永星,李楠,杨旭,李赛男,刘文华
(肇庆学院生命科学学院,广东肇庆526061)
丁氟螨酯对SH-SY5Y细胞的毒性作用及其机制
赵海洲,陈永星,李楠,杨旭,李赛男,刘文华
(肇庆学院生命科学学院,广东肇庆526061)
目的研究丁氟螨酯对人经神经母细胞瘤细胞SH-SY5Y细胞的毒性作用及其机制。方法加入丁氟螨酯0.03,0.06,0.125,0.25,0.5,1,2,2.6,4,6,8和16 mmol·L-1处理SH-SY5Y细胞48 h,MTT法测定细胞存活;DCFH-DA荧光探针标记法检测细胞内活性氧(ROS)水平;JC-1标记法检测细胞线粒体膜电位;Hoechst33258染色观察细胞核形态;碘化丙啶(PI)染色和流式细胞仪检测细胞周期和细胞凋亡;Western蛋白印迹法检测磷酸化P38蛋白(p-P38)和磷酸化Jun激酶(p-JNK)表达水平。结果与溶剂(DMSO)对照组相比,共孵育48 h后,丁氟螨酯≥0.06 mmol·L-1时可降低细胞存活率(P<0.05),且随浓度增高细胞存活率有降低趋势,IC50为2.6 mmol·L-1;丁氟螨酯1,2,4和6 mmol·L-1组细胞ROS水平升高(P<0.01),线粒体膜电位下降(P<0.01)。Hoechst 33258染色结果显示,丁氟螨酯2,4和6 mmol·L-1组SH-SY5Y细胞出现颗粒状荧光,细胞核固缩和崩解;流式细胞仪检测结果显示,丁氟螨酯2,4和6 mmol·L-1组细胞凋亡率由DMSO对照组的(0.7±0.1)%分别上升至(6.7±0.1)%,(72.4±8.6)%和(90.7±3.2)%(P<0.01);丁氟螨酯4和6 mmol·L-1组G1期细胞较DMSO对照组明显增加(P<0.01);Western蛋白印迹结果表明,丁氟螨酯4和6 mmol·L-1组p-JNK表达均升高(P<0.01),丁氟螨酯6 mmol·L-1组p-P38表达水平增加(P<0.01)。结论丁氟螨酯可能通过氧化损伤、激活P38蛋白和JNK蛋白诱导SH-SY5Y细胞G1期阻滞和凋亡。
丁氟螨酯;SH-SY5Y细胞;细胞凋亡;活性氧;应激反应
帕金森病(Parkinson disease,PD)是一种常见的神经退行性疾病,其主要病理特征是中脑黑质多巴胺能神经元的进行性死亡,其致病原因主要有年龄老化、遗传因素和环境毒素等[1-2]。含氟农药主要用作杀虫剂、除草剂和杀螨剂等,在农业生产以及日常生活中使用较为普遍,一般认为这类农药对人的毒性相对较小[3]。但近期研究表明,含氟农药可能具有潜在的神经毒性,如氟虫腈引起人神经母细胞瘤细胞SH-SY5Y细胞凋亡[4];大鼠黑质纹状体多巴胺能神经元减少[5];高效三氟氯氰菊酯降低发育期大鼠纹状体酪氨酸羟化酶蛋白表达[6];氟啶胺引起SH-SY5Y细胞凋亡[7]。
丁氟螨酯(cyflumetofen)是由日本大冢公司开发的新型含氟农药,于2007年获准公开销售,主要用于果树、蔬菜和茶树等农作物和花卉上螨虫、红蜘蛛的防治,尤其对幼螨的杀毒作用更强。丁氟螨酯对螨虫和红蜘蛛具有特异性毒杀效果,对昆虫类和鱼类等其他生物的毒性较低,其防治效果较以往的杀螨剂具有较大优势,一般认为丁氟螨酯杀螨毒性专一,对其他物种毒性较小。目前研究主要集中在合成、活性研究及环境残留测定上[8-10]。联合国粮农组织和世界卫生组织会议证实,丁氟螨酯对于雄性大鼠具有潜在的致癌作用[11]。Yoshida等[12]发现,丁氟螨酯长期经胃给药引起大鼠肝、肾肿大,肾上腺皮质细胞空泡化。Li等[13]认为,丁氟螨酯在水中的主要降解产物B-3具有较强的致突变作用。丁氟螨酯已在15个国家广泛注册和应用[14],但关于其神经毒性方面的研究未见文献报道。因此,开展其神经毒性的研究具有重要意义。
SH-SY5Y细胞的形态和生理生化功能类似于神经细胞,常作为细胞模型用于神经毒理药理研究[15]。本研究使用SH-SY5Y细胞研究丁氟螨酯的毒性作用,并进一步探讨其毒性机制,为该农药的合理使用提供理论和技术支持。
1 材料与方法
1.1 细胞、试剂和主要仪器
SH-SY5Y细胞购自中山大学细胞库;丁氟螨酯(纯度95%,美国Alfa Chemistry公司);胎牛血清、DMEM高糖培养基、青链霉素、胰蛋白酶和PBS(美国Gibco公司);MTT、DMSO、Hoechst 33258和碘化丙锭(美国Sigma公司);活性氧(reactive oxy⁃gen species,ROS)、线粒体膜电位(△Ψm)、BCA蛋白质定量试剂盒及细胞裂解液(江苏碧云天公司);ECL发光液(上海天能科技有限公司);兔抗人Jun激酶(Jun kinase,JNK)2/MBP多克隆抗体、兔抗人磷酸化SAPK/JNK(p-JNK)(Thr183/Tyr185)(81E11)单克隆抗体、兔抗人P38蛋白(D13E1)XP单克隆抗体和兔抗人磷酸化P38蛋白(p-P38)(Thr180/Tyr182)(12F8)单克隆抗体(美国Cell Signaling Technology公司);兔抗人β肌动蛋白多克隆抗体(美国Santa Cruz Biotechnology公司);HRP标记山羊抗兔IgG二抗(美国Merck Millipore公司);其余试剂均为市售国产分析纯。
HEARACELL 150i二氧化碳培养箱和离心机(美国Thermo Fisher Scientific公司);ELx800型酶标仪(美国BioTek公司);ECLIPSE TS100倒置和ECLIPSE Ci正置荧光显微镜(日本Nikon公司);FC500流式细胞仪(美国Beckman Coulter公司);Tanon 4200全自动化学发光成像分析系统(上海天能科技有限公司)。
1.2 细胞培养
SH-SY5Y细胞用含10%胎牛血清、青霉素100 kU·L-1及链霉素100 mg·L-1的高糖DMEM培养基在恒温37℃、含5%CO2的细胞培养箱中培养,每隔2~3 d传代1次,用对数期细胞进行实验。
1.3 MTT法检测细胞存活
每孔1×104个SH-SY5Y细胞接种于96孔培养板,培养24 h后用于实验。丁氟螨酯用DMSO溶解,初浓度为1 mol·L-1,使用时用不含血清的DMEM培养基稀释后加入96孔板中,药物终浓度范围0.03~16 mmol·L-1。实验设立空白组(只有培养基,无细胞)、溶剂(0.09%DMSO)对照组和丁氟螨酯(0.03~16 mmol·L-110个浓度梯度)组,每组设3复孔,作用48 h后每孔加入200μL MTT(0.5 g·L-1),孵育4 h,弃上清,加入200μL DMSO溶解甲瓒,酶标仪测吸光度值(A490nm)。细胞存活率(%)=(药物组A490nm-空白组A490nm)/(对照组A490nm-空白组A490nm)×100%,实验重复3次。使用Excel自带函数拟合曲线,结合实验数据作图得出IC50[16]。
1.4 荧光探针DCFH-DA检测SH-SY5Y细胞中ROS水平
每孔6×104个SH-SY5Y细胞接种于24孔培养板,设丁氟螨酯1,2,4和6 mmol·L-1组,同时设溶剂(DMSO)对照组,培养48 h后细胞染色。参照ROS检测试剂盒说明书用荧光探针DCFH-DA进行ROS检测。荧光显微镜下随机选取视野拍照,用荧光强度对ROS进行半定量分析。实验重复3次。
1.5 JC-1荧光探针检测线粒体膜电位
按1.4分组处理细胞,参考线粒体膜电位检测试剂盒说明书用JC-1荧光探针检测线粒体膜电位,荧光显微镜下随机选取视野拍照,实验重复3次。在线粒体膜电位较高时,JC-1聚集在线粒体的基质中,形成聚合物,可产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体,可以产生绿色荧光。用红绿荧光的比值表示线粒体膜电位。实验重复3次。
1.6 Hoechst33258染色观察细胞核
24孔板中加入无菌玻片,使用100 mg·L-1多聚赖氨酸浸泡30 min,PBS洗3次,每孔接种6×104细胞。设丁氟螨酯2,4和6 mmol·L-1处理组,同时设溶剂(DMSO)对照组,细胞培养48 h后,加入4%多聚甲醛固定液于4℃作用15 min,PBS洗2次,然后加入Hoechst 33258 10 mg·L-1室温避光染色10 min,PBS洗2次。将玻片取出,倒扣于载玻片上,随机选取视野在荧光显微镜下拍照,观察细胞核形态改变。实验重复3次。
1.7 流式细胞仪检测细胞周期和凋亡
按1.6分组处理细胞,细胞培养48 h后,0.25%胰酶消化,取细胞1×106~2×106,3 mL PBS洗1次,3 mL预冷PBS重悬细胞,1000×g离心5 min,弃上清。加入500μL PBS,轻轻重悬细胞,使细胞分离为单个细胞,用终浓度75%乙醇-20℃过夜固定。上机前,取固定好的细胞,4℃,1000×g离心5 min,弃固定液,用预冷PBS洗涤细胞1次以去除乙醇,4℃,1000×g离心5 min,弃上清。加500μL预冷PBS重悬细胞,加50μL RNA酶(1 g·L-1),37℃水浴30 min。之后加碘化丙锭(终浓度为50 mg·L-1,含0.1%Triton X-100),4℃避光染色30 min。细胞转移至流式管,使用流式细胞仪收集3×104细胞检测细胞凋亡和细胞周期。细胞凋亡率(%)=亚二倍体峰细胞数/总细胞数×100%。激发波长488 nm,发射波长630 nm。
1.8 Western蛋白印迹法检测P38和JNK蛋白表达
SH-SY5Y细胞接种于6 cm培养皿,待第2天细胞达到70%~80%融合度,按1.6分组处理细胞,用PBS洗2次,加入细胞裂解液,4℃摇床轻轻振荡裂解细胞,15 000×g离心15 min后吸取上清,BCA法测定总蛋白质含量。Western蛋白印迹检测应激蛋白P38,p-P38,JNK和p-JNK的表达。以Image J软件分析各条带积分吸光度(integrated absorbance,IA),待测蛋白的相对表达水平用IA目标蛋白/IAβ肌动蛋白的比值表示。
1.9 统计学分析
实验结果数据以x±s表示,采用SPSS 22.0软件进行单因素方差分析(ANOVA)和t检验,P<0.05认为差异具有统计学意义。
2 结果
2.1 丁氟螨酯对细胞存活率的影响
不同浓度丁氟螨酯处理SH-SY5Y细胞48 h细胞存活率见图1。与DMSO对照组相比,丁氟螨酯0.06 mmol·L-1时SH-SY5Y细胞存活率开始下降(P<0.05);<2 mmol·L-1时细胞存活率降低较缓慢(P<0.01);>2 mmol·L-1时细胞存活率迅速降低(P<0.01)。随着丁氟螨酯浓度增加,其对细胞的抑制作用有增强趋势,48 h半数抑制浓度(IC50)为2.6 mmol·L-1。

Fig.1 Effect of cyflumetofen on cell viability by MTT assay.SH-SY5Y cells were exposed to different concentra⁃tions of cyflumetofen for 48 h at 37°C.x±s,n=3.*P<0.05,**P<0.01,compared with DMSO control(0)group.
2.2 丁氟螨酯对SH-SY5Y细胞氧化应激的影响
相差显微镜明场照片表明(图2A),DMSO对照组细胞形态正常,呈梭形;丁氟螨酯1 mmol·L-1尚未改变细胞形态;2 mmol·L-1组部分细胞异常变圆;4和6 mmol·L-1组细胞形态变化较大,全部皱缩变圆。
DCFH-DA探针结果(图2A和B)表明,与DMSO对照组相比,丁氟螨酯1,2,4和6 mmol·L-1组SH-SY5Y细胞ROS水平显著增加(P<0.01),丁氟螨酯1和2 mmol·L-1组细胞ROS分别是DMSO对照组的25和31倍,丁氟螨酯4和6 mmol·L-1组均是DMSO对照组的6倍。

Fig.2 Effect of cyflumetofen on reactive oxygen species(ROS)levels in SH-SY5Y cells detected by DCFH-DA staining.SH-SY5Y cells were treated with cyflumetofen for 48 h. A:the morphology in light field and ROS fluorography,respec⁃tively;B:semi-quantitative resultof ROS.FI:fluorescence intensity. x±s,n=3.**P<0.01,compared with DMSO control(0)group.
2.3 丁氟螨酯对SH-SY5Y细胞线粒体膜电位的影响
JC-1探针结果(图3)表明,DMSO对照组显示明显红色荧光,红绿荧光比为7.3;丁氟螨酯1,2,4和6 mmol·L-1组绿荧光逐渐增强,红绿荧光比分别下降至3.0,1.8,0.7和0.3(P<0.01)。提示丁氟螨酯1,2,4和6 mmol·L-1组线粒体膜电位较DMSO对照组下降。
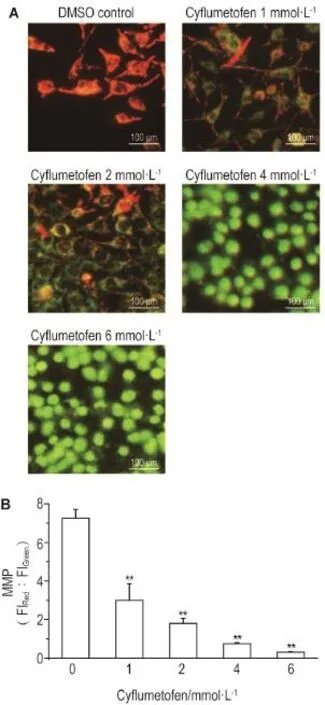
Fig.3 Effect of cyflumetofen on mitochondrial membrane potential(MMP)in SH-SY5Y cells detected by JC-1 staining.See Fig.2 for the cell treatment.B:the semi-quantita⁃tive result of A.x±s,n=3.**P<0.01,compared with DMSO con⁃trol(0)group.
2.4 丁氟螨酯对SH-SY5Y细胞核形态的影响
Hoechst 33258细胞核染色结果显示(图4),DMSO对照组细胞表现为弥漫均匀的低强度荧光,丁氟螨酯2 mmol·L-1组部分细胞有颗粒状亮蓝色点状荧光。与DMSO对照组相比,丁氟螨酯4和6 mmol·L-1组细胞主要表现为核固缩变小,亮蓝色点状聚集颗粒状荧光;有部分细胞的细胞核已发生崩解。上述结果从细胞核形态上验证了细胞凋亡的发生。

Fig.4 Effect of cyflumetofen on SH-SY5Y cell nuclei by Hoechst33258 staining.See Fig.2 for the celltreatment.↑:nucleic accumulation and nuclear shrinkage;△:nuclear dis⁃integration.
2.5 丁氟螨酯对SH-SY5Y细胞周期和细胞凋亡的影响
细胞周期分析(表1)发现,与DMSO对照组相比,丁氟螨酯4和6 mmol·L-1组G1期细胞比例由48.0%分别上升至61.1%和89.8%(P<0.01)。流式结果(图5)显示,与DMSO对照组相比,经丁氟螨酯2,4和6 mmol·L-1处理的SH-SY5Y细胞在48 h均检测到明显的亚二倍体峰,细胞凋亡率由(0.7± 0.1)%分别上升至(6.7±0.1)%,(72.4±8.6)%和(90.7±3.2)%(n=3,P<0.01)。

Tab.1 Effect of cyflumetofen on cell cycle of SH-SY5Y cells detected by flow cytometry
2.6 丁氟螨酯对SH-SY5Y细胞p-JNK和p-P38表达的影响
Western蛋白印迹结果(图6)显示,与DMSO对照组相比,丁氟螨酯4和6 mmol·L-1作用48 h后,细胞p-JNK表达明显增加(P<0.01);丁氟螨酯6 mmol·L-1使p-P38表达显著增加(P<0.01)。丁氟螨酯对细胞JNK和P38的表达水平没有影响(数据略)。

Fig.5 Effect of cyflumetofen on apoptosis of SH-SY5Y cells detected by flow cytometry.A,B,C and D:cyflumetofen 0,2,4 and 6 mmol·L-1group,respectively.

Fig.6 Effect of cyflumetofen on expression of phos⁃phorylated Jun kinase(p-JNK)and p-P38 in SH-SY5Y cells detected by Western blotting.See Fig.2 for the cell treatment.IA:integrated absorbance.B is the semi-quantitative re⁃sult of A.x±s,n=3.**P<0.01,compared with DMSO control(0)group.
3 讨论
丁氟螨酯于2007年批准上市,目前关于其神经毒理作用暂未见报道。本研究使用SH-SY5Y细胞模型,评价丁氟螨酯的神经毒性和作用机制。研究结果表明,丁氟螨酯0.06 mmol·L-1即能显著抑制细胞生长,随浓度的增加,抑制效果有增强趋势,IC50为2.6 mmol·L-1。丁氟螨酯4和6 mmol·L-1作用48 h后,Hoechst33258染色显示细胞核出现皱缩和大量的凋亡小体。流式细胞仪测定结果表明,在G1峰的左侧检测到亚二倍体峰,提示细胞发生了凋亡,出现细胞G1期阻滞。
环境毒素是散发性PD的主要致病原因,而农药及其残留物是环境毒素的重要来源之一。目前,杀虫剂和除草剂等农药在粮食生产、蔬菜水果和园林绿化等领域普遍使用,给人们带来了重大的安全隐患。一些以前认为是“安全”的农药,采用新检测方法和新毒理模型后,其毒性作用被逐步发现。
PD的病理原因是由于中脑黑质多巴胺能神经元发生退行性死亡,并导致纹状体中多巴胺递质含量减少而发生的。氧化损伤被认为是引起细胞损伤、衰老、凋亡及死亡的重要原因。在过度氧化应激状态下,细胞内ROS急剧增加,导致线粒体膜电位改变、线粒体DNA及电子传递链损伤,线粒体功能失调,最终导致神经元变性死亡[17-18]。线粒体膜通透性增加,膜电位降低是细胞早期凋亡的标志。本研究结果表明,丁氟螨酯1和2 mmol·L-1对SH-SY5Y细胞生长抑制作用还相对较小,细胞形态基本正常,但细胞内ROS水平已急剧升高;4和6 mmol·L-1组ROS水平比1和2 mmol·L-1组相对较低,其原因可能是4和6 mmol·L-1组细胞已大量死亡并裂解。线粒体膜电位结果显示,丁氟螨酯1 mmol·L-1即引起线粒体膜电位显著降低。上述结果表明,丁氟螨酯可以引起SH-SY5Y细胞氧化损伤,在高浓度的丁氟螨酯作用下,这种损伤又导致了细胞凋亡和坏死。
细胞凋亡的过程十分复杂多样。多个研究表明,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族成员JNK和P38参与了凋亡过程调节。百草枯和鱼藤酮通过激活JNK诱导多巴胺能神经细胞凋亡[19-20];P38的激活参与多巴胺能神经元凋亡、促进PD进程[21-22]。但也有研究报道JNK和P38的激活能够抑制细胞凋亡、增加细胞存活率[23]。本研究结果显示,丁氟螨酯2 mmol·L-1作用48 h对p-JNK和p-P38的表达都没有影响;4 mmol·L-1作用后引起p-JNK显著升高;6 mmol·L-1作用后p-JNK进一步升高,p-P38也明显增加。这些结果与上述丁氟螨酯4和6 mmol·L-1显著抑制SH-SY5Y存活、诱导细胞大量凋亡具相关性,提示JNK和P38参与了丁氟螨酯诱导的SH-SY5Y细胞毒性过程。
综上所述,本研究发现,丁氟螨酯对SH-SY5Y细胞具有毒性损伤作用,并诱导细胞凋亡和G1期阻滞,其信号通路可能与氧化应激引起的线粒体功能失调、以及应激蛋白JNK和P38的激活有关。丁氟螨酯属新型农药,在国内的需求将可能稳定增长。因此,对其进行全面系统的毒理作用研究十分紧迫和必要。
[1]Gao HM.Research progress in effect of pesticide exposure on pathogenesis of neurodegenerative diseases[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2013,27(S1):30.
[2]Polito L,Greco A,Seripa D.Genetic profile,environmental exposure,and their interaction in Parkinson′s disease[J].Parkinsons Dis.2016,2016(4):1-9.
[3]Zou JL,LI S.Progress of organic fluorine pesticides[J].J Hubei Nor Univ(Nat Sci)〔湖北师范学院学报(自然科学版)〕,1987,(1):63-75.
[4]Vidau C,González-Polo RA,Niso-Santano M,Gómez-Sánchez R,Bravo-San Pedro JM,Pizarro-Estrella E,et al.Fipronil is a powerful uncoupler of oxidative phosphorylation that triggers apoptosis in human neuronal cell line SH-SY5Y[J].Neuro⁃toxicology,2011,32(6):935-943.
[5]Park JH,Park YS,Koh HC.Progressive loss of nigrostriatal dopaminergic neurons induced by inflammatory responses to fipronil[J].Toxicol Lett,2016,258:36-45.
[6]Ansari RW,Shukla RK,Yadav RS,Seth K,Pant AB,Singh D,et al.Involvement of dopaminergic and serotonergic systems in the neurobe⁃havioral toxicity of lambda-cyhalothrin in developing rats[J].Toxicol Lett,2012,211(1):1-9.
[7]Lee JE,Kang JS,Shin IC,Lee SJ,Hyun DH,Lee KS,et al.Fluazinam-induced apoptosis of SHSY5Y cells is mediated by p53 and Bcl-2 family proteins[J].Neurotoxicology,2011,32(6):702-710.
[8]Chai BS,Liu YX,Yang JC,Liu CL.Recentadvance on development of insecticide and acaricide[J]. Agrochemicals(农药),2007,46(12):800-805,809.
[9]Li Y,Zhang H,Liu YX,Zhou YP,Luo YM,Liu CL. Synthesis and acaricidal activities of cyflumetofen[J].Agrochemicals(农药),2009,48(7):474-475,478.
[10]Li MM.Study on residue and environmentalbehavior of the acaricide cyflumetofen(杀螨剂丁氟螨酯残留分析及环境降解行为研究)[D].Harbin:Northeast AgriculturalUniversity(东北农业大学),2013.
[11]Liu N,Dong F,Xu J,Liu X,Chen Z,Pan X,et al.Enantioselective separation and pharmacoki⁃netic dissipation of cyflumetofen in field soil by ultra-performance convergence chromatography with tandem mass spectrometry[J].J Sep Sci,2016,39(7):1363-1370.
[12]Yoshida T,Ikemi N,TakeuchiY,Ebino K,Kojima S,Chiba Y,et al.A repeated dose 90-day oral toxicity study of cyflumetofen,a novel acaricide,in rats[J].J ToxicolSci,2012,37(1):91-104.
[13]Li M,Liu X,Dong F,Xu J,Kong Z,Li Y,et al. Simultaneous determination of cyflumetofen and its main metabolite residues in samples of plant and animal origin using multi-walled carbon nano⁃tubes in dispersive solid-phase extraction and ultra⁃high performance liquid chromatography-tandem mass spectrometry[J].J Chromatogr A,2013,1300(2):95-103.
[14]Takahashi N,Nakagawa H,Sasama Y,Ikemi N. Development of a new acaricide,cyflumetofen[J]. J Pestic Sci,2012,37(3):263-264.
[15]Nicolini G,Miloso M,Zoia C,Di Silvestro A,Cavaletti G,Tredici G.Retinoic acid differentiated SH-SY5Y human neuroblastoma cells:an in vitro model to assess drug neurotoxicity[J].Anticancer Res,1998,18(4A):2477-2481.
[16]Zhao B,Ge JF,Zhu JJ,Huang XH,Li J.Discus⁃sion on the method of calculating IC50in MTT assay of cell proliferation iInhibition[J].Anhui Med Pharm J(安徽医药),2007,11(9):834-836.
[17]Orth M,Schapira AH.Mitochondrial involvement in Parkinson′s disease[J].Neurochem Int,2002,40(6):533-541.
[18]Park CB,Larsson NG.Mitochondrial DNA muta⁃tions in disease and aging[J].J Cell Biol,2011,193(5):809-818.
[19]Peng J,Mao XO,Stevenson FF,Hsu M,Andersen JK.The herbicide paraquat induces dopaminergic nigral apoptosis through sustained activation of the JNK pathway[J].J Biol Chem,2004,279(31):32626-32632.
[20]Klintworth H,Newhouse K,Li T,Choi WS,Faigle R,Xia Z.Activation of c-Jun N-terminal protein kinase is a common mechanism underlying paraquat-and rotenone-induced dopaminergic cell apoptosis[J].Toxicol Sci,2007,97(1):149-162.
[21]Karunakaran S,Saeed U,Mishra M,Valli RK,Joshi SD,Meka DP,et al.Selective activation of p38 mitogen-activated protein kinase in dopaminergic neurons of substantia nigra leads to nuclear trans⁃location ofp53 in 1-methyl-4-phenyl-1,2,3,6-tetra⁃hydropyridine-treated mice[J].J Neurosci,2008,28(47):12500-12509.
[22]Jha SK,Jha NK,Kar R,Ambasta RK,Kumar P. p38 MAPK and PI3K/AKT signalling cascades in Parkinson′s disease[J].Int J Mol Cell Med,2015,4(2):67-86.
[23]Liang XM,Yang KD.Caspase,JNK/SAPK,p38 MAPK and apoptosis[J].Foreign Med Sci(Hygiene)(国外医学卫生学分册),2008,35(1):5-10.
Cytotoxicity of cyflumetofen on SH-SY5Y cells and possible mechanism
ZHAO Hai-zhou,CHEN Yong-xing,LI Nan,YANG Xu,LISai-nan,LIU Wen-hua
(Schoolof Life Sciences,Zhaoqing University,Zhaoqin g 526061,China)
OBJECTIVETo investigate the cytotoxicity of cyflumetofen for SH-SY5Y cells and the mechanism.METHODSSH-SY5Y cells treated with cyflumetofen 0.03,0.06,0.125,0.25,0.5,1,2,2.6, 4,6,8 and 16 mmol·L-1for 48 h.Cellsurvivalwas measured with MTT assay.The reactive oxygen species (ROS)was determined with the DCFH-DA probe,and mitochondrialmembrane potential(MMP)was detected by JC-1 staining.The morphologicalchanges in cellnucleiwere observed with Hoechst33258 staining.Cellcycle and apoptosis were determined by flow cytometry.The protein levels ofphosphorylated Jun Kinase(p-JNK)and p-P38 were measured by Western blotting.RESULTSCompared with solvent (DMSO)control group,cyflumetofen(≥0.06 mmol·L-1)inhibited the proliferation of SH-SY5Y cells obviously(P<0.05),and the IC50was 2.6 mmol·L-1.MMP declined and ROS levels increased significantly in cyflumetofen 1,2,4 and 6 mmol·L-1groups(P<0.01).Cyflumetofen 2,4 and 6 mmol·L-1induced nucleic accumulation,nuclear shrinkage and disintegration in SH-SY5Y cells.Apoptosis rates of cyflu⁃metofen 2,4 and 6 mmol·L-1groups increased from(0.7±0.1)%in DMSO controlgroup to(6.7±0.1)%, (72.4±8.6)%and(90.7±3.2)%(P<0.01).Cyflumetofen 4 and 6 mmol·L-1induced G1phase cellcycle arrest(P<0.01).In addition,Western blotting showed thatcyflumetofen 4 and 6 mmol·L-1up-regulated the expression ofp-JNK(P<0.01),while the levelofp-P38 in SH-SY5Y cells was increased in cyflumetofen 6 mmol·L-1group(P<0.01).CONCLUSIONCyflumetofen induces cell damage,apoptosis and G1phase cellcycle arrest in SH-SY5Y cells.The mechanism may be associated with oxidative damage, and activation of P38 and JNK stress-response pathways.
cyflumetofen;SH-SY5Y cells;apoptosis;reactive oxygen species;stress reaction
LIU Wen-hua,E-mail:wenhualiu@hotmail.com
R994.6,R996
:A
:1000-3002-(2017)04-0318-07
10.3867/j.issn.1000-3002.2017.04.004
Foundation item:The project supported by National Natural Science Foundation of China(31271124);Major Project of Bureau of Education of Guangdong Province(2014KZDXM075);and Innovation Team Project of Bureau of Education of Guangdong Province(2015KCXTD032)
2016-08-24接受日期:2017-03-16)
(本文编辑:贺云霞)
国家自然科学基金项目(31271124);广东省教育厅重大项目(2014KZDXM075);广东省教育厅创新团队项目(2015KCXTD032)
赵海洲,硕士,研究实习员,主要从事神经药理毒理学研究。
刘文华,E-mail:wenhualiu@hotmail.com
