麦冬皂苷D′对大鼠心肌细胞H9c2的细胞毒性
2017-06-01任思嘉徐焕华李明郝斐然马增春汤响林梁乾德谭洪玲肖成荣王宇光高月
任思嘉,徐焕华,李明,郝斐然,马增春,汤响林,梁乾德,谭洪玲,肖成荣,王宇光,高月
(1.广西医科大学药学院,广西南宁530021;2.军事医学科学院放射与辐射医学研究所药理毒理研究室,北京100850)
麦冬皂苷D′对大鼠心肌细胞H9c2的细胞毒性
任思嘉1,2,徐焕华2,李明2,郝斐然2,马增春2,汤响林2,梁乾德2,谭洪玲2,肖成荣2,王宇光2,高月1,2
(1.广西医科大学药学院,广西南宁530021;2.军事医学科学院放射与辐射医学研究所药理毒理研究室,北京100850)
目的研究麦冬皂苷D′对大鼠心肌细胞H9c2的细胞毒性作用,初步探讨其作用机制,为寻找其临床安全使用剂量提供依据。方法麦冬皂苷D′0.1,1,5,10,20,25和50μmol∙L-1作用于H9c2细胞24 h。MTS法检测细胞存活率及其IC50;荧光显微镜观察细胞形态变化;高内涵免疫荧光筛选检测细胞核数目变化;流式细胞仪检测其活性氧生成、线粒体膜电位和细胞凋亡率。结果麦冬皂苷D′0.1,1,5,10,20,25和50μmol∙L-1作用于H9c2细胞24 h后,细胞存活率分别为108.9%,106.3%,91.9%,61.0%,24.8%,24.7%和24.2%,IC50为9.9μmol·L-1;荧光显微镜检测显示细胞皱缩;高内涵免疫荧光检测显示细胞核数目减少(P<0.05)。流式细胞术检测显示,麦冬皂苷D′0.1,1,5和10μmol·L-1显著升高活性氧生成量(P<0.05),降低线粒体膜电位(P<0.05),升高细胞凋亡率(P<0.05)。结论麦冬皂苷D′对H9c2心肌细胞有明显的细胞毒性作用,该作用可能与其激活细胞凋亡通路有关。
麦冬皂苷D′;H9c2细胞;毒性作用
麦冬(Ophiopogon japonicus Lf.Ker Gawl)具有养阴生津、润肺清心的功效[1]。现代研究发现,麦冬对于心律失常和心肌缺血等疾病都具有一定的疗效[2-4]。常用麦冬的复方制剂,如由红参和麦冬2味中药配伍而成参麦注射液,是临床常用的治疗冠心病等心脏疾病的一线用药[5-6]。使用高效液相色谱-质谱联用(HPLC-MS/MS)等方法测定参麦注射液成分发现,其主要成分为人参皂苷和麦冬皂苷[7],其中麦冬皂苷具有广泛的药理作用,不仅能增加心肌收缩力,抑制心血管疾病进程[8-9],同时对癌症也有一定的抑制作用[10]。麦冬皂苷有效成分是麦冬皂苷D(ophiopogonin D,OPD)和麦冬皂苷D′(ophiopogonin D′,OPD′)[11]。贾诚等[12]建立了利用高效液相色谱-蒸发光散射(HPLC-ELSD)检测OPD和OPD′含量的方法,提出将具有多种药理活性的OPD和OPD′作为麦冬药材质量标准的研究对象,并把二者在麦冬药材中的含量检测定为麦冬质量控制的1个重要指标。
本实验室前期研究了参麦注射液中的OPD的药物结构和药理作用[13-15]。研究显示,OPD结构含有五碳糖基、甲基五碳糖基和岩藻糖基各1个,这种特殊结构可使OPD通过诱导细胞色素P450酶2J实现对细胞内Ca2+稳态调控,从而抑制氧化应激,减少心肌细胞凋亡[14]。同时,OPD通过抑制c-Jun氨基末端激酶和细胞外调节蛋白激酶通路,降低活性氧(reative oxygen species,ROS),有效缓解由多柔比星(doxorubicin,DOX)引起的细胞自噬[15]。高浓度OPD也可通过阻滞乳腺癌细胞分裂周期,使细胞停滞在G0/M期,诱导乳腺癌细胞凋亡[16]。而与OPD结构相似的OPD′却未见其药理毒理相关研究报道。本实验室研究发现,OPD结构(图1A)中含有岩藻糖取代基的部分在OPD′(图1B)为葡萄糖取代基。为此,本研究探讨OPD′对心肌H9c2细胞的毒性作用。
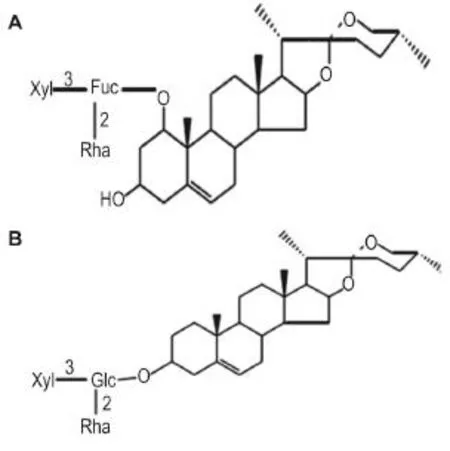
Fig.1 Structure ofophiopogonin D(OPD′,A)and OPD′(B).
1 材料与方法
1.1 药品、细胞、试剂和仪器
OPD′购自上海一飞生物科技有限公司,用二甲亚砜分别配制为1和20 mmol∙L-1母液保存于-20℃;H9c2心肌细胞购自北京协和细胞库中心;澳洲胎牛血清(fetalbovine serum,FBS)购自GenStar康润生物科技有限公司;DMEM细胞培养基、磷酸盐缓冲液(phosphate buffered saline,PBS)、青霉素、链霉素和胰蛋白酶购自美国Gibco BRL公司;细胞核染料Hoechst 33342购自美国Thermo Life公司;MTS细胞毒性检测试剂盒购自美国Promega公司;ROS和线粒体膜电位检测试剂盒(JC-1)购自碧云天生物技术研究所;AnnexinⅤ-FITC/PI细胞凋亡试剂盒购自天津三箭生物技术股份有限公司。
FC500MCL型流式细胞仪,美国Beckman公司;Axiover200荧光分析显微镜,德国ZEISS公司;VICTOR X型多标记酶标仪,美国Perkin Elmer公司;Microfuge 22R型离心机,美国Beckman公司;细胞培养箱和超净台等均来自军事医学科学院药品器材供应站。
1.2 H9c2心肌细胞培养
大鼠心肌细胞H9c2为贴壁细胞,培养于含有10%FBS和双抗的DMEM培养基中,置于5%CO2,37℃恒温培养箱,待细胞生长至约80%时,用0.25%胰蛋白酶消化,传代。平均2~3 d传代1次,取对数生长期细胞进行实验。
1.3 H9c2心肌细胞形态的观察
将H9c2细胞接种于12孔板培养24 h,待细胞贴壁生长至约80%后弃去培养基,用PBS洗去未贴壁细胞。将OPD′以不含血清、不含双抗的DMEM稀释并加入贴壁的H9c2细胞,OPD′终浓度为0.1,1,5,10,20,25和50μmol·L-1,培养24 h,在Axiover200荧光分析显微镜下观察细胞形态,并拍照。
1.4 MTS检测H9c2细胞存活率
将H9c2细胞用0.25%胰蛋白酶消化,一次性吸管轻轻吹打成单细胞悬液,均匀接种于96孔板,每孔150μL。待细胞贴壁生长至约80%后弃去培养基,用PBS洗去未贴壁细胞。设细胞对照组和OPD′0.1,1,5,10,20,25和50μmol∙L-1组,并设调零对照组。OPD′与H9c2细胞孵育24 h弃去培养上清,每孔加MTS 20μL和不含血清培养基100μL,将96孔板于37℃孵育0.5~1 h。用酶标仪测定480 nm处吸光度值(A480nm),GraphPad Prism 5.0计算其IC50。细胞存活率(%)=(给药组A480nm-调零组A480nm/细胞对照组A480nm-调零组A480nm)× 100%。
1.5 高内涵免疫荧光筛选检测细胞核数目面积
将H9c2细胞按照1.4处理,于培养箱中孵育24 h。用不含血清DMEM培养基将Hoechst 33342稀释至5μmol·L-1,每孔加50μL,置37℃孵育0.5~1 h后,每孔加100μL预温至室温的含12%甲醛的PBS,室温避光固定细胞20 min。弃去上清液,每孔200μL PBS清洗细胞3次,最终每孔加PBS 200μL,用高内函分析系统计数荧光阳性细胞核数目,并计算细胞核面积。
1.6 流式细胞术检测活性氧含量
取对数生长期的H9c2细胞,接种于6孔板培养,待细胞贴壁生长后,弃去含血清的培养液,用PBS洗去未贴壁细胞。设细胞对照组和OPD′0.1,1,5和10μmol∙L-1组,同时增加试剂盒中Rosup试剂为阳性对照组,置5%CO2,37℃恒温培养箱中孵育24 h。按照ROS检测试剂盒说明书操作,流式细胞仪进行检测。其激发波长为485 nm,发射光波长为530 nm,测定荧光强度。
1.7 流式细胞术检测线粒体膜电位
将H9c2细胞按照1.6处理,于培养箱中培养24 h。按照线粒体膜电位检测试剂盒(JC-1)说明书操作,流式细胞仪进行检测,其激发波长为525 nm,发射光波长为595 nm,测定荧光强度。
1.8 流式细胞术检测细胞凋亡
将H9c2细胞按照1.6处理,于培养箱中培养24 h。按照Annexin V-FITC/PI细胞凋亡检测试剂盒说明书操作,用流式细胞仪进行定量分析。
1.9 统计学分析
实验结果数据用x±s表示,计量资料组间比较采用单因素方差分析,统计分析软件使用GraphPad Prism 5.0,P<0.05为差异有统计学意义。
2 结果
2.1 麦冬皂苷D′对H9c2细胞形态的影响
荧光显微镜下观察显示,细胞对照组(图2A)细胞形态正常,呈梭长形,且细胞密度大,细胞贴壁性良好;OPD′0.1和1μmol∙L-1组(图2B,2C)细胞形态正常;5和10μmol∙L-1组(图2D,2E)细胞形态皱缩,体积减小;20,25和50μmol∙L-1组(图2F,2G和2H)细胞完全皱缩,细胞形态模糊,出现坏死细胞;DMSO溶剂对照组(图2I)细胞形态无明显变化。

Fig.2 Effect of OPD′on H9c2 cell morphology(ⅹ200). The cells were cultured with OPD′for 24 h.A:cell control;BH:OPD′0.1,1,5,10,20,25 and 50μmol∙L-1,respectively;I:DMSO solventcontrol.The arrows show injured cells.
2.2 麦冬皂苷D′对H9c2细胞存活率的影响
MTS细胞毒性检测分析结果(图3)显示,随着OPD′浓度的增加,H9c2细胞存活率逐渐降低,提示细胞有不同程度的损伤。OPD′对细胞存活的抑制作用具有一定的量效关系(R2=0.994,P<0.05)。GraphPad Prism 5.0计算其IC50为9.9μmol∙L-1,当OPD′浓度高于20μmol∙L-1,H9c2细胞存活率低于20%。

Fig.3 Effect of OPD′on cell viability of H9c2 cells by MTS assay.The cells were cultured with OPD′for 24 h.Cellviabil⁃ity(%)=(A480nmofdrug group-A480nmof zero group)/(A480nmof cell controlgroup-A480nmofzero group)ⅹ100%.x±s,n=3.**P<0.01,compared with cellcontrolgroup.
2.3 麦冬皂苷D′对H9c2细胞毒性作用
高内涵免疫荧光筛选检测分析结果(图4)显示,与细胞对照组比较,OPD′0.1,1和5μmol∙L-1组细胞核数目和形态未见明显改变;OPD′10,20,25和50μmol∙L-1组细胞核数目明显减少,且细胞核面积减小(P<0.05),进一步提示细胞发生皱缩。
2.4 麦冬皂苷D′对H9c2细胞ROS水平的影响
流式细胞术检测OPD′对H9c2细胞ROS含量的影响。由表1显示,与细胞对照组相比,OPD′0.1和1μmol∙L-1组ROS含量无明显变化,5和10μmol·L-1组ROS含量升高(P<0.05,P<0.01)。

Tab.1 Effect of OPD′on reactive oxygen species(ROS)release in H9c2 cells
2.5 麦冬皂苷D′对H9c2细胞线粒体膜电位的影响
流式细胞术检测OPD′对H9c2细胞线粒体膜电位的影响。由表2所示,与细胞对照组相比,OPD′0.1,1,5和10μmol∙L-1组细胞线粒体膜电位下降(P<0.05,P<0.01),OPD′10μmol∙L-1组线粒体膜电位下降最为显著(P<0.01)。

Fig.4 Effect of OPD′on H9c2 cell nucleus number and nucleus area observed by high content immune fluores⁃cence screening(×20).The cells were cultured with OPD′for 24 h.B and C were the quantitative results of A.x±s,n=3.*P<0.05,**P<0.01,compared with cellcontrol(0)group.

Tab.2 Effect of OPD′on mitochondrial membrane potential(MMP)of H9c2 cells
2.6 麦冬皂苷D′对H9c2细胞凋亡的影响
流式细胞术检测OPD′对H9c2细胞凋亡的影响。由表3和图5所示,与细胞对照组相比,OPD′5和10μmol∙L-1组细胞早期凋亡率升高(P<0.05,P<0.01),提示OPD′可能诱导H9c2细胞凋亡。

Tab.3 Effect of OPD′on apoptosis of H9c2 cells

Fig.5 Effect of OPD′on apoptosis of H9c2 cells.The cells were cultured with OPD′for 24 h.
3 讨论
本研究发现,当OPD′浓度>5μmol∙L-1时,使H9c2细胞形态发生皱缩,细胞存活率显著下降,细胞核数目减少,ROS含量升高,线粒体膜电位下降,细胞凋亡率升高,并且呈浓度依赖性,提示OPD′对H9c2细胞有明显的毒性作用,且这种毒性作用可能通过激活细胞凋亡通路来实现。ROS包括氧自由基、过氧化氢及下游产物氧化物等,可调节多种生理病理过程[17],是常见的细胞凋亡通路影响因素。研究报道,抑制ROS引起的线粒体氧化应激可有效降低细胞凋亡率[18]。细胞内ROS含量不同,细胞接收到的相关信号也不同[19]。当细胞受到外源性毒物刺激时,细胞内ROS含量突增,诱发氧化应激或者内质网应激,相关通路开放,凋亡因子被激活,细胞DNA破损,细胞凋亡发生[20]。线粒体膜电位是细胞凋亡早期的一个重要指标。在特定信号的刺激下,细胞线粒体膜电位丢失,线粒体的通透性发生变化,一些与细胞凋亡相关的因子会从线粒体释放至细胞质中,从而会影响线粒体的正常功能[21]。本研究结果表明,OPD′可能通过升高H9c2细胞ROS水平接收相关信号。
尽管对麦冬的化学成分和药理作用的研究较广泛,但多集中于研究其粗提物的药理活性,对其单体化合物的研究较少。OPD′和OPD结构相似,仅表现在糖基侧链取代不同,但是二者的药理活性截然相反。OPD侧链取代基有岩藻糖[16],可诱导细胞色素P450酶2J减少心肌细胞凋亡[14],有效缓解多柔比星引起的细胞自噬[22],诱导乳腺癌细胞凋亡[23]。OPD′在相同取代基位置糖基侧链为葡萄糖[18]。本研究发现,OPD′对H9c2细胞有明显的细胞毒性作用,提示参麦注射液的不良反应可能与OPD′的含量有关。现有研究表明,OPD′在大鼠体内被大肠杆菌代谢为薯蓣皂苷[24],且OPD′经4℃、反复冻融以及-70℃长期冷冻未见分解变质,并且于体内未见蓄积现象[25]。提示OPD′在参麦注射液中含量虽少,但其稳定性较好。
药物分子结构的特殊性会引发药物特质性毒性反应[26]。结构相似的药物,由于其内部取代基或取代位置不同而导致的药物药理活性不同屡见报道。如柴胡皂苷a具有抗炎和保肝等作用,而与其结构相似的柴胡皂苷b2却对肝有毒性作用[27]。布洛芬和异丁芬酸结构非常相似,布洛芬安全性良好而异丁芬酸却因肝毒性撤市[28]。针对这种情况,通常采取优化药物结构的方式来降低药物毒性。目前,本实验室已针对结构相似而药理活性截然相反的OPD和OPD′开展了一系列研究,探究了二者对心肌细胞的作用,但是对于OPD′作用机制和毒效转化等尚不清楚,待深入研究。
[1]Pharmacopoeia of the People’s Republic of China(2010 Edition):Traditional Chinese Medicine[中华人民共和国药典2010年版(中药)一部][M].Beijing:The Medicine Scinece and Technology Press of China.2010:144-145.
[2]Zhou FB.Research progress of the pharmacologi⁃cal actions of ophiopogon root[J].J Mudanjiang Med Coll(牡丹江医学院学报),2006,27(3):69-70.
[3]Cheng H,Liu WW,Cheng X,Yu EX.Antiarrhythmic effects of total flavones of Metasequoia[J].J Hubei Med Univ,1999,20(1):28-29
[4]Cheng JB,Wei HC,Zhang S.Pharmacodynamic effect of extracts in Radix Ophiopogonis on myo⁃cardialischemia dog[J].Chin J Pathophysiol(中国病理生理杂志),2001,17(8):810.
[5]Ye LF,Zheng YR,Wang LH.Effects of Shenmai⁃injection and its bioactive components following ischemia/reperfusion in cardiomyocytes[J].Exp Ther Med,2015,10(4):1348-1354.
[6]Ma S,LiX,Dong L,Zhu J,Zhang H,Jia Y.Protec⁃tive effect of Shengmai Yin,a traditional Chinese⁃preparation,against doxorubicin-induced cardiac⁃toxicity in rats[J].BMC Complement Altern Med,2016,16(1):1-10.
[7]Yu J,Xu XZ,Gu LQ,Gao HY,Xin YF,Xuan YX. Rb2,Rb1,Ro and ophiopogonin D in Shenmai Injec⁃tion by liquid chromatography-tandem mass spec⁃trometry[J].Chin Arch Tradit Chin Med(中华中医药学刊),2014,32(1):71-74.
[8]Yu XW,Du HZ,Sun L,Yuan ST.Research progress on the pharmacological effects of ophiopogo⁃nins[J].Prog Pharm Sci(药学进展),2014,38(4):279-284.
[9]Lan S,Yi F,Shuang L,Chenjie W,Zheng XW. Chemical constituents from the fibrous root of Ophiopogon japonicus,and their effect on tube formation in human myocardial microvascular endo⁃thelialcells[J].Fitoterapia,2013,85(1):57-63.
[10]Hu YF,Ma J,Jiang FR,Zhang X,Dai JG,Cheng XQ,et al.Influence of several Ophiopogon japonicus extracts on expression of ICAM-1,VEGF,Bcl-2 in damaged HUVEC induced by hydrogenperoxide[J].Prog Mod Biomed(现代生物医学进展),2011,11(18):3421-3426.
[11]Wu Y,Wei X,Zhang LY,Yu ZF,Ren BN,Qi JL,et al.Simultaneous determination of seven compo⁃nents in Shenmai injection by HPLC-MS/MS[J]. Chin Tradit Herb Drugs(中草药),2014,45(18):2625-2630.
[12]Jia C,Ye ZL,Jiang XJ,Zhou DZ,Li DK.Quantita⁃tive determination of ophiopogonin D and ophio⁃pogonin D′from Ophiopogon japonicus by ELSDHPLC[J].Chin Med J Res Prac(现代中药研究与实践),2012,26(3):79-81.
[13]Zhang HX.Effects of Shenmai injection and its effective components on drug metabolism enzyme(参麦注射液及其有效成分对药物代谢酶的影响)[D]. Chongqing:Chongqing Medical University(重庆医科大学),2014.
[14]You WT,Zhou T,Ma ZC,Liang QD,Xiao CR,Tang XL,et al.Ophiopogonin D maintains Ca2+homeostasis in rat cardiomyocytes in vitro by upregu⁃lating CYP2J3/EETs and suppressing ER stress[J].Acta PharmacolSin,2016,37(3):368-381.
[15]Wang Y,Wang YG,Ma ZC,Tang XL,Liang QD,Tan HL,et al.Ophiopogonin D attenuates angio⁃tensinⅡ-induced myocardialhypertrophy by reducing autophagy[J].Chin Pharmacol Bull(中国药理学通报),2016,32(10):1370-1376.
[16]Zhang T.Study on steroidal saponins from O phio⁃pogon japonicus(中药麦冬中甾体皂苷类成分的研究)[D].Beijing:Academy of Military Medical Sciences(军事医学科学院),2009.
[17]Higa A,Chevet E.Redoxs ignaling loops in the unfolded protein response[J].Cell Signal,2012,24(8):1548-1555.
[18]Shin EJ,Nam Y,Lee JW,Nguyen PT,Yoo JE,Tran TV,et al.N-Methyl,N-propynyl-2-phenyle⁃thylamine(MPPE),a selegiline analog,attenuates MPTP-induced dopaminergic toxicity with guaranteed behavioral safety:involvement of inhi⁃bitions of mitochondrial oxidative burdens and p53gene-elicited pro-apoptotic change[J].Mol Neurobiol,2016,53(9):6251-6269.
[19]Ji YB,He XJ,Qu ZY,Zou X.Research on reac⁃tive oxygen species induced apoptosis[J].Chin Tradit Herb Drugs(中草药),2009,40(s1):19-21.
[20]Liu CL,Wang YG,Ma ZC,Liang QD,Xiao CR,Tan HL,et al.Cytotoxic effect of veratrine hydro⁃chloride on HepG2 cells and its possible mecha⁃nism[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2014,28(3):391-397.
[21]Haeberlein SL.Mitochondrial function in apoptotic neuronalcelldeath[J].Neurochem Res,2004,29(3):521-530.
[22]Zhang YY,Meng C,Zhang XM,Yuan CH,Wen MD,Chen Z,et al.Ophiopogonin D attenu⁃ates doxorubicin-induced autophagic cell Death by relieving mitochondrial damage in vitro and in vivo[J].J Pharmacol Exp Ther,2015,352(1):166-174.
[23]Zang QQ,Zhang L,Gao N,Huang C.Ophiopogonin D inhibits cellproliferation,causes cell cycle arrest at G2/M,and induces apoptosis in human breast carcinoma MCF-7 cells[J].J Integr Med,2016,14(1):51-59.
[24]Shen L,Xu DS,Feng Y,Li X,Wu XR.Effect of intestinal bacteria on metabolism of ophiopogonin⁃saponin D′in rats[J].China J Chin Mater Med(中国中药杂志),2005,30(8):618-620.
[25]Dong XQ,Tang S,Yang R,Zhang SL,Zhu WL,Li GX,et al.Concentration of ophiopogonin D′in healthy Beagle dog′s plasma by LC-MS/MS[J]. Chin Arch Tradit Chin Med(中华中医药学刊),2016,34(8):1829-2833.
[26]Nassar AE,Kamel AM,Clarimont C.Improving the decision-making process in structuralmodification of drug candidates:reducing toxicity[J].Drug Discov Today,2004,9(24):1055-1064.
[27]Zhang Q.Study on the saikosaponins structure transformation and the toxicity of saikosaponin b2(柴胡皂苷结构转化及柴胡皂苷b2毒性初步研究)[D].Luoyang:Henan University of Science and Technology(河南科技大学),2014.
[28]Baba A,Yoshioka T.Structure-activity relation⁃ships for the degradation reaction of 1-beta-O-acyl⁃glucuronides.Part3:Electronic and steric descrip⁃tors predicting the reactivity of aralkylc arboxylic acid 1-beta-O-acylglucuronides[J].Chem Res Toxicol,2009,22(12):1998-2008.
Cytotoxicity of ophiopogonin D′for rat H9c2 cardiomyocytes
REN Si-jia1,2,XU Huan-hua2,LIMing2,HAO Fei-ran2,MA Zeng-chun2,TANGXiang-lin2,LIANGQian-de2, TAN Hong-ling2,XIAO Cheng-rong2,WANG Yu-guang2,GAO Yue1,2
(1.SchoolofPharmacy,GuangxiMedicalUniversity,Nanning 530021,China;2.Departmentof Pharmacology and Toxicology,Institute of Radiation Medicine,Academy of Military MedicalSciences,Beijing 100850,China)
OBJECTIVETo study the cardiotoxicity ofophiopogonin D′(OPD′)for rat H9c2 cardio⁃myocytes.METHODSH9c2 cells were exposed to OPD′0.1,1,5,10,20,25 and 50μmol∙L-1for 24 h. Cellviability was examined by MTS assay,and the morphologicalchanges in H9c2 cells were quanti⁃fied.The cell nucleus injury was examined by high content immune fluorescence screening and the morphological changes were observed under a fluorescence microscope.After treatment with OPD′0.1,1,5 and 10μmol∙L-1for 24 h,the effect on reactive oxygen species(ROS),mitochondrialmem⁃brane potential(MMP)and apoptosis was detected by flow cytometry.RESULTSThe viability was sig⁃nificantly reduced following exposure to OPD′0.1,1,5,10,20,25 and 50μmol∙L-1(P<0.05,P<0.01). The IC50value was 9.9μmol∙L-1and cellshrinkage and apoptosis occurred.The levels of ROS and apoptosis rate of H9c2 cells were significantly increased after exposure to OPD′0.1,1,5 and 10μmol∙L-1for 24 h(P<0.05,P<0.01)and MMP markedly declined(P<0.05,P<0.01).CONCLUSIONOPD′has significentcytotoxicity on H9c2 cells.Itmay be related to inducing apopotsis pathways.
ophiopogonin D′;H9c2 cells;toxic actions
WANG Yu-guang,Tel:(010)66932201,E-mail:wangyg@bmi.ac.cn;GAO Yue,Tel:(010)66931312, E-mail:gaoyue@nic.bmi.ac.cn
R285.1
:A
:1000-3002-(2017)04-0325-07
10.3867/j.issn.1000-3002.2017.04.005
Foundation item:The project supported by National Natural Science Foundation of China(81630102);National Natural Science Foundation of China(81673633);and National Key Basic Research and Development Program("973") (2012CB518402)
2016-12-01接受日期:2017-03-21)
(本文编辑:乔虹)
国家自然科学基金(81630102);国家自然科学基金(81673633);国家重点基础研究发展计划(“973”)资助项目(2012CB518402)
任思嘉,女,硕士研究生,主要从事药理学研究,Tel:(010)66932318,E-mail:rensijia790651896@163.com;王宇光,男,副研究员,主要从事分子药理学研究;高月,女,研究员,博士生导师,主要从事中药药理与毒理学研究。
王宇光,E-mail:wangyg@bmi.ac.cn,Tel:(010)66932201;高月,E-mail:gaoyue@nic.bmi.ac.cn,Tel:(010)66931312
