双孢菇胞内和胞外多糖对伴刀豆凝集素A诱导免疫性肝损伤小鼠的保护作用
2017-06-01郑丹丹姜楠胡扬扬杨健华董亮君王琦
郑丹丹,姜楠,胡扬扬,杨健华,董亮君,王琦
(吉林农业大学1.食药用菌教育部工程研究中心,2.动物科学技术学院,吉林长春130118)
双孢菇胞内和胞外多糖对伴刀豆凝集素A诱导免疫性肝损伤小鼠的保护作用
郑丹丹1,姜楠1,胡扬扬2,杨健华1,董亮君1,王琦1
(吉林农业大学1.食药用菌教育部工程研究中心,2.动物科学技术学院,吉林长春130118)
目的研究双孢菇胞内多糖(IPS)和胞外多糖(EPS)对伴刀豆凝集素A(Con A)所致小鼠免疫性肝损伤的保护作用。方法小鼠预先ig给予IPS或EPS 100,200和400 mg·kg-1,每日1次,连续12 d,末次给药后4 h尾静脉注射Con A 25 mg·kg-1制备免疫性肝损伤小鼠模型。8 h后眼球取血,取肝、脾和胸腺。全自动生化分析仪测定血清谷丙转氨酶(GPT)和谷草转氨酶(GOT)水平。流式细胞仪检测脾细胞中CD4+和CD8+T淋巴细胞百分比。生化试剂盒检测血清干扰素γ(IFN-γ)和肿瘤坏死因子α(TNF-α)含量及肝组织中超氧化物歧化酶(SOD)活性和丙二醛(MDA)水平。光学显微镜观察肝组织切片的病理改变。结果与正常对照组相比,模型小鼠胸腺指数明显降低(P<0.01),肝、脾指数明显增高(P<0.01);与模型组比较,预先给予IPS 100,200和400 mg·kg-1及EPS 200和400 mg·kg-1小鼠胸腺指数明显升高(P<0.01),肝、脾指数均明显降低(P<0.01)。与正常对照组相比,模型小鼠血清GOT和GPT活性及TNF-α和IFN-γ含量显著升高(P<0.01);预先给予IPS及EPS 200和400 mg·kg-1小鼠血清GOT和GPT活性及TNF-α和IFN-γ含量较模型组显著降低(P<0.01)。与正常对照组相比,模型小鼠肝组织SOD活性降低(P<0.01),MDA水平升高(P<0.01);与模型组比较,预先给予IPS及EPS 200和400 mg·kg-1SOD活性明显升高(P<0.01),MDA水平降低(P<0.01)。与正常对照组相比,模型小鼠脾细胞中CD4+T淋巴细胞百分比和CD4+/CD8+T淋巴细胞比值明显下降(P<0.01);预先给予IPS和EPS 400 mg·kg-1CD4+T淋巴细胞百分比与模型组比较明显升高(P<0.01),CD4+/CD8+T淋巴细胞比值变化不明显。镜下观察模型组小鼠肝组织出现明显的病理改变,预先给予IPS和EPS能减轻Con A引起的病理变化。结论双孢菇IPS和EPS对小鼠免疫性肝损伤有一定的保护作用,其机制可能与清除自由基、抑制脂质过氧化和调节免疫系统平衡有关。
双孢菇;多糖;免疫性肝损伤;T淋巴细胞
双孢菇(二孢蘑菇,Agaricus bisporus)俗称为白蘑菇、圆蘑菇或洋蘑菇,属中低温性菇类,因为担子上通常着生2个担孢子而得名。遗传研究表明,典型的双孢菇以次级同宗配合为主、异宗配合为辅的遗传方式来完成其生活史,它的四孢变种以异宗配合的遗传方式来完成其生活史[1],是一种高蛋白、低脂肪、低能量的蕈类,所含蛋白质总量是其他水果和蔬菜的3~10倍。很多研究发现,双孢菇具有抗肿瘤、抗病毒、抗菌、抗氧化、抗过敏、抗高胆固醇血症和辅助治疗糖尿病等作用[2-4]。以双孢菇匀浆液为主要成分的“健肝片”,是治疗肝炎的一种辅助药品,对早期肝炎、慢性肝炎和肝肿大都有一定疗效[5-6]。近年来,真菌多糖作为食品、药品和化工行业的原料受到了人们的广泛关注。采用液体发酵不但可以获得大量的多糖,而且还包含有单宁、苦味酸、黄酮类化合物、萜类和甾体皂苷等。如曹小红等[7]报道了灰树花孢(Grifola frondosa)胞外多糖对小鼠急性肝损伤具有良好的修复作用。董开忠等[8]报道了冬虫夏草胞内多糖对免疫性肝损伤小鼠有一定的保护作用。毛勇等[9]报道了双孢菇胞外多糖(exopolysaccharides,EPS)能提高糖尿病小鼠肝超氧化物歧化酶(superoxide dismutase,SOD)活性,降低丙二醛(malondialdehyde,MDA)含量,增强糖尿病小鼠肝抗氧化能力,推测双孢菇胞内多糖(intracellular polysaccharides,IPS)和EPS对肝具有保护作用。本研究制备免疫性肝损伤小鼠模型,进一步研究IPS和EPS对小鼠免疫性肝损伤的修复作用,为双孢菇发酵多糖应用于保肝提供实验基础。
1 材料与方法
1.1 双孢菇多糖的制备
双孢菇子实体于2012年夏季采集于西藏日喀则地区,菌株编号为T12387,根据显微镜观察及基因测序,内转录间隔区(ITS)序列比对及简单重复序列区间(ISSR)比对,以99%置信限确定为野生的双孢蘑菇蕈株。此蕈株全部保藏在吉林省长春市吉林农业大学食药用菌教育部工程研究中心的菌种库中。经本实验室分离、传代及保藏菌种,将该菌种进行液体发酵,获得的菌丝球在<60℃烘干,粉碎,蒸馏水浸提,Sevage法除蛋白,透析,95%乙醇沉淀,分离纯化获得IPS[10]。发酵液经过浓缩,除蛋白,透析及乙醇沉淀,真空干燥,分离纯化获得EPS[9]。根据苯酚硫酸法测得IPS和EPS的纯度分别为72.6%和77.5%,其成分主要为葡萄糖、木糖和甘露糖等。本研究均采用同一批多糖制品。
1.2 试剂和仪器
水飞蓟宾胶囊购于天津天士力圣特制药有限公司;伴刀豆凝集素A(concanavalin A,Con A)购于美国Sigma公司;SOD活性测定试剂盒(货号20131202)、MDA含量测定试剂盒(货号20140117)和BCA蛋白质浓度测定试剂盒(货号20151209)均购于南京建成生物工程研究所;肿瘤坏死因子α(tumornecrosis factor-α,TNF-α)测定试剂盒(货号88-7324-22)和干扰素γ(interferon-γ,IFN-γ)测定试剂盒(货号88-7314-22)均购于美国eBioscience公司;CD3e-APC试剂盒(货号561826)、CD4-PE试剂盒(货号557308)和CD8-FITC试剂盒(货号553030)均购于美国BD公司。680型酶标仪(美国Bio Rad公司);SW-CJ-1FD型超净工作台(苏州苏洁净化设备有限公司);Accuri C6流式细胞仪(美国BD公司);TD5A型离心机(湖南凯达科学仪器有限公司);石蜡切片机(德国Leica公司);APES防脱载玻片(上海尚宝生物科技有限公司);全自动生化分析仪(迈瑞生物医疗电子股份有限公司)。
1.3 小鼠免疫性肝损伤模型的制备
雄性ICR小鼠,SPF级,18~22 g,购于北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2009-0004。饲养条件:温度22~26℃,湿度50%~ 70%,12/12 h昼夜间断照明,每天添加饲料2次,换水1次,小鼠自由进食、饮水。ICR小鼠随机分为正常对照组、模型组、阳性药组、IPS和EPS组,每组15只。IPS或EPS组ig给予IPS或EPS 100,200和400 mg·kg-1[11-12];阳性药组ig给予水飞蓟宾47.25 mg·kg-1[13-16],正常对照组和模型组ig给予等体积生理盐水,每日1次,连续给药12 d。末次给药后4 h,除正常对照组外,模型组、IPS组、EPS组和阳性药组均尾静脉注射Con A 25 mg·kg-1诱导Con A免疫性肝损伤模型[17-19]。禁食不禁水后8 h,肝损伤程度达到高峰,眼球取血,之后处死小鼠,分别称取肝、脾和胸腺进行实验指标的测定。
1.4 免疫器官脏器指数测定
测量小鼠体质量和肝、脾和胸腺质量,按下列公式计算脏器指数:脏器指数=脏器质量(mg)/体质量(g)。
1.5 血清谷丙转氨酶(glutamic-pyruvic transam⁃inase,GPT)和谷草转氨酶(glutamic-oxalacetic transaminase,GOT)活性检测
小鼠眼球取血,4℃,1000×g分离血清,全自动生化分析仪测定GPT和GOT活性。
1.6 小鼠脾中T淋巴细胞亚群CD4+和CD8+百分比及CD4+/CD8+比值的测定
剥离小鼠脾,置于200目无菌滤网中,加入RPMI 1640培养液1 mL,研磨充分后,4℃,447×g离心5 min。弃上清液,收集淋巴细胞,用PBS溶液洗涤,加入500μL红细胞裂解液,室温裂解5~8 min。4℃,447×g离心5 min,弃上清,收集淋巴细胞,用PBS洗涤,PBS 1 mL重悬细胞。300目尼龙膜小心过滤后,用细胞计数板计数,收集的细胞密度为1×109L-1。每个离心管分别加入10μL CD3,CD4和CD8荧光标记抗体,充分混匀,4℃避光孵育45 min。用100μL PBS溶液轻轻地重悬细胞沉淀,用锡箔纸包好样品,上流式细胞仪检测CD4+和CD8+T淋巴细胞,并计算CD4+/CD8+比值。实验设空白对照、抗CD3单标、抗CD4和抗CD8单标对照组,排除假阳性。
1.7 血清中IFN-γ和TNF-α含量的测定
小鼠血液在4℃冰箱中放置3 h后,1000×g分离血清,按照IFN-γ和TNF-α试剂盒操作测定其含量。
1.8 肝组织SOD活性和MDA含量检测
称取小鼠肝左叶0.2 g,冷生理盐水洗净积血后制备10%肝匀浆,按照试剂盒说明书操作测定SOD活性和MDA含量。
1.9 肝组织病理观察
取小鼠肝右叶,用10%甲醛溶液浸泡固定,48 h后制作肝组织切片,HE染色,光学显微镜下观察其病理变化。
1.10 统计学分析
2 结果
2.1 Con A免疫性肝损伤模型的确定
以Con A 20和25 mg·kg-1进行预实验,根据小鼠活动状况、血清GPT和GOT活性、T淋巴细胞亚群和细胞因子的变化及脏器观察等进行比较,选择Con A 25 mg·kg-1进行实验。在正式实验中,Con A注射后3 h,模型组、IPS和EPS 100 mg·kg-1组各有1只小鼠死亡,其他小鼠出现少动、精神萎靡、不嗜饮水和尿液黄等症状。8 h后,每组随机取3只小鼠进行模型指标鉴定。模型组和各给药组血清中GPT和GOT活性明显高于正常对照组(P<0.01)。大体观察发现,除正常对照组外,其余各组肝表面颜色变暗,呈现颗粒状,其他脏器如心、肺和肾等均无明显病变。组织病理观察发现,肝实质内大量淋巴细胞浸润,显示Con A引起的特异性肝损伤,表明模型制备成功。
2.2 IPS和EPS对免疫性肝损伤小鼠脏器指数的影响
除正常对照组外,其余各组小鼠肝出现不同程度的损伤,肝表面有大小不同的坏死斑,整肝呈现颗粒状,其他脏器如心、肺和肾等无异常,表明Con A诱导肝损伤具有靶向性。图1结果表明,与正常对照组相比,模型组小鼠肝、脾指数明显增高(P<0.01),表明出现肝、脾肿大;IPS和EPS给药均能够有效降低肝、脾指数,以200 mg·kg-1效果最为明显(P<0.01)。模型组小鼠的胸腺指数较正常对照组明显降低(P<0.01),IPS和EPS给药组能显著升高胸腺指数,200 mg·kg-1组升高最为明显(P<0.01)。
2.3 IPS和EPS对免疫性肝损伤小鼠血清转氨酶及肝组织SOD活性和MDA含量的影响
图2结果显示,与正常对照组比较,模型组小鼠血清GPT和GOT水平显著升高,肝组织中SOD活性明显降低,MDA含量明显升高(P<0.01)。与模型组相比,IPS和EPS给药组血清GOT和GPT水平明显降低,肝组织中SOD活性显著升高,MDA含量明显降低(P<0.01),但尚未恢复到正常对照组水平。
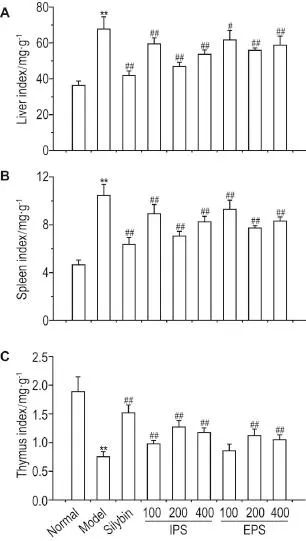
Fig.1 Effect of Agaricus bisporus intracellular poly⁃saccharide(IPS)and exopolysaccharides(EPS)on index of liver(A),spleen(B)and thymus(C)of mice with autoimmune liver injury induced by concanavalin A(Con A).Silybin 47.25 mg·kg-1,IPS and EPS 100,200 and 400 mg·kg-1were ig given once daily for 12 d,re⁃spectively.Then,Con A 25 mg·kg-1was injected from the tail vein at 4 h after the last ig given drugs.The liver,spleen and thy⁃mus were taken 8 h after Con A was given.Organ index=organ mass(mg)/body mass(g).x±s,n=10.**P<0.01,compared with normalgroup;#P<0.05,##P<0.01,compared with modelgroup.
2.4 IPS和EPS对免疫性肝损伤小鼠脾细胞中T淋巴细胞亚群的影响
小鼠脾细胞中T淋巴细胞亚群CD4+和CD8+百分比及其比值如图3所示。与正常对照组比较,模型组CD4+百分比和CD4+/CD8+比值明显降低(P<0.01)。与模型组比较,阳性药组、IPS 400 mg·kg-1组和EPS 400 mg·kg-1组CD4+百分比明显升高(P<0.01),EPS 200和400 mg·kg-1组CD8+百分比升高(P<0.05),各给药组CD4+/CD8+比值与模型组比较无明显差异。
2.5 IPS和EPS对免疫性肝损伤小鼠血清TNF-α和IFN-γ含量的影响

Fig.2 Effect of IPS and EPS on serum glutamic-oxalacetic transaminase(GOT)(A)and glutamic-pyruvic transam⁃inase(GPT)(B)activity and superoxide dismutase(SOD)activity(C)and malondialdehyde(MDA)content(D)in liver of mice with autoimmune liver injury induced by Con A.See Fig.1 for the mouse treatment.,n=10.**P<0.01,compared with normalgroup;#P<0.05,##P<0.01,compared with modelgroup.

Fig.3 Effect of IPS and EPS on CD4+(A),CD8+(B)and CD4+/CD8+(C)ratio of T lymphocytes in spleen of mice with autoimmune liver injury induced by Con A. See Fig.1 for the mouse treatment.x±s,n=10.**P<0.01,compared with normalgroup;##P<0.01,compared with modelgroup.

Fig.4 Effect of IPS and EPS on tumor necrosis factor-α(TNF-α)(A)and interferon-γ(IFN-γ)(B)contents in serum of mice with autoimmune liver injury induced by Con A.See Fig.1 for the mouse treatment.x±s,n=10.**P<0.01,compared with normalgroup;##P<0.01,compared with modelgroup.
图4结果显示,与正常对照组比较,模型组血清中TNF-α和IFN-γ含量明显升高(P<0.01)。与模型组相比,阳性药组、IPS和EPS 200,400 mg·kg-1组血清中TNF-α和IFN-γ含量明显降低(P<0.01)。
2.6 IPS和EPS对免疫性肝损伤小鼠肝组织病理改变的影响

Fig.5 Effect of IPS and EPS on liver histopathological changes of mice with autoimmune liver injury induced by Con A(HE staining).See Fig.1 for the mouse treatment.A:normal group;B:modelgroup;C:silybin group;D,E and F:IPS 100,200 and 400 mg·kg-1group,respectively;G,H and I:EPS 100,200 and 400 mg·kg-1group,respectively.The arrows show the necrotic hepatocytes.
图5结果显示,正常对照组(图5A)小鼠肝组织结构清晰,肝索围绕肝静脉呈放射状排列,肝细胞无变性坏死等病理变化;模型组(图5B)小鼠肝组织呈着色不均,肝索排列不规则,大范围出现水肿及气球样变性,肝窦内红细胞淤积,伴有肝点状或灶状坏死及炎性细胞浸润;IPS及EPS给药组小鼠肝组织的恢复能力不及阳性药组(图5C),其200和400 mg·kg-1组(图5E,F,H,I)与模型组相比病变程度有所减轻,中央静脉周围坏死细胞较少,细胞肿胀程度减轻。
3 讨论
目前,食用菌深层发酵的产品在医药领域的应用已越来越被人们认可,发酵过程中产生多糖、多肽、萜类化合物、甾醇类、生物碱、苷类、酶、抗生素和氨基酸等多种活性化合物[20],这些物质具有抗肿瘤、防衰老和增强免疫力等功效。双孢菇是近年来开发的功能显著的食药兼用菌之一。本研究观察其2种发酵多糖IPS和EPS对Con A所致肝损伤的保护作用。
Con A是从巴西橡胶刀豆中提取的植物凝集素,其诱发的小鼠肝损伤与人类病毒性肝炎及自身免疫性肝病的病理过程非常相似,是T淋巴细胞诱导的免疫性肝损伤,尤其是CD4+T淋巴细胞,具有肝特异性和靶向性。因此,该模型被认为更适合研究人类病毒性肝炎、自身免疫性肝病等的病理机制并进行抗免疫性肝损伤的药物筛选,造模所需时间短,方法简便,损伤自然恢复时间较长,为临床和基础研究提供了较稳定的动物模型。因此被科研工作者广泛采纳[18,21]。
Con A通过活化的T淋巴细胞诱发特异性肝损伤,肝窦内存在大量的巨噬细胞,激活后产生TNF-α、IFN-γ和白细胞介素2等细胞因子,可直接损伤肝细胞[22]。TNF-α为诱导肝损伤的终末介质,它既是肝细胞凋亡的正性触发因子,可通过激活核因子诱导多个调节免疫和炎症过程的基因转录,包括诱导型一氧化氮合酶及IFN-γ,直接损伤血管内皮细胞,又可活化中性粒细胞促进其趋化聚集于肝,释放蛋白酶或氧自由基引起肝细胞凋亡或坏死[23]。T淋巴细胞活化后产生的IFN-γ是巨噬细胞的重要激活剂,对促进肝内Kupffer细胞参与炎症反应和刺激巨噬细胞分泌TNF-α起重要作用。大量活化的T淋巴细胞和IFN-γ聚集到肝,破坏血管内皮细胞,导致肝损伤。Con A与肝窦具有亲和性,可以直接使循环T淋巴细胞汇入肝窦并在局部增殖,释放多种细胞因子间接地损伤肝细胞。此外,由于Con A刺激及细胞因子的释放激活机体免疫系统,脾中大量活化的T淋巴细胞产生细胞因子,T淋巴细胞与细胞因子随血流到达肝,直接与肝细胞接触或进一步激活巨噬细胞,破坏血管内皮细胞,导致肝损伤[24]。
本研究结果可见,注射Con A后8 h,小鼠肝、脾指数明显增高,胸腺指数明显降低;血清GPT和GOT活性显著上升,TNF-α和IFN-γ含量显著上升;脾细胞中CD4+T淋巴细胞百分比明显降低,CD4+/CD8+T淋巴细胞比值明显下降;肝组织SOD活性降低,MDA水平升高;肝组织出现明显病理改变。上述结果表明,Con A引起肝的氧化应激损伤,氧自由基攻击肝细胞膜和线粒体膜上的多不饱和脂肪酸,引起一系列脂质过氧化反应,使膜通透性发生改变,导致GPT及GOT大量释放到血液中。本研究预先ig给予小鼠IPS或EPS 100~400 mg·kg-1,每日1次,连续12 d,可减轻之后注射Con A引起的上述肝损伤,说明IPS和EPS可以提高SOD活性,增强肝清除自由基的能力,抵御脂质过氧化反应,保护肝细胞膜和线粒体膜,达到肝保护作用。IPS和EPS显著降低血清TNF-α和IFN-γ的含量,增加脾细胞中CD4+T淋巴细胞百分比,在一定程度上抑制了肝损伤小鼠免疫系统的过度激活,减轻大量淋巴细胞和细胞因子对肝造成的损伤。
本研究初步证实了IPS和EPS对肝的保护作用,其确切的有效成分及作用机制还需深入研究。
[1]Wang ZS,Liao JH,Chen MY,CaiZX.Breeding and industrial development of Agaricus bisporus[J].Acta Edulis Fungi(食用菌学报),2012,19(3):1-14.
[2]Dutta S.Role of mushrooms as nutraceutical:an overview[J].Int J Pharm Biol Sci,2013,4(4):B59-B66.
[3]Rathee S,Rathee D,Rathee D,Kumar V,Rathee P. Mushrooms as therapeutic agents[J].Rev Braz Farmacogn,2012,22(2):459-474.
[4]Xu T,Beelman RB,Lambert JD.The cancer preventive effects of edible mushrooms[J].Anti⁃cancer Agents Med Chem,2012,12(10):1255-1263.
[5]Kanaya N,Kubo M,Liu Z,Chu P,Wang C,Yuan YC,et al.Protective effects of white button mushroom(Agaricus bisporus)against hepatic steatosis in ovariectomized mice as a model of postmenopausal women[J].PLoS One,2011,6(10):e26654.
[6]Uyanoglu M,Canbek M,van Griensven LJ,Yamac M,Senturk H,Kartkaya K,et al.Effects of polysaccharide from fruiting bodies of A garicus bisporus,Agaricus brasiliensis,and Phellinus linteus on alcoholic liver injury[J].Int J Food Sci Nutr,2014,65(4):482-488.
[7]Cao XH,Zhu H,Wang CL,Lu MF,Zeng B,Wang AH.Protective effect of exo-polysaccharides produced by Grifola frondosa on carbon tetrachloride induced liver injury in mice[J].Nat Prod Res Dev(天然产物研究与开发),2010,22(5):777-780.
[8]Dong KZ,Gao YS,Wang XH,Ma YQ,Su L. Protective effect of mycelial polysaccharides from Cordyceps sinensis on immunological liver injury in mice[J].Med J Chin PLA(解放军医学杂志),2016,41(4):284-288.
[9]Mao Y,Mao J,Meng X.Extraction optimization and bioactivity of exopolysaccharides from Agari⁃cus bisporus[J].Carbohydr Polym,2013,92(2):1602-1607.
[10]Gao HW,Li ZL,Liu ZL,Yu L.Isolation,purifica⁃tion and chemical structure analysis of Agaricus bisporus intracellular polysaccharide and exopoly⁃saccharides[J].J.Nanjing Univ Tradit Chin Med(南京中医药大学学报),1999,15(4):224-225.
[11]Liu T,Ma L,Zhao J,Ma Q,Su DQ,Ji FC.The protective effects of polysaccharide from Vitis vinifera on immunologicalliver injury in mice and its mech⁃anism[J].Acta Nutr Sin(营养学报),2008,30(6):5960-601.
[12]Fang SY,Xu MH,Ye LB,Gu HX,Bao LL,Zhang XY.Study on protective action of Cordyceps on immunological liver injury in mice model[J].Chin J Immunol(中国免疫学杂志),2011,27(10):891-894.
[13]Wang HW,Li SC,He HB,Zeng X,Di GJ,Zhang CC,et al.Protection of Panax japonicus extractagainst acute alcoholic liver injury in mice[J].Chin J Clin Pharmacol Ther(中国临床药理学与治疗学),2012,17(9):961-966.
[14]Guo H,He H,Yu GC,Du J.Hepatoprotective effects of corn peptides on immunological liver injury in mice[J].J Chin Cereals Oils Assoc(中国粮油学报),2009,24(10):41-45.
[15]Serviddio G,Bellanti F,Stanca E,Lunetti P,Blonda M,Tamborra R,et al.Silybin exerts antiox⁃idant effects and induces mitochondrial biogenesis in liver of rat with secondary biliary cirrhosis[J]. Free Radic BiolMed,2014,73:117-126.
[16]Stanca E,Serviddio G,Bellanti F,Vendemiale G,Siculella L,Giudetti AM.Down-regulation of LPCAT expression increases platelet-activating factor level in cirrhotic rat liver:potential antiinflammatory effect of silybin[J].Biochim Biophys Acta,2013,1832(12):2019-2026.
[17]Huang ZB,Huang Y,Zhou RR,Chen RC,Yi PP,Li N,et al.Protective role of high mobility group box-1 protein antibody in Con A-induced liver injury in mice[J].Chin J Infect Control(中国感染控制杂志),2015,14(12):793-797.
[18]Heymann F,Hamesch K,Weiskirchen R,Tacke F. The concanavalin A model of acute hepatitis in mice[J].Lab Anim,2015,49(1 Suppl):12-20.
[19]Xiao H,Pan WM,Sun W,Chen HY,Xu JF.Protec⁃tive effect of soluble protein mB7-H4 on liver injury of mice induced by Con A[J].J Jilin Univ(Med Ed)〔吉林大学学报(医学版)〕,2016,42(1):36-39.
[20]Tang YJ,Zhong JJ.Submerged fermentation of higher fungi for production of valuable bioactive metabolites[J].J East China Univ Sci Technol(华东理工大学学报),2001,27(6):704-711.
[21]Zheng CH,Xie XH.Advances in concanavalin A-induced liver injury on immune cells and cyto⁃kines[J].Acad J PLA Postgrad Med School(解放军医学院学报),2016,37(2):191-194.
[22]Hu XD,Jiang SL,Liu CH,Hu YY,Liu C,Sun MY,et al.Preventive effects of 1,25-(OH)2VD3 against Con A-induced mouse hepatitis through promot⁃ing vitamin D receptor gene expression[J].Acta PharmacolSin,2010,31(6):703-708.
[23]Erhardt A,Tiegs G.Tolerance induction in response to liver inflammation[J].Dig Dis,2010,28(1):86-92.
[24]Kremer M,Hines IN,Milton RJ,Wheeler MD. Favored T helper 1 response in a mouse model of hepatosteatosis is associated with enhanced T cellmediated hepatitis[J].Hepatology,2006,44(1):216-227.
Protective effect of Agaricus bisporus intracellular polysaccharides and exopolysaccharides against concanavalin A-induced immunologicalliver injury in mice
ZHENG Dan-dan1,JIANG Nan1,HU Yang-yang2,YANG Jian-hua1,DONG Liang-jun1,WANG Qi1
(1.Engineering Research Center ofChinese Ministry of Education for Edible and MedicinalFungi,2.Animal Science and Technology College,Jilin AgriculturalUniversity,Changchun 130118,China)
OBJECTIVETo evaluate the protective effect of Agaricus bisporus intracellular polysac⁃charides(IPS)and exopolysaccharides(EPS)on immunological liver injury induced by concanavalin A (Con A).METHODSMice were pretreated with IPS and EPS(100,200 and 400 mg·kg-1,ig)daily for 12 d.Immunologicalliver injury was induced by Con A 25 mg·kg-1by injection via the tailvein ofmice. Eighthours after injection of Con A,the indexes ofthe liver,spleen and thymus,serum levelofglutamicpyruvic transaminase(GPT),glutamic-oxalacetic transaminase(GOT),tumor necrosis factor-α(TNF-α) and interferon-γ(IFN-γ),splenic lymphocyte percentages of CD4+and CD8+,and liver homogenate content of superoxide dismutase(SOD)and malondialdehyde(MDA)were measured.Liver pathological changes were observed by HE staining.RESULTSCompared with normalgroup,the autoimmune liver injury in mice induced by Con A resulted in an increase in the liver index(P<0.01),spleen index(P<0.01),the activity of GPT(P<0.01)and GOT(P<0.01),the content of TNF-α(P<0.01)and IFN-γ(P<0.01),and the levelof MDA(P<0.01),but a decrease in the thymus index(P<0.01),the percentage ofCD4+(P<0.01),the ratio of CD4+/CD8+(P<0.01),and SOD activity(P<0.01).Compared with modelgroup, treatmentwith IPS(200 and 400 mg·kg-1)and EPS(200 and 400 mg·kg-1)respectively resulted in an increase in the thymus index(P<0.01)but in a decrease in the liver index and spleen index(P<0.01). Similarly,the activity of GOT and GPT was decreased obviously(P<0.01),and the contentof TNF-αand IFN-γin IPS and EPS 200 and 400 mg·kg-1groups was decreased.Compared with model group,the activity of SOD in IPS and EPS(200 and 400 mg·kg-1)group was increased(P<0.01)while MDA was decreased(P<0.01).Moreover,the percentage of CD4+Iymphocytes decreased(P<0.01),whereas no significant difference was found in the ratio of CD4+/CD8+.Pathological changes of the liver were observed under a microscope.Pretreatment with IPS and EPS could effectively reduce the liver injury induced by Con A.CONCLUSIONIPS and EPS have certain protective effect on immunologicalliver injury,which may be related to their ability to clean up free radicals,controllipid peroxidation and regulate the balance ofthe immune system.
Agaricus bisporus;polysaccharides;immunologicalliver injury;T lymphocytes
WANG Qi,E-mail:q-wang2006@126.com
R285.5
:A
:1000-3002-(2017)04-0303-08
10.3867/j.issn.1000-3002.2017.04.002
Foundation item:The projectsupported by National Key Technologies R&D Program(2012BAC01B04);and National Basic Research Program of China(2014CB138304)
2016-12-09接受日期:2017-03-29)
(本文编辑:齐春会)
国家科技支撑计划(2012BAC01B04);国家重点基础研究发展计划(2014CB138304)
郑丹丹,女,硕士研究生,主要从事药理及免疫学研究,E-mail:sunnysky06@126.com;王琦,女,教授,博士生导师,主要从事食药用菌研究。
王琦,E-mail:q-wang2006@126.com
